Mozlijev zakon Linijski spektri Xzraka Henry Moseley THE





- Slides: 16

Mozlijev zakon Linijski spektri X-zraka

Henry Moseley THE HIGH FREQUENCY SPECTRA OF THE ELEMENTS By H. G. J. Moseley, M. A. Phil. Mag. (1913), p. 1024 Henri Mozli (1887 -1915): britanski hemičar student Radeforda je briljantno razvio primjenu karakterističnih spektara X-zraka za istraživanje atomskih struktura. Njegova istraživanja su kao rezultat imala korekcije u tada poznatom periodnom sistemu elemenata. On je uspio tačnije odrediti atomske brojeve nekih elemenata. Na žalost, Mozli je poginuo u poznatoj bici Prvog svjetskog rata na Galipolju u Turskoj 1915. godine. Imao je samo 28. godina.

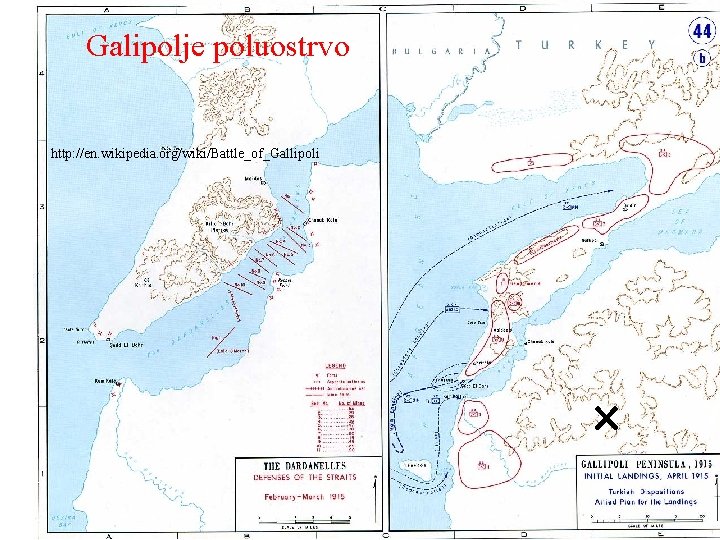
Galipolje poluostrvo http: //en. wikipedia. org/wiki/Battle_of_Gallipoli

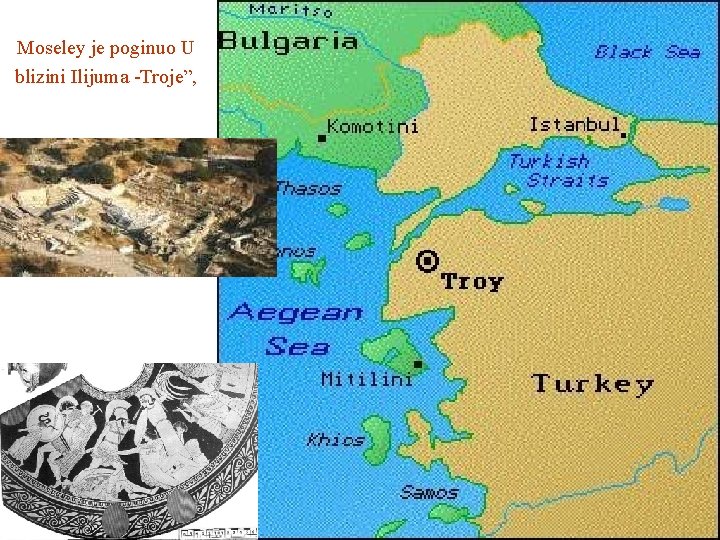
Moseley je poginuo U blizini Ilijuma -Troje”,

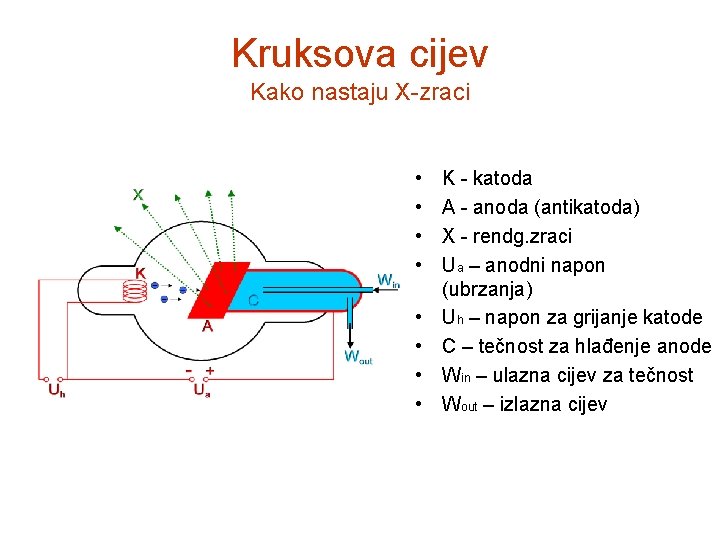
Kruksova cijev Kako nastaju X-zraci • • K - katoda A - anoda (antikatoda) X - rendg. zraci Ua – anodni napon (ubrzanja) Uh – napon za grijanje katode C – tečnost za hlađenje anode Win – ulazna cijev za tečnost Wout – izlazna cijev

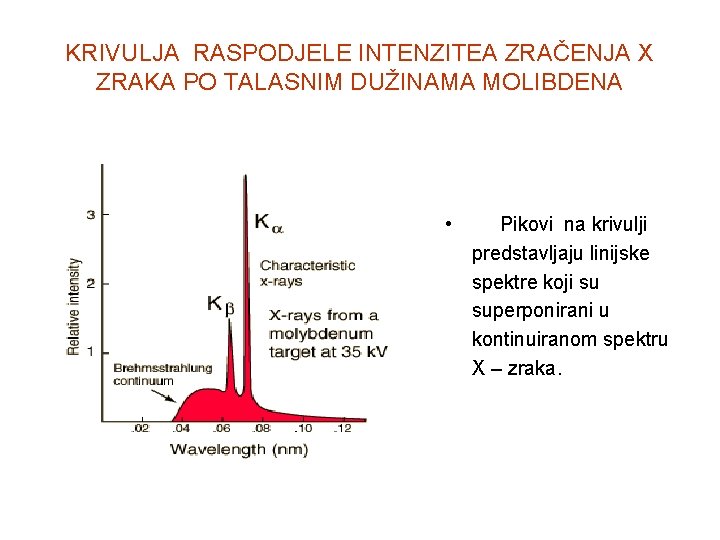
KRIVULJA RASPODJELE INTENZITEA ZRAČENJA X ZRAKA PO TALASNIM DUŽINAMA MOLIBDENA • Pikovi na krivulji predstavljaju linijske spektre koji su superponirani u kontinuiranom spektru X – zraka.

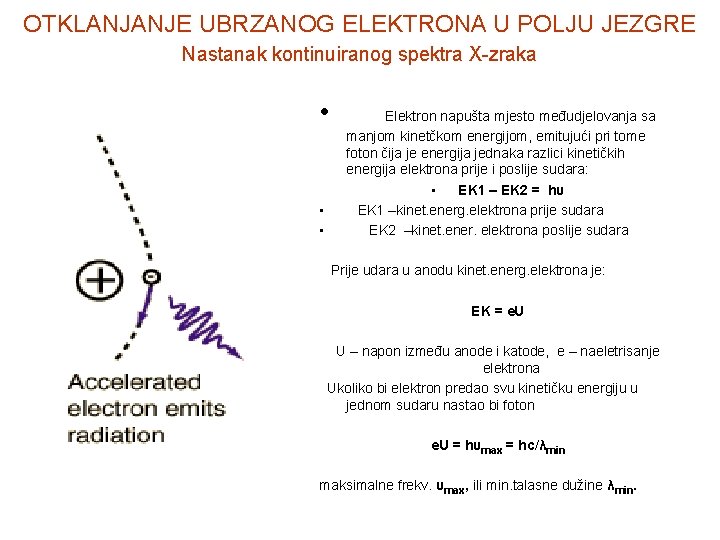
OTKLANJANJE UBRZANOG ELEKTRONA U POLJU JEZGRE Nastanak kontinuiranog spektra X-zraka • Elektron napušta mjesto međudjelovanja sa • • manjom kinetčkom energijom, emitujući pri tome foton čija je energija jednaka razlici kinetičkih energija elektrona prije i poslije sudara: • EK 1 – EK 2 = hυ EK 1 –kinet. energ. elektrona prije sudara EK 2 –kinet. ener. elektrona poslije sudara Prije udara u anodu kinet. energ. elektrona je: EK = e. U U – napon između anode i katode, e – naeletrisanje elektrona Ukoliko bi elektron predao svu kinetičku energiju u jednom sudaru nastao bi foton e. U = hυmax = hc/λmin maksimalne frekv. υmax, ili min. talasne dužine λmin.

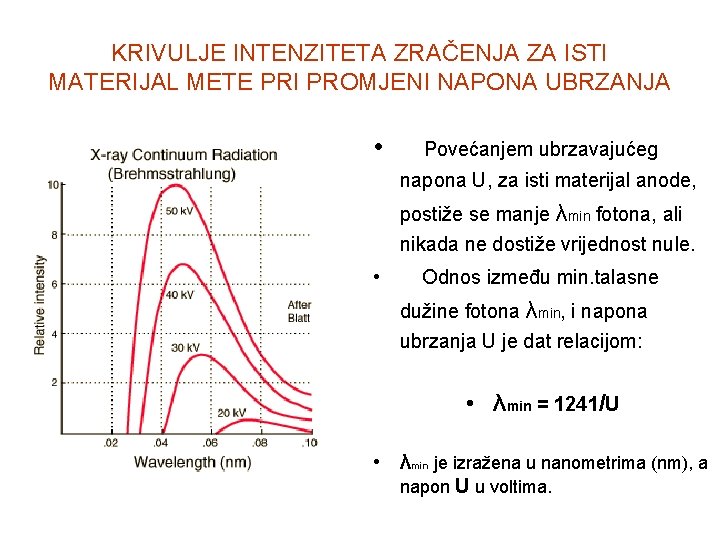
KRIVULJE INTENZITETA ZRAČENJA ZA ISTI MATERIJAL METE PRI PROMJENI NAPONA UBRZANJA • Povećanjem ubrzavajućeg napona U, za isti materijal anode, postiže se manje λmin fotona, ali nikada ne dostiže vrijednost nule. • Odnos između min. talasne dužine fotona λmin, i napona ubrzanja U je dat relacijom: • λmin = 1241/U • λmin je izražena u nanometrima (nm), a napon U u voltima.

DIJAGRAM ZAVISNOSTI KORJENA IZ FREKVENCIJE ZRAČENJA LINIJSKOG SPEKTRA OD REDNOG BROJA Z • Mozli se oslonio na Borovu teoriju po kojoj je energija elektrona na prvoj orbiti proporcionalna sa kvadratom naelektrisanja jezgra: • E 1 = - • stoga će i frekvencija fotona X - zraka ν, biti zavisna od atomskog broja elementa mete (E = hν). Krivulje sa dijagrama se mogu opisati jednačinom: gdje su An i b konstante koje treba odrediti za svaku liniju u spektru.

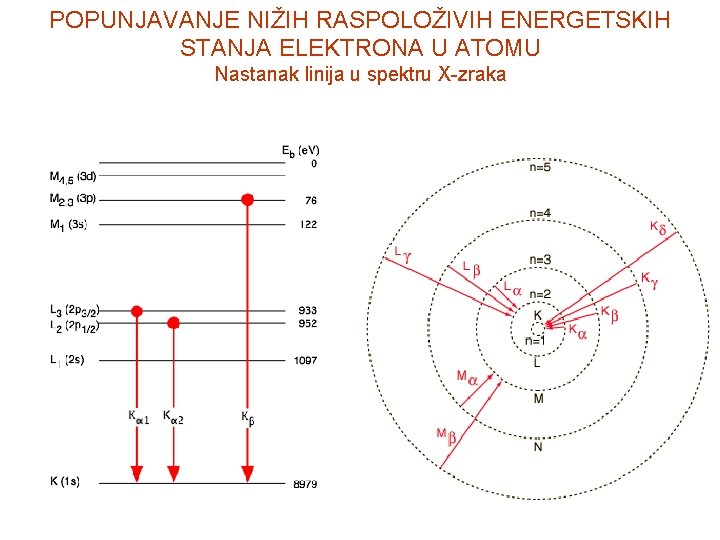
POPUNJAVANJE NIŽIH RASPOLOŽIVIH ENERGETSKIH STANJA ELEKTRONA U ATOMU Nastanak linija u spektru X-zraka

(1) Mozli je u Borovu formulu za frakvencije linijskog spektra vodonikovog atoma: (2) uvrstio vrijednost k=1, a Z zamijenio sa sa (Z - 1) i dobio frekvencije linija iz K-serije Iz formula (1) i (2) dobićemo da je konstanta An Talasna dužina K- serije će biti

Isti rezultat dobijemo iz privlačne sile jezgra s nabojem (Z-1) i elektrona: uz primjenu Borovog kvantnog uslova mvr = nћ Onda je: ili

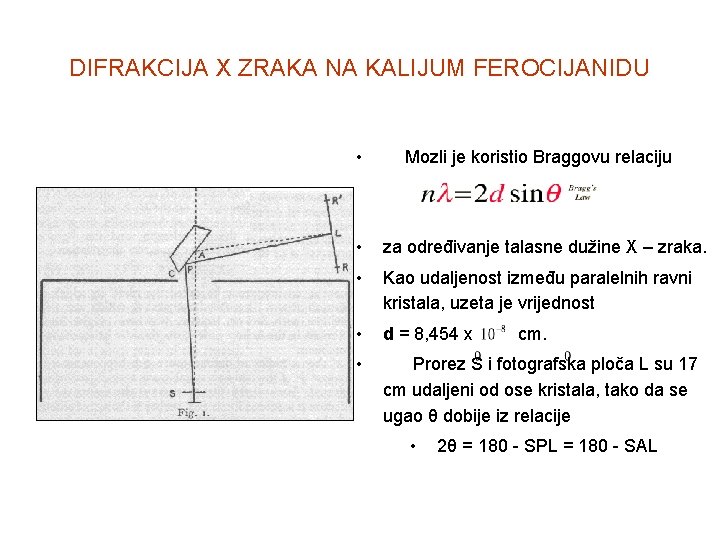
DIFRAKCIJA X ZRAKA NA KALIJUM FEROCIJANIDU • Mozli je koristio Braggovu relaciju • za određivanje talasne dužine X – zraka. • Kao udaljenost između paralelnih ravni kristala, uzeta je vrijednost • d = 8, 454 x cm. • Prorez S i fotografska ploča L su 17 cm udaljeni od ose kristala, tako da se ugao θ dobije iz relacije • 2θ = 180 - SPL = 180 - SAL

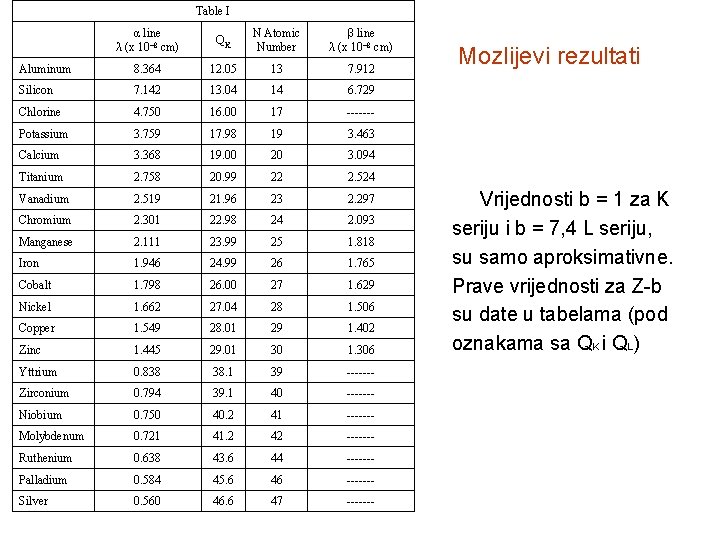
Table I α line λ (x 10¯ 8 cm) QK N Atomic Number β line λ (x 10¯ 8 cm) Aluminum 8. 364 12. 05 13 7. 912 Silicon 7. 142 13. 04 14 6. 729 Chlorine 4. 750 16. 00 17 ------- Potassium 3. 759 17. 98 19 3. 463 Calcium 3. 368 19. 00 20 3. 094 Titanium 2. 758 20. 99 22 2. 524 Vanadium 2. 519 21. 96 23 2. 297 Chromium 2. 301 22. 98 24 2. 093 Manganese 2. 111 23. 99 25 1. 818 Iron 1. 946 24. 99 26 1. 765 Cobalt 1. 798 26. 00 27 1. 629 Nickel 1. 662 27. 04 28 1. 506 Copper 1. 549 28. 01 29 1. 402 Zinc 1. 445 29. 01 30 1. 306 Yttrium 0. 838 38. 1 39 ------- Zirconium 0. 794 39. 1 40 ------- Niobium 0. 750 40. 2 41 ------- Molybdenum 0. 721 41. 2 42 ------- Ruthenium 0. 638 43. 6 44 ------- Palladium 0. 584 45. 6 46 ------- Silver 0. 560 46. 6 47 ------- Mozlijevi rezultati Vrijednosti b = 1 za K seriju i b = 7, 4 L seriju, su samo aproksimativne. Prave vrijednosti za Z-b su date u tabelama (pod oznakama sa QK i QL)

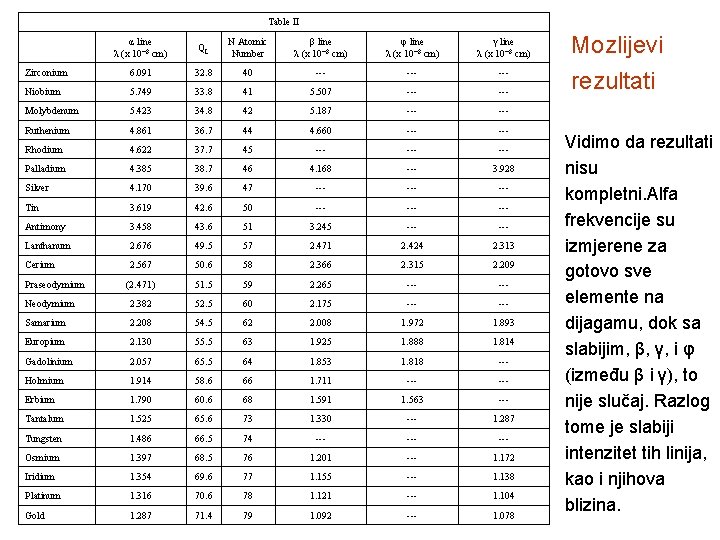
Table II α line λ (x 10¯ 8 cm) QL N Atomic Number β line λ (x 10¯ 8 cm) φ line λ (x 10¯ 8 cm) γ line λ (x 10¯ 8 cm) Zirconium 6. 091 32. 8 40 --- Niobium 5. 749 33. 8 41 5. 507 --- Molybdenum 5. 423 34. 8 42 5. 187 --- Ruthenium 4. 861 36. 7 44 4. 660 --- Rhodium 4. 622 37. 7 45 --- Palladium 4. 385 38. 7 46 4. 168 --- 3. 928 Silver 4. 170 39. 6 47 --- Tin 3. 619 42. 6 50 --- Antimony 3. 458 43. 6 51 3. 245 --- Lanthanum 2. 676 49. 5 57 2. 471 2. 424 2. 313 Cerium 2. 567 50. 6 58 2. 366 2. 315 2. 209 (2. 471) 51. 5 59 2. 265 --- Neodymium 2. 382 52. 5 60 2. 175 --- Samarium 2. 208 54. 5 62 2. 008 1. 972 1. 893 Europium 2. 130 55. 5 63 1. 925 1. 888 1. 814 Gadolinium 2. 057 65. 5 64 1. 853 1. 818 --- Holmium 1. 914 58. 6 66 1. 711 --- Erbium 1. 790 60. 6 68 1. 591 1. 563 --- Tantalum 1. 525 65. 6 73 1. 330 --- 1. 287 Tungsten 1. 486 66. 5 74 --- Osmium 1. 397 68. 5 76 1. 201 --- 1. 172 Iridium 1. 354 69. 6 77 1. 155 --- 1. 138 Platinum 1. 316 70. 6 78 1. 121 --- 1. 104 Gold 1. 287 71. 4 79 1. 092 --- 1. 078 Praseodymium Mozlijevi rezultati Vidimo da rezultati nisu kompletni. Alfa frekvencije su izmjerene za gotovo sve elemente na dijagamu, dok sa slabijim, β, γ, i φ (između β i γ), to nije slučaj. Razlog tome je slabiji intenzitet tih linija, kao i njihova blizina.

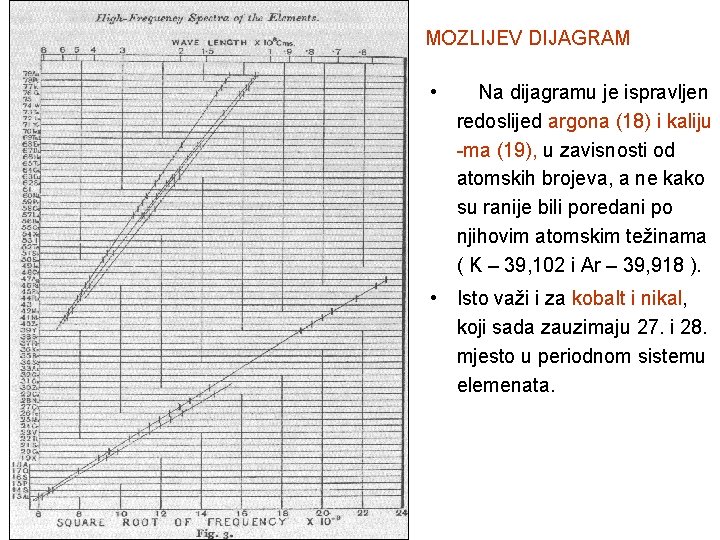
MOZLIJEV DIJAGRAM • Na dijagramu je ispravljen redoslijed argona (18) i kaliju -ma (19), u zavisnosti od atomskih brojeva, a ne kako su ranije bili poredani po njihovim atomskim težinama ( K – 39, 102 i Ar – 39, 918 ). • Isto važi i za kobalt i nikal, koji sada zauzimaju 27. i 28. mjesto u periodnom sistemu elemenata.
 Kontinualni spektar
Kontinualni spektar Bregova formula
Bregova formula Mozlijev zakon
Mozlijev zakon хенри мозли
хенри мозли Mozlijev zakon
Mozlijev zakonHenry moseley atomic theory timeline
 Henry moseley contribution to the periodic table
Henry moseley contribution to the periodic table Insert metodi
Insert metodi Molekulski spektri
Molekulski spektri Tavola periodica degli elementi mappa concettuale
Tavola periodica degli elementi mappa concettuale Linijski dijagram
Linijski dijagram Razgranati algoritmi
Razgranati algoritmi Prikaz i analiza podataka 6 razred
Prikaz i analiza podataka 6 razred Konkavno konveksna masa
Konkavno konveksna masa La tabla periódica actual fue diseñada por el alemán
La tabla periódica actual fue diseñada por el alemán Gesetz von moseley
Gesetz von moseley Trofazni sustav spoj u zvijezdu
Trofazni sustav spoj u zvijezdu