TALASNO KORPUSKULARNA PRIRODA ELEKTROMAGNETNIH ZRAENJA 1 ELEKTROMAGNETNA ZRAENJA





























- Slides: 40

TALASNO – KORPUSKULARNA PRIRODA ELEKTROMAGNETNIH ZRAČENJA 1

ELEKTROMAGNETNA ZRAČENJA TALASNO – KORPUSKULARNE PRIRODE • Pitanje prirode svetlosti privlačilo je pažnju istraživača još od najranijih vremena. • Međutim, prve naučne teorije o prirodi svetlosti datiraju iz XVIIveka. • Shvatanja o prirodi svetlosti znatno su menjala s razvojem nauke, tako da se ni danas taj problem ne smatra potpuno okončanim. • Izučavajući prirodu svetlosti Isak Njutn je postavio 1675. godine teoriju, po kojoj se svetlost svodi na kretanje veoma malih i brzih čestica, tzv. korpuskula, čije se kretanje pokorava zakonima klasične mehanike. • Time je Njutn postavio tzv. korpuskularnu teoriju o prirodi svetlosti. 2

• Prema ovoj teoriji, svetlost se od svetlosnog izvora prostire u vidu čestica na sve strane. • Odbijanje svetlosti tumačeno je kao odbijanje elastičnih lopti od prepreke. Različite boje tumačene su kao postojanje čestica različite veličine. • Holandski naučnik Kristijan Hajgens postavio je, skoro u isto vreme, talasnu teoriju o prirodi svetlosti. • Prema ovoj teoriji, svetlost je talasne prirode. Odbijanje svetlosti objašnjava se isto kao i odbijanje svakog drugog talasa, dok su boje svetlosti opisivane postojanjem svetlosti različitih talasnih dužina. • Međutim, kada je Maksvel 1863. godine postavio teoriju elektromagnetnih talasa, mnogi naučnici su smatrali da je Hajgensova teorija o talasnoj prirodi svetlosti jedina ispravna. • Talasna priroda svetlosti kasnije je potvrđena interferencijom, difrakcijom i polarizacijom svetlosti. 3

• Ova teorija nije mogla da prevagne u to vreme, jer je Njutn još uvek bio jak autoritet u odnosu na Hajgensa. • Međutim, kada je Maksvel 1863. godine postavio teoriju elektromagnetnih talasa, mnogi naučnici su smatrali da je Hajgensova teorija o talasnoj prirodi svetlosti jedina ispravna, a da Njutnovu korpuskularnu teoriju treba odbaciti. • Posle ovoga prevagu je dobila talasna teorija svetlosti, tim pre što su se njome lako opisivale mnoge svetlosne pojave – odbijanje, prelamanje, poralrizacija, interferencija i difrakcija svetlosti. • Dalja istraživanja svetlosti pokazala su da svetlost ima identična svojstva kao i ostali elektromagnetni talasi i da je među njima jedina razlika u talasnoj dužini - za vidljivu svetlost ona iznosi od 380 - 760 nm. 4

• Talasna teorija nije mogla da objasni neke pojave vezane za EM talase vrlo visokih frekvencija - infracrveno zračenje, vidljiva svetlost, ultraljubičasto zračenje, X-zraci, -zraci. • Zatim : • zakon zračenja apsolutno crnog tela, • fotoefekat, • pojavu atomskih spektara itd. . . • Nedostaci Maksvelove teorije su doveli do razvoja kvantne fizike. 5

• Nemački naučnik Plank 1900. godine, proučavjaući problem zračenja apsolutno crnog tela, postavio je teoriju kvanta. • On je pretpostavio da se zračenje tela vrši u strogo određenim količinama energije, tzv. kvantima. • Ova teorija kao da ide na ruku Njutnovoj korpuskularnoj teoriji i pored toga što se kvanti energije ne zamišljaju kao čestice u mehaničkom smislu , već kao fotoni svetlosti , koje prvenstveno karakteriše energija kojom raspolažu. • Koristeći kvantnu teoriju, Ajnštajn je uspeo da objasni fotoelektrični efekat 1905. godine i za to je dobio Nobelovu nagradu. • Istraživači su bili u dilemi. • Za koju se teoriju opredeliti? • Pokazalo se da su i jedna i druga teorija pogodne za objašnjenje nekih svetlosnih pojava. • Ovu dilemu rešio je 1924. godine francuski naučnik Luj de Brolj. On je uveo pretpostavku da se svetlosti pa i svakoj čestici u kretanju može pripisati i talasna i korpuskularna priroda. • Kasnije je to nepobitno dokazano. 6

ZAKONI ZRAČENJA APSOLUTNO CRNOG TELA • Usled termalnog kretanja molekula i atoma, svako telo na temperaturi iznad apsolutne temperature zrači elektromagnetne talase. • Sa porastom temperature raste intenzitet termalnog kretanja i količina zračenja koje ono emituje. • Promena temeprature tela u znatnoj meri utiče i na vrstu zračenja. • Eksperimentalno je utvrđeno da telo na temperaturi oko 500⁰C zrači vidljivu crvenkastu svetlost. • Spektralna raspodela emitovane svetlosti menja se sa promenom temperature. • Na istim temeraturama bolje zrače tela koja bolje apsorbuju toplotno zračenje. • Glavni faktor koji utiče na ovaj proces je boja tela. 7

• Tela crne boje više zrače od tela drugih boja. • Tela crne boje takođe više i apsorbuju toplotu od tela drugih boja. • Takvo telo koje predstavlјa idealni apsorber i emiter zračenja zove se - apsolutno crno telo. • Približno crno telo se može napraviti pomoću šupljine sa unutrašnjim zidovima obloženim (metalom) materijom koja savršeno reflektuje elektromagnetne talase i koje ima veoma malu rupu na površini. • Zračenje ulazi kroz rupu i biva zarobljena unutar šupljine, koja ga apsorbuje kao crno tijelo. • Sa druge strane, kada se šupljina zagreva do temperature T na površini tijela, zračenje napušta šupljinu koja time postaje savršen emiter. • Sa porastom temperature šupljina počinje da isijava. 8

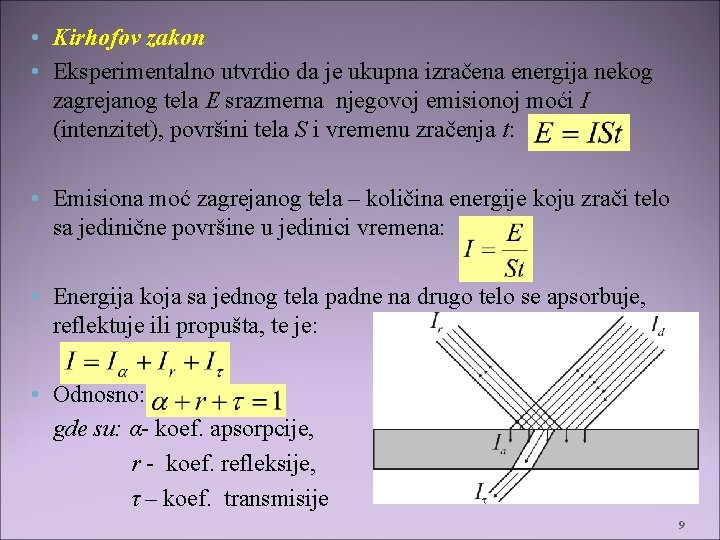
• Kirhofov zakon • Eksperimentalno utvrdio da je ukupna izračena energija nekog zagrejanog tela E srazmerna njegovoj emisionoj moći I (intenzitet), površini tela S i vremenu zračenja t: • Emisiona moć zagrejanog tela – količina energije koju zrači telo sa jedinične površine u jedinici vremena: • Energija koja sa jednog tela padne na drugo telo se apsorbuje, reflektuje ili propušta, te je: • Odnosno: gde su: α- koef. apsorpcije, r - koef. refleksije, τ – koef. transmisije 9

• Ako je: • α = 1 – apsolutno crno telo – apsorbuje svu energuju koja padne na njega r = 1 – apsolutno belo telo – reflektuje svu energuju koja padne na njega • τ =1 – dijatermičko telo – apsolutno propustljivo telo. • • Proučavajući odnose apsorpcione i emisone moći Krihof je došao da važnih zaključaka – objedinjenih u Kirhofovom zakonu. • Kirhofov zakon: odnos između emisionih moći ma kojih dveju površina na datoj temperaturi jednak je odnosu njihovih koeficijenta apsorpcije, tj. : • Odnos emisione i apsorpcione moći nekog tela zavisi od njegove prirode. • Što je veća sposobnost tela da aporbuje zračenje, veća mu je i sposobnost da emituje isto. • Kirhof je eksperimentalno dokazao da emisona moć jednod tela zavisi od talasne dužine emitovanog zračenja i njegove aposlutne temeprature: 10

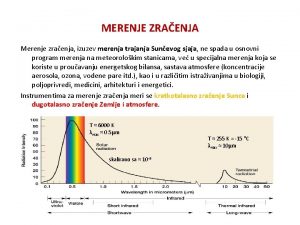
• Eksperimentalno se pokazalo se da u stanju ravnoteže emitovano zračenje ima dobro definisanu, neprekidnu distribuciju energije: da svakoj talasnoj dužini (frekvenciji) odgovara neka gustina energije koja zavisi od hemijske strukture objekta ali ne zavisi, recimo, od njegovog oblika, već samo od temperature, kao na slici. • Spektralna raspodela gustine energije za različite temperature crnog tela. 11

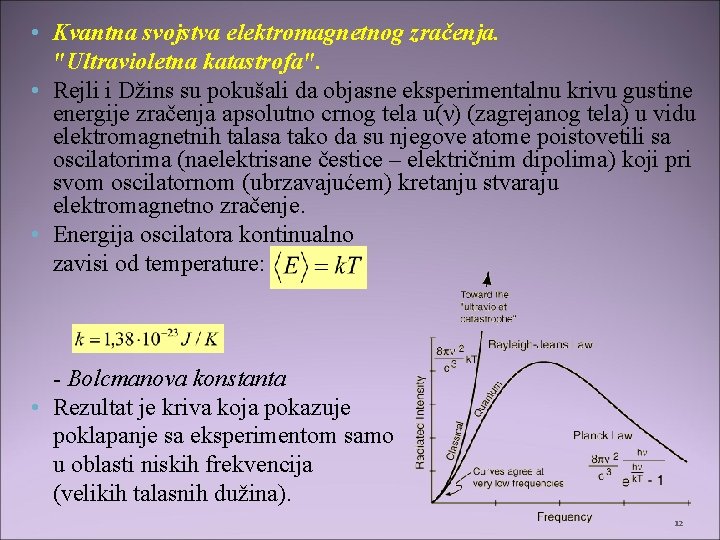
• Kvantna svojstva elektromagnetnog zračenja. "Ultravioletna katastrofa". • Rejli i Džins su pokušali da objasne eksperimentalnu krivu gustine energije zračenja apsolutno crnog tela u(ν) (zagrejanog tela) u vidu elektromagnetnih talasa tako da su njegove atome poistovetili sa oscilatorima (naelektrisane čestice – električnim dipolima) koji pri svom oscilatornom (ubrzavajućem) kretanju stvaraju elektromagnetno zračenje. • Energija oscilatora kontinualno zavisi od temperature: - Bolcmanova konstanta • Rezultat je kriva koja pokazuje poklapanje sa eksperimentom samo u oblasti niskih frekvencija (velikih talasnih dužina). 12

• Plankov zakon zračenja • Pokušaji teorijskog odredjivanja emisione moći zračenja apsolutnog crnog tela sa aspekta klasične fizike nisu bili uspešni. • Maks Plank (1900. ) uzima da se energija oscilatora (rezonatora) ne menja kontinualno, već diskretno, u koracima – kvantima (tj. da je kvantovana veličina). • Energija kvanta je funkcija frekvencije ν. • Energija može da im se promeni samo za tačno određen iznos energije: • gde je n=0, 1, 2, 3. . –kvantni broj (celobrojne vrednosti) • - Plankova konstanta. 13

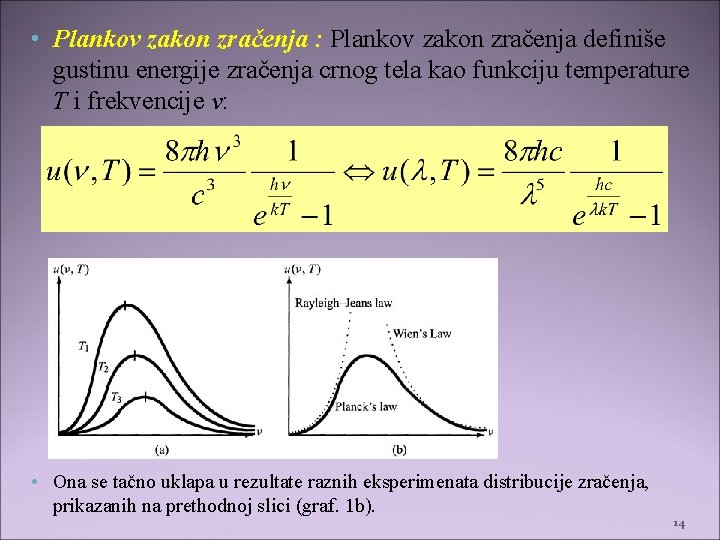
• Plankov zakon zračenja : Plankov zakon zračenja definiše gustinu energije zračenja crnog tela kao funkciju temperature T i frekvencije ν: • Ona se tačno uklapa u rezultate raznih eksperimenata distribucije zračenja, prikazanih na prethodnoj slici (graf. 1 b). 14

• Štefan-Bolcmanov zakon • Eksperimenti pokazuju da je brzina gubitka toplote direktno poroporcionalna četvrtom stepenu njegove temeprature i da je za crna tela veća nego za bela, kao i za tela veće površine: • gde su : σ – Štefan - Bolcmanova konstanta, S – površina tela, a e – emisivnost: za crna tela e=1, za bela e=0. • Ts – temperatura okoline; • Tt – temperatura tela. 15

• Štefan-Bolcmanov zakon: Energija koju izrači apsolutno crno telo sa jedinice površine u jedinici vremena (intenzitet ili ukupna snaga po jedinici površine isijane energije - emisiona moć) proporcionalna je četvrtom stepenu njegove apsolutne temperature: • - Štefan - Bolcmanova konstanta • Emisiona moć I (sposobnost) bilo kojeg tela zavisi od relativne emisione sposobnosti tela e (0 < e < 1), koja je karakteristika materijala i strukture površine tela koje zrači. • Iz Plankovog zakona zračenja Štefan – Bolcmanov zakon : 16

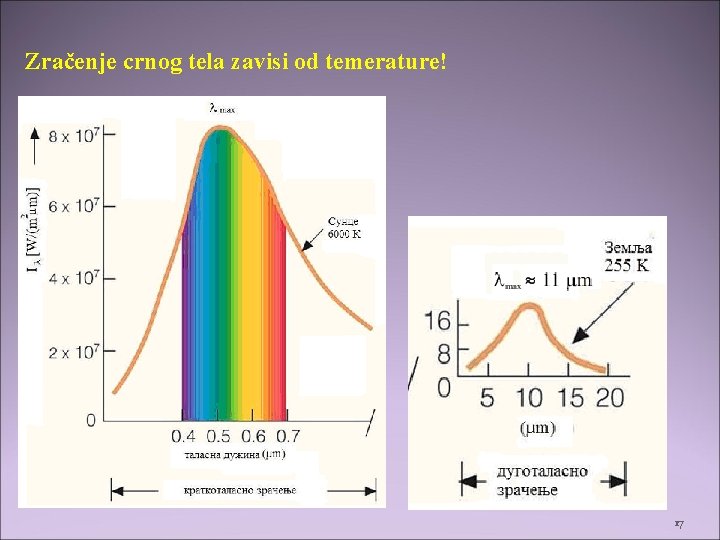
Zračenje crnog tela zavisi od temerature! 17

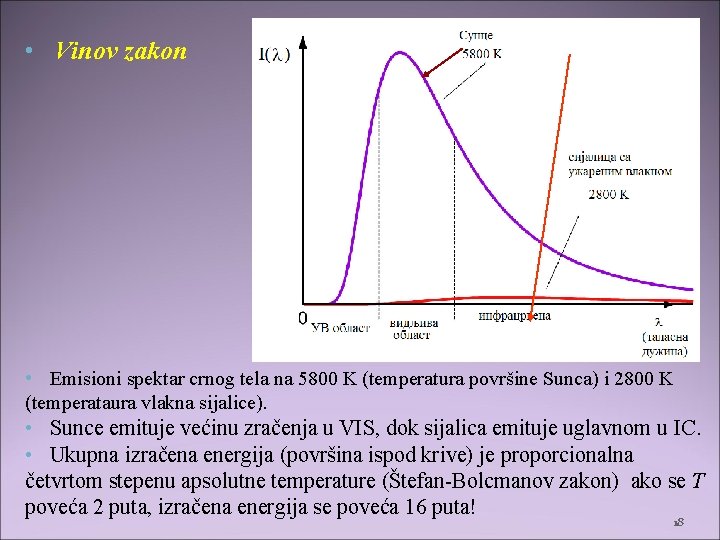
• Vinov zakon • Emisioni spektar crnog tela na 5800 K (temperatura površine Sunca) i 2800 K (temperataura vlakna sijalice). • Sunce emituje većinu zračenja u VIS, dok sijalica emituje uglavnom u IC. • Ukupna izračena energija (površina ispod krive) je proporcionalna četvrtom stepenu apsolutne temperature (Štefan-Bolcmanov zakon) ako se T poveća 2 puta, izračena energija se poveća 16 puta! 18

• Vinov zakon: talasna dužina koja odgovara maksimalnoj emitovanoj energiji obrnuto je proporcionalna odgovarajućoj apsoplutnoj temperaturi: • • Vinova konstanta – • Merenjem te talasne dužine možemo da odredimo kolika je temperatura površine objekta koji zrači. • Iz Plankovog zakona zračenja Vinov zakon: 19

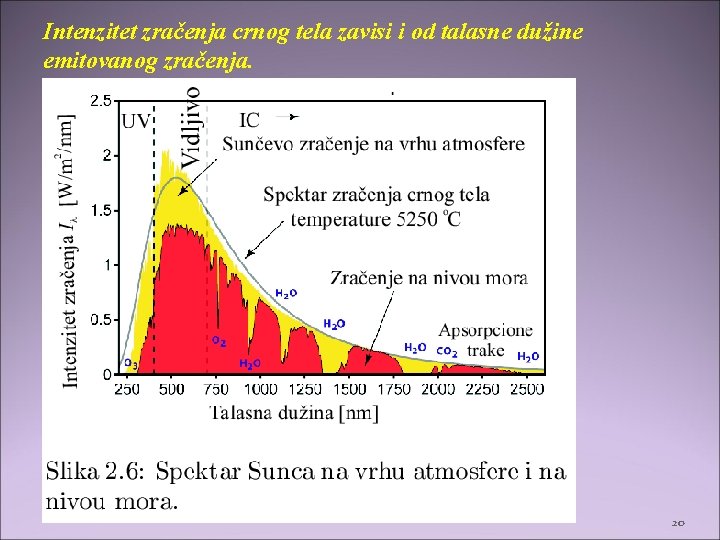
Intenzitet zračenja crnog tela zavisi i od talasne dužine emitovanog zračenja. 20

FOTOELEKTRIČNI EFEKAT • Pojava da neki metal kada se osvetli zrači elektrone – Herc 1887. godine. • Ovaj proces je (kao i zračenje crnog tela) bio u suprotnosti sa klasičnom fizikom. • Eksperimentalno ustanovljene osobine: • Kada EM zračenje dođe na metal elektroni bivaju odmah izbačeni; • Menjanjem frekvencije upadnog zračenja uočava se granična frekvencija ispod koje se efekat ne ispoljava; • Menjanje intenziteta zračenja ne utiče na kinetičku energiju elektrona; • Broj emitovanih elektrona je srazmeran intenzitetu EM zračenja; • Osobine koje je predviđala klasična fizika: • Elektroni ne bi trebalo da budu izbačeni odmah – dok ne nakupe dovoljno energije; • Promena frekvencije zračenja ne bi smelo da utiče na proces; • Povećanjem intenziteta bi trebalo da raste kinetička energija elektrona a ne broj emitovanih elektrona; 21

• 1905. god, fotoefekat je objasnio Ajnštajn (dobio Nobelovu nagradu za to 1921. godine). • Polazna pretpostavka – EM zračenje je kvantovano – sastoji se iz “čestica”. • Kvant EM zračenja – foton: • Energija se niti zrači niti apsorbuje u proizvolјnim iznosima već samo u tačno određenim. • Posledica: kinetička energija fotoelektrona je jednaka razlici energije fotona i izlaznog rada: • Granična frekvencija (ispod koje se on ne dešava) fotoefekta se dobija u graničnom slučaju : 22

MODELI ATOMA • U današnje vreme je poznato da se atom sastoji od relativno malog pozitivno naelektrisanog jezgra (≈10− 15 m) oko kojeg se kreću negativni elektroni na relativno velikom rastojanju (poluprečnik atoma ≈10− 10 m). • Prvi model atoma je statički model - Tomsonov model: atom jeste neutralan ali ima u sebi i + i – naelektrisanja – 1903. model “puding sa šlјivama” u kome elektroni “plivaju”-osciluju oko ravnotežnih položaja u “moru” pozitivnih naelektrisanja. 23

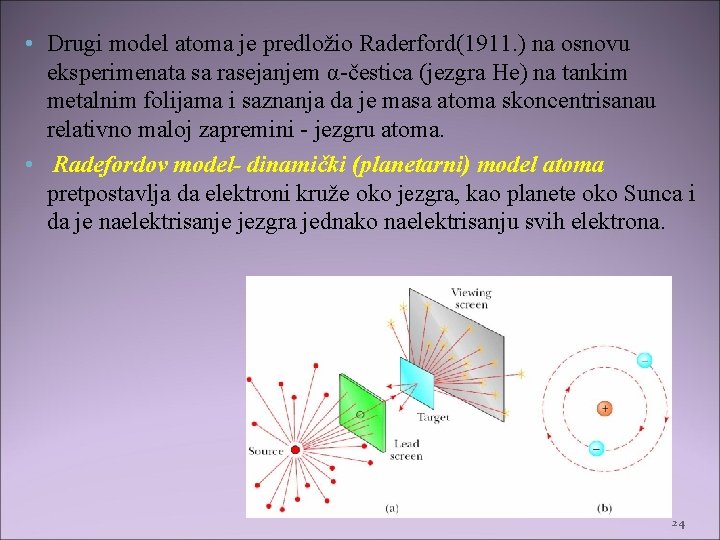
• Drugi model atoma je predložio Raderford(1911. ) na osnovu eksperimenata sa rasejanjem α-čestica (jezgra He) na tankim metalnim folijama i saznanja da je masa atoma skoncentrisanau relativno maloj zapremini - jezgru atoma. • Radefordov model- dinamički (planetarni) model atoma pretpostavlja da elektroni kruže oko jezgra, kao planete oko Sunca i da je naelektrisanje jezgra jednako naelektrisanju svih elektrona. 24

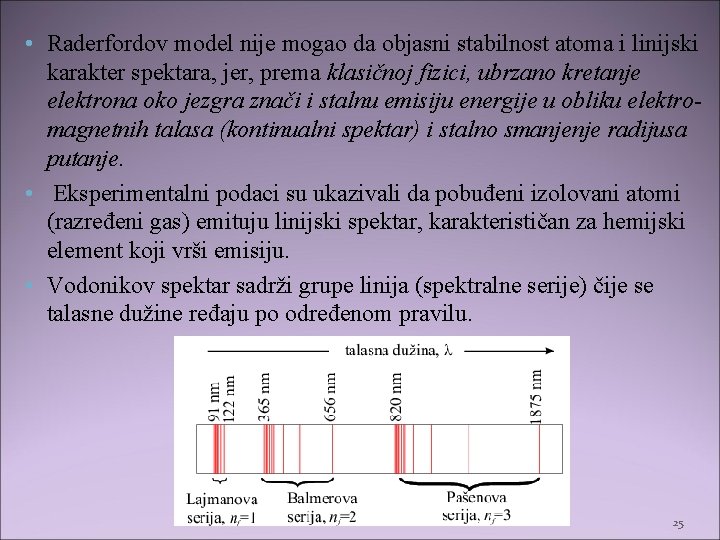
• Raderfordov model nije mogao da objasni stabilnost atoma i linijski karakter spektara, jer, prema klasičnoj fizici, ubrzano kretanje elektrona oko jezgra znači i stalnu emisiju energije u obliku elektromagnetnih talasa (kontinualni spektar) i stalno smanjenje radijusa putanje. • Eksperimentalni podaci su ukazivali da pobuđeni izolovani atomi (razređeni gas) emituju linijski spektar, karakterističan za hemijski element koji vrši emisiju. • Vodonikov spektar sadrži grupe linija (spektralne serije) čije se talasne dužine ređaju po određenom pravilu. 25

• Borov model atoma • Nils Bor (1913. ) je kombinovao Raderfordov planetarni model atoma sa idejama Planka i Ajnštajna o kvantovanju (diskretnosti) energije atoma i elektromagnetnog zračenja, što je rezultovalo definisanjem dva postulata kojima se opisuje atom. • Pretpostavke i postulati na kojima se bazira Borov model atoma su sledeći: • I Borov postulat: Atom se može naći u nizu diskretnih stacionarnih stanja u kojima niti emituje, niti apsorbuje energiju. U tim stanjima elektron se kreće oko jezgra u atomu po kružnoj putanji pod uticajem Kulonove električne privlačne sile. Moment impulsa (količine kretanja) elektro na u takvim stanjima takođe diskretne vrednosti i zadovoljava: 26

• II Borov postulat: Atom emituje ili apsorbuje energiju u vidu kvanata elektromagnetnog zračenja hν prilikom promene stacionarnog stanja, tj. prelaska elektrona između različitih orbita: • Drugim postulatom se opisuje linijski karakter atomskih spektara. • Na osnovu ovih postulata, izračunati su poluprečnici kružnih putanja elektrona i energije elektrona E u stacionarnim stanjima (zbir kinetičke i potencijalne energije u električnom polju jezgra). • To su takođe veličine sa diskretnim vrednostima -tzv. kvantovane veličine. 27

• Energija je negativna – energija veze. Isti iznos ima i energija jonizacije. • Poluprečnici “orbita” su kvantovani: - Borov radijus. 28

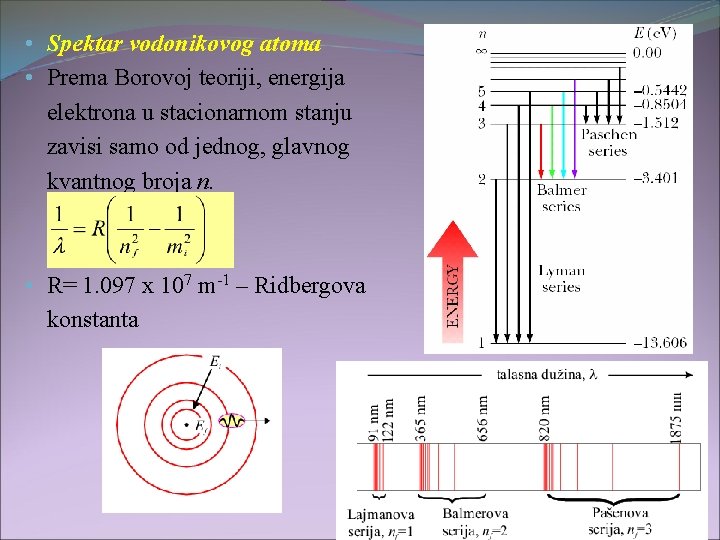
• Spektar vodonikovog atoma • Prema Borovoj teoriji, energija elektrona u stacionarnom stanju zavisi samo od jednog, glavnog kvantnog broja n. • R= 1. 097 x 107 m-1 – Ridbergova konstanta 29

• Kasnije je Borov model modifikovan i primenjen za slučaj vodoniku sličnih jona, osnosno sa jednim elektronom u omotaču atoma (He+, Li 2+, Be 3+). - Z – nalektisanje jona • Neuspesi Borovog modela atoma: spektri (položaj i intenzitet linija) višeelektronskih atoma. • Modifikacija Borovog modela od strane Zomerfelda uvodi pretpostavku o eliptičnosti orbita elektrona i novi kvantni broj orbitalni kvantni broj l, koji karakteriše stanje elektrona u različitim orbitalama sa istom vrednošću n: 30

TALASNA SVOJSTVA MATERIJE • Luj De Brolji (1924. god. ) je postavio obrnuto pitanje: Ako svetlost osim talasnih poseduje i čestična svojstva, da li onda česticama supstance, kao što su, na primer, elektroni, treba takođe, osim čestičnih, pridružiti i talasna svojstva? • Njegovu teoriju su potvrdili Džermer i Dejvison 1927. god. u eksperimentu, kojim je dokazana difrakcija elektrona na kristalima. • - De Broljeva talasna dužina, p – impuls čestice. • Borov kvantni uslov za moment impulsa koji je bio “veštački” uveden je zapravo posledica talasnih osobina elektrona! 31

• Kvantno-mehanički model atoma • Za razliku od Borovog shvatanja strukture atoma koje pretpostavlja postojanje jednog kvantnog broja n kojim se određuje orbita i energija elektrona, savremena kvantna mehanikaje u fiziku atoma uvela 4 kvantna broja pomoću kojih opisuje stanje elektrona ne samo u atomu tipa vodonika veći u višeelektronskim atomima: • n - glavni kvantni broj - određuje ukupnu energiju e atoma - (n=1, 2. . ) • l - orbitalni kvantni broj - određuje moment impulsa(količine kretanja) koji elektroni poseduju zbog orbitalnog kretanja -(l=0, 1, 2, …, (n− 1)) • ml -orbitalni magnetni kvantni broj - određuje ponašanje elektrona u atomskoj orbiti u primenjenom spoljašnjem magnetnom polju, i može imati vrednosti: ml= −l, …, − 2, − 1, 0, 1, 2, …, l • ms - spinski magnetni kvantni broj - određuje spinski moment impulsa koji elektroni poseduju zbog spina, i uzima vrednosti dve projekcije: (ms= −½, + ½) 32

• Kvantno mehanički model atoma • Prema kvantno-mehaničkom pristupu, u atomu položaj elektrona se ne može potpuno sigurno odrediti, već se može govoriti samo o većoj ili manjoj verovatnoći nalaženja elektrona u nekom delu prostora oko jezgra. • Položaj elektrona se uobičajeno predstavlja oblakom verovatnoće, čija se gustina menja postepeno od tačke do tačke. 33

• Problem poretka elektrona po elektronskim ljuskama (omotačima, karakteriše ih glavni kvantni broj n) i podljuskama (karakteriše ih orbitalni kvantni broj l) kod atoma sa više elektrona u osnovnom (stabilnom) stanju rešio je Pauli (1925. ) definisanjem tzv. Paulijev princip isključenja: U atomu dva elektrona ne mogu imati iste vrednosti sva 4 kvantna broja (n, l, ms) ili dva elektrona u atomu se ne mogu naći u istom kvantnom stanju. • Raspored elektrona po kvantnim stanjima naziva se elektronska konfiguracija atoma. 34

• Otkriće atomskog jezgra (Raderford, 1911. , rasejanje α-čestica) – skoro celokupna masa atoma je skoncentrisana u prostoru dimenzija 10− 15 m. • Jezgro sadrži protone - Z i neutrone - N. • Broj protona Z određuje redni broj elementa u Periodnom sistemu, a zbir broja protona (Z) i neutrona (N) daje atomski broj A: • Nelektrisanje jezgra: Ze, e - elementarno naelektrisanje: 35

• Izotopi nekog hemijskog elementa su atomi čija jezgra imaju jednak redni broj Z , a različit broj neutrona N. • Izotopi istog hemijskog elementa se u prirodi nalaze u veoma različitom međusobnom odnosu, a nekih čak ni nema u prirodi, već se u veštačkim (laboratorijskim) uslovima pojavljuju – kao rezultat nuklearnih reakcija. • Primer: ugljenik : , , a postoje jos i: i • Izobari jednak atomski broj A a različito Z i N. • Izotoni jednak broj N a različito Z i A. 36

• Poluprečnik jezgra - se odredjuje eksperimentalno ili modelom tečne kapi: • Zavisi od atomskog broja jezgra. • - zavisi od ekperimentalnih merenja ili detalja modela. • Gustina jezgra je konstantna veličina ( model tečne kapi) za sva jezgra i ne zavisi od vrste atoma. 37

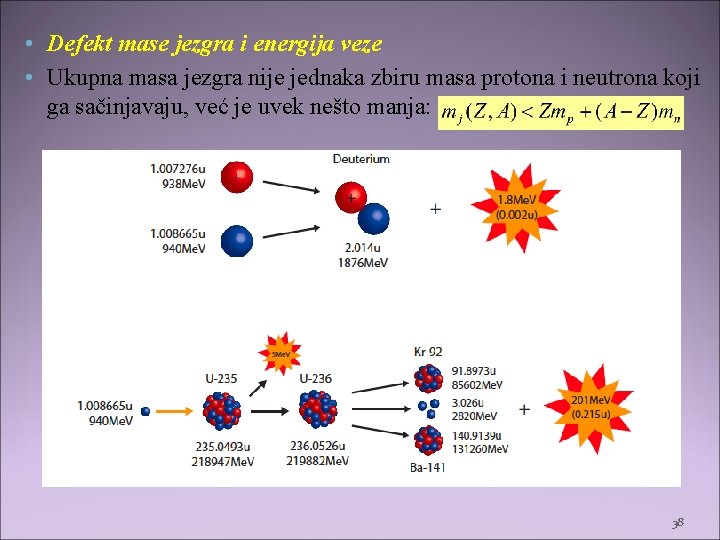
• Defekt mase jezgra i energija veze • Ukupna masa jezgra nije jednaka zbiru masa protona i neutrona koji ga sačinjavaju, već je uvek nešto manja: 38

• Razlika u masi jezgra i njegovih sastavnih delova se naziva defekt mase Δm i odgovara energiji veze Ev nukleona u jezgru : • Energija veze Ev je energija koju je potrebno uložiti za razlaganje jezgra, odnosno energija koja se oslobodi pri stvaranju jezgra. • Prema Ajnštajnovoj relaciji o ekvivalentnosti mase i energije, zbog čega defektu mase Δm odgovara energija veze Ev izražena preko relacije: • Što je energija veze veća, veća je i stabilnost jezgra. • Energija veze po nukleonu , je konstantna veličina u Periodnom sistemu elemenata, što je posledica karakteristika nuklearnih sila. • Za sva jezgra u periodnom sistemu kreće se od 6 -9 Me. V, osim za Helijum – oko 2, 09 Me. V. 39

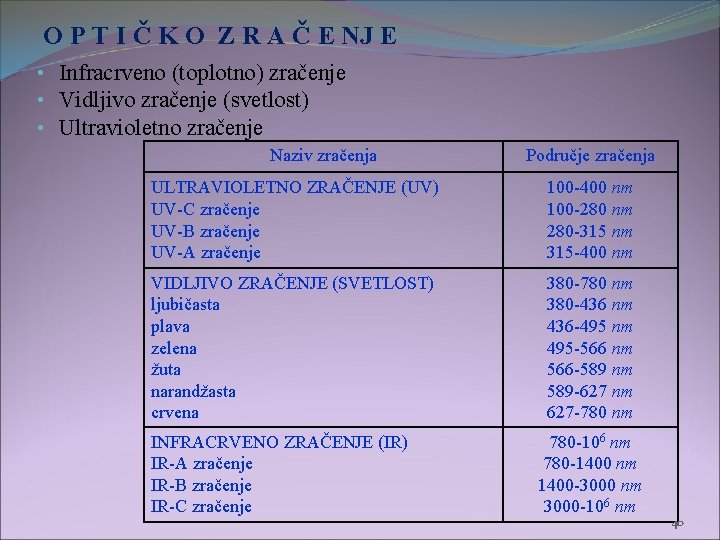
O P T I Č K O Z R A Č E NJ E • Infracrveno (toplotno) zračenje • Vidljivo zračenje (svetlost) • Ultravioletno zračenje Naziv zračenja Područje zračenja ULTRAVIOLETNO ZRAČENJE (UV) UV-C zračenje UV-B zračenje UV-A zračenje 100 -400 nm 100 -280 nm 280 -315 nm 315 -400 nm VIDLJIVO ZRAČENJE (SVETLOST) ljubičasta plava zelena žuta narandžasta crvena 380 -780 nm 380 -436 nm 436 -495 nm 495 -566 nm 566 -589 nm 589 -627 nm 627 -780 nm INFRACRVENO ZRAČENJE (IR) IR-A zračenje IR-B zračenje IR-C zračenje 780 -106 nm 780 -1400 nm 1400 -3000 nm 3000 -106 nm 40
 Elektromagnetna dizalica
Elektromagnetna dizalica Majkl faradej
Majkl faradej Elektromagnetna kompatibilnost
Elektromagnetna kompatibilnost Sferni i ravni talasi
Sferni i ravni talasi Plankov zakon
Plankov zakon Zapaljivi materijali 4 razred
Zapaljivi materijali 4 razred Vijetove formule zadaci
Vijetove formule zadaci Kurikulum priroda i društvo
Kurikulum priroda i društvo Asocijacije turizam
Asocijacije turizam Jednoznačnice
Jednoznačnice živa priroda 4. razred kviz
živa priroda 4. razred kviz Istraživačke vještine priroda i društvo
Istraživačke vještine priroda i društvo Republika hrvatska 4 razred
Republika hrvatska 4 razred Priroda i društvo 4 razred kviz brežuljkasti zavičaj
Priroda i društvo 4 razred kviz brežuljkasti zavičaj Priroda reaktanata
Priroda reaktanata Kruzenje ugljenika u prirodi
Kruzenje ugljenika u prirodi Iz prošlosti domovine hrvatske kviz
Iz prošlosti domovine hrvatske kviz Nacrtana visibaba
Nacrtana visibaba Nacionalni parkovi 4 razred
Nacionalni parkovi 4 razred Najkrajšie miesta na svete ktoré vytvorila príroda
Najkrajšie miesta na svete ktoré vytvorila príroda živá a neživá příroda
živá a neživá příroda Priroda reaktanata
Priroda reaktanata živé prírodniny
živé prírodniny Priroda u proljeće
Priroda u proljeće Kvantna priroda elektromagnetnog zracenja
Kvantna priroda elektromagnetnog zracenja Priroda i društvo 1 razred testovi proljeće
Priroda i društvo 1 razred testovi proljeće Nezive prirodniny
Nezive prirodniny Priroda jezičnog znaka
Priroda jezičnog znaka