Visoka tehnika kola strukovnih studijaaak Predmet Hemija Odsek












![Homogene kataliza A+K [AK] +B [AK] AB+K ØKod homogene katalize jedan od reaktanata gradi Homogene kataliza A+K [AK] +B [AK] AB+K ØKod homogene katalize jedan od reaktanata gradi](https://slidetodoc.com/presentation_image_h/0d6f5840f4c31e995917f95a0ebf4afb/image-21.jpg)











- Slides: 33

Visoka tehnička škola strukovnih studija-Čačak Predmet: Hemija Odsek: Grafička tehnika Ekološki menadžment Predavanje: HEMIJSKA RAVNOTEŽA I KINETIKA HEMIJSKA KINETIKA BRZINA HEMIJSKE REAKCIJE HEMIJSKA RAVNOTEŽA Vesna Veličković, spec. predavač

HEMIJSKA KINETIKA BRZINA HEMIJSKE REAKCIJE HEMIJSKA RAVNOTEŽA

Hemijske reakcije ØHemijska reakcija je interakcija najmanje 2 supstance pri čemu nastaju nove supstance sa novim hemijskim svojstvima. ØVRSTE HEMIJSKIH REAKCIJA: ØANALIZA- rastavljanje složenih supstanci na prostije ØSINTEZA- dobijanje složenih supstanci iz prostijih. ØH 2 O → H 2 + O 2 analiza ØH 2 + O 2→ H 2 O sinteza

Brzina hemijske reakcije je promena koncentracije reaktanata ili proizvoda u jedinici vremena. (+) kada şe posmatra promena koncentracije proizvoda jer njihova koncentracija raste (-) kada se posmatra promena koncentracija reaktanata jer njihova koncentracija opada ( od manjeg se oduzima veće)

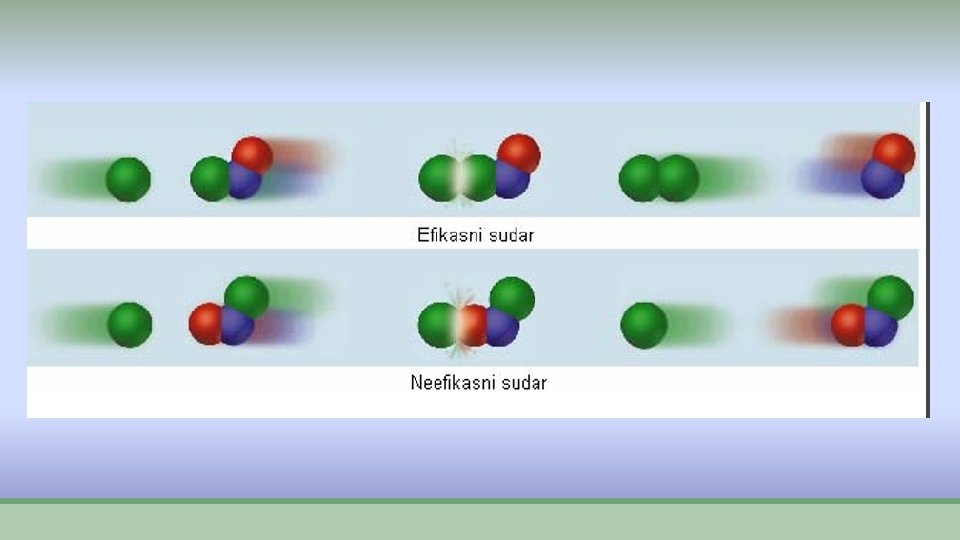
Teorija sudara ØKada se izmešaju reaktanti da bi došlo do hemijske reakcije to jest do nastajanja proizvoda reakcije potrebno je: Ø 1. Čestice reaktanata se moraju sudariti Ø 2. Čestice treba da imaju dovoljnu energiju Ø 3. Čestice treba da se sudare sa pogodnom orjentacijom ØIspunjavanje ovih uslova dodvodi do efikasnog sudara.


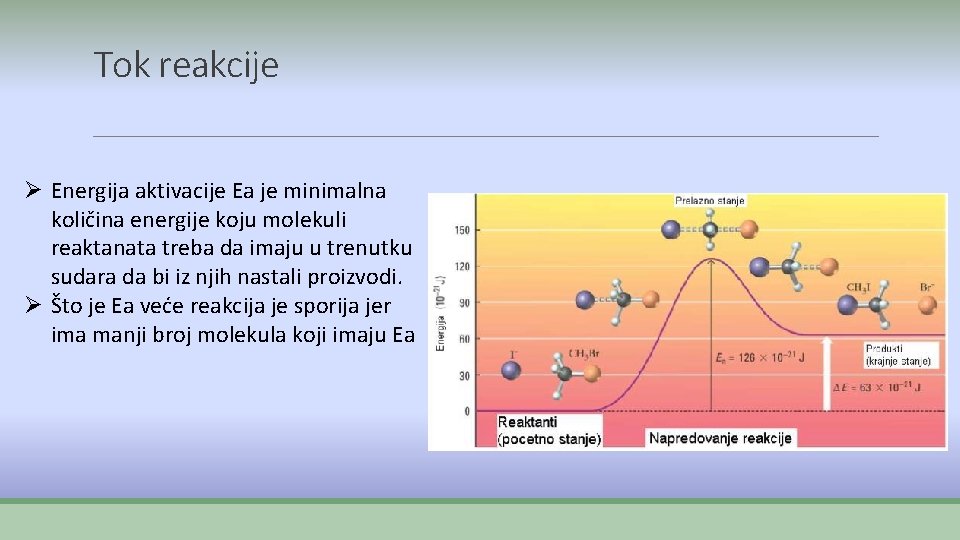
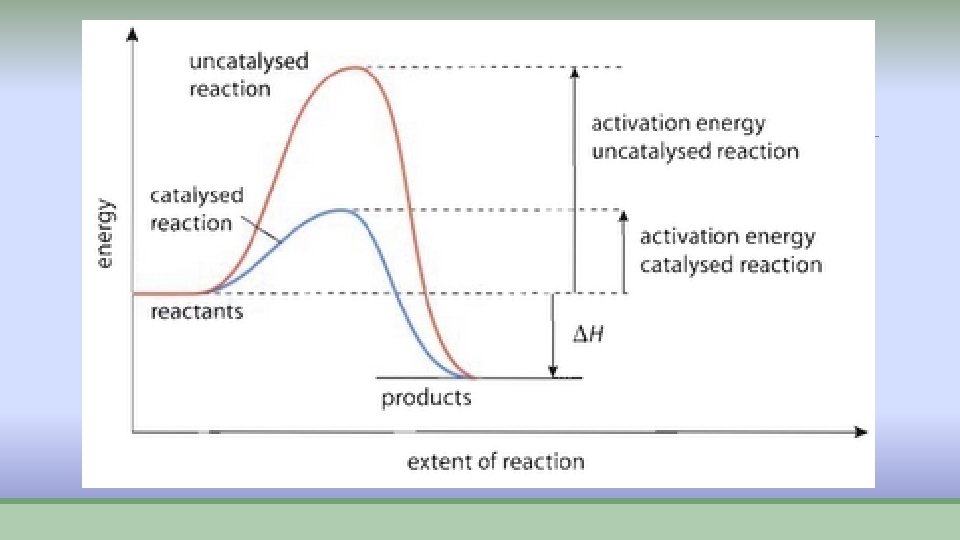
Tok reakcije Ø Energija aktivacije Ea je minimalna količina energije koju molekuli reaktanata treba da imaju u trenutku sudara da bi iz njih nastali proizvodi. Ø Što je Ea veće reakcija je sporija jer ima manji broj molekula koji imaju Ea

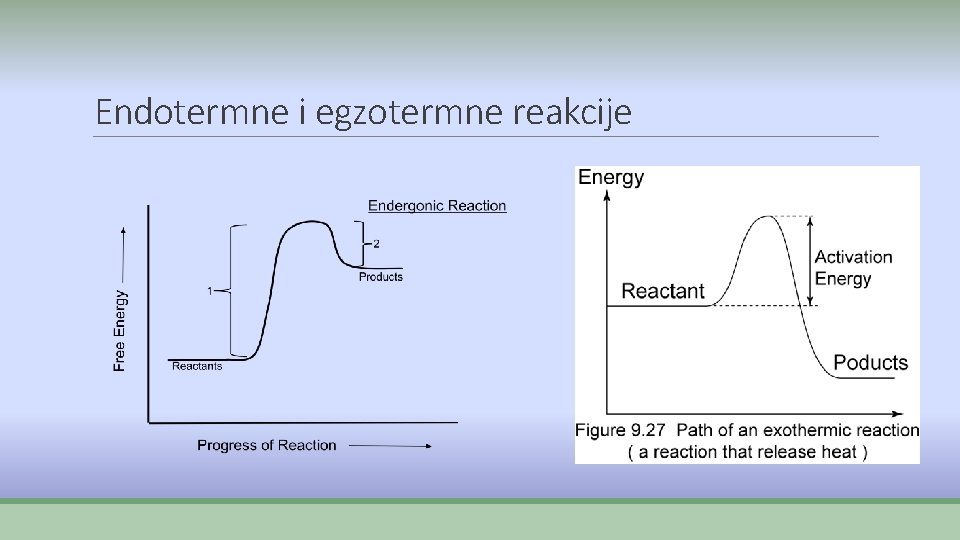
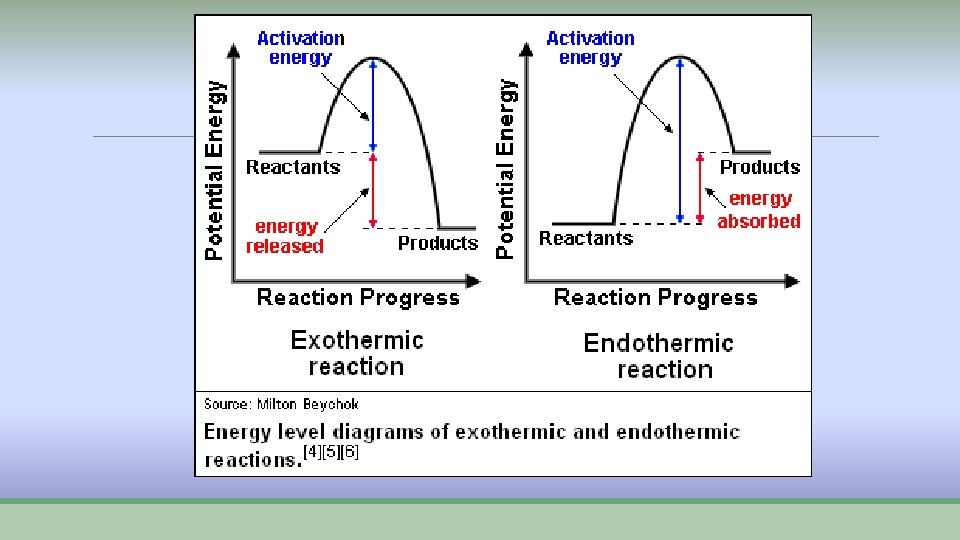
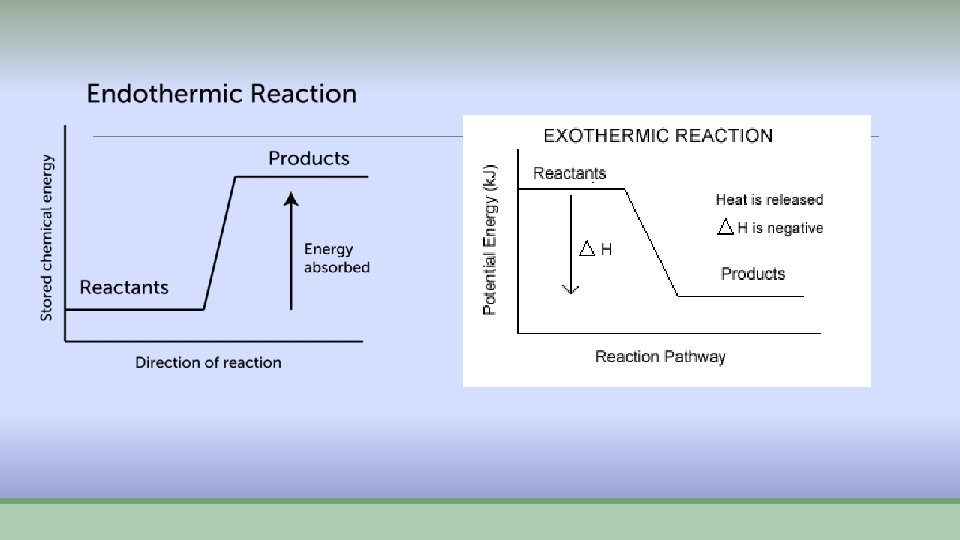
Procesi pri hemijskim reakcijama ØPri hemijskim reakcijama odvijaju se dva procesa: Ø 1. raskidanje starih veza- energija se troši E 1 Ø 2. stvaraju se nove veze- energija se oslobađa E 2 ØAko je E 1> E 2 reakcija se odvija uz utrošak energije- vezuje se toplota -ENDOTERMNA REAKCIJA – „hladna“ ØAko je E 2> E 1 reakcija se opdvija uz oslobađanje energije u vidu toplote- EGZOTERMNA reakcija – „topla“

Endotermne i egzotermne reakcije


Endotermne i egzotermne reakcije ØKod endotermnih reakcija proizvodi imaju veću energiju od reaktanara, pa se energija mora dovoditi. ØKod egzotermnih reakcija proizvodi imaju manju energiju od reaktanata i višak se oslobađa u vidu toplote.


Faktori ØFaktori koji utiču na brzinu hemijske reakcije su: Ø 1. priroda reaktanata Ø 2. temperatura Ø 3. koncentracija Ø 4. prisustvo katalizatora

Priroda reaktanata ØU istoj reakciji različiti reaktanti reaguju različitim brzinama. ØNa primer u reakciji metala sa HCl Mg +2 HCl → Mg. Cl 2 +H 2 Zn + 2 HCl →Zn. Cl 2 + H 2 Sn + 2 HCl →Sn. Cl 2 + H 2 ØBrzina izdvajanja H 2: Mg> Zn> Sn

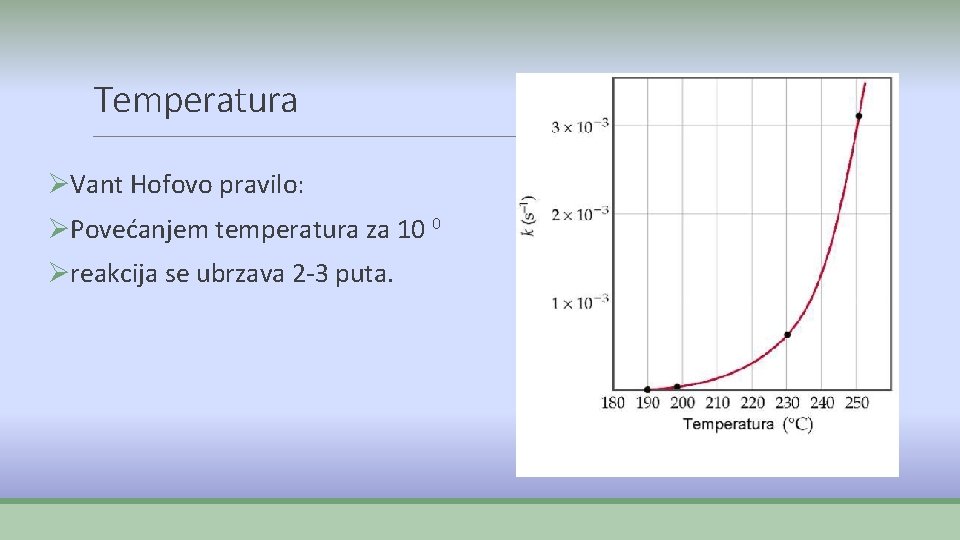
Temperatura ØVant Hofovo pravilo: ØPovećanjem temperatura za 10 0 Øreakcija se ubrzava 2 -3 puta.

Temperatura 1. Povećanjem temperature- dovođenje toplote- povećeve se kinetička energija molekula reaktanata Ek ↗ , - molekuli se brže kreću, - veći je broj sudara, pa i uspešnih sudara.

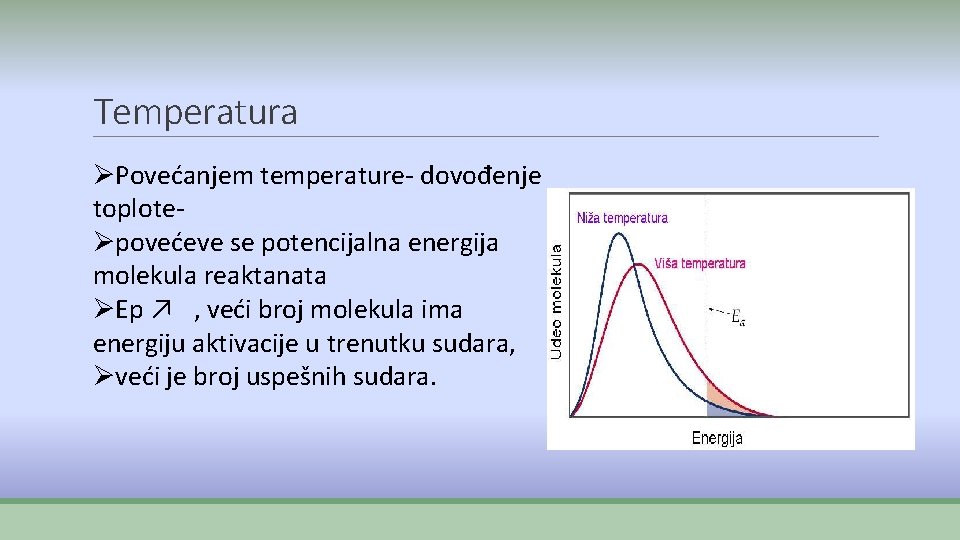
Temperatura ØPovećanjem temperature- dovođenje toploteØpovećeve se potencijalna energija molekula reaktanata ØEp ↗ , veći broj molekula ima energiju aktivacije u trenutku sudara, Øveći je broj uspešnih sudara.

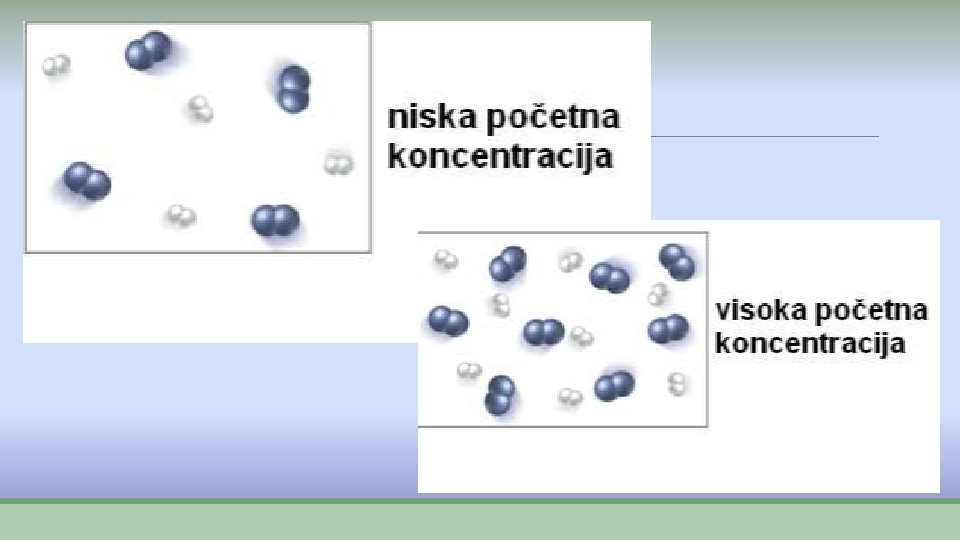
Koncentracija ØPovećanje koncentracije reaktanata znači veći broj molekula u istoj zapremini, što znači veći broj sudara i brža reakcija. ØGuldberg i Vage: Zakon o dejstvu masa: ØBrzina hemijske reakcije je srazmerna proizvodu koncentracija reaktanata na određenoj temperaturi. ØZa reakciju: ØH 2(g) + I 2(g) → 2 HI(g) Øv= k·[H 2] ·[I 2]


Kataliza ØKatalizatori su supstance koje ubrzavaju hemijske reakcije. ØInhibitori su supstance koje usporavaju hemijske reakcije. ØKataliza može biti: ØHOMOGENA- katalizator i reaktanti istog agregatnog stanja ØHETEROGENA- katalizator i reaktanti različitog agregatnog stanja
![Homogene kataliza AK AK B AK ABK ØKod homogene katalize jedan od reaktanata gradi Homogene kataliza A+K [AK] +B [AK] AB+K ØKod homogene katalize jedan od reaktanata gradi](https://slidetodoc.com/presentation_image_h/0d6f5840f4c31e995917f95a0ebf4afb/image-21.jpg)
Homogene kataliza A+K [AK] +B [AK] AB+K ØKod homogene katalize jedan od reaktanata gradi kompleks sa katalizatorom koji ima nižu energiju aktivacije od reakcije bez katalizatora.


Heterogena kataliza ØKod heterogene katalize jedan od reaktanata se vezuje na dodoirnoj površini sa katalizatorom. ØPovećana koncentracija reaktanta u dodirnom sloju ubrzava hemijsku reakciju.

Hemijska ravnoteža Hemijske reakcije mogu biti: NEPOVRATNE- idu do kraja, tj. u reakcionom sudu ima samo proizvoda nakon završene reakcije. A+B C+D POVRATNE - ne idu do kraja, tj. Reaktanti reaguju dajući proizvode a onda proizvodi reaguju dajući ponovo reaktante. U reakcionom sudu ima i reaktanata i proizvoda. A+B C +D A +B C+ D

Hemijska ravnoteža ØNa početku reakcije c. A i c. B je maksimalno pa je v 1 =max a c. C i c. D =0 pa je i v 2=0 ØU toku reakcije c. A i c. B opada pa i v 1 opada, a c. C i c. D raste tako da v 2 raste Sve dok se ne izjednače. ØTada nastupa DINAMIČKA RAVNOTEŽA. ØReakcije se ne zaustavljaju, već teku istom brzinom (dinamička) v 1 =v 2 ØKocentracija reaktanata i proizvoda se ne menja. Koliko se nagradi proizvoda toliko se i razgradi.

Hemijska ravnoteža Za reakciju a. A +b. B Ako je v 1=v 2 onda je k 1 • [A]a • [B]b = k 2 • [C ]c • [D]d c. C + d. D

Hemijska ravnoteža Ako je Kr velika vrednost u reakcionom sudu ima više proizvoda nego reaktanata Ako je Kr mala vrednost u reakcionom sudu ima više reaktanata ngo proizvoda hemijske reakcije

Faktori koji utiču na hemijsku ravnotežu su: 1. Temperatura 2. Koncentracija 3. Pritisak kod gasova Katalzatori ne utiču na položaj ravnoteže već samo ubrzavaju nastajanje.

Temperatura ØKod povreatnih reakcija ako je polazna egzotermna onda je povratna endotermna i obrnuto. ØPovećanje temperature odgovara endotermnoj rekciji a hlađenje egzotermnoj reakciji ØHlađenjem pomera se ravnoteža u pravcu egzotermne reakcije. ØZagrevanjem pomera se ravnoteža u pravcu endotermne reakcije. ØT ↗ → endotermna reakcija ØT↘ → egzotermna reakcija

Koncentracija ØPovećanjem koncentracije reaktanata pomera se ravnoteža u pravcu proizvoda. ØPovećanje koncentracije proizvoda pomera ravnotežu u pravcu reaktanata. ØCA i CB ↗ → u pravcu proizvoda udesno ØCC i CD ↗ → u pravcu reaktanata ulevo

Pritisak utiče kod gasova samo ako ima različiti broj molova gasa reaktanta i proizvoda. Na pr. 2 SO 2 (g) +O 2(g) 2 SO 3(g) S leve strane 3 mola gasa (2 mola. SO 2 i 1 mol O 2) a sa desne strane 2 mola gasa (2 mola SO 3) p • V= const. Onda p↗ → V↘ p↘ → V↗

Le Šateljejev princip Ako se sistem nalazi u ravnoteži i ako se promeni neki od faktora koji utiče na ravnotežu, sistem će zauzeti neki novi položaj kojim suzbija taj uticaj. Na pr. 2 SO 2 (g) +O 2(g) 2 SO 3(g) Povećanje pritiska pomera ravnotežu u pravcu smanjenja zapremine , udesno

Primena Le Šateljeovog principa Za reakciju N 2(g) + 3 H 2(g) 2 NH 3 (g) + toplota Pomeriti ravnotežu u pravcu nastajanja NH 3, udesno 1. Udesno je egzotermna reakcija pa treba sistem hladiti 2. pritisak povećavati jer 4 mola gasa levo daju 2 mola gasa desno 3. katalizator smanjuje Ea veoma stabilnih molekula N 2 i H 2
 Akademija poslovnih strukovnih studija beograd
Akademija poslovnih strukovnih studija beograd Akademija poslovnih strukovnih studija beograd
Akademija poslovnih strukovnih studija beograd Sulfatni papir
Sulfatni papir Ploščina krožnega odseka
Ploščina krožnega odseka Gulova vrstva
Gulova vrstva Gulovy odsek
Gulovy odsek Visoka renesansa
Visoka renesansa Univerzitet bitola
Univerzitet bitola Aaiedu
Aaiedu Visoka in nizka afrika
Visoka in nizka afrika Visoka skola za usluzni biznis
Visoka skola za usluzni biznis Junaci pavlove ulice ispit
Junaci pavlove ulice ispit Predstavnici humanizma
Predstavnici humanizma Europska renesansa
Europska renesansa Visoka renesansa
Visoka renesansa Prve kopenske rastline
Prve kopenske rastline Duboka stampa
Duboka stampa Visoka medicinska skola cuprija
Visoka medicinska skola cuprija Visoka trobenta značilna za 17 18 stoletje
Visoka trobenta značilna za 17 18 stoletje висока ренесанса
висока ренесанса Niska afrika
Niska afrika Tehnika
Tehnika Alfanumerički znakovi primjer
Alfanumerički znakovi primjer Texnikani
Texnikani Psihologija na maturi
Psihologija na maturi Stranac kratak sadržaj
Stranac kratak sadržaj Tenis servis tehnika
Tenis servis tehnika Osnovne grane tehnike
Osnovne grane tehnike Grataž postupak
Grataž postupak Mahover test
Mahover test Seldingerova metoda
Seldingerova metoda Niski i visoki start
Niski i visoki start Priprema materijala za zavarivanje
Priprema materijala za zavarivanje Nauka tehnika i kultura između dva svjetska rata
Nauka tehnika i kultura između dva svjetska rata

























































