ORGANSKA HEMIJA l Organska hemija e hemija na




























































- Slides: 188

ORGANSKA HEMIJA l Organska hemija e hemija na jaglerodnite soedinenija. l Neorganski i organski soedinenija. l Jaglerodot ima 4 valentni elektroni. Energetski e nevozmo`no davawe ili primawe na 4 elektroni pa jaglerodot gradi kovalentni vrski so drugite atomi. l Elektronskata konfiguracija na atomot na jaglerodot: 1 s 2 2 p 2 l Jaglerodot ne se vrzuva kako dvovalenten nego kako ~etvorovalenten atom so 4 istovrsni, ednakvovredni vrski.

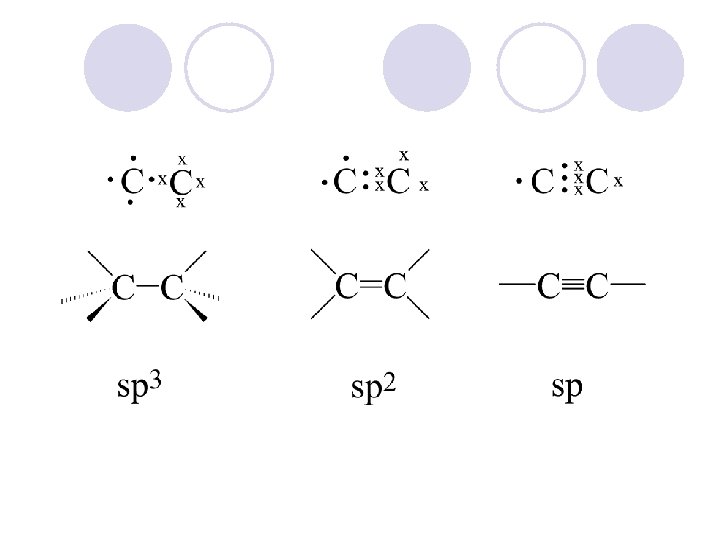
HIBRIDIZACIJA l So Linearnata kombinacija na atomskite orbitali se dobivaat hibridni (me{ani) orbitali. l Imaat forma na deformirani osumki ramnomerno raspredeleni vo prostorot

STRUKTURA NA ORGANSKITE SOEDINENIJA l Jaglerodnite atomi mo`e da se vrzuvaat me|usebno pri {to nastanuvaat molekuli so razli~ni broevi na jaglerodnite atomi koi mo`e da bidat povrzani vo ramni nizi, razgranati nizi ili prsteni. Osven so atomite na jaglerodot i vodorodot, jaglerodnite atomi mo`e da se se vrzuvaat i so drugi atomi: kislorod, azot, fosfor, sulfur, so halogenite itn.

l Razli~nite soedinenija izgradeni se od razli~ni atomi ili imaat razli~en raspored na atomite, a sekoe soedinenie ima karakteristi~ni hemiski i fizi~ki svojstva. l Molekulite na organskite soedinenija gi poka`uvame so strukturnite formuli koi ni poka`uvaat od koi atomi se izgradeni tie molekuli i kako tie atomi me|usebno se povrzani. Od strukturnite molekuli mo`eme da pretpostavime kakvi se hemiskite svojstva na tie soedinenija.

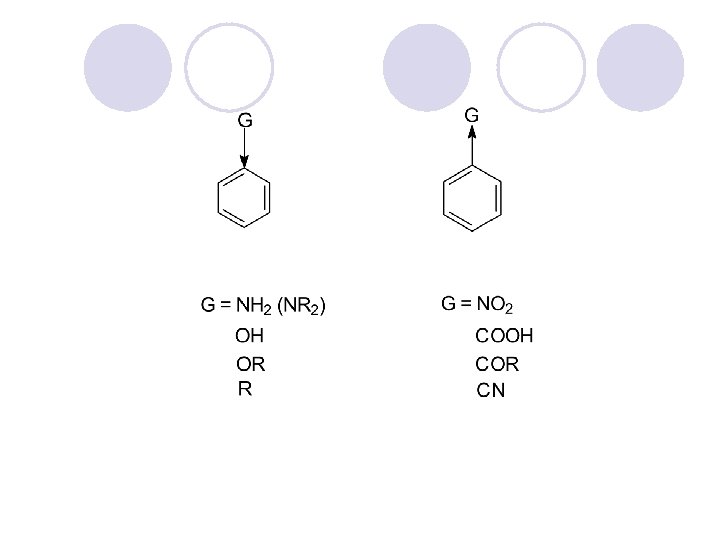
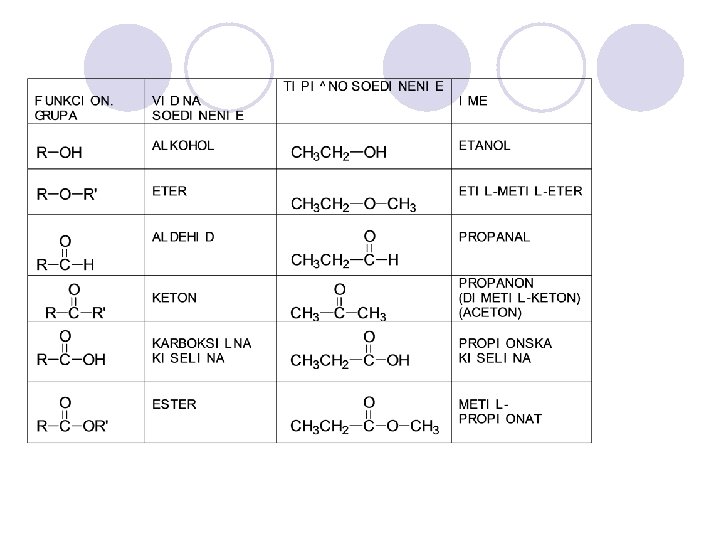
l Vo strukturata (gradbata) na organskite molekuli treba da se razlikuva skeletot (kosturot) i funkcionalnite grupi. l Skeletot go so~inuvaat site me|usebno povrzani jaglerodni atomi so sopstvenite vodorodni atomi. Soedinenija sostaveni samo od jaglerodot i vodorodot (jaglevodorodi) slabo se reaktivni. l Funkcionalnite grupi gi odreduvaat fizi~kite i hemiskite svojstva na organskite soedinenija. So nivnata pretvorba ostvaruvame promena na svojstvata.

Organskite soedinenija gi klasificirame prema funkcionalnite grupi.

HEMISKI REAKCII VO ORGANSKA HEMIJA l Sintetskata organska hemija gi prou~uva metodite koi se koristat za gradba na skeletot i promena na funkcionalnite grupi. l Mnogubrojnite metodi vo organskata sinteza mo`e da se svedat na tri osnovni tipovi na reakcija: l 1. REAKCII NA SUPSTITUCIJA (ZAMENA) l 2. REAKCII NA ADICIJA (SPOEWE) l 3. REAKCII NA ELIMINACIJA

1. REAKCII NA SUPSTITUCIJA l Reakcii na supstitucija se reakcii vo koi eden del od organskata molekula se zamenuva so edniot del na molekulata na reagensot. l Supstrat - reagens

2. REAKCII NA ADICIJA l Reakcii vo koi se spojuvaat dve molekuli, pri {to nastanuva edna molekula na produktot. Ograni~eni se na soedinenija koi sodr`uvaat pove}ekratno povrzani atomi, t. e. atomi koi me|usebno delat pove}e od eden elektronski par.

3. REAKCII NA ELIMINACIJA l Reakcii na eliminacija se reakcii na razlo`uvawe pri {to od edna molekula na reaktantot nastanuvaat dve molekuli. Ova e reverzibilna reakcija na adicija i so taa reakcija se voveduva dvojna ili trojna vrska vo molekulata.

HEMISKA REAKTIVNOST l Kovalentnata hemiska vrska mo`e da nastane ili da se raskine na dva na~ina. l 1. Homoliti~ki procesi l 2. Heteroliti~ki procesi

HOMOLITI^KI PROCESI l Dva neutralna atoma, koi imaat nespareni elektroni vo valentnite orbitali, reagiraat so sozdavawe na kovalentna vrska vo koja sekoj od tie atomi dava po eden elektron. l Vo obrnatniot proces hemiskata vrska (elektronski par) se kine taka da po eden elektron pripa|a na sekoj atom. l Od neutralnite molekuli nastanuvaat neutralni atomi.

l Molekulata so kovalentna vrska mnogu e postabilna od radikalite koi nastanuvaat so raskinuvawe na taa vrska pa homolizata e proces koja ima potreba od mnogu energija (endotermna reakcija). l Obratno, nastanuvaweto na kovalentnata vrska od radikalite e mnogu lesen i brz proces (egzotermna reakcija).

HETEROLITI^KI PROCESI l Kovalentnata vrska mo`e da se raskine taka da mo`e da nastanuvaat joni ili vrskata mo`e da nastanuva so reakcii na joni.

l Pri heteroliti~koto raskinuvawe na vrskite zaedni~kiot elektronski par se priklonuva kon poelektronegativniot atom dobiva negatinen naboj i nastanuva anjon, dodeka ostanatiot atom koj go gubi elektronskiot par ostanuva pozitivno naelektriziran kako katjon. l Gotovo site organsko-hemiski reakcii koi se sproveduvaat vo nekoj rastvor se jonski, heteroliti~ki reakcii. l Vo obratniot proces takvite soedinenija mo`at da nastanat od atomi (ili pomali molekuli) koi imaat sloboden elektronski par i koi mo`at da go dadat toj elektronski par vo novata kovalentna vrska.

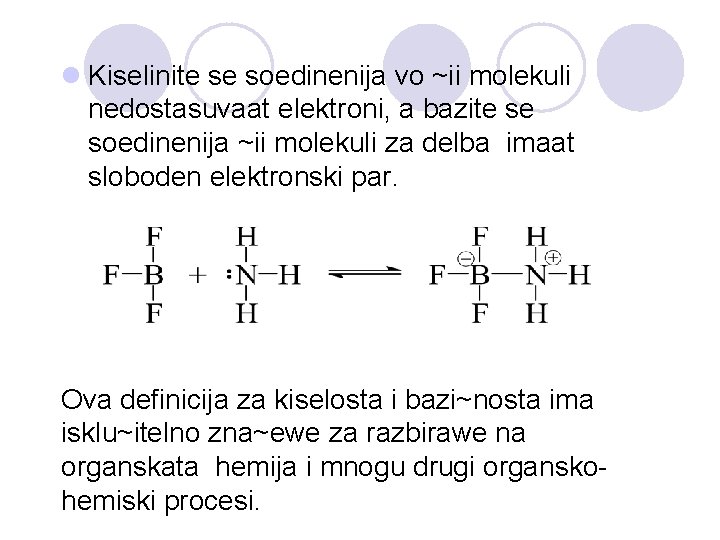
LEVISOVA DEFINICIJA NA BAZITE I KISELINITE l Baza e supstanca koja mo`e da dava elektronski par za formirawe na kovalentnata vrska, a kiselina e supstanca koja mo`e da primi elektronski par za formirawe na kovalentnata vrska. l Kiselina e akceptor na elektronskiot par, a baza e donor na elektronskiot par.

l Kiselinite se soedinenija vo ~ii molekuli nedostasuvaat elektroni, a bazite se soedinenija ~ii molekuli za delba imaat sloboden elektronski par. Ova definicija za kiselosta i bazi~nosta ima isklu~itelno zna~ewe za razbirawe na organskata hemija i mnogu drugi organskohemiski procesi.

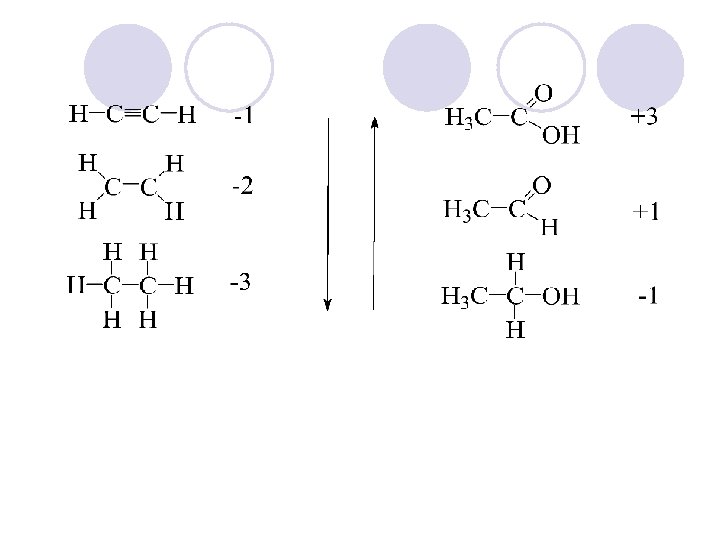
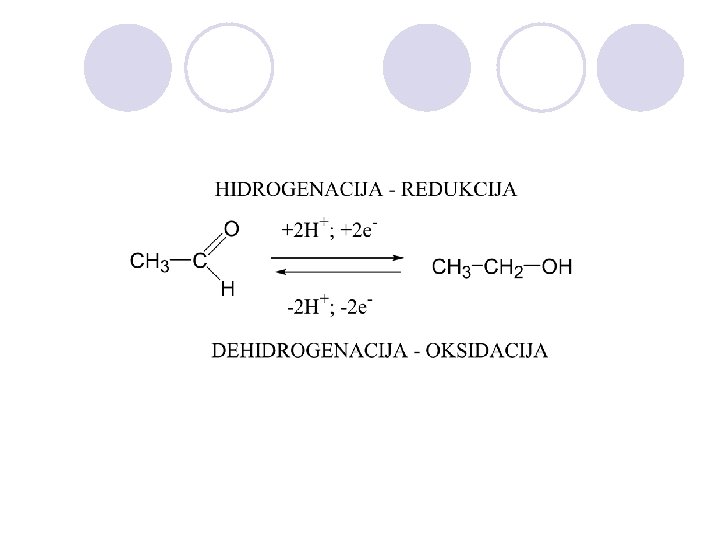
OKSIDO - REDUKCIJA l Oksidacija e otstranuvawe na elektronite od nekoj atom (molekula ili jon) pri {to se namaluva elektronskata gustina, a redukcija e dodavanje na elektronite na nekoj atom (molekula ili jon) pri {to se zgolemuva elektronska gustina okolu toj atom. l Vo neorganskata hemija so oksidacija se zgolemuva, a so redukcijja se namaluva oksidaciskiot broj (valencija) na atomite.

l Vo organskata hemija nema promena na oksidaciskiot broj (valentnost) na atomot na jaglerodot, no so promenata na atomot koi se vrzani na jaglerodniot atom se menuva i elektronskata gustina na toj atom. l Zgolemuvaweto na elektronskata gustina se narekuva redukcija, a namaluvaweto oksidacija. l Za polesno da se sledi redukciskooksidaciskite promeni na poedinite C atomi voveden e formalen oksidaciski broj: l C-C 0 C-H -1 C-X +1


IZOMERIJA l Izomeri – razli~ni soedinenija koi imaat ista molekulska formula. l VIDOVI NA IZOMERI: 1. Konstituciski izomeri 2. Stereoizomeri 2. 1. Konformaciski 2. 2. Konfiguraciski

KONSTITUCISKI IZOMERI l Soedinenijata koi imaat ednakvi molekulski formuli, a se razlikuvaat po redosledot na vrzuvaweto na kovalentnite atomi.

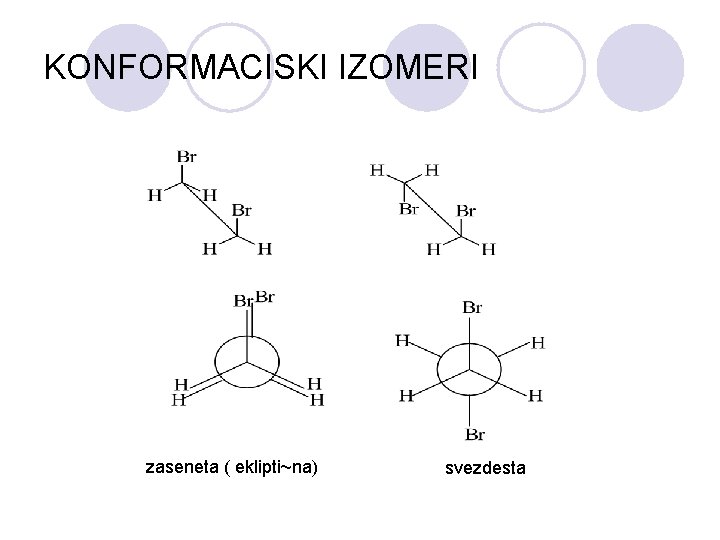
STEREOIZOMERI l Soedinenijata koi imaat ista molekulska formula, no razli~ni fizi~ki i hemiski svojstva se narekuvaat izomeri, dodeka izomerite koi se razlikuvaat vo prostorniot raspored se narekuvaat stereoizomeri l 1. KONFORMACISKI IZOMERI – pretstavuva slobodna rotacija na atomi ili atomski grupi okolu zaedni~kata ( ) vrska pome|u C-C atomi. l 2. KONFIGURACISKI IZOMERI - mora da dojde do raskinuvawe na vrskata da eden preminuva vo drug.

KONFORMACISKI IZOMERI zaseneta ( eklipti~na) svezdesta

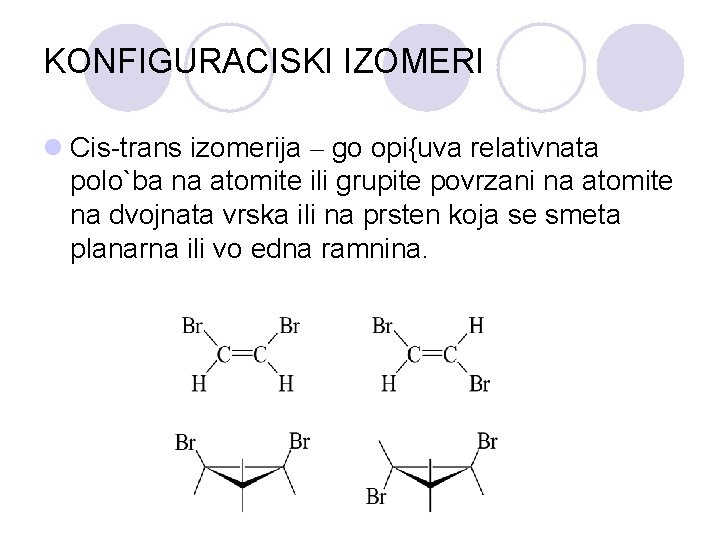
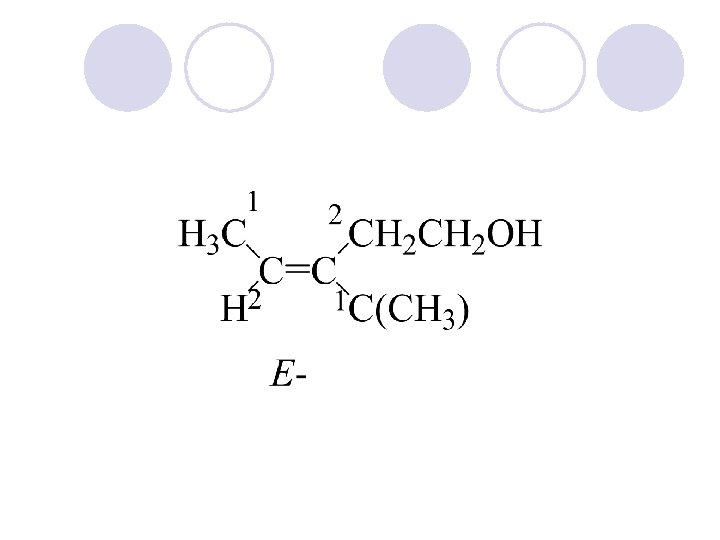
KONFIGURACISKI IZOMERI l Cis-trans izomerija – go opi{uva relativnata polo`ba na atomite ili grupite povrzani na atomite na dvojnata vrska ili na prsten koja se smeta planarna ili vo edna ramnina.

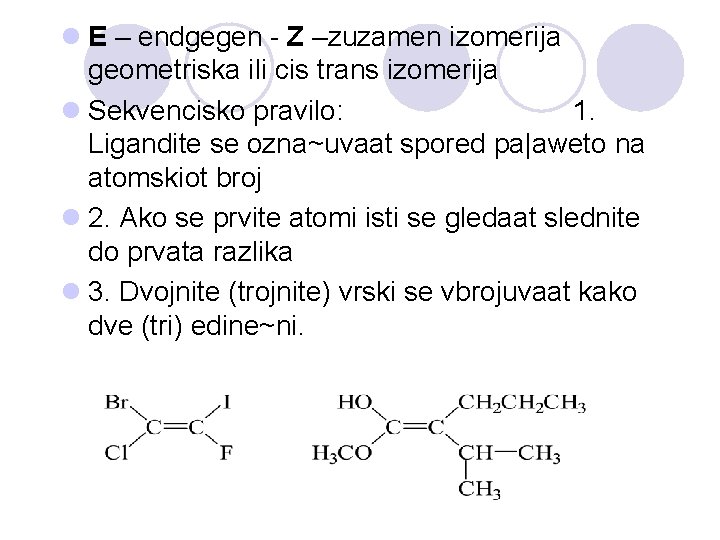
l E – endgegen - Z –zuzamen izomerija geometriska ili cis trans izomerija l Sekvencisko pravilo: 1. Ligandite se ozna~uvaat spored pa|aweto na atomskiot broj l 2. Ako se prvite atomi isti se gledaat slednite do prvata razlika l 3. Dvojnite (trojnite) vrski se vbrojuvaat kako dve (tri) edine~ni.



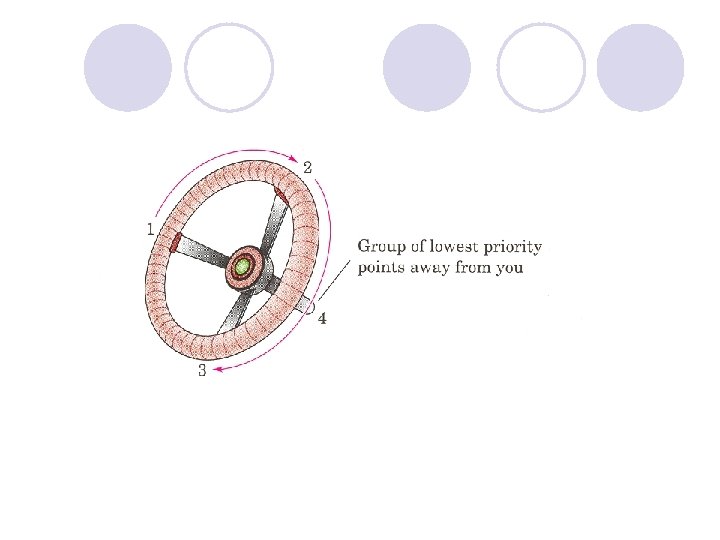
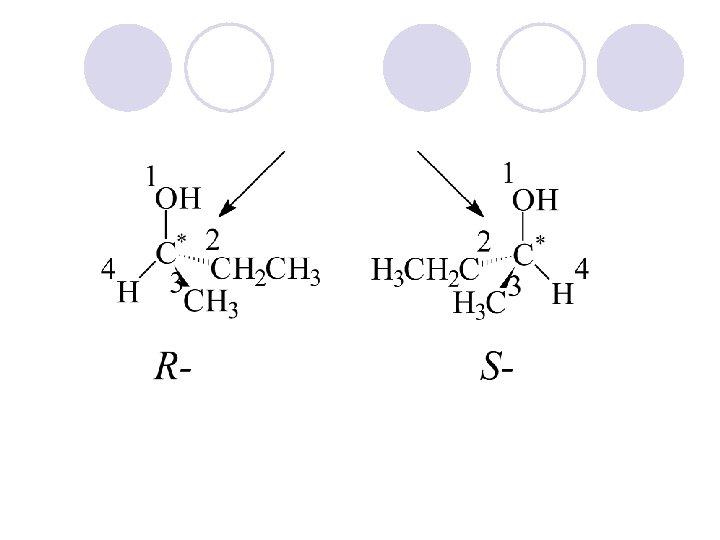
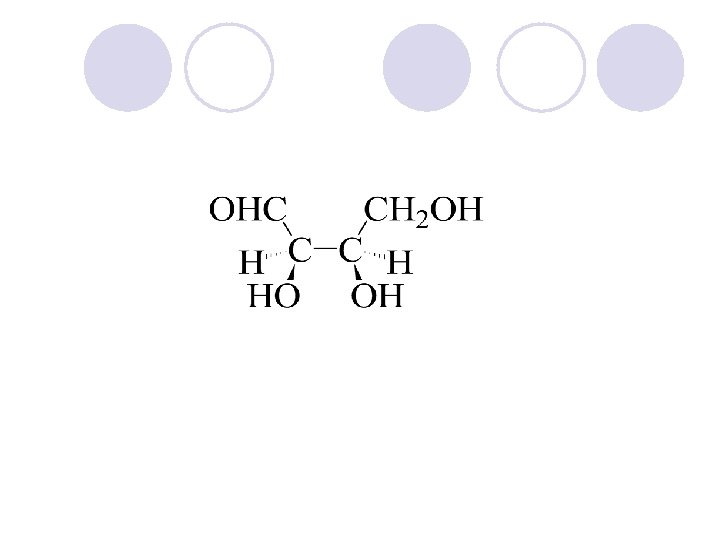
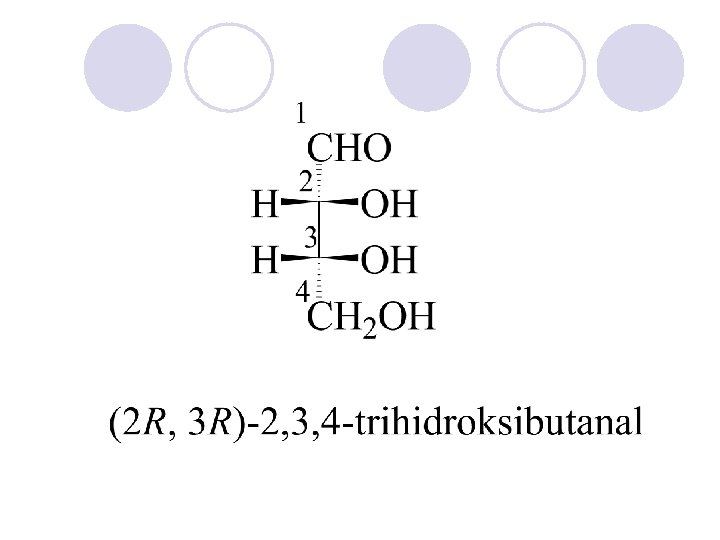
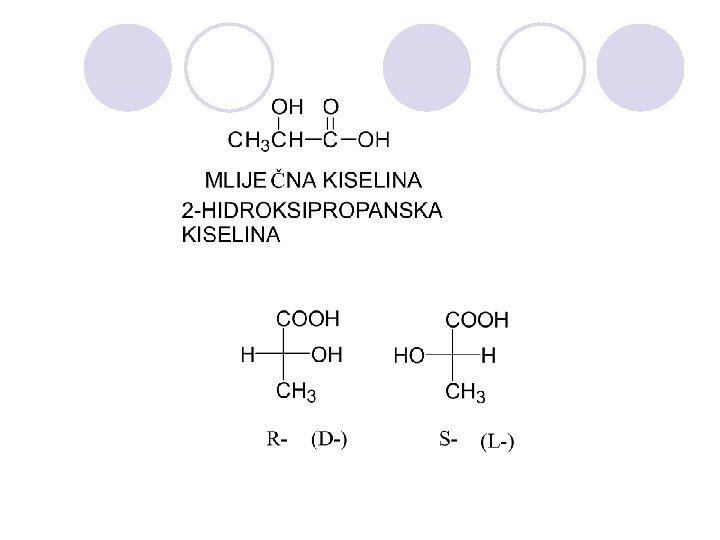
APSOLUTNA KONFIGURACIJA l Apsolutnata konfiguracija go ozna~uva prostorniot raspored na atomite na hiralnite molekulski edinki (ili grupi) i go dava nejzinot stereohemiski opis, na. pr. R ili S. l Ako ~etirite valencii na C- atomot, vo molekulata na soodvetnoto organsko soedinenie se zasiteni so ~etiri razli~ni atomi ili atomski grupi, toj C-atom se narekuva hiralen (asimetri~en) C-atom i se bele`i so yvezdi~ka. (*) l Hiralnite molekuli nemaat nitu eden element na simetrija. Hiralniot C-atom gradi dva vozmo`ni prostorni izomeri koi se odnesuvaat eden sproti drug kako levata raka kon desnata ili kako predmet kon likot vo ogledaloto, i vzaemno ne mo`at da se preklopuvaat. Sredi{teto na asimetrijata e hiralniot ili asimetri~niot C atom.

Konfiguracija na asimetri~nite (hiralnite) jaglerodni atomi se ozna~uva so R ili S, a se odreduva taka da: 1. Odreduvame prioritet na atomite ili atomskite grupi vrzani na hiralniot atom (sekvencisko pravilo) 2. Ja definirame nasokata na gledawe.




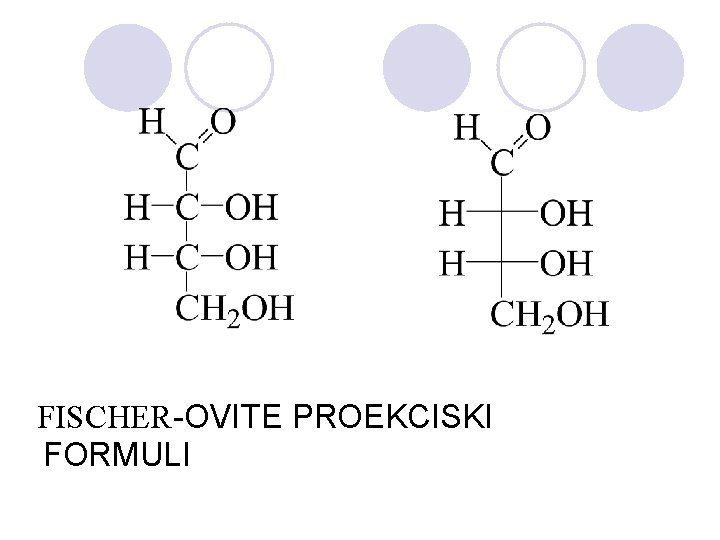
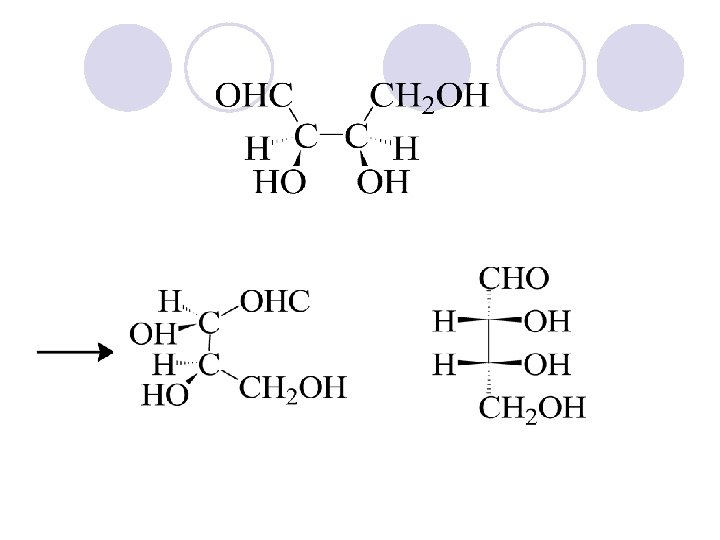
FISCHER-OVITE PROEKCISKI FORMULI



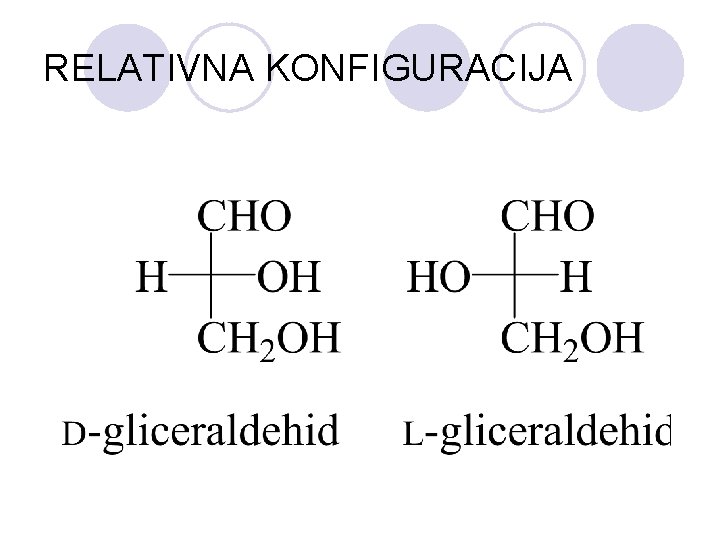
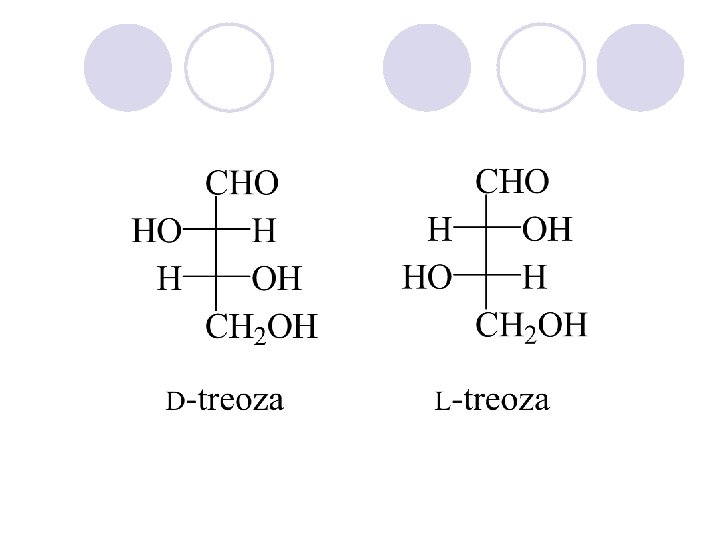
RELATIVNA KONFIGURACIJA


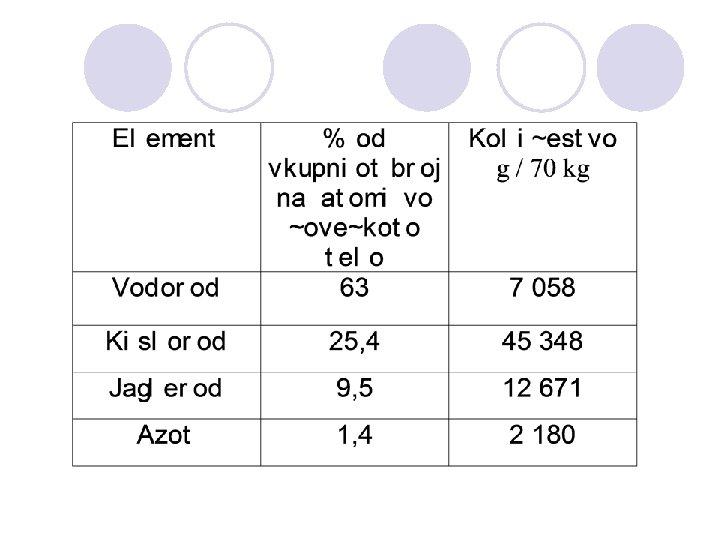
ELEMENTI POTREBNI ZA @IVOT l glavni elementi (H, O, C, N) 99, 3 % na atomite l makrominerali (Ca, P, K, S, Cl, Na, Mg) l elementi vo tragovi (I, F, Zn, Cu, Co …)


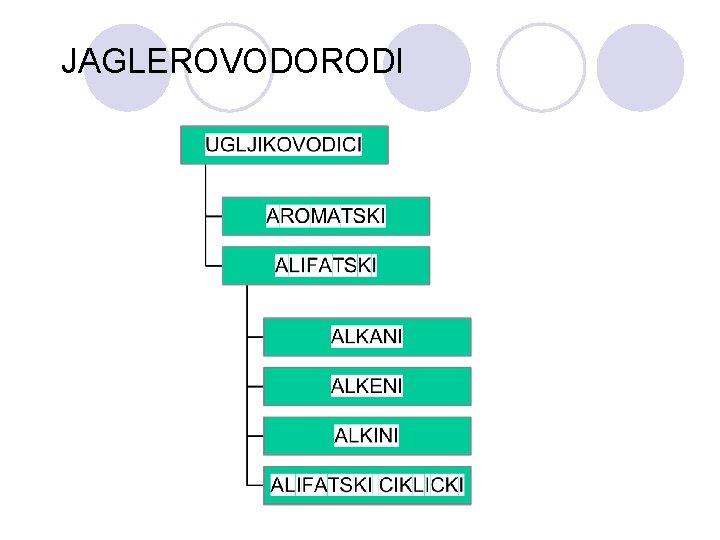
JAGLEROVODORODI


ALKANI l Alkanite se organski soedinenija sostaveni samo od C i H atomite. l Site C-C vrski vo nivnite molekuli se edine~ni pa gi narekuvame i zasiteni jaglerovodorodi. l Bidej}i se mnogu stabilni i nereaktivni i te{ko stapuvaat vo reakcija so drugite soedinenija se narekuvaat i parafini ( od lat. Parum affinis - slabo reaktivni).

STRUKTURA NA ALKANITE l Op{ta formula e Cn. H 2 n+2 (n = celi broevi). l Sekoj ~len od nizot se razlikuva od sosednite ~lenovi za edna metilenska-CH 2 - grupa. Onie pretstavuvaat homologna niza, a poedinite ~lenovi na toj niz se homolozi. l Site vrski vo molekulite na alkanite se edine~ni, a C atomite se sp 3 hibridizirani. l Site ~etiri H-atomi me|usebno se ekvivalentni, maksimalno oddale~eni od C-atomot so pribli`en agol od 109, 5 o.

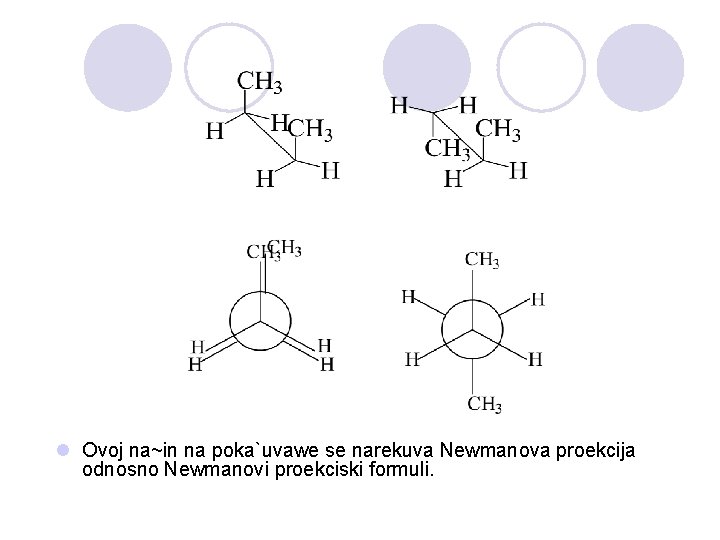
KONFORMACIJA NA ALKANITE l Molekulite na alkanite nemaat cvrsti strukturi. l Atomite mo`at da ja menuvaat me|usebnata polo`ba, koja e posledica na rotacijata na edine~nata vrska. l Razli~nite formi na molekulite koi se posledica na rotacijata okolu vrskata se konformacii.

l Ovoj na~in na poka`uvawe se narekuva Newmanova proekcija odnosno Newmanovi proekciski formuli.

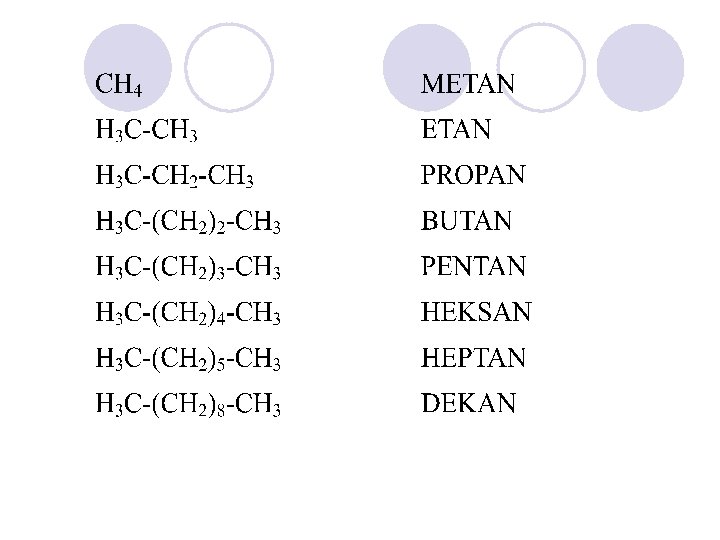
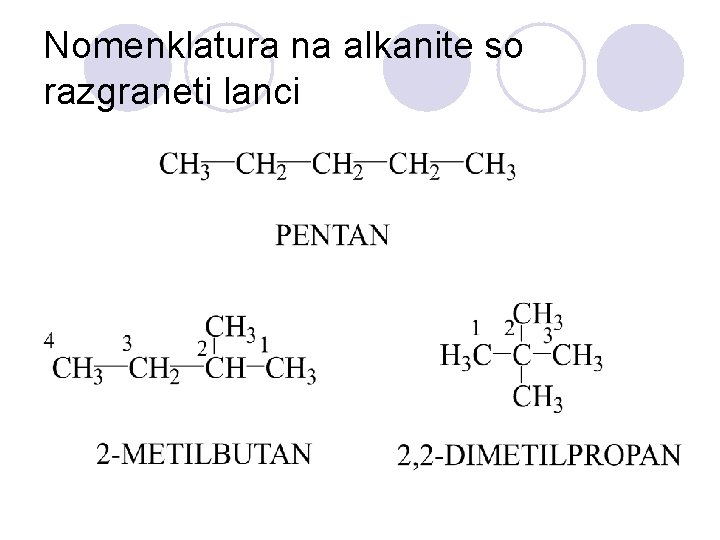
NOMENKLATURA NA ALKANITE l Sekoe soedinenie ima sopstveno ime/ naziv koe go objasnuva samo toa soedinenie. l Nekoi soedinenija poseduvaat nesvojstveni, voobi~aeni( trivijalni imiwa), koi ~esto se poednostavni i poprakti~ni. l Nazivite na alkanite se sozdavaat na toj na~in {to na osnovata- koja go ozna~uva brojot na C-atomite vo sostavot, se dodava nastavkata –an.


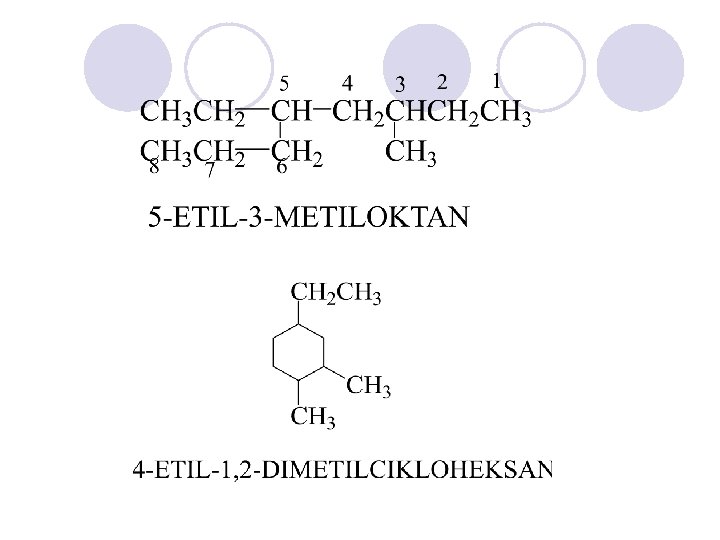
Nomenklatura na alkanite so razgraneti lanci


FIZI^KI SVOJSTVA NA ALKANITE l Kaj molekulite na alkanite nema me}usebni dipol -dipol privlekuvawa, nema vodorodni vrski, mnogu se slabi intermolekulskite sili na privlekuvawe (van der Waals-ovi sili) i spored toa alkanite i tie imaat najniski vriewa, odnosno topewa, od site organski soedinenija, sli~ni na relativnata molekulska masa. l Vriewata, topewata i gustinata na n-alkanite, se zgolemuvaat so zgolemuvaweto na brojot na C atomite.

DOBIVAWE NA ALKANITE l Alkanite se dobivaat edinstveno od prirodni izvori: od nafta i od zemen gas. l So destilacija, vrz osnova na nivnite razli~ni temperaturi na vriewe, se odvojuvaat razli~ni jaglevodorodi, odnosno sme{i jaglevodorodi so sli~ni temperaturi na vriewe. l So posebna postapka na raskinuvawe (kreking), od pogolemite molekuli se dobivaat pomali molekuli, a mo`at da se dobijat i nezasiteni jaglevodorodi.

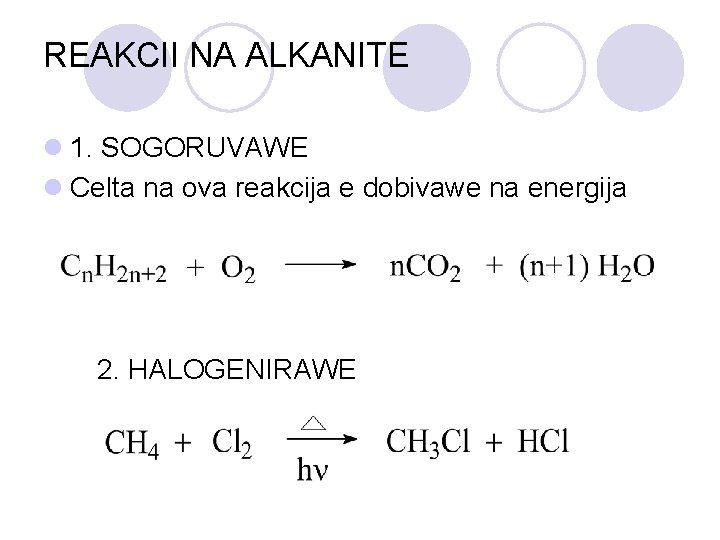
REAKCII NA ALKANITE l 1. SOGORUVAWE l Celta na ova reakcija e dobivawe na energija 2. HALOGENIRAWE

ALKENI l Alkenite se soedinenija koi imaat dvojna vrska pome|u jaglerodnite atomi. l Nivnata struktura ne e tetraedarska tuku planarna (site vrski le`at vo edna ramnina) pod agol od 120 o pome|u poedine~nite vrski.

l Dvojnite i trojnite vrski se pomalku stabilni, {to zna~i deka se poreaktivni od edine~nite vrski. Poradi toa onie formiraat reaktivni mesta vo organskata molekula. l Soedinenijata so dvojni i trojni vrski mo`at da adiraat (vrzuvaat) na sebe nekoi drugi atomi i zatoa ka`eme deka se onie nezasiteni.

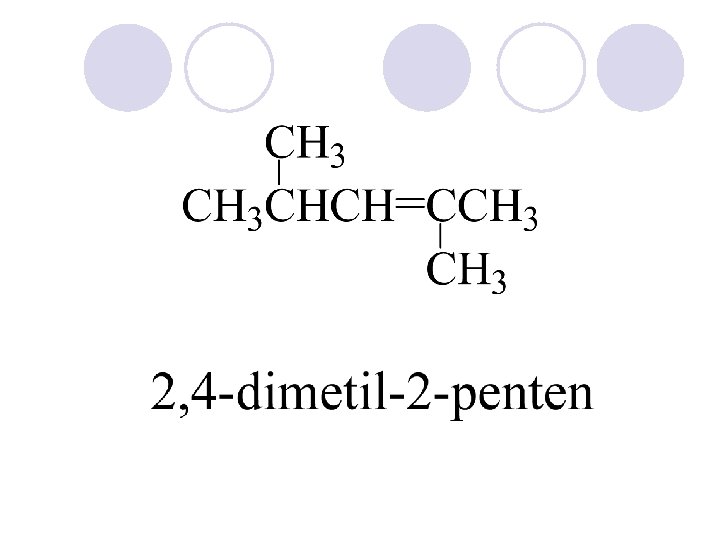
NOMENKLATURA NA ALKENI l Imiwata na alkenite se formiraat isto kako i imiwata na alkanite samo {to na korenot na imeto se dodava nastavkata -en. l Kako glavna niza se zema najdolgata niza na ja jaglerodnite atomi koi sodr`at dvojna vrska. l Broi se taka da dvojnata vrska da ima {to ponizok broj. Se ozna~uva samo prviot C atom na dvojnata vrska. l Ako molekulata ima dve ili pove}e dvojni vrski se dodava prefiks di-, tri- tetra, … ispred nastavkata -en.


FIZI^KITE SVOJSTVA NA ALKENITE l Nerastvorlivi vo voda , no dobro se rastvorlivi vo nepolarnite rastvoruva~i (benzen, eter, hloroform). l Polesni se od vodata l Temperaturata na vriewe i mrznewe se zgolemuva so zgolemuvawe na brojot na C atomi.

DOBIVAWE NA ALKENI l PRIRODNI IZVORI: nafta (destilacija i krekirawe) l LABORATORISKA PRIPREMA:

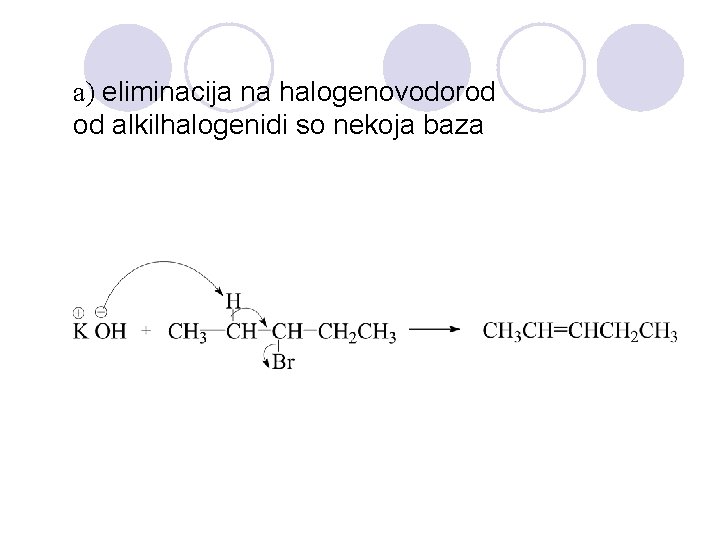
a) eliminacija na halogenovodorod od alkilhalogenidi so nekoja baza

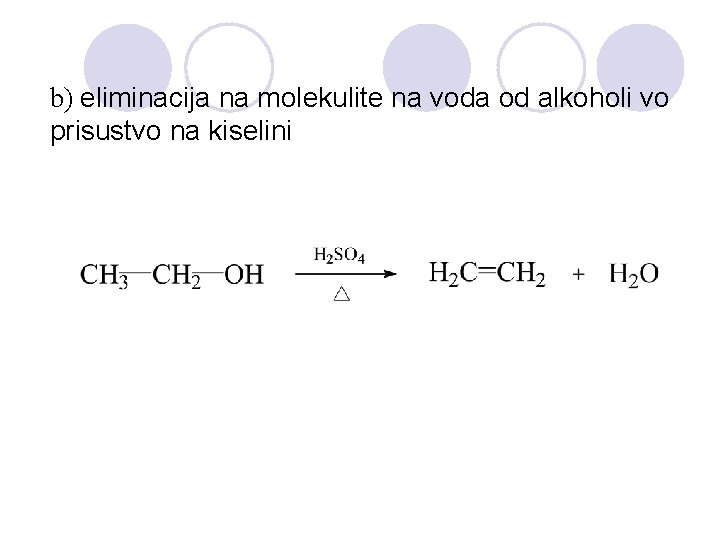
b) eliminacija na molekulite na voda od alkoholi vo prisustvo na kiselini

c) eliminacija na molekulite na halogen od dihalogenalkani so cink

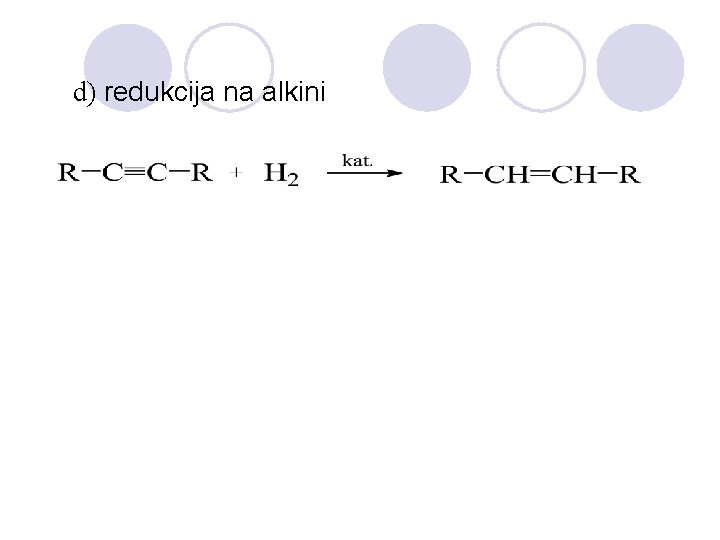
d) redukcija na alkini

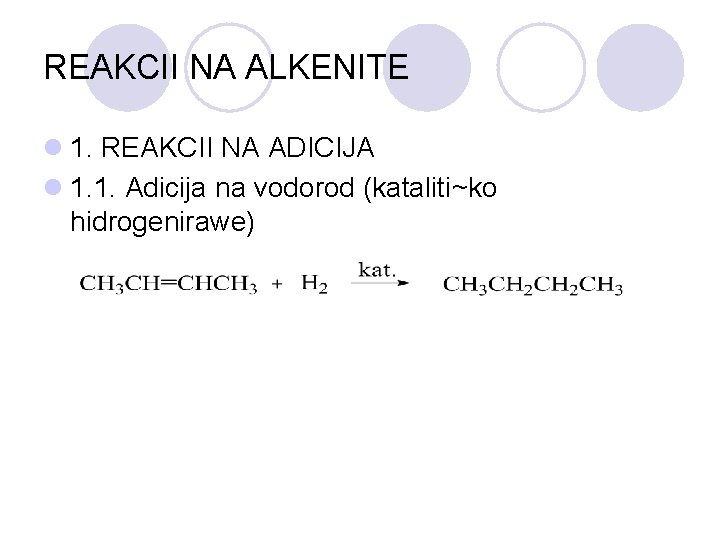
REAKCII NA ALKENITE l 1. REAKCII NA ADICIJA l 1. 1. Adicija na vodorod (kataliti~ko hidrogenirawe)

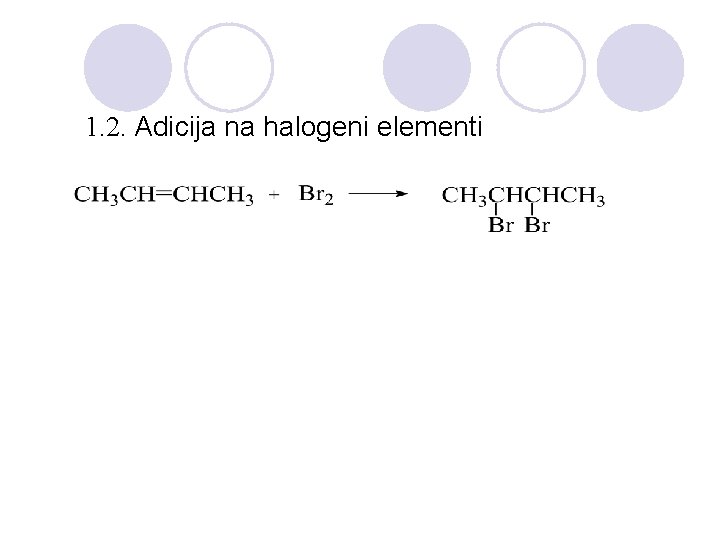
1. 2. Adicija na halogeni elementi

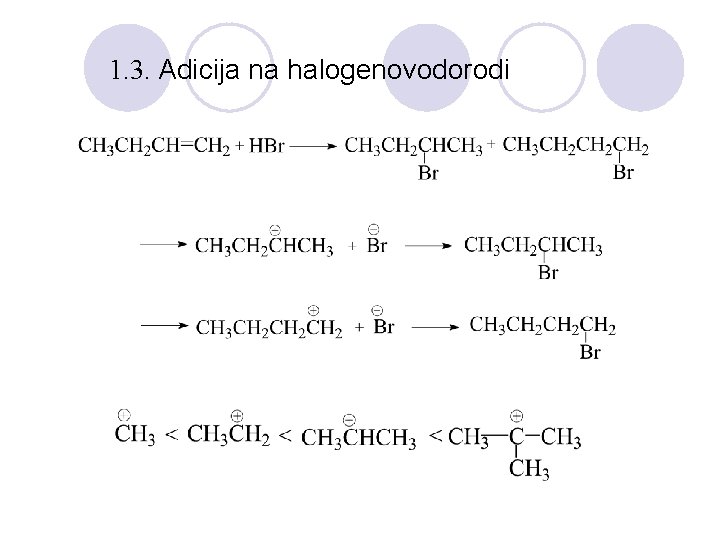
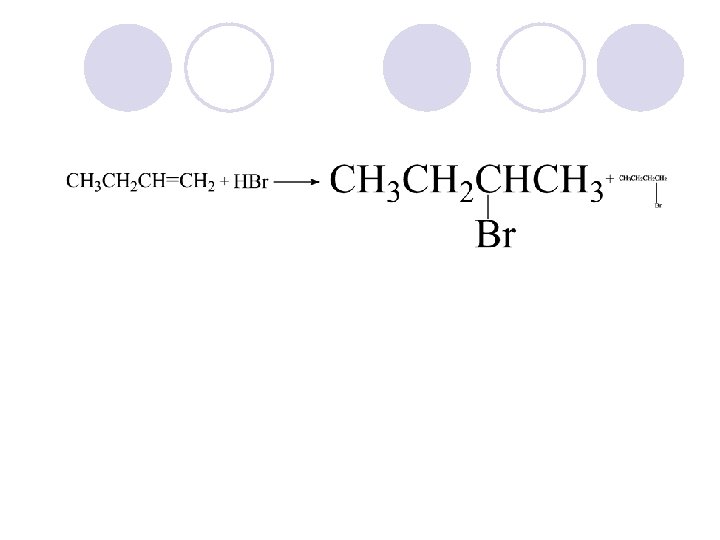
1. 3. Adicija na halogenovodorodi


MARKOVNIKOVO PRAVILO l Atomot na vodorod se vrzuva na jaglerodniot atom na alkenot koj ima pove}e vodorodni atomi. 1. 3. Adicija na voda

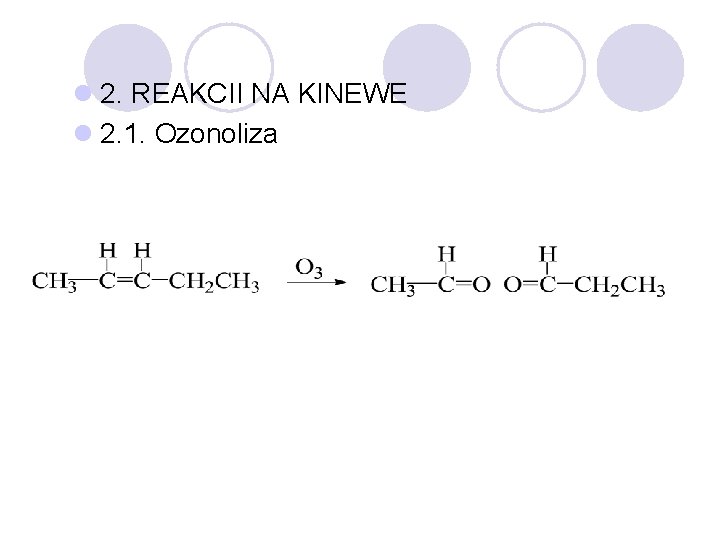
l 2. REAKCII NA KINEWE l 2. 1. Ozonoliza

ALKINI l Jaglevodorodi koi sodr`at edna ili pove}e trojni vrski pome|u dva jaglerodni atomi. l Op{ta formula:

NOMENKLATURA NA ALKINITE l Imiwata na alkinite, sprema pravilata na IUPAC-, se dobivaat so dodavaweto na nastavka -in vo korenot koj go ozna~uva brojot na jaglerodnite atomi vo molekulata, so toa {to so redniot broj se ozna~uva polo`bata na trojnata vrska.

FIZI^KI SVOJSTVA NA ALKINITE l Temperaturite na topewe, vriewe i gustinata na ednostavnite alkini se ne{to povisoki nego kaj alkenite i alkanite so ist broj na C atomite. Rastat so zgolemuvawe na brojot na C atomite. l Rastvorlivi vo nepolarni rastvoruva~i

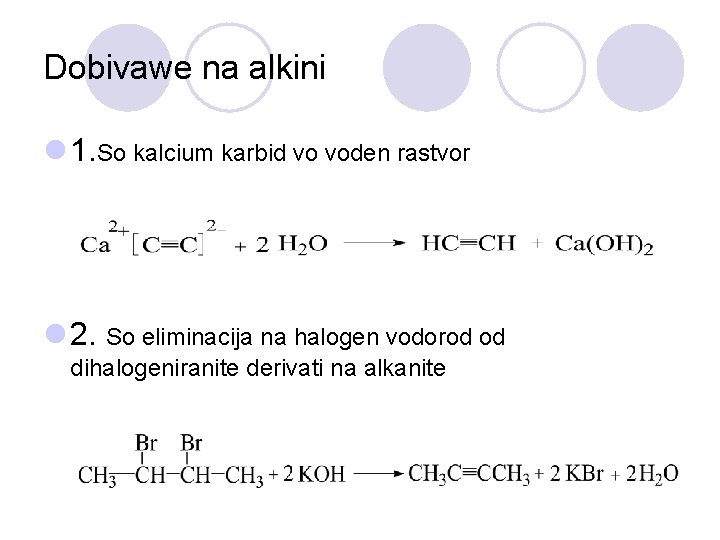
Dobivawe na alkini l 1. So kalcium karbid vo voden rastvor l 2. So eliminacija na halogen vodorod od dihalogeniranite derivati na alkanite

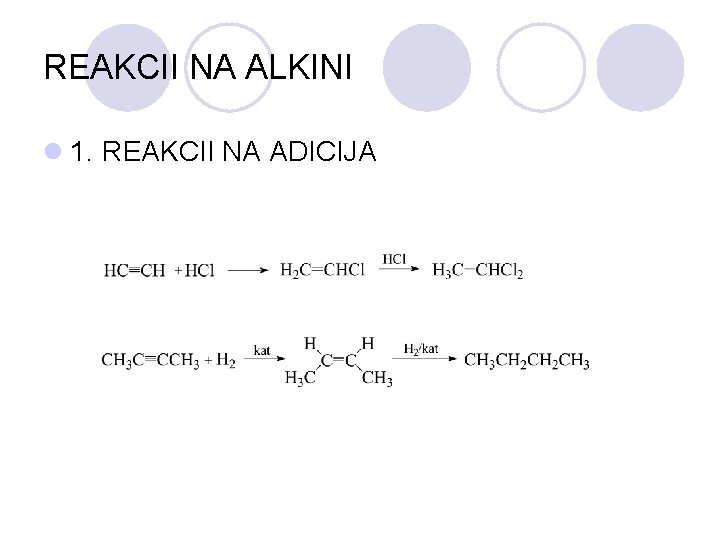
REAKCII NA ALKINI l 1. REAKCII NA ADICIJA

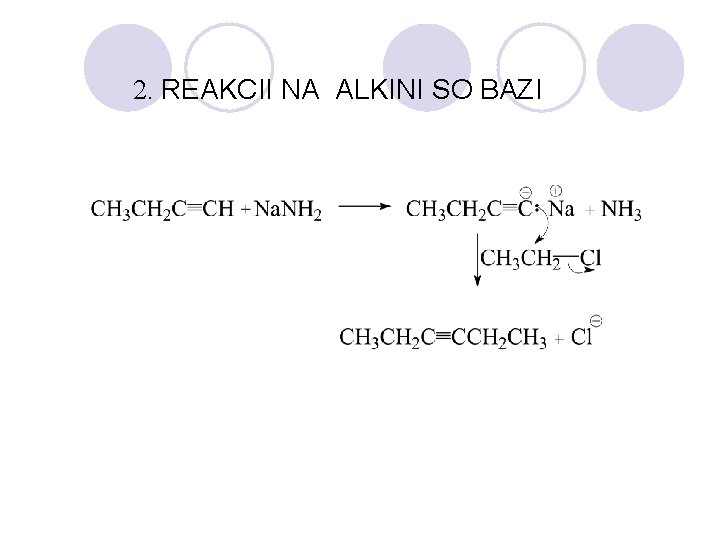
2. REAKCII NA ALKINI SO BAZI

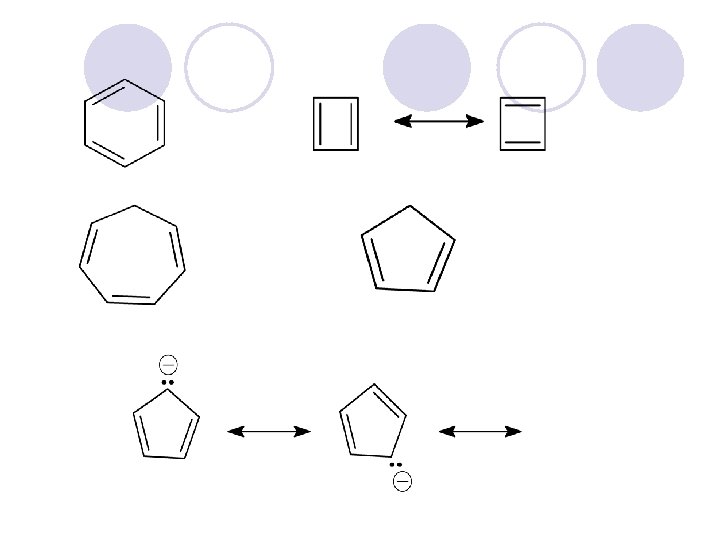
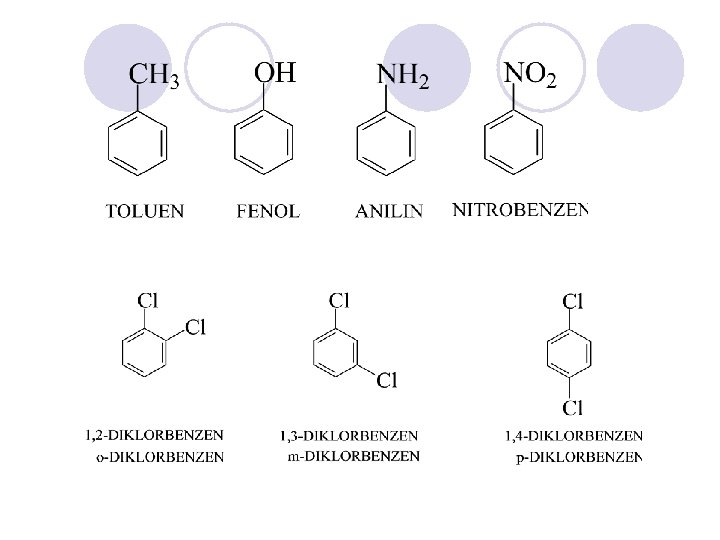
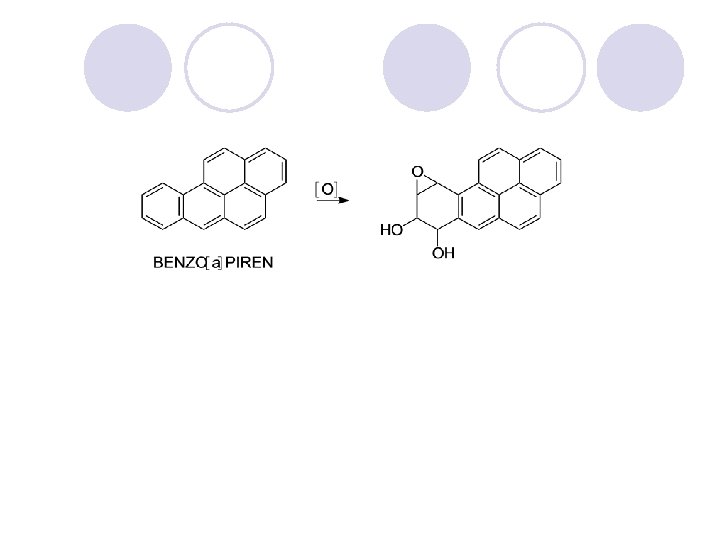
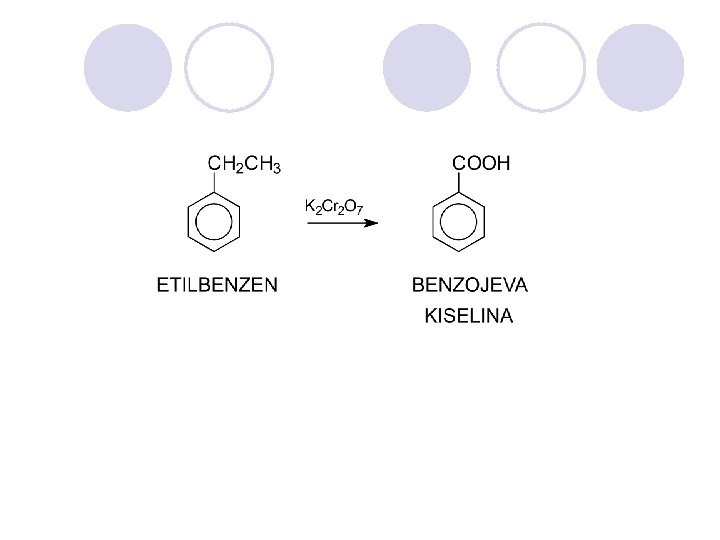
ARENI (AROMATI^NI JAGLEVODORODI) l Nezasiteni, cikli~ni soedinenija koi po svoite svojstva se razlikuvaat od alifati~nite nezasiteni soedinenija. l Postabilni se, pomalku reaktivni i podlo`ni na reakcii na supstitucija (elektrofilna aromatska supstitucija), a ne podle`at na reakcii na adicija.

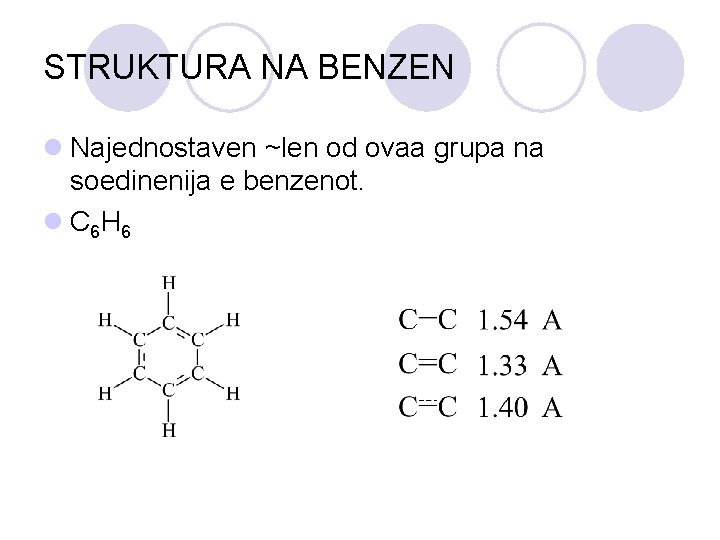
STRUKTURA NA BENZEN l Najednostaven ~len od ovaa grupa na soedinenija e benzenot. l C 6 H 6

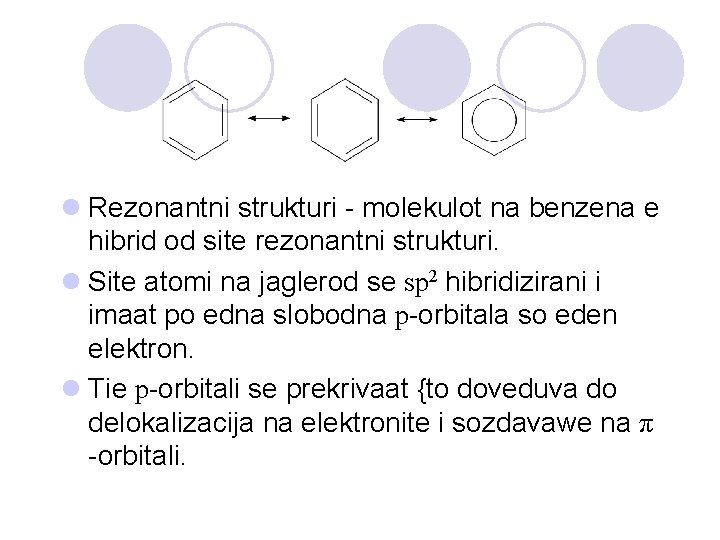
l Rezonantni strukturi - molekulot na benzena e hibrid od site rezonantni strukturi. l Site atomi na jaglerod se sp 2 hibridizirani i imaat po edna slobodna p-orbitala so eden elektron. l Tie p-orbitali se prekrivaat {to doveduva do delokalizacija na elektronite i sozdavawe na π -orbitali.

l Delokalizacija na π-elektronite ja pravat molekulata na benzen mnogu stabilna. l Stabilizacija na prstenestata molekula koja e posledica na delokalizacijata na π-elektronite vo prstenot se narekuva aromati~nost.

AROMATI^NOST l Molekulata e aromati~na ako e: l 1. Cikli~na (prsten) l 2. Potpolno kowugirana (sekoj atom od prstenot mora da ima p-orbitala vklu~ena vo delokalizacijata) l 3. Planarna l 4. (4 n+2) π-elektronite (Hückelovo pravilo) l n= 0, 1, 2, 3 природни броеви, Само молекули кои имаат 2, 6, 10, 14, 18 π -електрони можат да бидат ароматични додека молекули со 4 n π електрони ( 4, 8, 12, 16. . . ) не можат да бидат ароматични


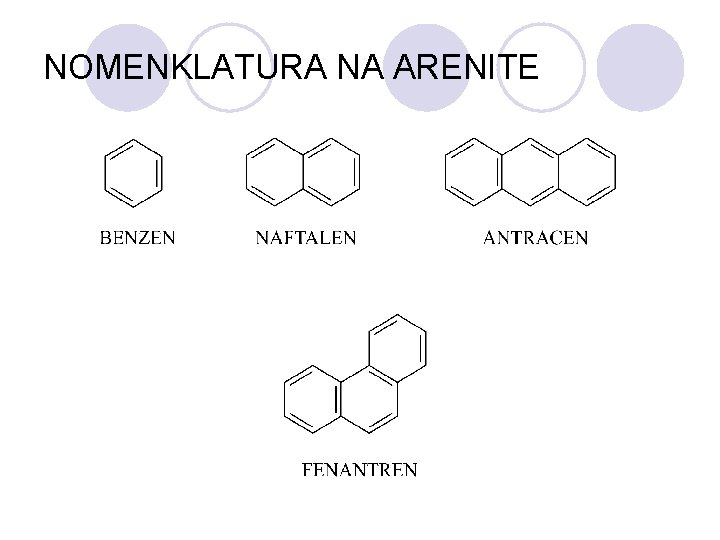
NOMENKLATURA NA ARENITE


FIZI^KI SVOJSTVA NA ARENITE l Mnogu slaba rastvorlivost vo voda l Gustinata pomala od gustinata na vodata l Temperaturite na vriewa rastat so zgolemuvaweto na molekulskata masa l Temperaturata na topewe zavisi od simetri~nosta na molekulata. Simetri~nite molekuli imaat povisoki temperaturi na topewe.

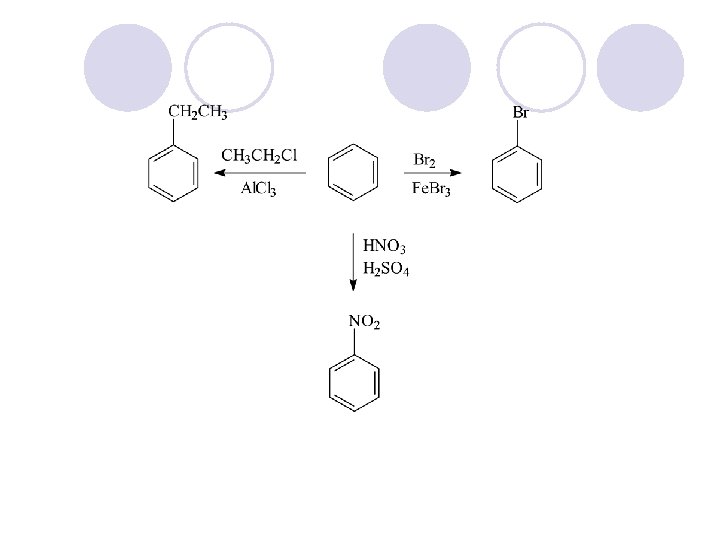
DOBIVAWE NA AREITE l 1. PRIRODNI IZVORI: ¡ NAFTA ¡ KATRAN (PRODUKT NA DESTILACIJA NA SUVIOT JAGLEN)

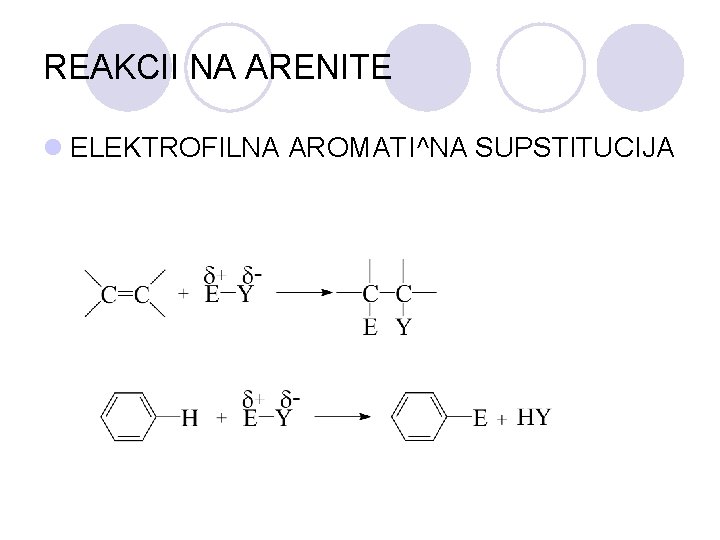
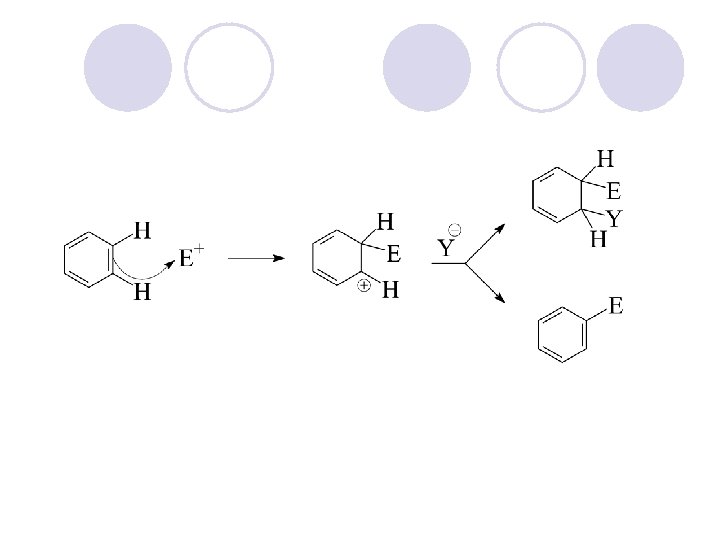
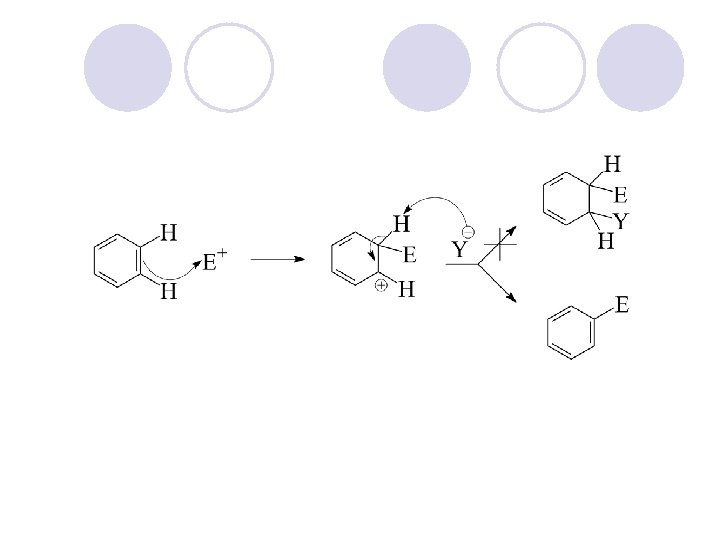
REAKCII NA ARENITE l ELEKTROFILNA AROMATI^NA SUPSTITUCIJA







ORGANSKI SOEDINENIJA KOI SODR@AT KISLOROD l Heteroatomi l Skelet i funkcionalni grupi l Funkcionalnitee grupi gi odreduvaat fizi~kite i hemiskite svojstva na organskite soedinenija. So nivnoto pretvarawe se ostvaruva promena na svojstvata na organskite soedinenija.


ALKOHOLI l Alkoholite se organski soedinenija ~ii molekuli sodr`at hidroksilna funkcionalna grupa. l Op{ta formula: R-OH

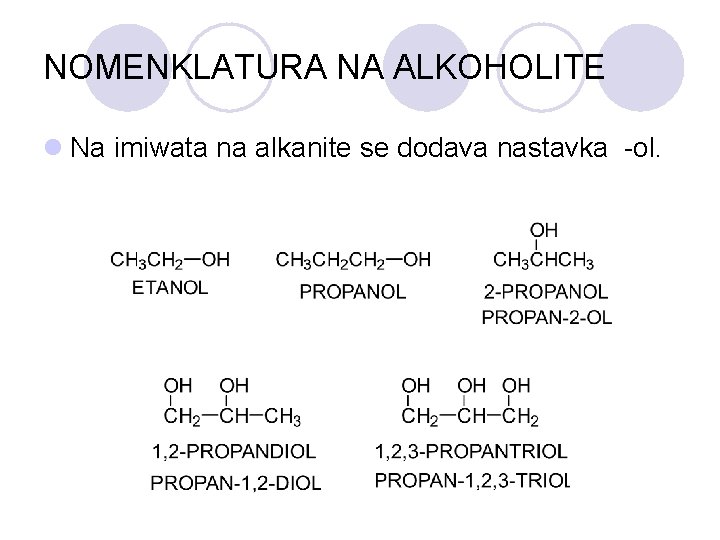
NOMENKLATURA NA ALKOHOLITE l Na imiwata na alkanite se dodava nastavka -ol.

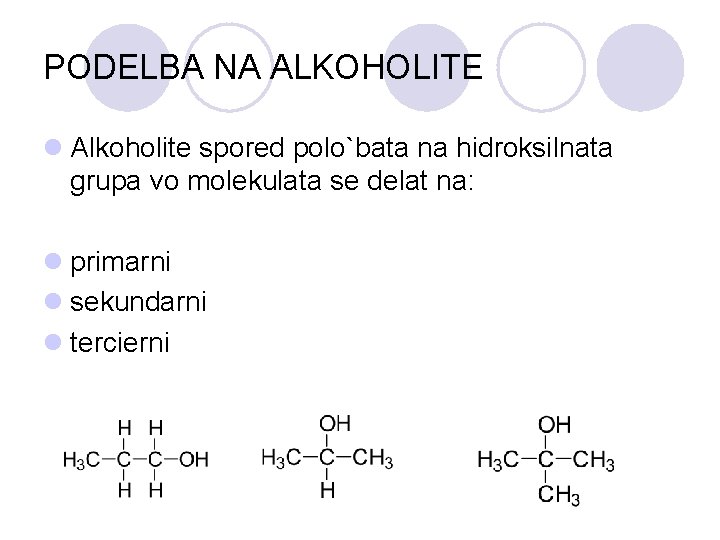
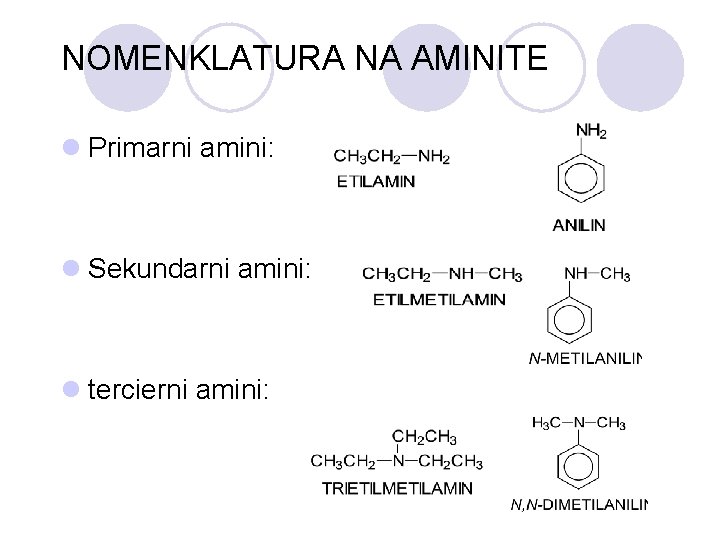
PODELBA NA ALKOHOLITE l Alkoholite spored polo`bata na hidroksilnata grupa vo molekulata se delat na: l primarni l sekundarni l tercierni

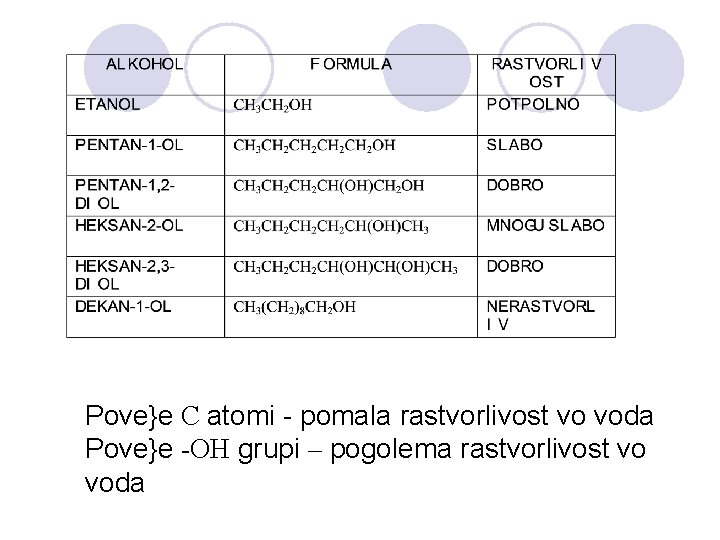
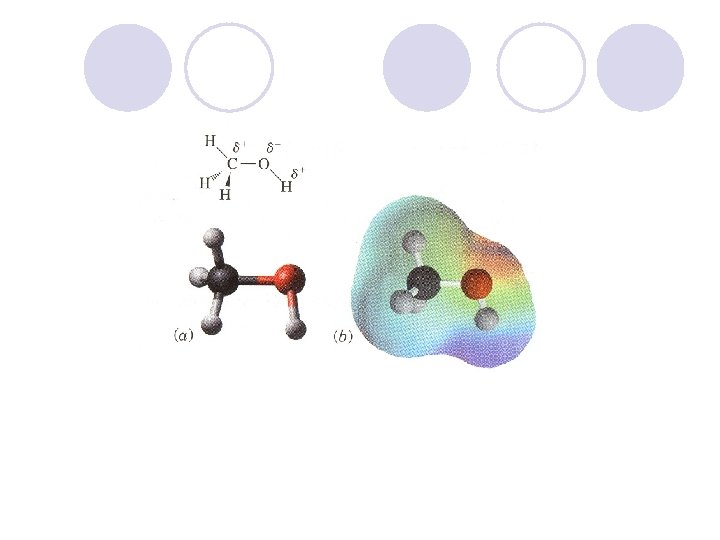
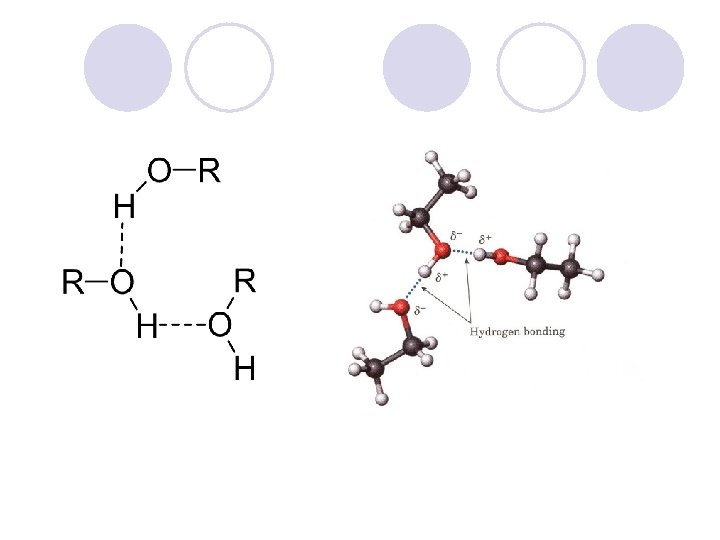
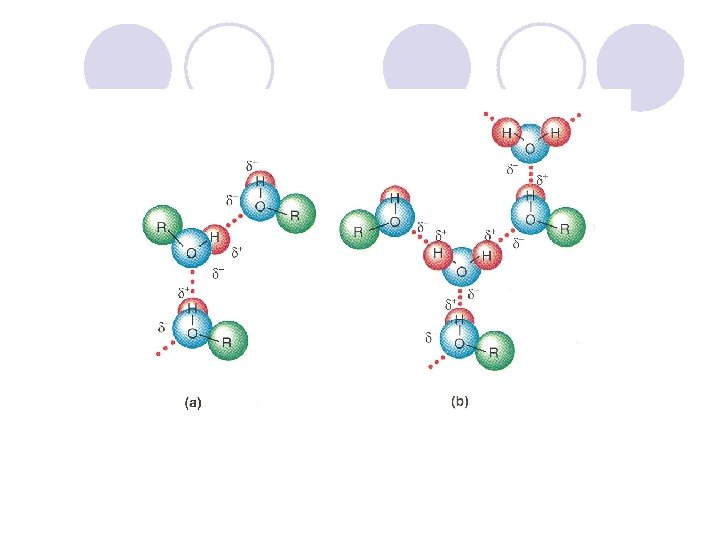
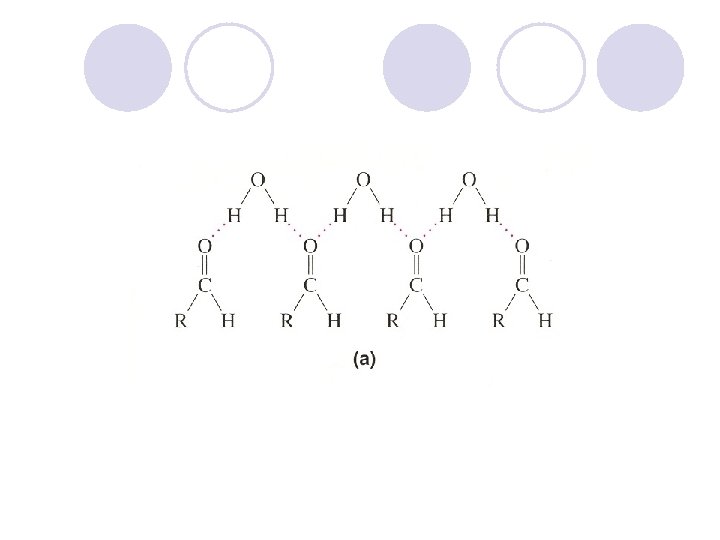
FIZI^KI SVOJSTVA NA ALKOHOLITE l Hidroksilnata grua, poradi elektronegativnosta na kislorodniot atom, predizvikuva polarnost vo molekulata na alkoholot. l Vodorodot formira vodorodna vrska so drugite molekuli na alkoholite ili so molekulite na vodata. Vlijanie na brojot na C atomite na rastvorlivost na alkoholite. Vlijanie na brojot na hidroksilnite grupi na rastvorlivost na alkoholite.

Pove}e C atomi - pomala rastvorlivost vo voda Pove}e -OH grupi – pogolema rastvorlivost vo voda




l Alkoholite imaat znatno povisoka temperatura na vriewe nego alkanite so isti, ili sli~ni, molekulski masi. l Etanol (46) Tv = 78 o. C 45 o. C Propan (44) Tv = – l Butan-1 -ol (74) Tv = 117 o. C l Pentan (72) Tv = 36 o. C

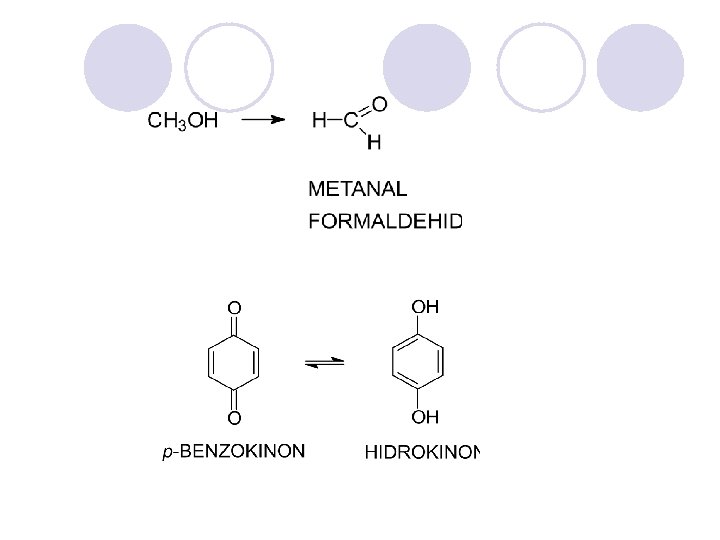
METANOL l CH 3 OH l (metil-alkohol) l Otroven e : vo mali koli~estva (< 10 ml) predizvikuva slepilo, a > 30 ml mo`e da bide smrtonosen.

ETANOL l CH 3 CH 2 OH l (etil-alkohol) l Najstara sintetski pripremena supstanca, odnosno prva supstanca koj e proizveden od ~ovek. Toa bilo vo Egipet pred okolu 5 700 godina.

l Kletkite na kvascite vo ovo{jata koristat sostojki koi postojat okolu niv za da obezbedat energija. l So procesot na fermentacija go pretvara {ekerot (glukozata) vo energija. l Etanolot ima {iroka primena vo medicinata. l Se koristi za dezinfekcija, kako antiseptik, bidej}i gi uni{tuva bakteriite. l Najefikasen e 70%.

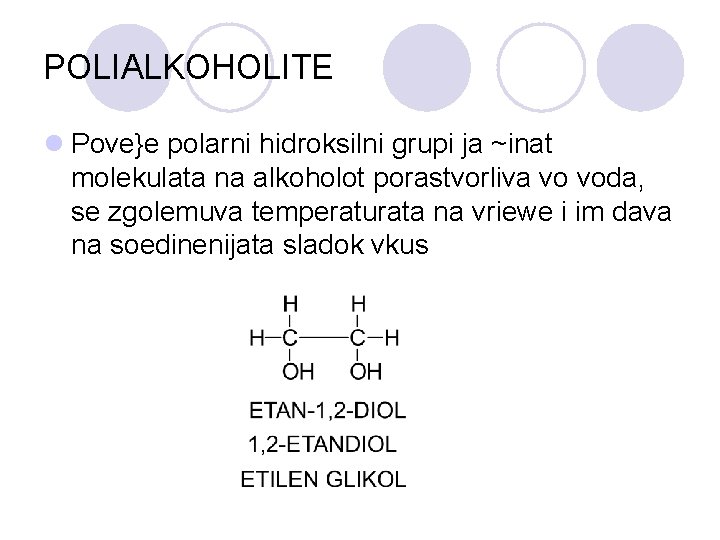
POLIALKOHOLITE l Pove}e polarni hidroksilni grupi ja ~inat molekulata na alkoholot porastvorliva vo voda, se zgolemuva temperaturata na vriewe i im dava na soedinenijata sladok vkus

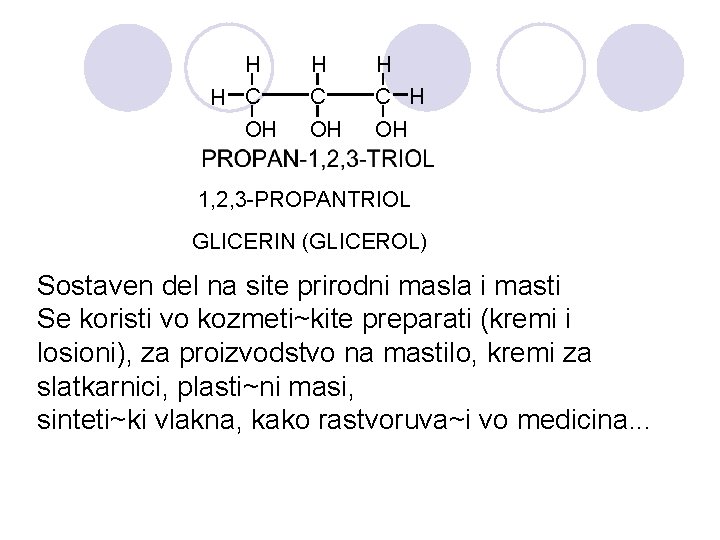
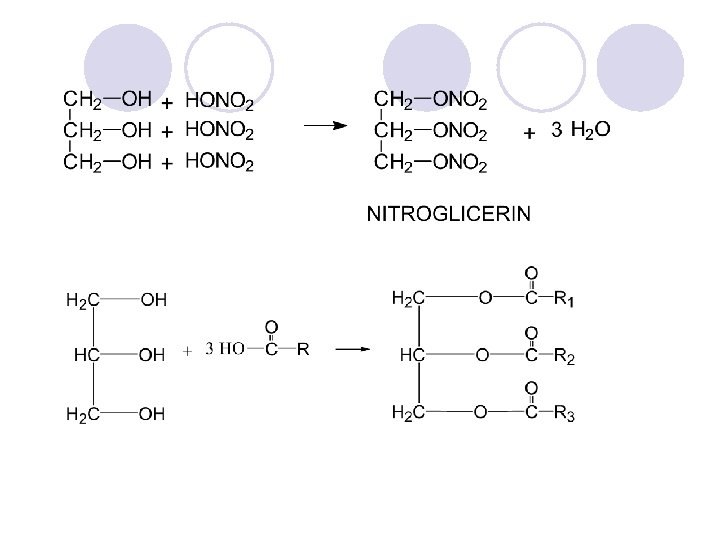
H H C OH H C H OH 1, 2, 3 -PROPANTRIOL GLICERIN (GLICEROL) Sostaven del na site prirodni masla i masti Se koristi vo kozmeti~kite preparati (kremi i losioni), za proizvodstvo na mastilo, kremi za slatkarnici, plasti~ni masi, sinteti~ki vlakna, kako rastvoruva~i vo medicina. . .

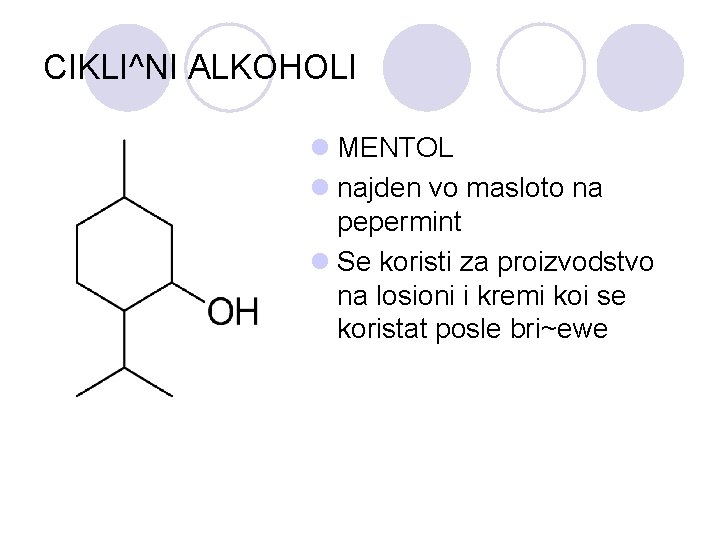
CIKLI^NI ALKOHOLI l MENTOL l najden vo masloto na pepermint l Se koristi za proizvodstvo na losioni i kremi koi se koristat posle bri~ewe

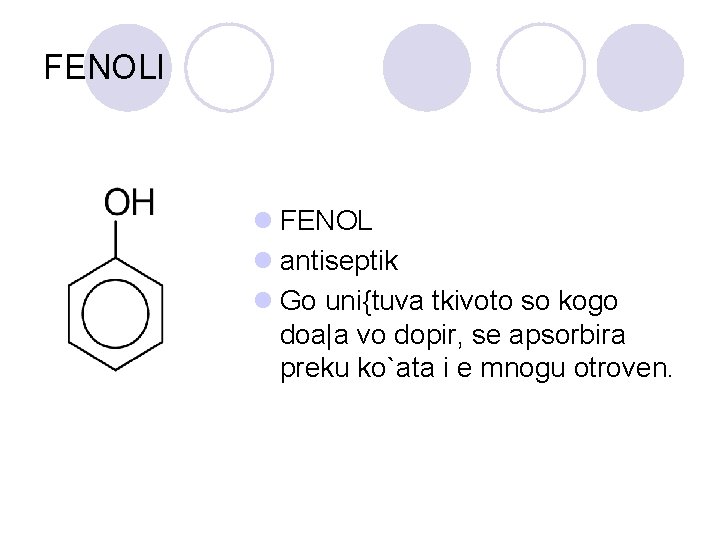
FENOLI l FENOL l antiseptik l Go uni{tuva tkivoto so kogo doa|a vo dopir, se apsorbira preku ko`ata i e mnogu otroven.

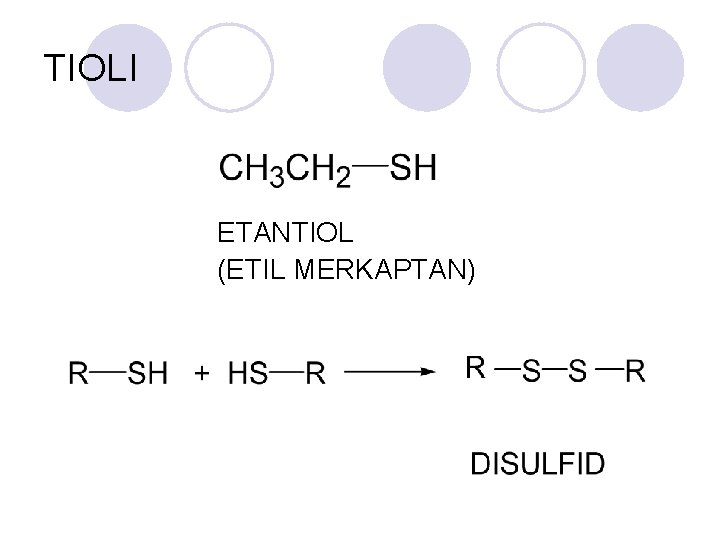
TIOLI ETANTIOL (ETIL MERKAPTAN)

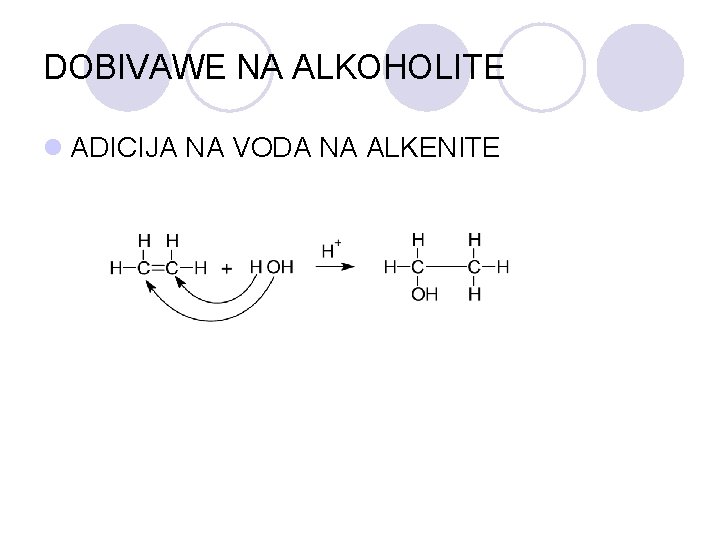
DOBIVAWE NA ALKOHOLITE l ADICIJA NA VODA NA ALKENITE

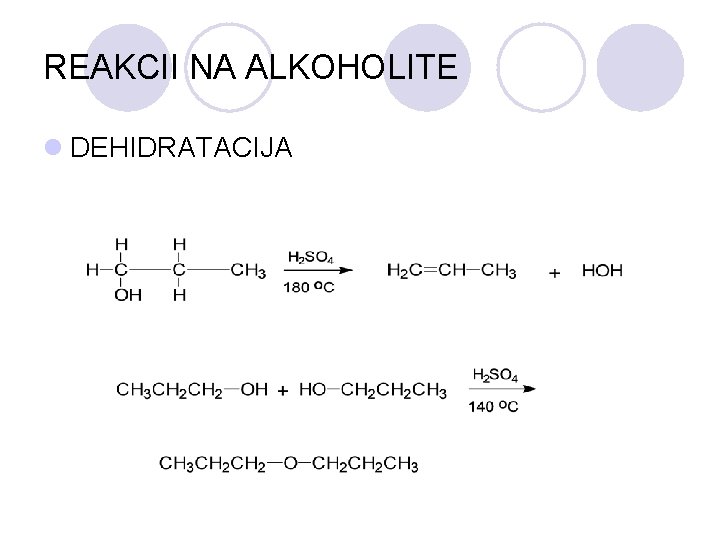
REAKCII NA ALKOHOLITE l DEHIDRATACIJA

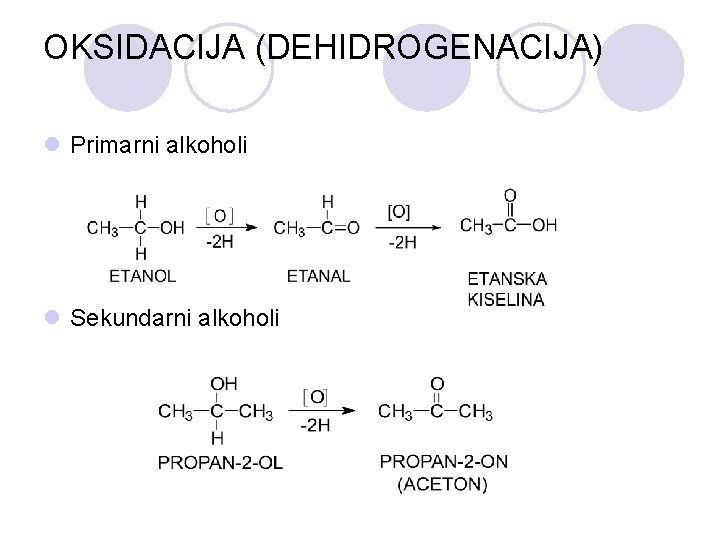
OKSIDACIJA (DEHIDROGENACIJA) l Primarni alkoholi l Sekundarni alkoholi

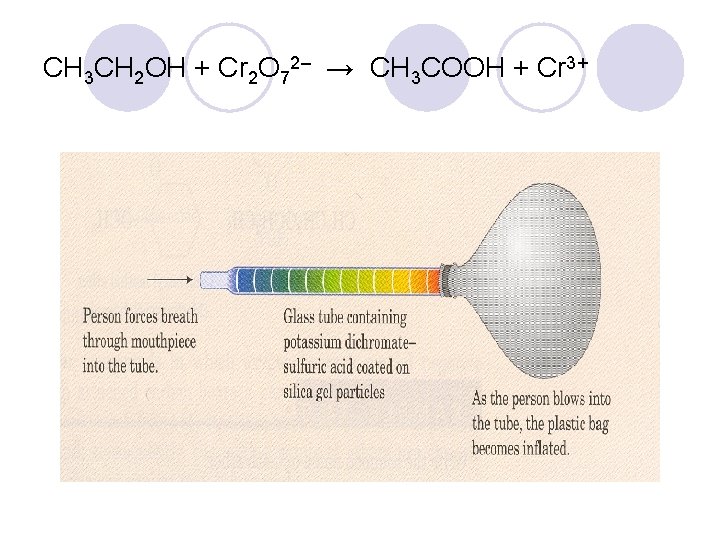
CH 3 CH 2 OH + Cr 2 O 72– → CH 3 COOH + Cr 3+

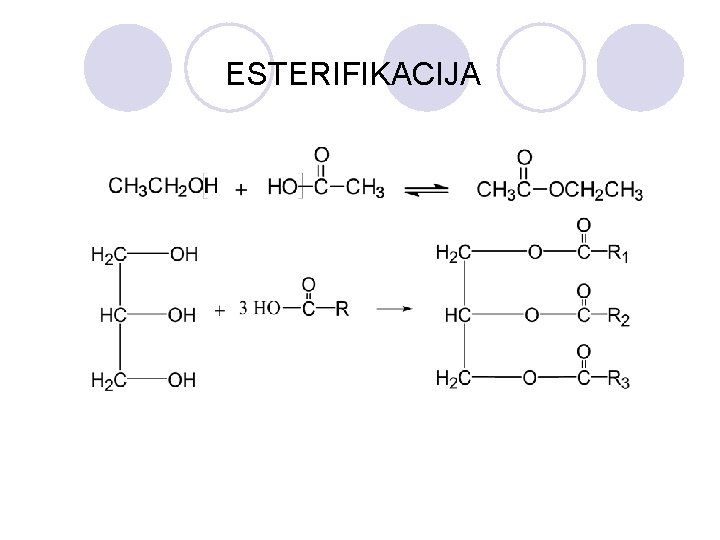
ESTERIFIKACIJA


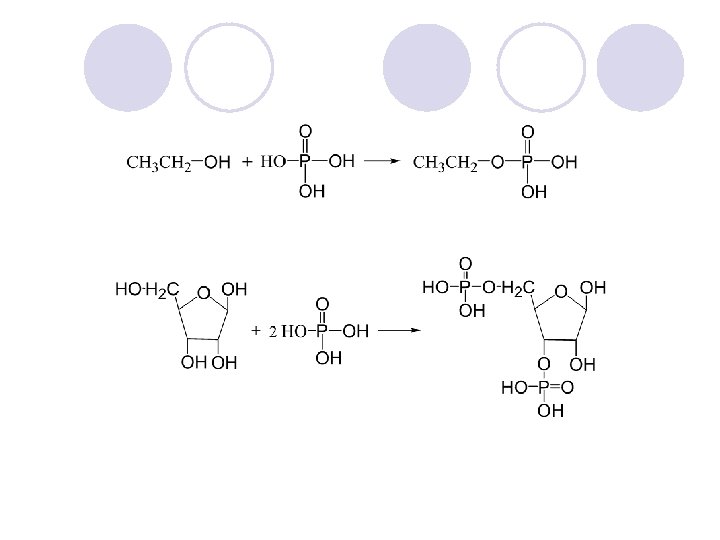
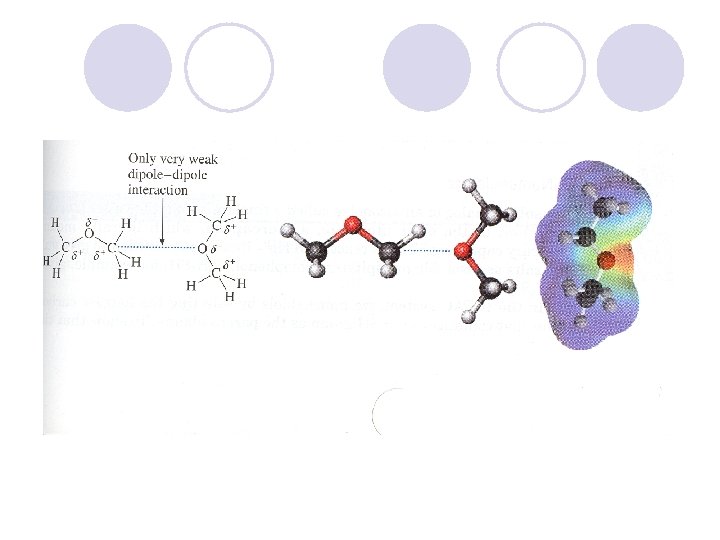
ETERI l R-O-R´ l Eterite ne formiraat vodorodni vrski: l -ne se rastvorlivi vo voda l -rastvorlivi vo nepolarnite, organskite, rastvoruva~i l -temperaturite na vriewa mnogu poniski od alkoholite so ista molekulska masa l dimetil-eter (46) Tv = -23 o. C CH 3 -O- CH 3 l etanol (46) Tv = 78 o. C CH 3 CH 2 -OH


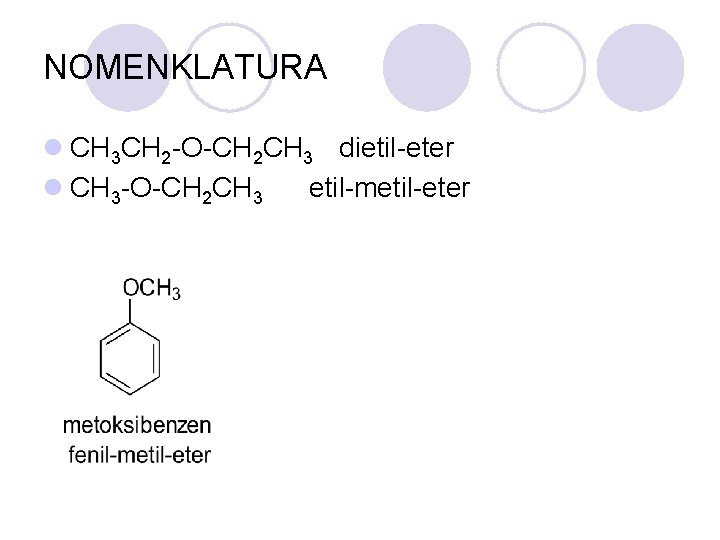
NOMENKLATURA l CH 3 CH 2 -O-CH 2 CH 3 dietil-eter l CH 3 -O-CH 2 CH 3 etil-metil-eter

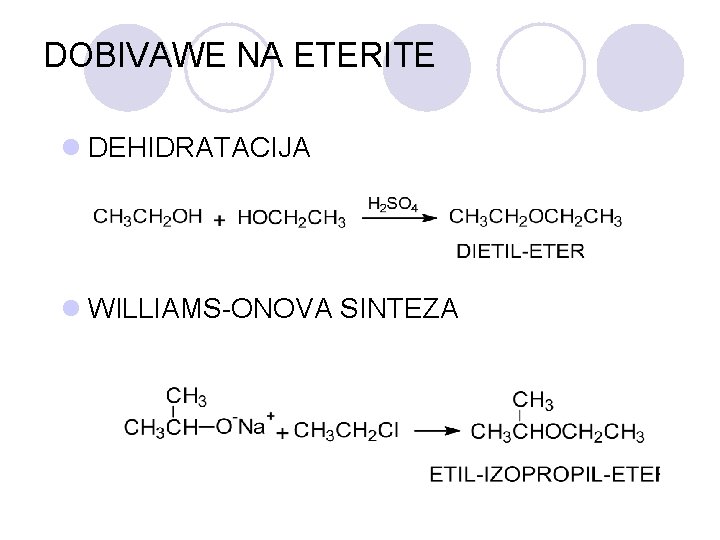
DOBIVAWE NA ETERITE l DEHIDRATACIJA l WILLIAMS-ONOVA SINTEZA

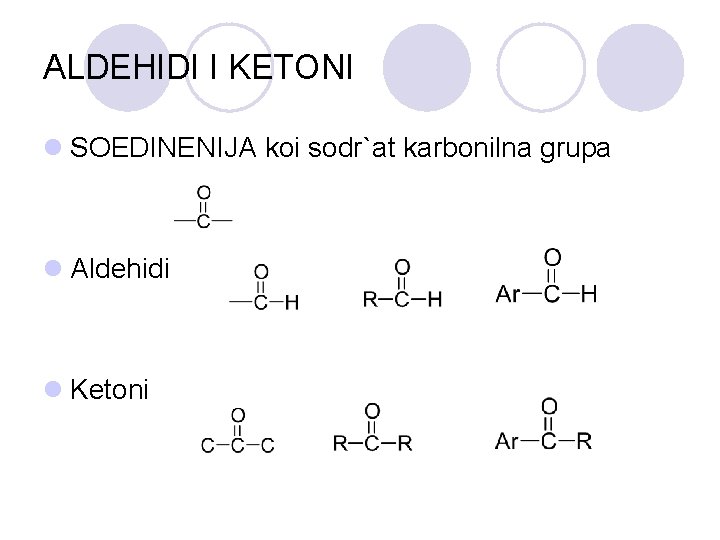
ALDEHIDI I KETONI l SOEDINENIJA koi sodr`at karbonilna grupa l Aldehidi l Ketoni

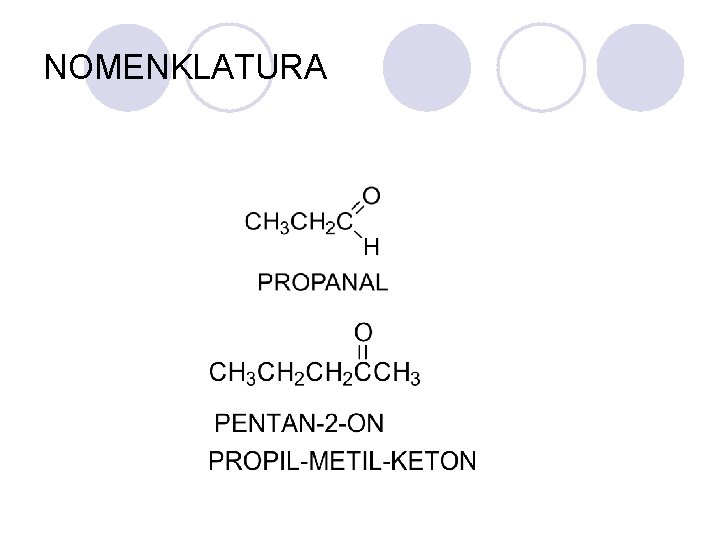
NOMENKLATURA

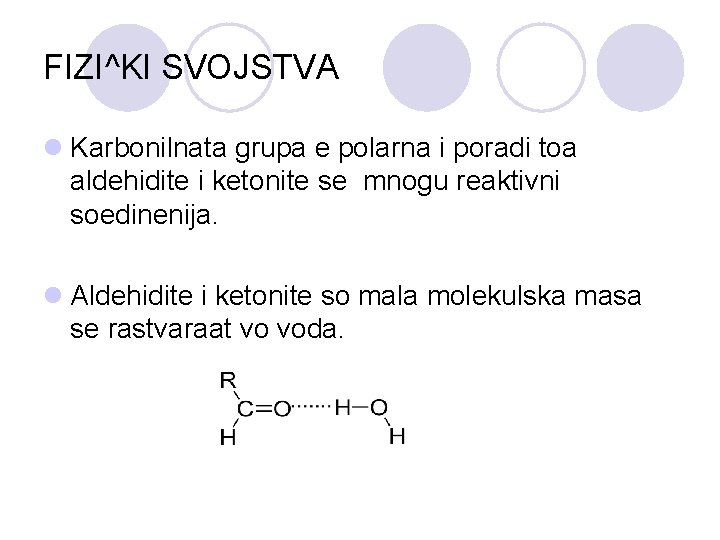
FIZI^KI SVOJSTVA l Karbonilnata grupa e polarna i poradi toa aldehidite i ketonite se mnogu reaktivni soedinenija. l Aldehidite i ketonite so mala molekulska masa se rastvaraat vo voda.



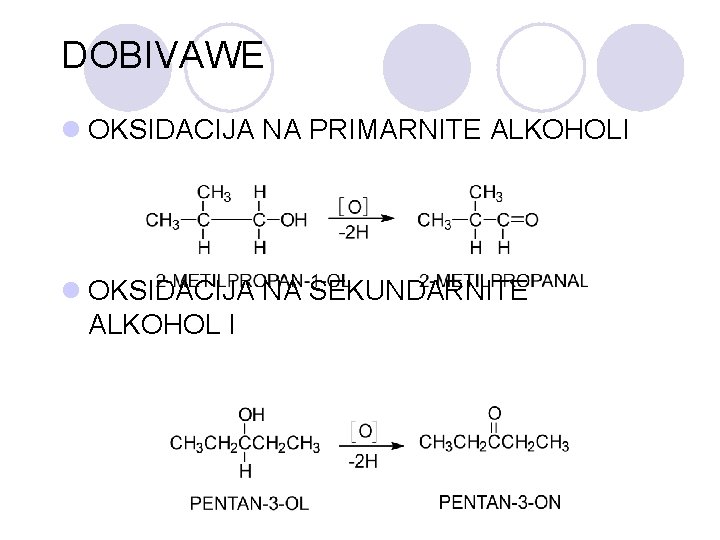
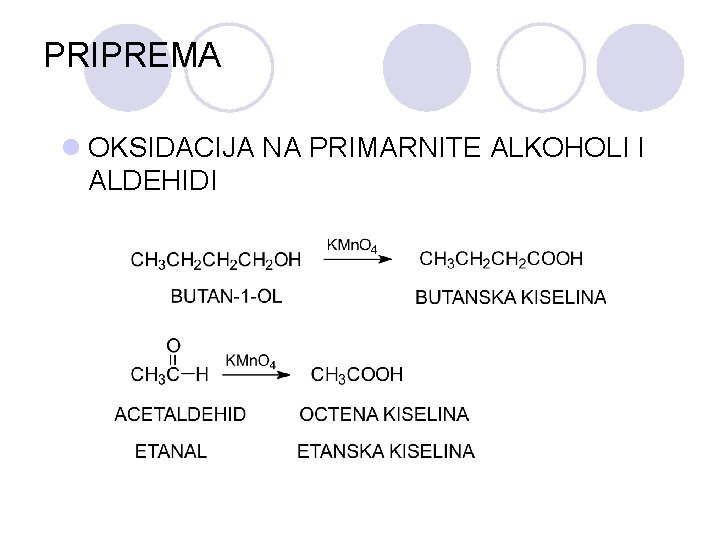
DOBIVAWE l OKSIDACIJA NA PRIMARNITE ALKOHOLI l OKSIDACIJA NA SEKUNDARNITE ALKOHOL I

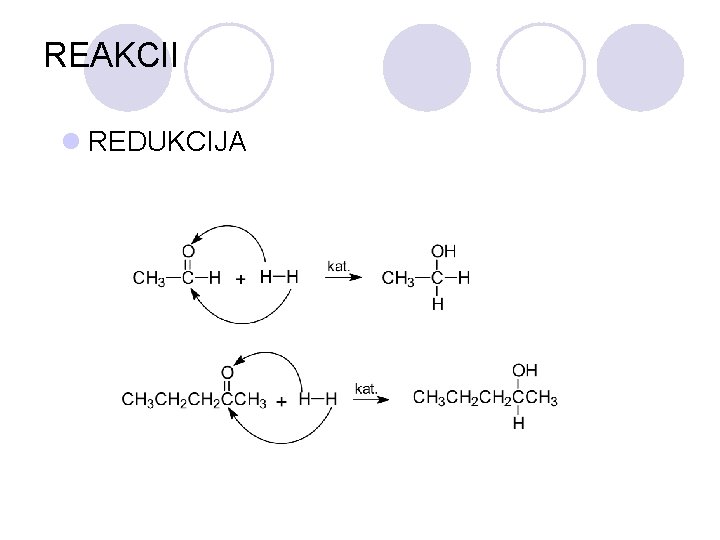
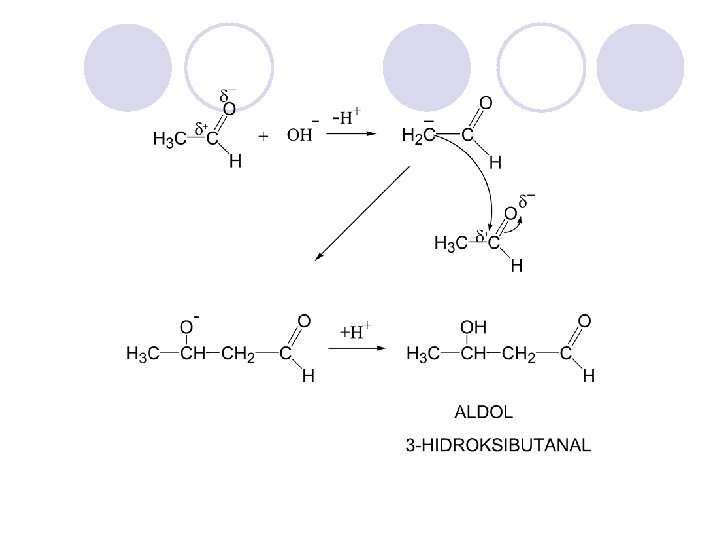
REAKCII l REDUKCIJA


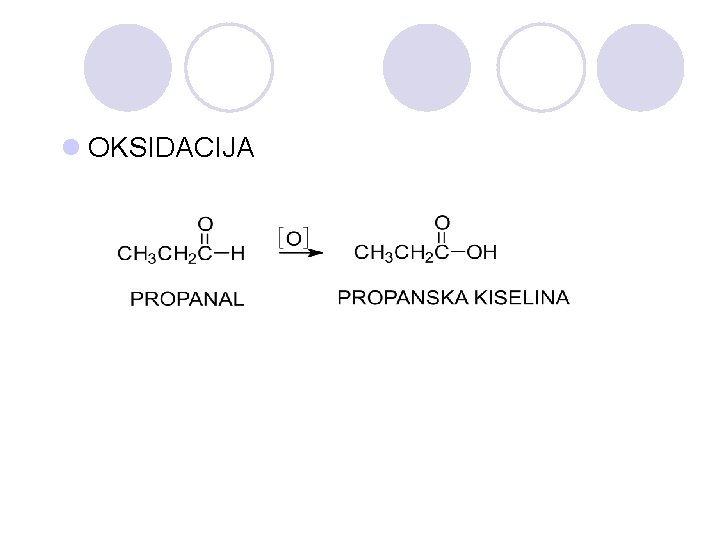
l OKSIDACIJA

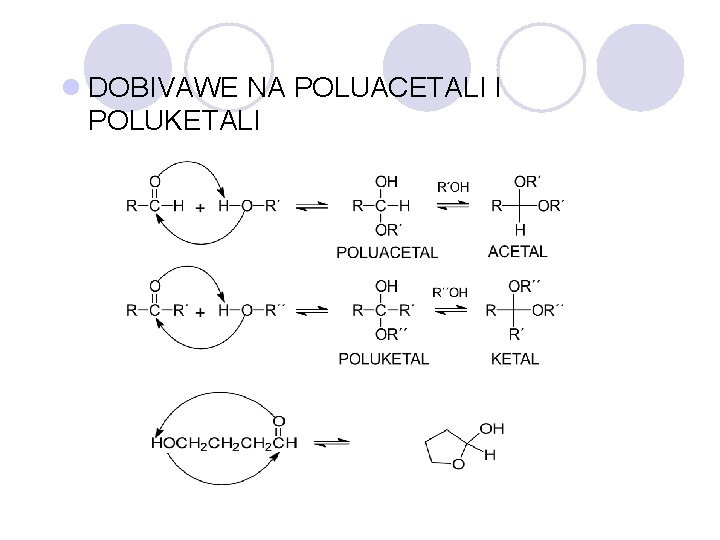
l DOBIVAWE NA POLUACETALI I POLUKETALI

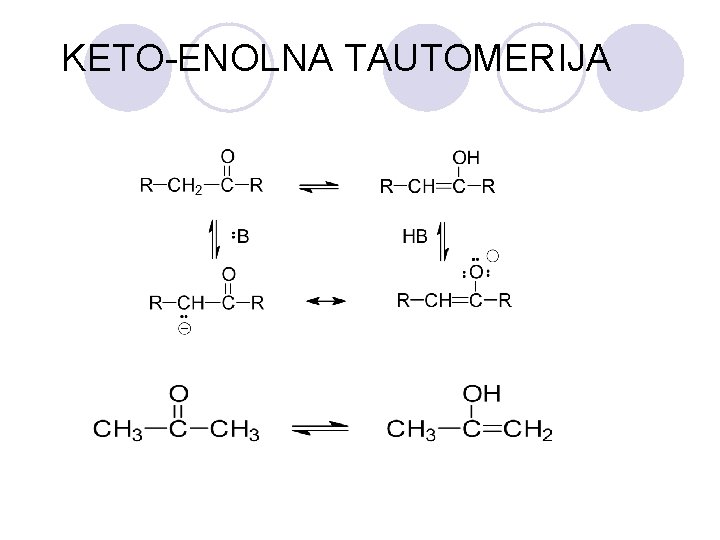
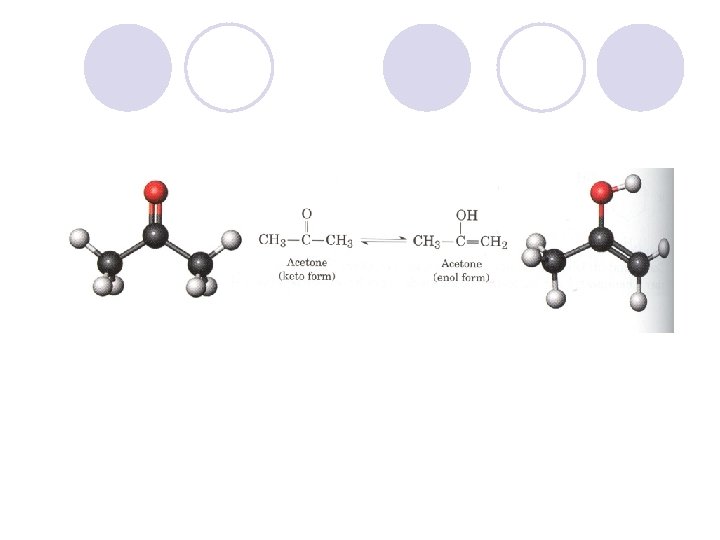
KETO-ENOLNA TAUTOMERIJA





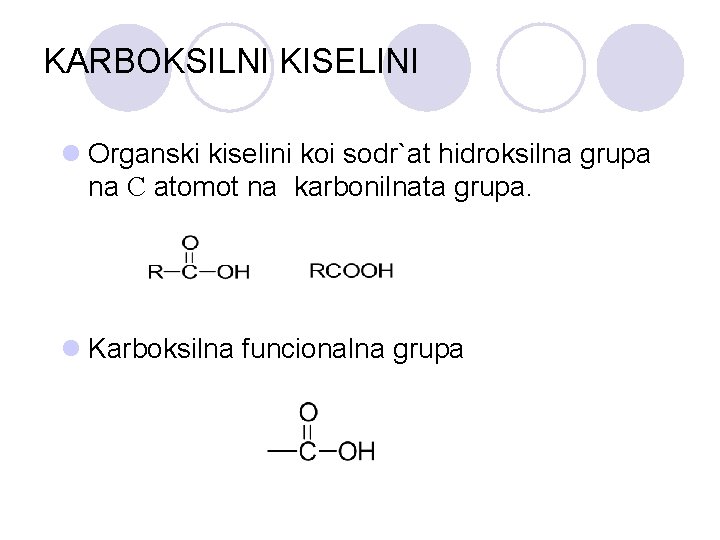
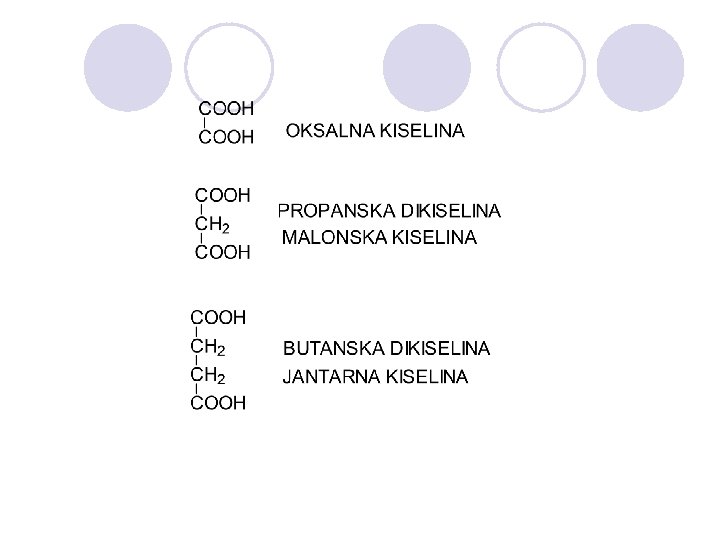
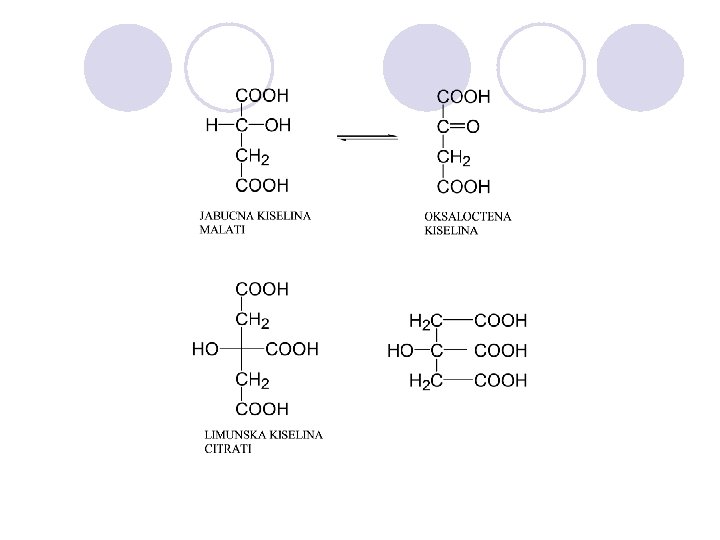
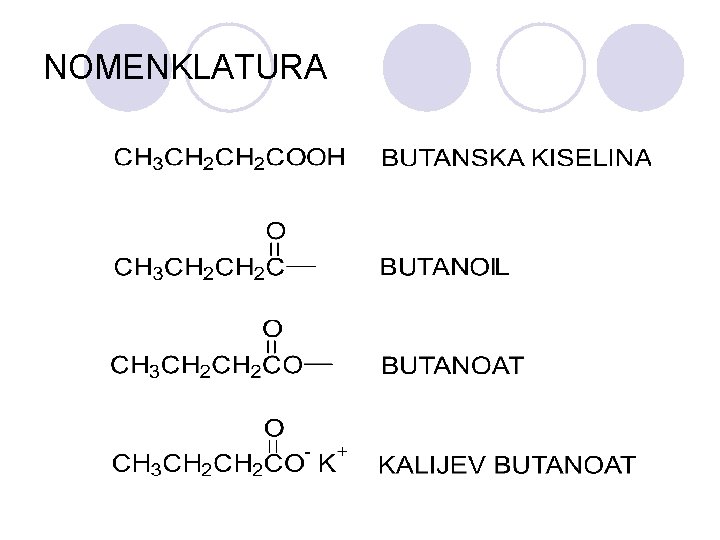
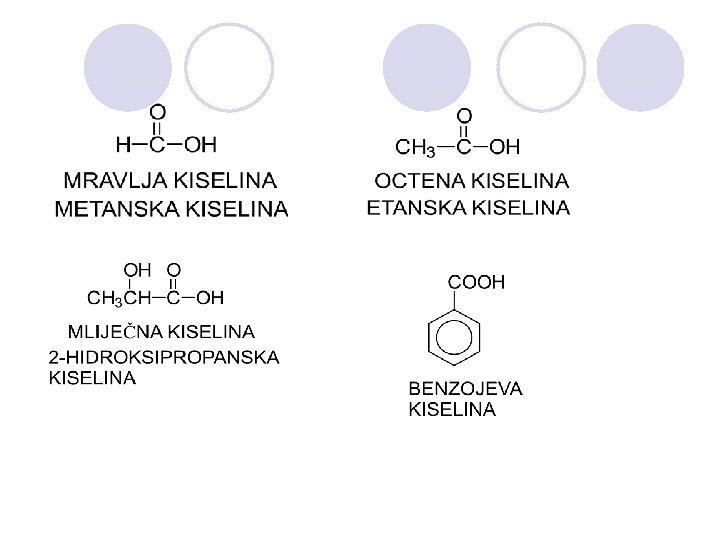
KARBOKSILNI KISELINI l Organski kiselini koi sodr`at hidroksilna grupa na C atomot na karbonilnata grupa. l Karboksilna funcionalna grupa





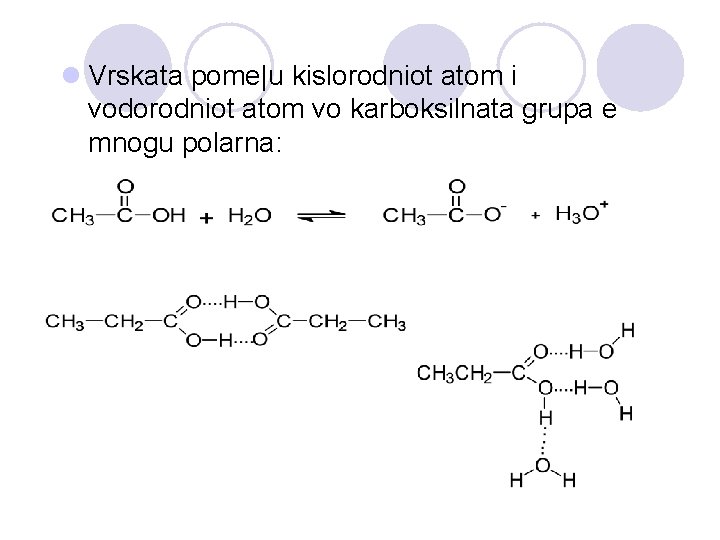
l Vrskata pome|u kislorodniot atom i vodorodniot atom vo karboksilnata grupa e mnogu polarna:

FIZI^KI SVOJSTVA l Karboksilnite kiselini imaat povisoka temperatura na vriewe od alkoholite so ista molekulska masa poradi ja~inata na intermolekularnite vodorodni vrski. l Ni`ite karboksilni kiselini potpolno se rastvorlivi vo voda. Vi{ite kiselini se rastvaraat (me{aat) so vodata podobro od soodvetnite alkoholi, aldehidi i ketoni.

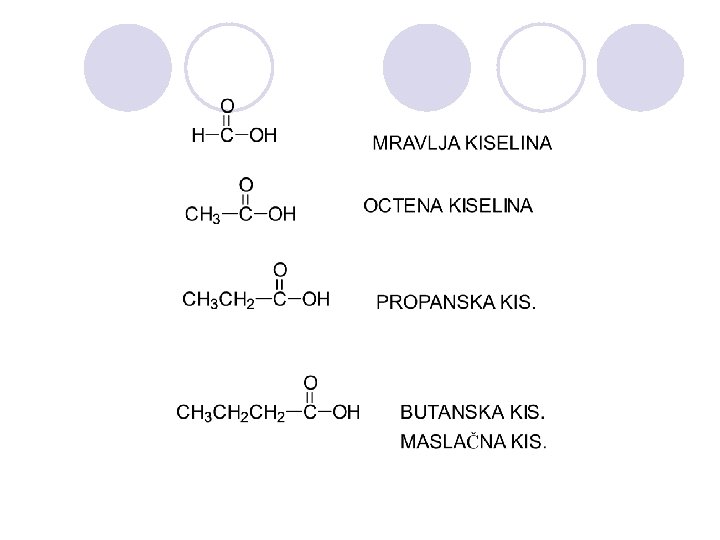
NOMENKLATURA

PRIPREMA l OKSIDACIJA NA PRIMARNITE ALKOHOLI I ALDEHIDI






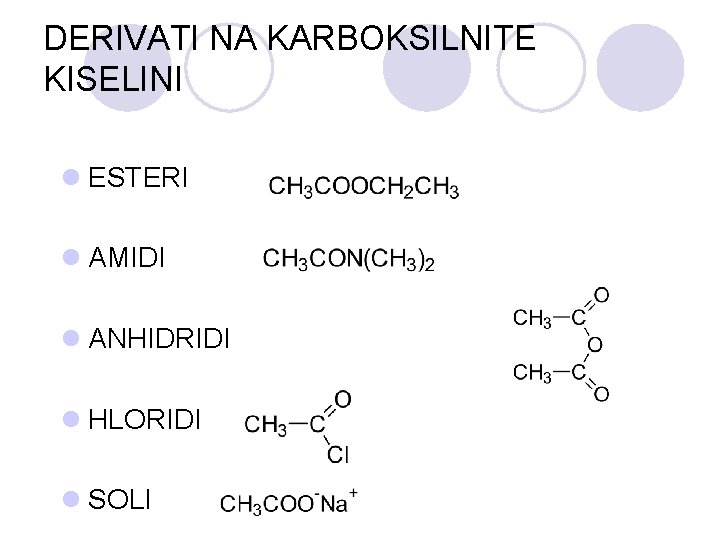
DERIVATI NA KARBOKSILNITE KISELINI l ESTERI l AMIDI l ANHIDRIDI l HLORIDI l SOLI

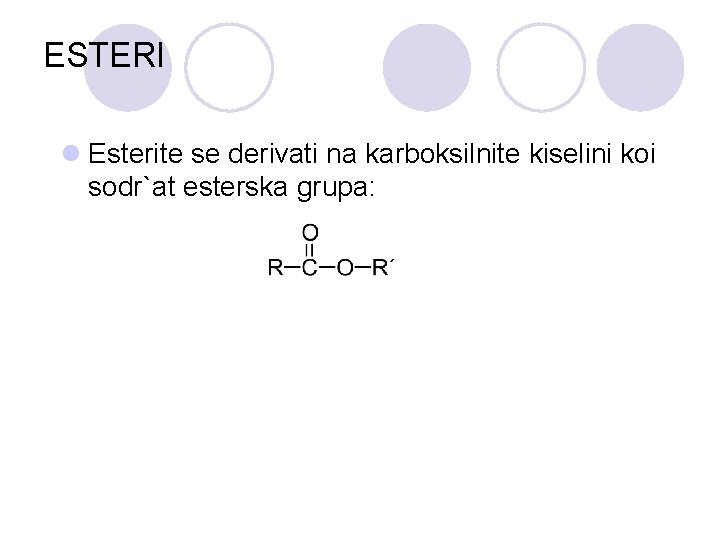
ESTERI l Esterite se derivati na karboksilnite kiselini koi sodr`at esterska grupa:

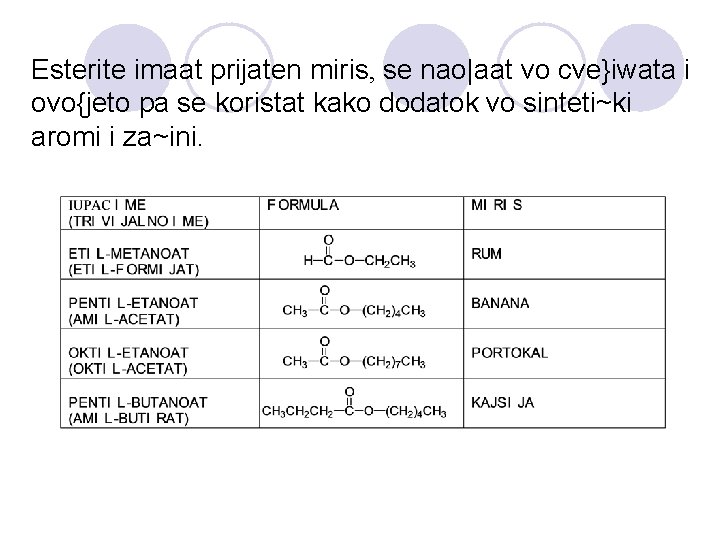
Esterite imaat prijaten miris, se nao|aat vo cve}iwata i ovo{jeto pa se koristat kako dodatok vo sinteti~ki aromi i za~ini.

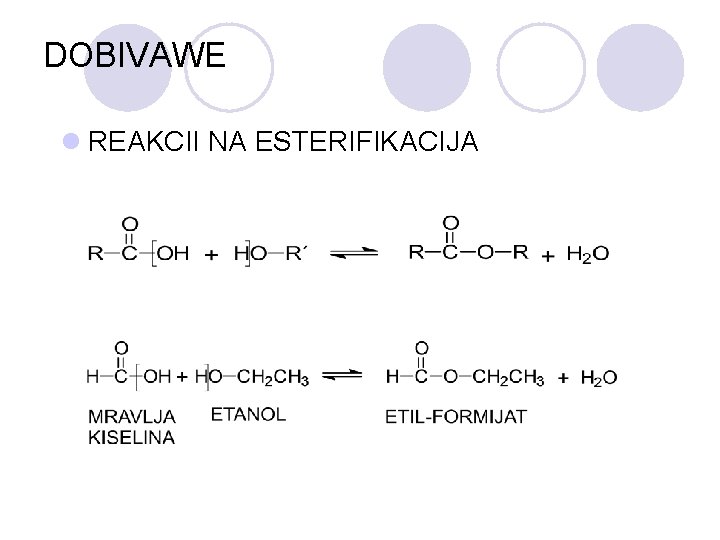
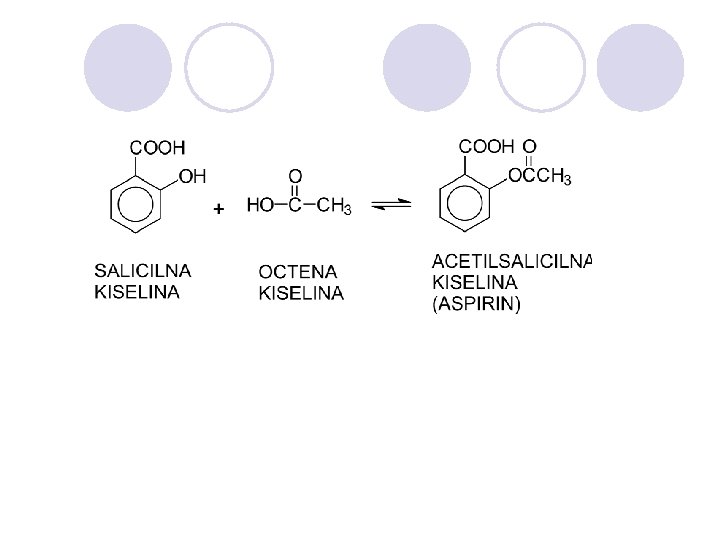
DOBIVAWE l REAKCII NA ESTERIFIKACIJA



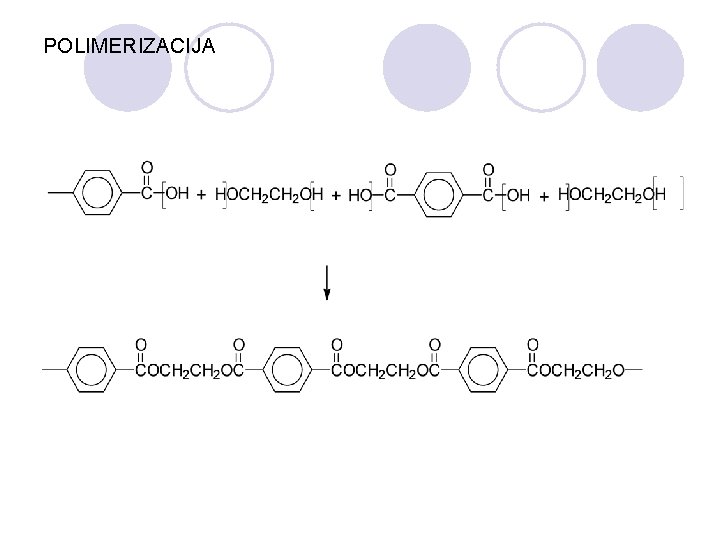
POLIMERIZACIJA

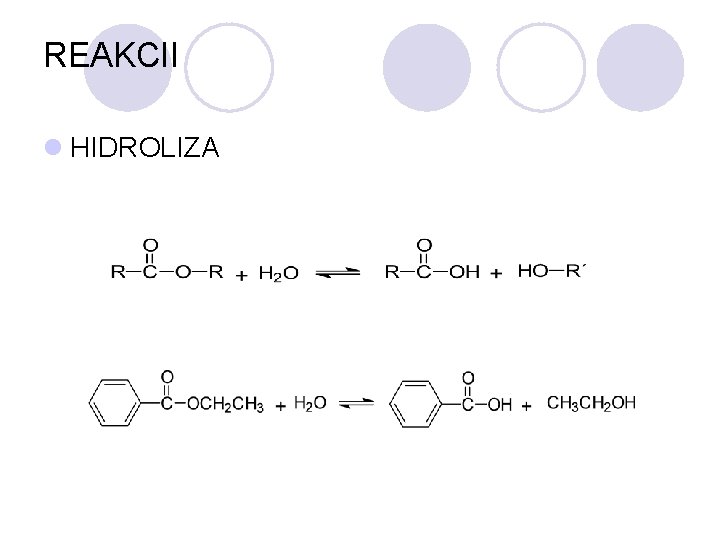
REAKCII l HIDROLIZA

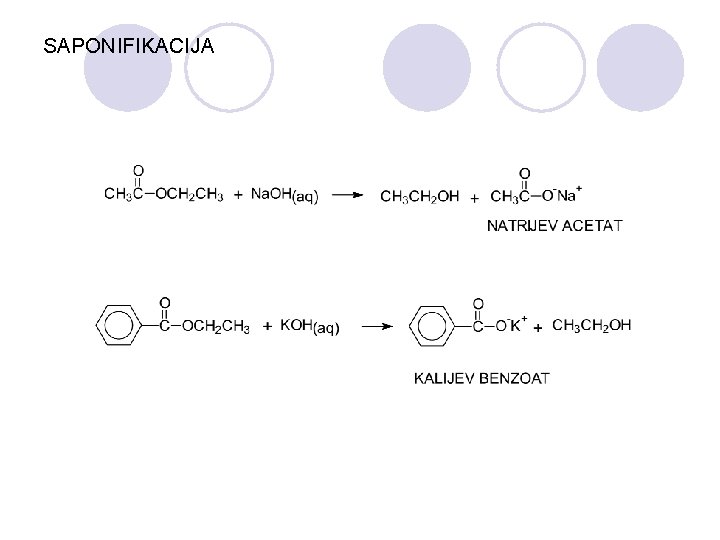
SAPONIFIKACIJA


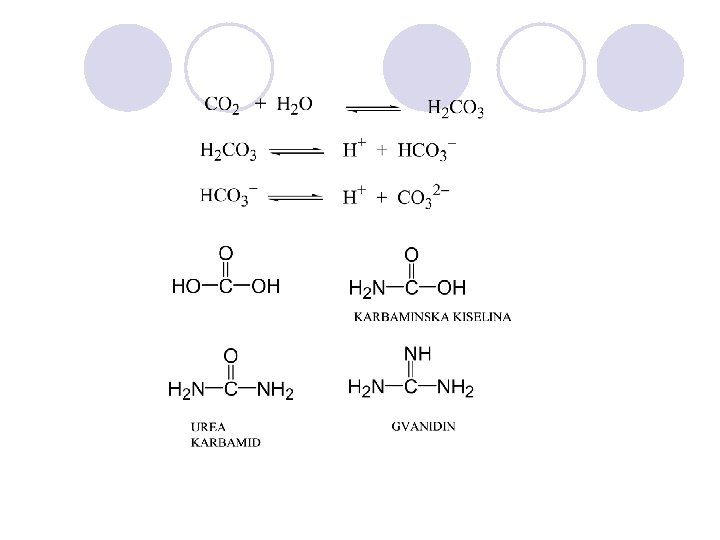
ORGANSKI SOEDINENIJA KOI SODR@AT AZOT l Azotot e 4. element po zastapenosta vo ~ove~kiot organizam. On ~ini 1, 4% od site atomi vo na{eto telo. l Atomot na azotot ima 5 valentni elektroni i da stane stabilen treba da u~estvuva vo tri kovalentni vrski: 3 edine~ni, 1 dvojna + 1 edine~na ili 1 trojna. l Atomot na azotot formira stabilni vrski so atomite na jaglerod, kislorod i vodorod.

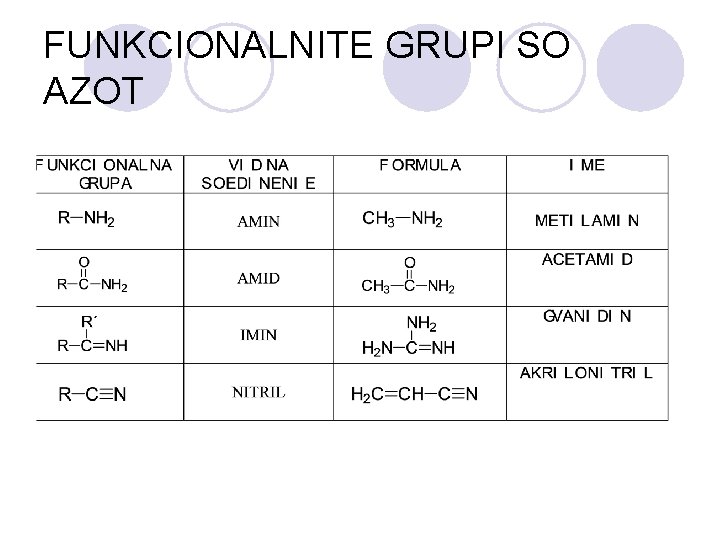
FUNKCIONALNITE GRUPI SO AZOT

AMINITE l Op{ta formula: R-NH 2 l Aminite imaat ostar, prodoren miris. l PODELBA: ¡ primarni ¡ sekundarni ¡ tercierni


NOMENKLATURA NA AMINITE l Primarni amini: l Sekundarni amini: l tercierni amini:

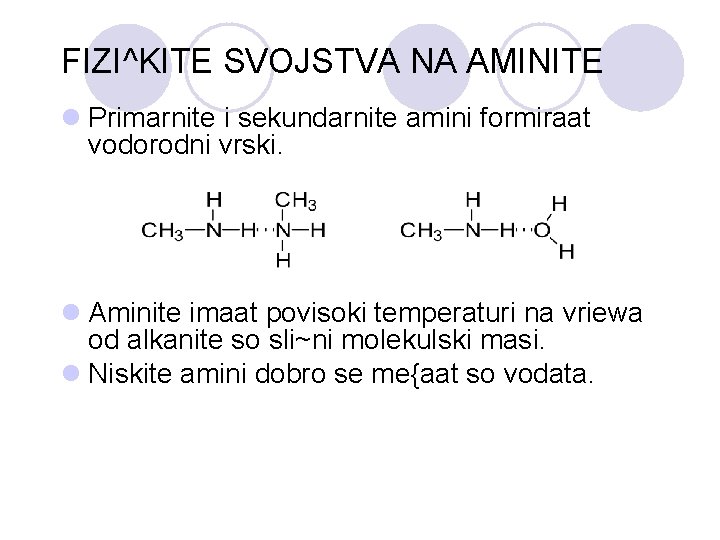
FIZI^KITE SVOJSTVA NA AMINITE l Primarnite i sekundarnite amini formiraat vodorodni vrski. l Aminite imaat povisoki temperaturi na vriewa od alkanite so sli~ni molekulski masi. l Niskite amini dobro se me{aat so vodata.

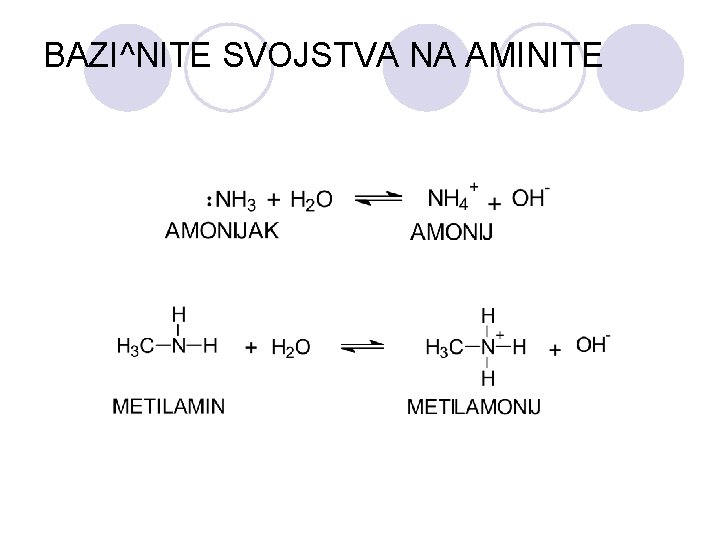
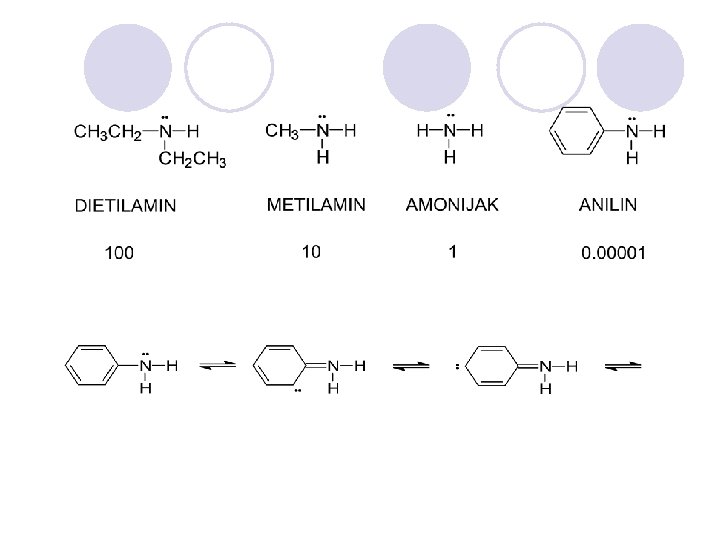
BAZI^NITE SVOJSTVA NA AMINITE


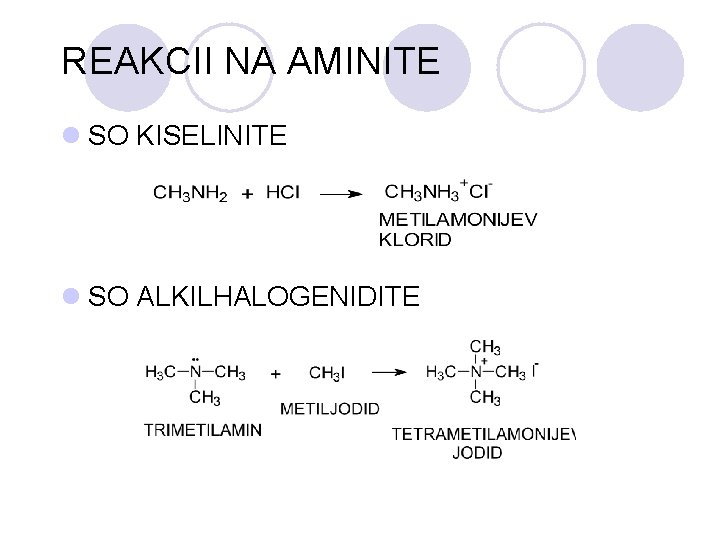
REAKCII NA AMINITE l SO KISELINITE l SO ALKILHALOGENIDITE




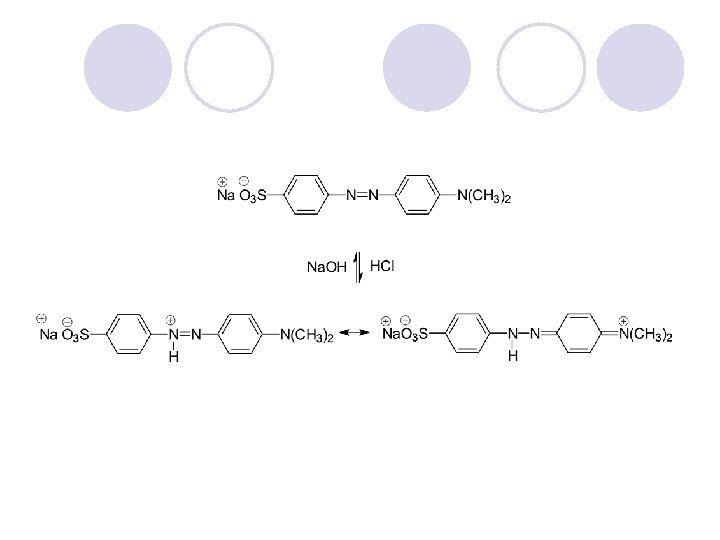
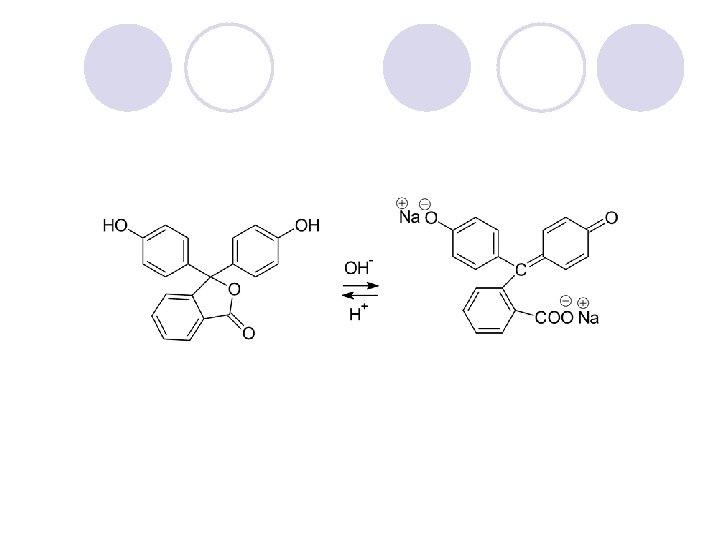
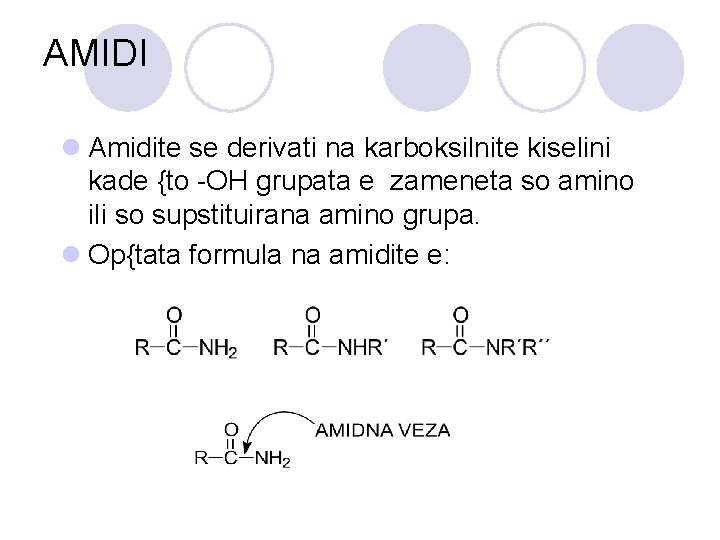
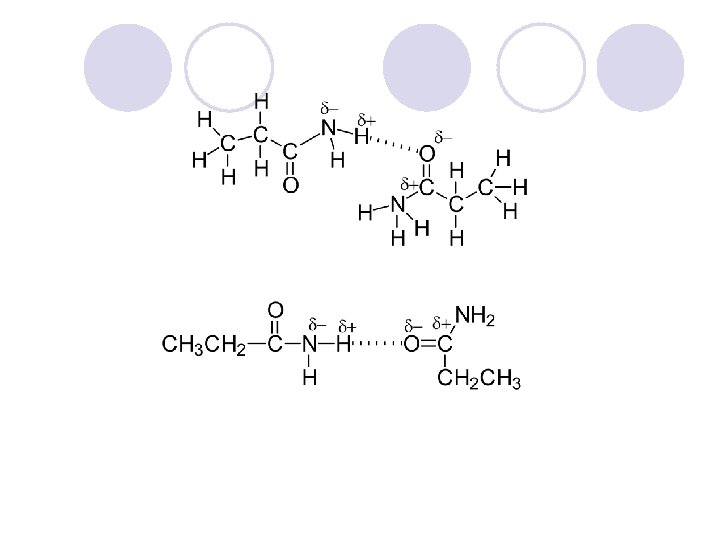
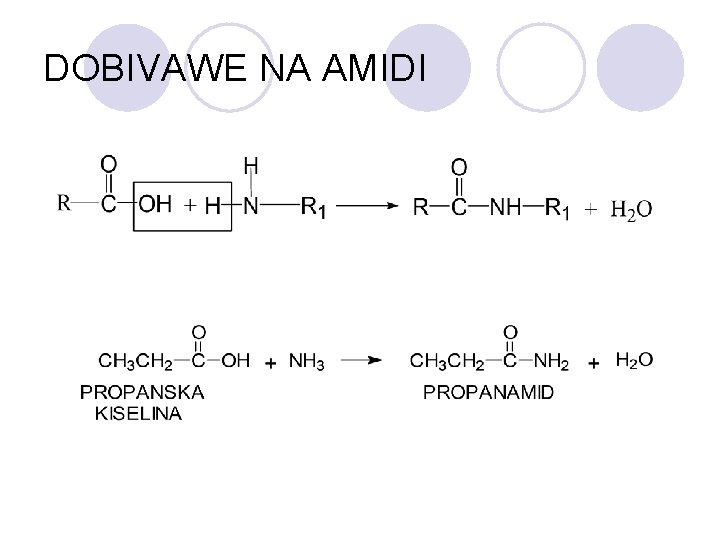
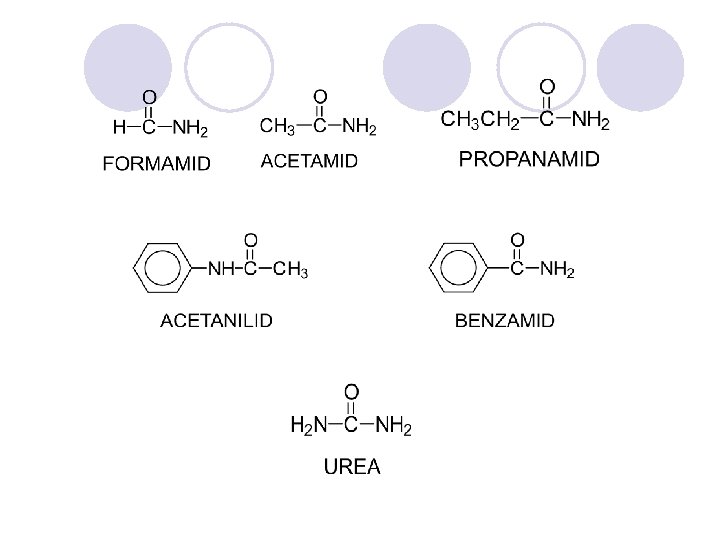
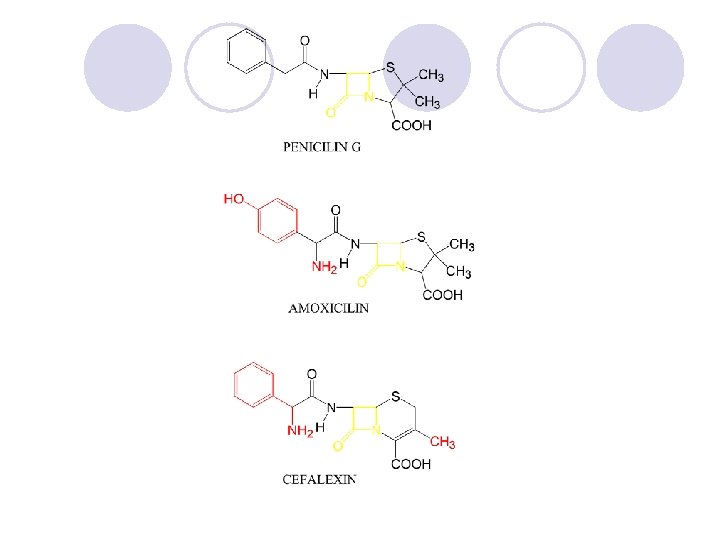
AMIDI l Amidite se derivati na karboksilnite kiselini kade {to -OH grupata e zameneta so amino ili so supstituirana amino grupa. l Op{tata formula na amidite e:


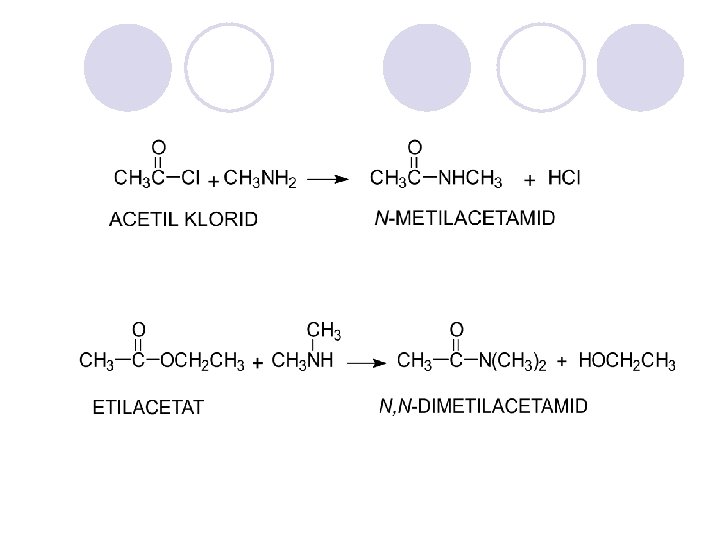
DOBIVAWE NA AMIDI





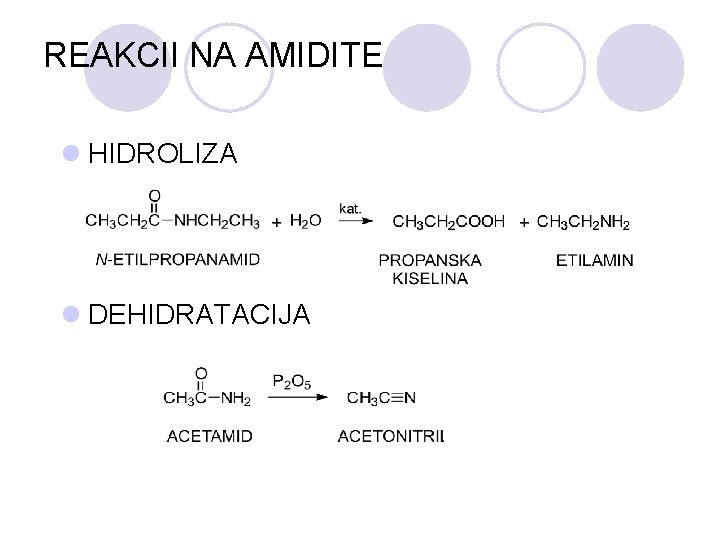
REAKCII NA AMIDITE l HIDROLIZA l DEHIDRATACIJA

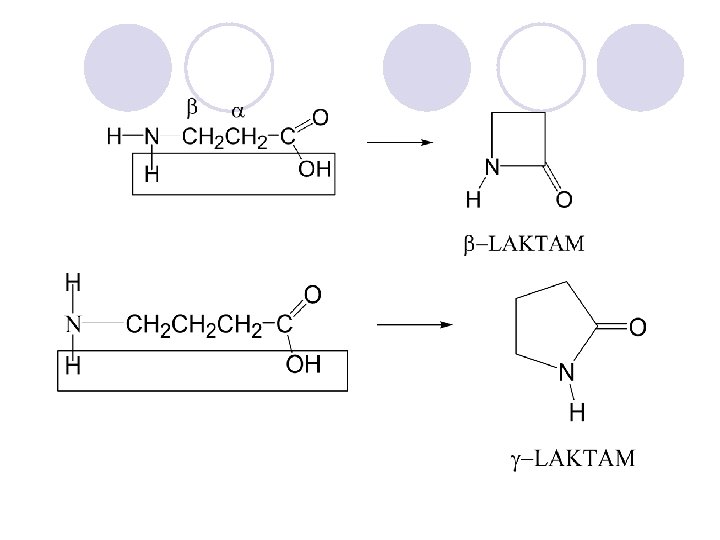
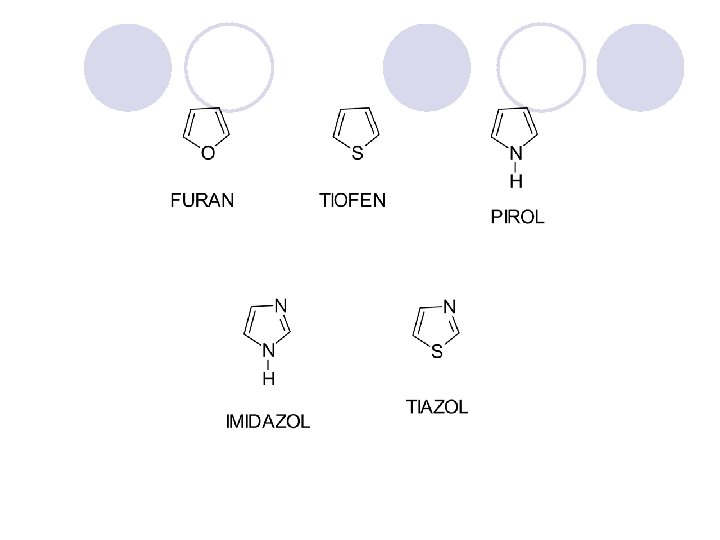
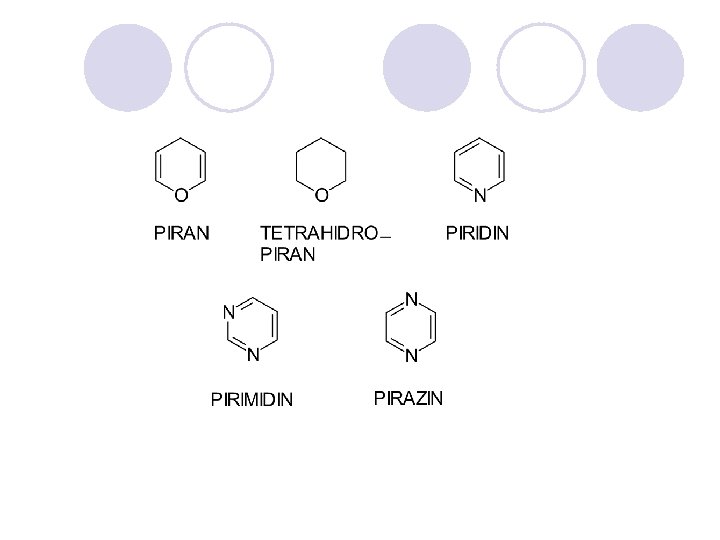
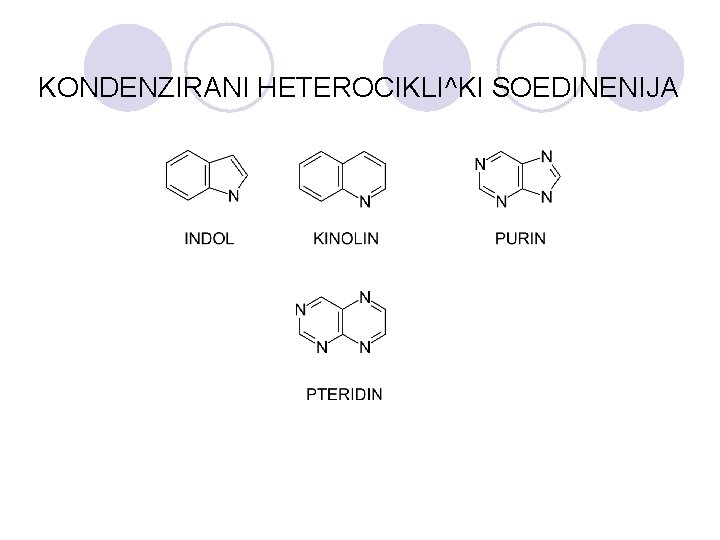
HETEROCIKLI^KI SOEDINENIJA l Heterocikli~kite soedinenija se organski soedinenija koi vo prstenestata struktura sodr`at osven jaglerodni atomi na drugite elementi, naj~esto azot, kislorod i sulfur. l Heteroaromatskite soedinenija se aromatski soedinenija koi vo prstenestata struktura sodr`at heteroatomi. l Se delat na: ¡ednostavni - imaat eden prsten ¡ kondenzirani - imaat dva ili pove}e povrzani prsteni.




KONDENZIRANI HETEROCIKLI^KI SOEDINENIJA

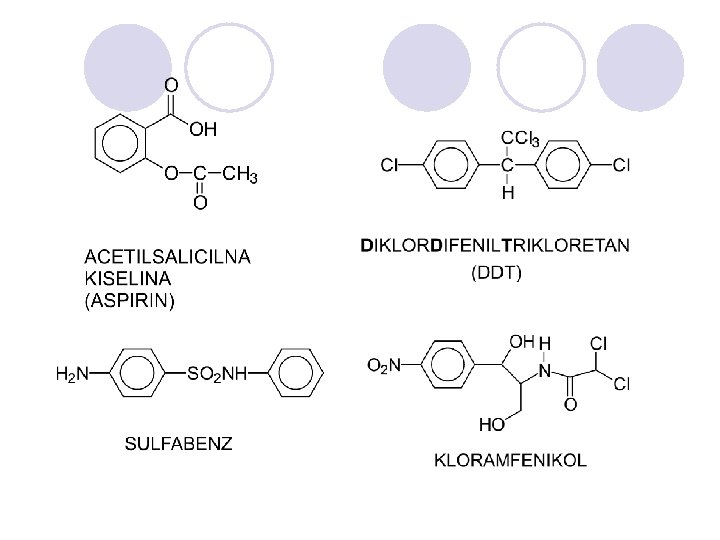
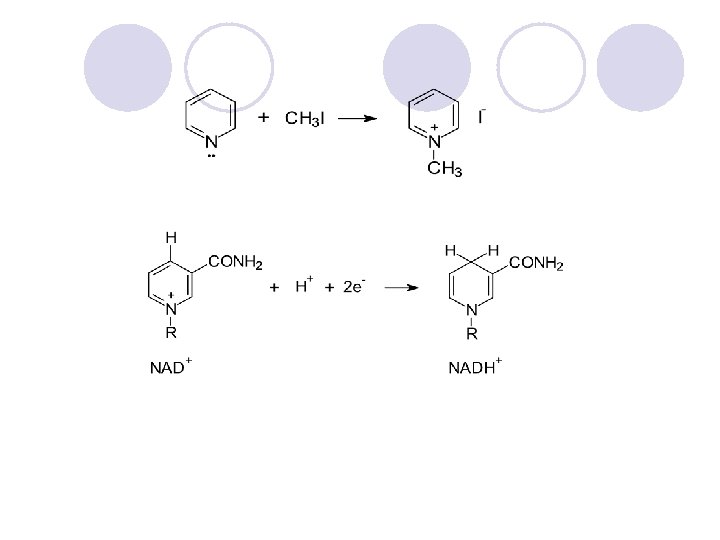
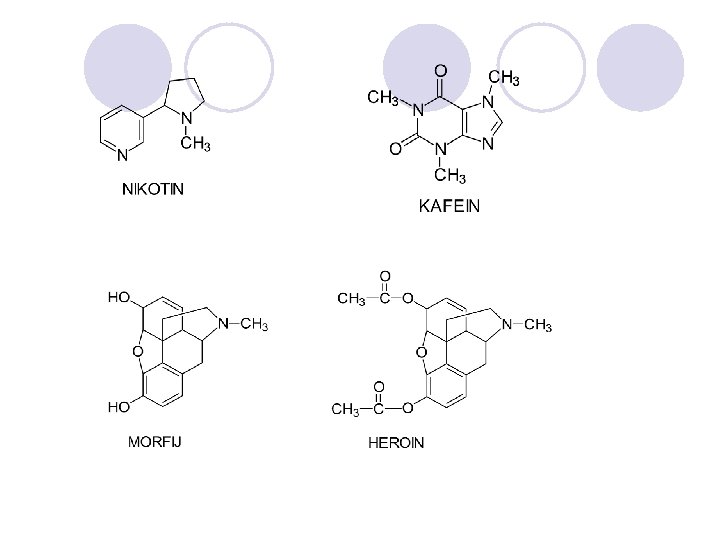
ALKALOIDI l Grupa na prirodni soedinenija koi sodr`at heterocikli~ki prsteni. l Bilni produkti so bazi~ni svojstva so silno fiziolo{ko dejstvo na lu|e i `ivotoni. l Alkaloidite se razvrstuvaat sprema bilkata vo koja se nao|aat: alkaloidi na tutunot, opijumot itn.

