HERPESVRUS HUMANOS 1 2 3 4 Generalidades Morfologia




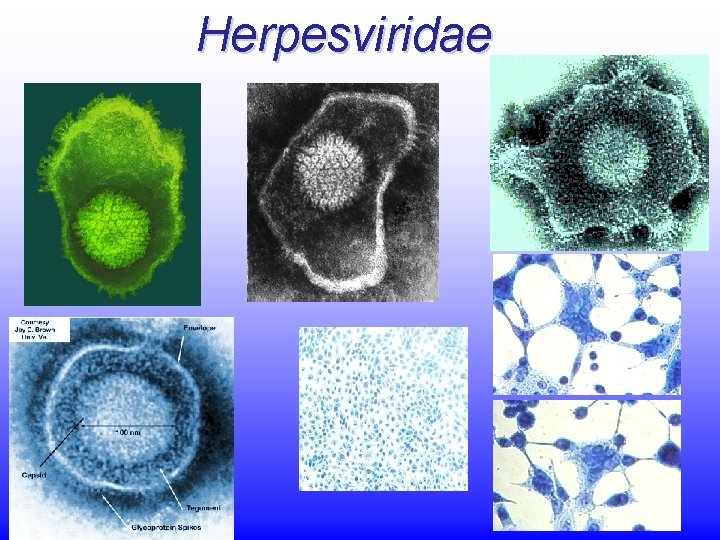




























































- Slides: 109

HERPESVÍRUS HUMANOS 1. 2. 3. 4. Generalidades / Morfologia / Quais são / Classificação Latência/reativação Replicação viral Para cada vírus: Epidemiologia (população alvo, transmissão/distribuição) Sinais clínicos Diagnóstico Prevenção/controle Tratamento

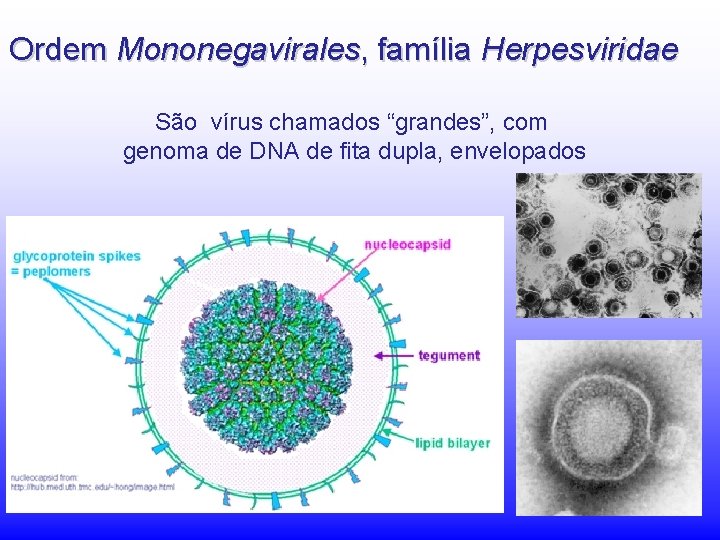
Ordem Mononegavirales - Família Herpesviridae Generalidades: Os herpesvírus infectam provavelmente todas as espécies animais. Em humanos: 8 identificados até o presente Herpesvírus são causa importante de doenças virais em humanos, secundárias somente aos vírus respiratórios (influenza, resfriados) Os herpesvírus infectam a maioria das populações. Após a meia idade a maioria das pessoas é soropositiva para a maiorir deles.

Herpesviridae Após a infecção primária, os herpesvírus estabelecem infecções latentes, isto é, sem produção de vírus infeccioso Uma vez infectado, o hospedeiro permanece infectado até a morte. Intermitentemente o vírus latente pode ser reativado, em resposta a vários estímulos, produzindo vírus infeccioso novamente e ocasionalmente causando sinais clínicos


Ordem Mononegavirales, família Herpesviridae São vírus chamados “grandes”, com genoma de DNA de fita dupla, envelopados

Herpesviridae

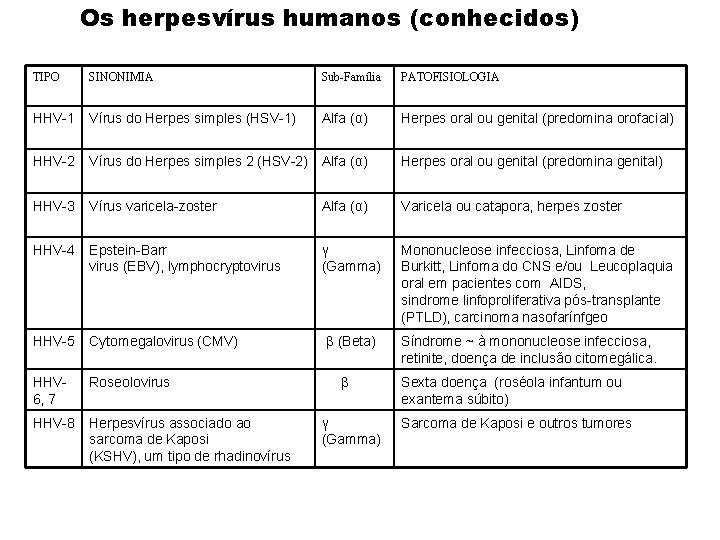
Os herpesvírus humanos (conhecidos) TIPO SINONIMIA Sub-Família PATOFISIOLOGIA HHV-1 Vírus do Herpes simples (HSV-1) Alfa (α) Herpes oral ou genital (predomina orofacial) HHV-2 Vírus do Herpes simples 2 (HSV-2) Alfa (α) Herpes oral ou genital (predomina genital) HHV-3 Vírus varicela-zoster Alfa (α) Varicela ou catapora, herpes zoster HHV-4 Epstein-Barr virus (EBV), lymphocryptovirus γ (Gamma) Mononucleose infecciosa, Linfoma de Burkitt, Linfoma do CNS e/ou Leucoplaquia oral em pacientes com AIDS, sindrome linfoproliferativa pós-transplante (PTLD), carcinoma nasofarínfgeo HHV-5 Cytomegalovirus (CMV) β (Beta) Síndrome ~ à mononucleose infecciosa, retinite, doença de inclusão citomegálica. HHV 6, 7 Roseolovirus HHV-8 Herpesvírus associado ao sarcoma de Kaposi (KSHV), um tipo de rhadinovírus β γ (Gamma) Sexta doença (roséola infantum ou exantema súbito) Sarcoma de Kaposi e outros tumores

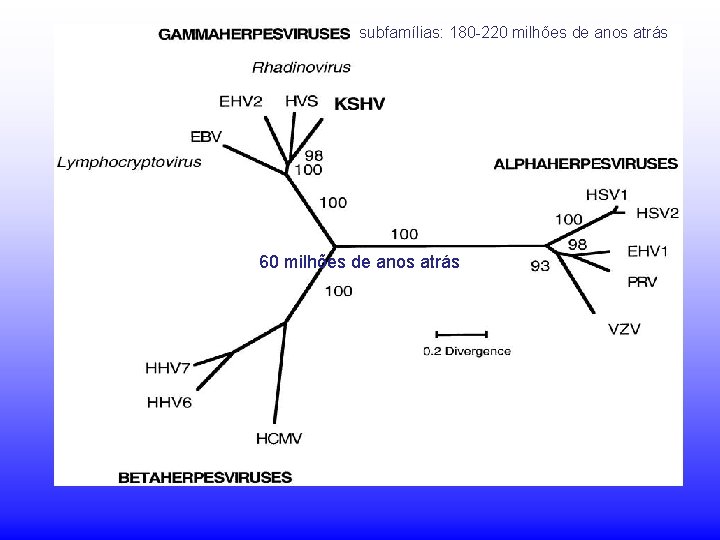
Classificação Três sub-famílias, com base em seu tropismo tecidual, patogenicidade e comportamento. Sub-família: Alphaherpesvirinae • Replicação rápida • Espectro de hospedeiros variável • Tipicamente líticos para as células in vitro • Latência em gânglios sensoriais Vírus do Herpes Simples tipos 1 e 2 (HSV-1/HSV-2) Vírus Varicela-Zoster (VZV)

Classificação Sub família: Betaherpesvirinae • Replicação lenta • Espectro de hospedeiros restrito • Células infectadas aumentam de tamanho (citomegalia) • Latência em glândulas secretórias, células linforeticulares, tecidos renais Citomegalovírus (CMV) Herpesvírus humanos tipos 6 e 7 (HHV-6/HHV-7)

Classificação Subfamília Gammaherpesvirinae • Replicação pobre • Espectro de hospedeiros altamente restrito • Latência estabelecida em tecidos linfóides (células T ou B) Epstein-Barr Virus (EBV), um vírus que transforma céls. B Human Herpesvirus-8 (HHV-8, KSHV)

subfamílias: 180 -220 milhões de anos atrás 60 milhões de anos atrás


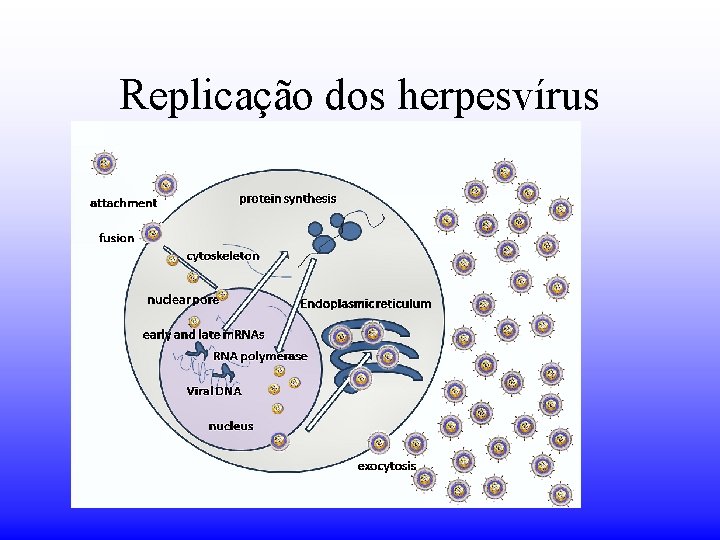
Replicação dos herpesvírus

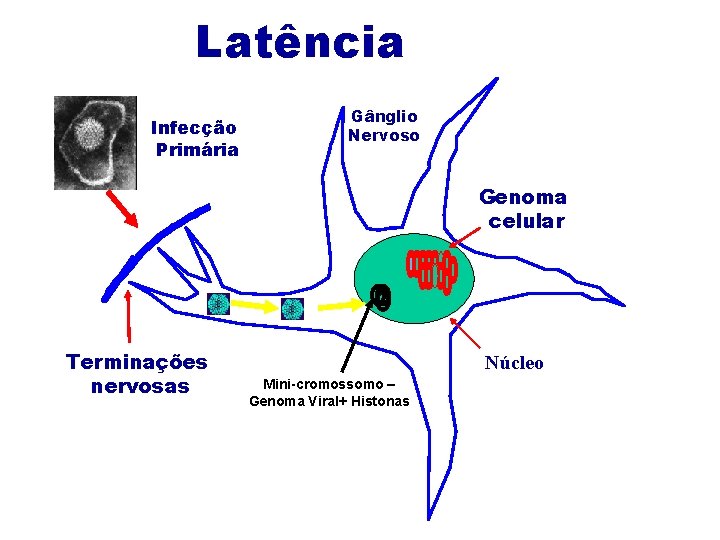
Latência Infecção Primária Gânglio Nervoso Genoma celular Terminações nervosas Núcleo Mini-cromossomo – Genoma Viral+ Histonas


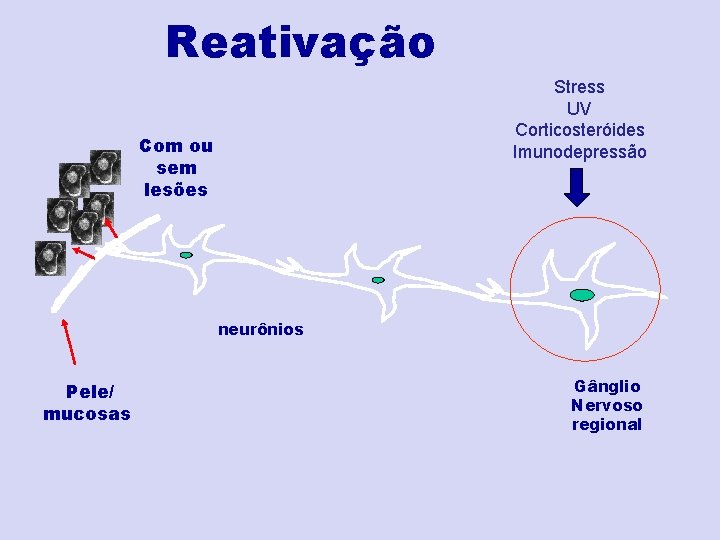
Reativação Stress UV Corticosteróides Imunodepressão Com ou sem lesões neurônios Pele/ mucosas Gânglio Nervoso regional

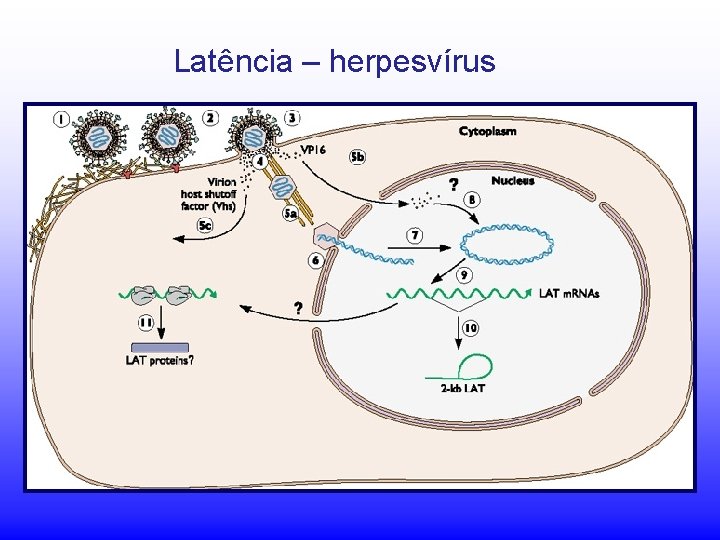
Latência – herpesvírus

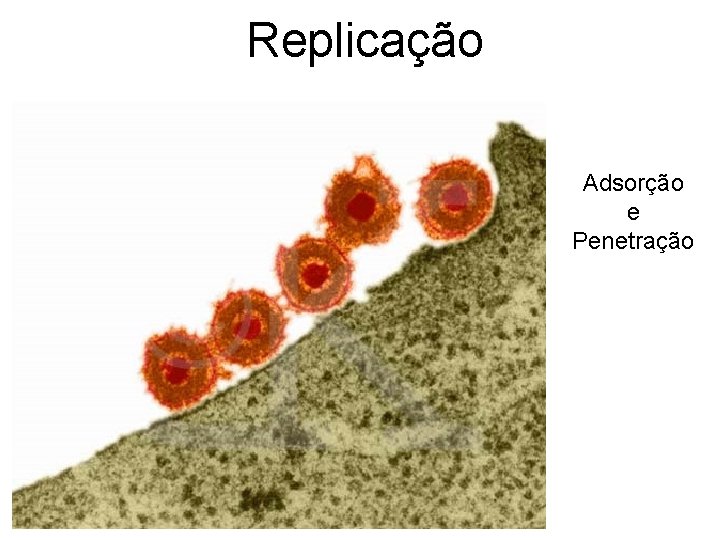
Replicação Adsorção e Penetração

Replicação herpesvírus ADSORÇÃO Glicoproteínas do envelope (ex. g. B e g. D) são necessárias para adsorção; Vários receptores celulares podem ser utilizados: • • • Receptor de complemento C 3 d para EBV Epidermal growth factor receptor Tumor necrosis factor (TNF) Herpesvirus entry mediator receptor HVEM Receptores de heparina Receptores de imunoglobulinas

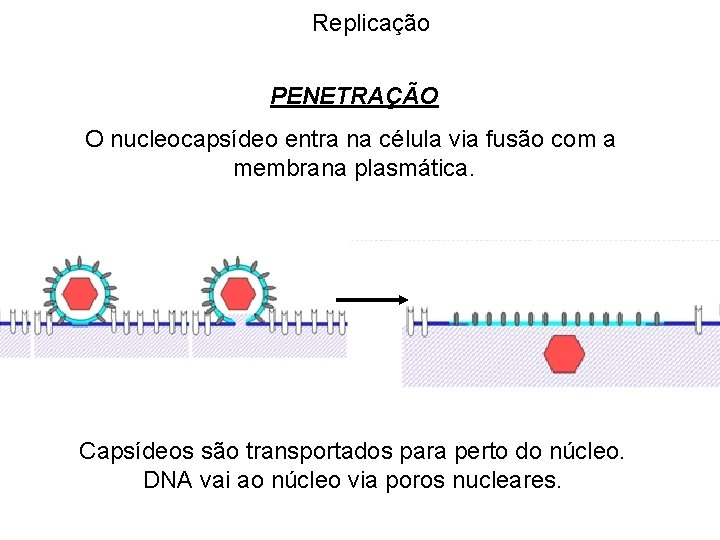
Replicação PENETRAÇÃO O nucleocapsídeo entra na célula via fusão com a membrana plasmática. Capsídeos são transportados para perto do núcleo. DNA vai ao núcleo via poros nucleares.

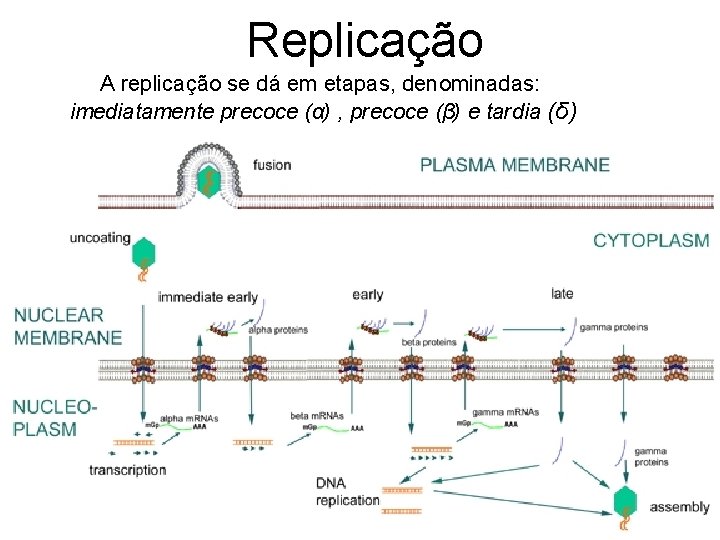
Replicação A replicação se dá em etapas, denominadas: imediatamente precoce (α) , precoce (β) e tardia (δ)

Replicação Montagem A montagem do nucleocapsídeo se dá no núcleo. O nucleocapsídeo “brota” pelas membranas intracelulares captando as proteínas do tegumento sob o envelope.


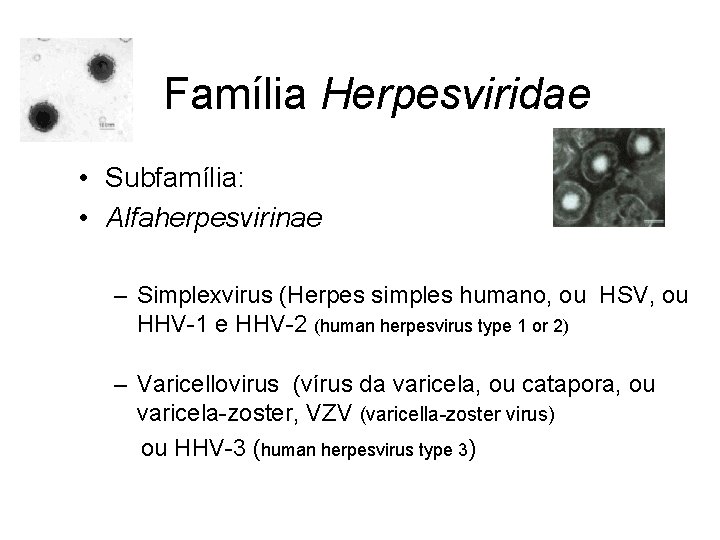
Família Herpesviridae • Subfamília: • Alfaherpesvirinae – Simplexvirus (Herpes simples humano, ou HSV, ou HHV-1 e HHV-2 (human herpesvirus type 1 or 2) – Varicellovirus (vírus da varicela, ou catapora, ou varicela-zoster, VZV (varicella-zoster virus) ou HHV-3 (human herpesvirus type 3)

Vírus do Herpes Simples Humano - são alfaherpesvírus, latencia em neurônios - Capsídeo icosaédrico, 162 capsômeros - codifica cerca de 70 polipeptídeos - tipos 1 e 2 muito semelhantes - multiplicação intranuclear Ver structure em: F: ENSINOAnimaçõesHSVzipped exe

Patogenia- HSV-1 HSV-2 1. O vírus é introduzido na mucosa ou abrasão na pele; Replicação produtiva em células epiteliais no sítio de inoculação e espalhase no tecido adjacente. 2. Vírus penetra nos axônios dos neurônios sensoriais e é transportado ao corpo celular no gânglio. 3. Estabelece uma infecção latente, no núcleo celular, mas não integrado ao genoma celular (em forma epissomal). 4. Quando reativado, ocorre pelo menos um ciclo produtivo limitado. Capsídeos são transportados por transporte neuronal anterógrado aos términos axonais e vírions são liberados 5. Vírus reativado causa infecções recorrente na mucosa ou pele, com ou sem lesões aparentes disseminando mais vírions.

Reativação Trauma (p. ex. procedimentos cirúrgicos) na região inervada por gânglio infectado. Estímulos sistêmicos: Estresse emocional Hipertermia, Menstruação Desequilíbrio hormonal Exposição a UV – luz solar Outras infecções (resfriado, HIV) Administração de imunossupressores

Patogenia/epidemiologia A maioria das infecções ocorre na infância Maioria dos adultos soropositivos Transmissão por contato direto/indireto Transmissão no canal do parto HSV 1/2 sexual: Transmissão sexual/ ou Transmissão de HSV 1/2 sexual > com > parceiros sexuais Papel do sexo orogenital - importante HSV 1= causa importante de encefalites em adultos HSV 2= causa importante de encefalites em bebês

Epidemiologia – HSV-1 Infecções primárias => usual < 5 anos; maioria assintomáticas. Boca e lábios são sítios mais comuns, mas qualquer local pode ser infectado. Quando ocorre sinais, a manifestação usual é gengivostomatite. Infecção primária em adutlos tem sido associada com faringite e uma sídrome que lembra mononucleose. O vírus pode ser disseminado em fezes e boca por até 23 dias média 7 -10 dias. Anticorpos neutralizantes aparecem entre 4 e 7 dias depois dos sinais e tem pico em ~3 semanas. Porém, a presença de anticorpos é um indicador sorológico pouco preciso, Os níveis de anticorpos flutuam ao longo do tempo, Pode haver pessoas que se apresentam soronegativas, embora infectadas. Vírus pode ser isolado de crianças assintomáticas. Em menores de 6 meses- disseminação incomum. Em mais velhos a disseminação tende a diminuir. Aos 15 anos => 2. 7%. Média de vários estudos de 2% a 5%

Disseminação de vírus sem sinais HSV-1 & HSV-2 Disseminação de vírus sem sinais é crucial para a disseminação da infecção genital !! Até 70% das novas infecções => sem sinais Suabes genitais diários => 15% dos dias com disseminação HSV-1 18% dos dias. [6] Pessoas assintomáticas disseminam vírus igual que recorrentes com até 12 episódios/ano [6, 7] Fleming DT, Mc. Quillan GM, Johnson RE, et al. Herpes simplex virus type 2 in the United States 1976 to 1994. N Engl J Med. 1997; 337: 1105 -1111. Abstract Leone PA, Fleming DT, Gilsenan AW, Li L, Justus S. Seroprevalence of herpes simplex virus-2 in suburban primary care offices in the United States. Sex Transm Dis. 2004; 31: 311 -316. Abstract Rooney JF, Felser JM, Ostrove JM, Straus SE. Acquisition of genital herpes from an asymptomatic sexual partner. N Engl J Med. 1986; 314: 1561 -1564. Abstract Mertz GJ, Coombs RW, Ashley RL, et al. Transmission of genital herpes in couples with one symptomatic and one asymptomatic partner: a prospective study. J Infect Dis. 1988; 157: 1169 -1177. Abstract Mertz GJ, Schmidt O, Jourden JL, et al. Frequency of acquisition of first-episode genital infection with herpes simplex virus from symptomatic and asymptomatic source contacts. Sex Transm Dis. 1985; 12: 33 -39. Abstract Wald A, Zeh J, Selke S, Ashley RL, Corey L. Virologic characteristics of subclinical and symptomatic genital herpes infection. N Engl J Med. 1995; 333: 770 -775. Abstract Wald A, Zeh J, Selke S, et al. Genital shedding of herpes simplex virus among men. J Infect Dis. 2002; 186(suppl): S 34 -S 39.

• Herpes simples tipos 1 e 2 (HHV-1 e 2) SINAIS CLÍNICOS

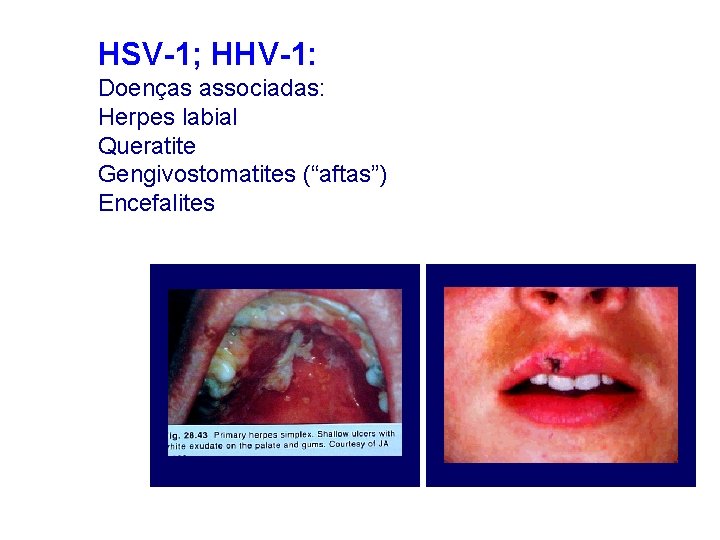
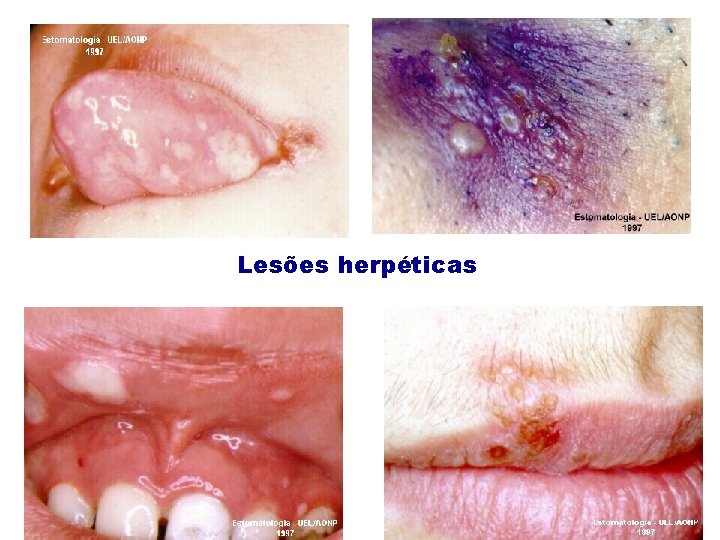
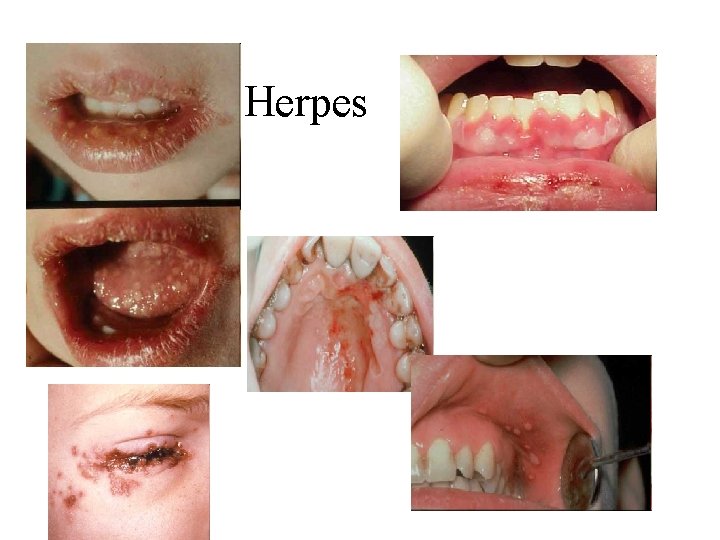
HSV-1; HHV-1: Doenças associadas: Herpes labial Queratite Gengivostomatites (“aftas”) Encefalites

Lesões herpéticas

Herpes

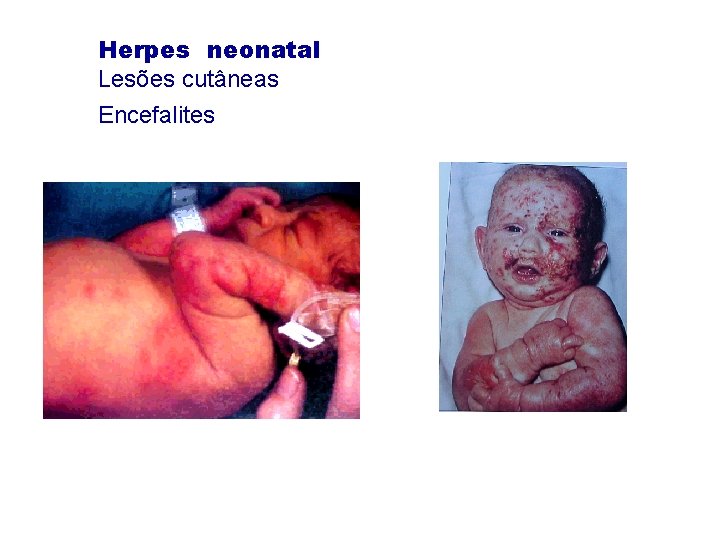
Herpes neonatal Lesões cutâneas Encefalites


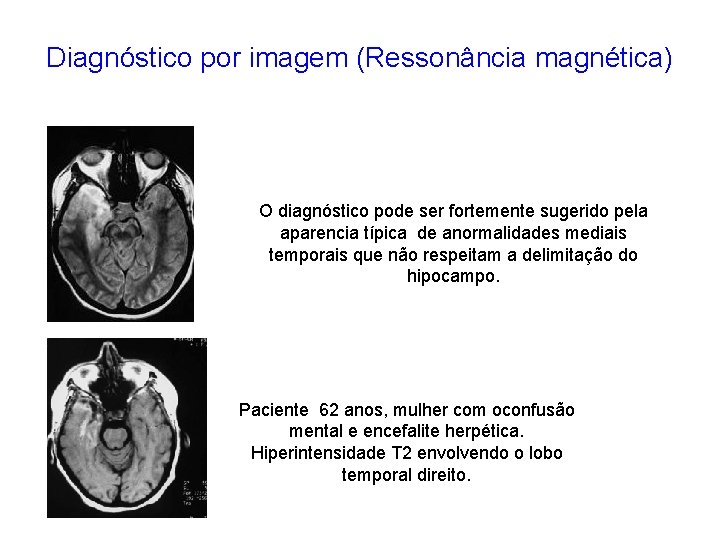
Diagnóstico por imagem (Ressonância magnética) O diagnóstico pode ser fortemente sugerido pela aparencia típica de anormalidades mediais temporais que não respeitam a delimitação do hipocampo. Paciente 62 anos, mulher com oconfusão mental e encefalite herpética. Hiperintensidade T 2 envolvendo o lobo temporal direito.

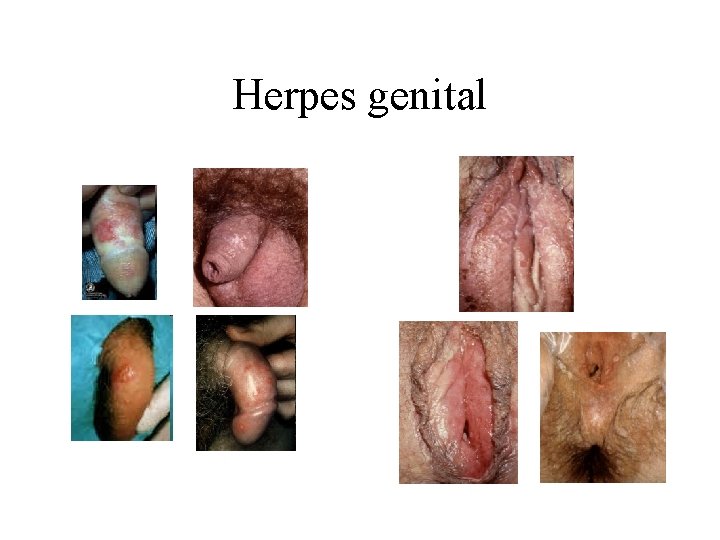
Herpes genital

Herpes DIAGNÓSTICO Clínico Diagnóstico laboratorial Imunofluorescência herpesvírus 1) Rápido: esfregaços de células (teste de Tzanck) e detecção antígenos por imunofluorescência 2) PCR – atualmente método de eleição 3) Isolamento de vírus- bom, mas demorado: Materiais para isolamento: fluido vesicular, suabes orais, nasais, conjuntivais, tecidos de abortos, fragmentos de encéfalo, LCR inoculação em células Vero, HEP e muitas outras efeito citopático (ECP) característico em 1 -3 dias Efeito citopático de herpesvírus em cultivo celular

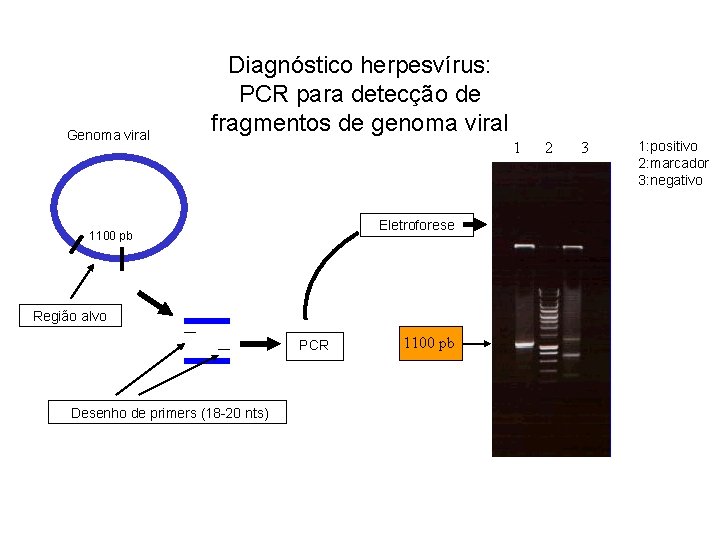
Genoma viral Diagnóstico herpesvírus: PCR para detecção de fragmentos de genoma viral 1 Eletroforese 1100 pb Região alvo PCR Desenho de primers (18 -20 nts) 1100 pb 2 3 1: positivo 2: marcador 3: negativo


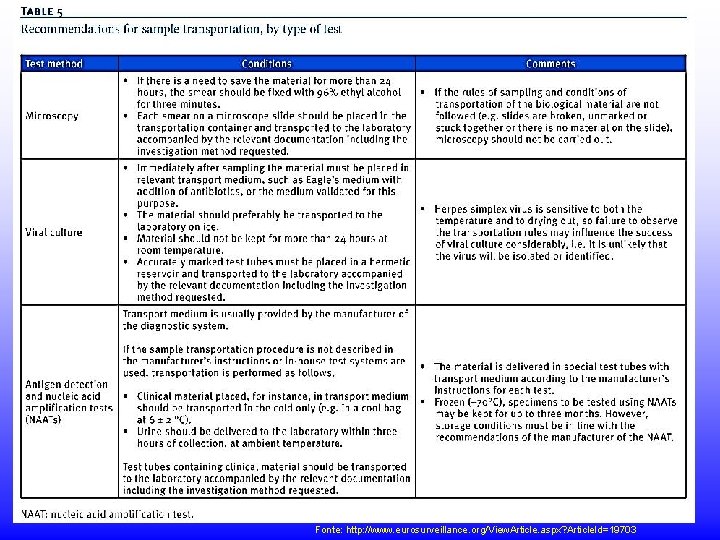
Fonte: http: //www. eurosurveillance. org/View. Article. aspx? Article. Id=19703

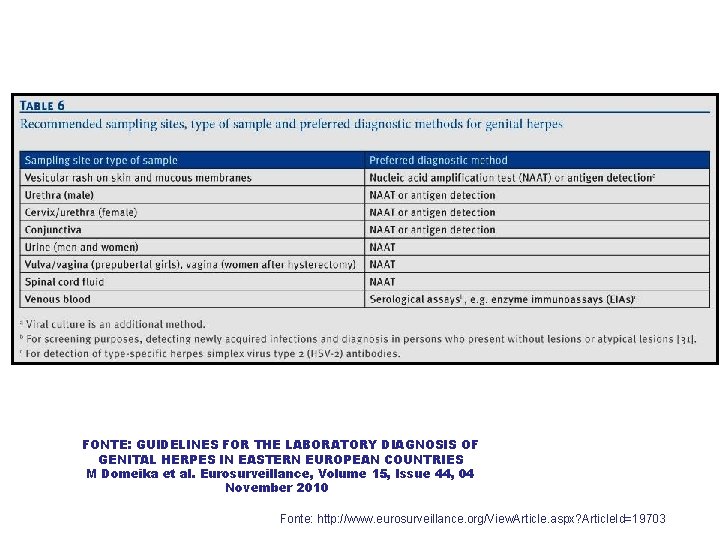
FONTE: GUIDELINES FOR THE LABORATORY DIAGNOSIS OF GENITAL HERPES IN EASTERN EUROPEAN COUNTRIES M Domeika et al. Eurosurveillance, Volume 15, Issue 44, 04 November 2010 Fonte: http: //www. eurosurveillance. org/View. Article. aspx? Article. Id=19703

Diagnóstico laboratorial • Para isolamento viral (importante): • O vírus é muito lábil a -20 graus Celsius • Manter em refrigeração ou a temperaturas menores que -70 graus C

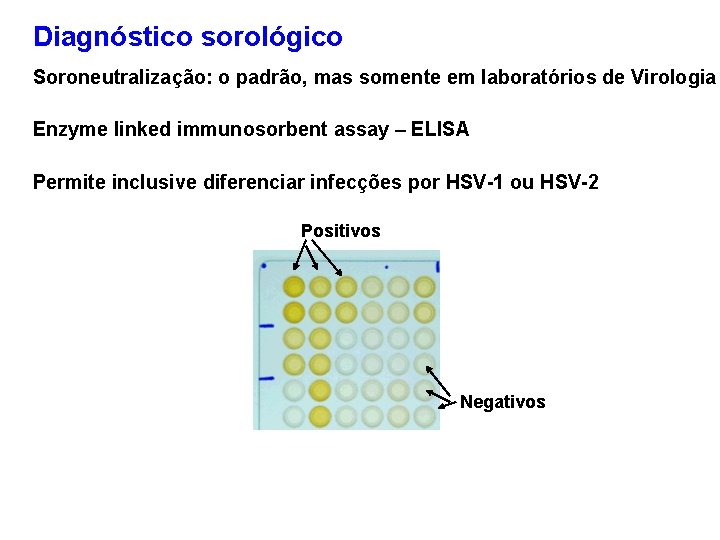
Diagnóstico sorológico Soroneutralização: o padrão, mas somente em laboratórios de Virologia Enzyme linked immunosorbent assay – ELISA Permite inclusive diferenciar infecções por HSV-1 ou HSV-2 Positivos Negativos

Família Herpesviridae • Subfamília: • Alfaherpesvirinae – Gênero Simplexvirus (Herpes simples humano, HSV, ou HHV-1 e 2) – Gênero Varicellovirus (vírus da varicela, ou catapora, ou varicela-zoster, VZV, ou HHV-3)

HERPESVÍRUS HUMANOS 1. Generalidades / Morfologia / Quais são / Classificação 2. Latência/reativação: usualmente gânglios sensoriais tóracolombares. Reativação: causa Zoster, não varicela 3. Replicação viral: igual a HSV 4. Epidemiologia (população alvo, transmissão/distribuição) Sinais clínicos Diagnóstico Prevenção/controle Tratamento

VARICELA; “Catapora” Sinais clínicos Período de incubação (p. i. ) = 14 -20 DIAS EVOLUÇÃO RÁPIDA ALTAMENTE CONTAGIOSA LESÕES EM DIFERENTES ESTÁGIOS

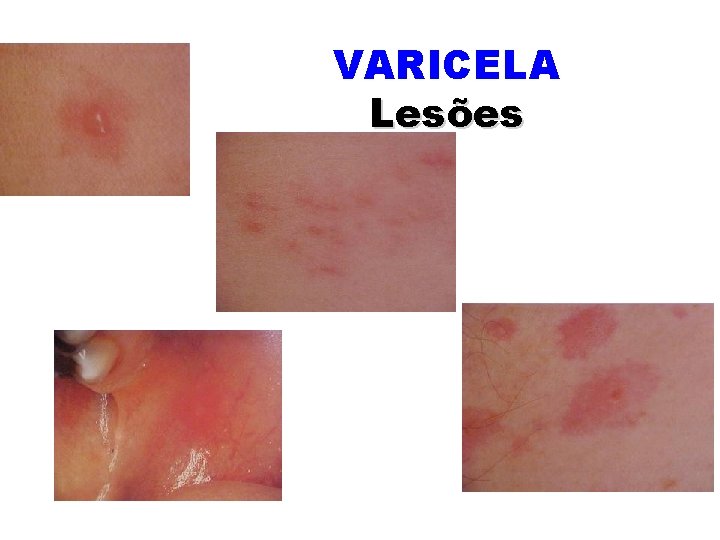
VARICELA Lesões

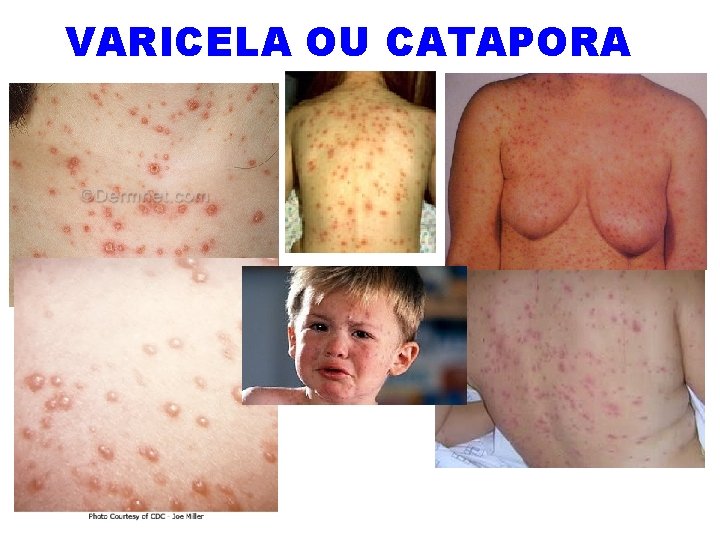
VARICELA OU CATAPORA

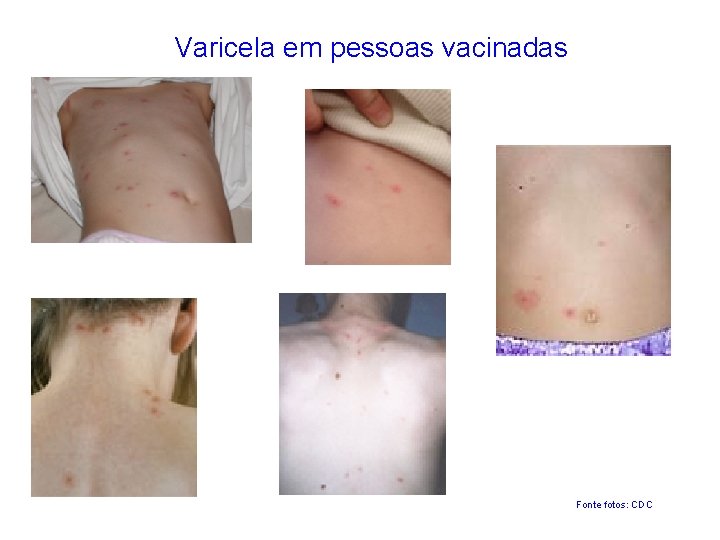
Varicela em pessoas vacinadas Fonte fotos: CDC

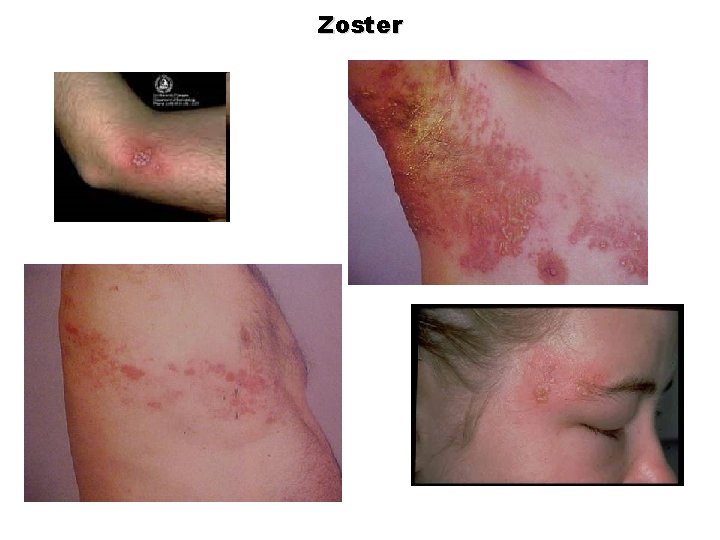
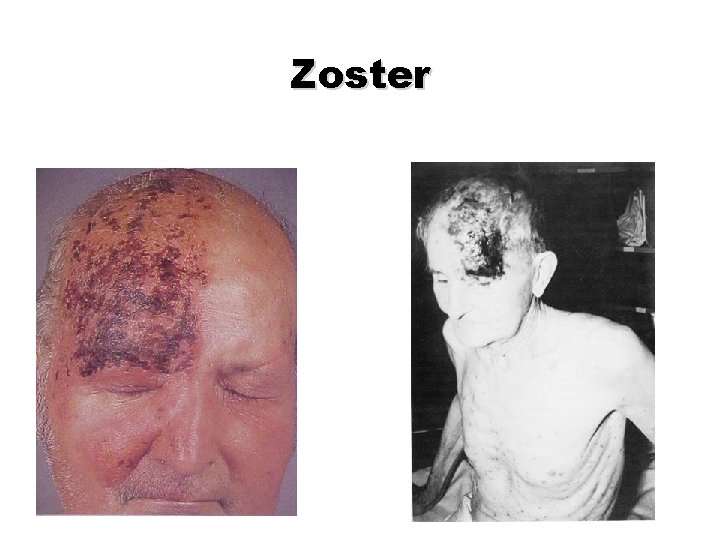
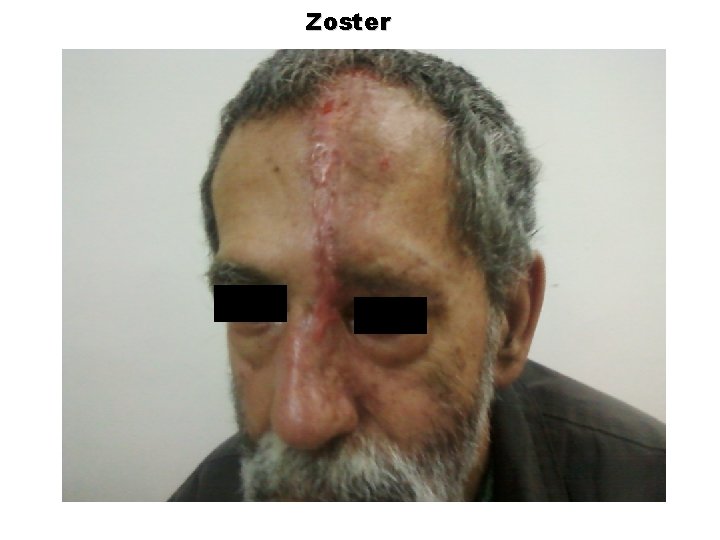
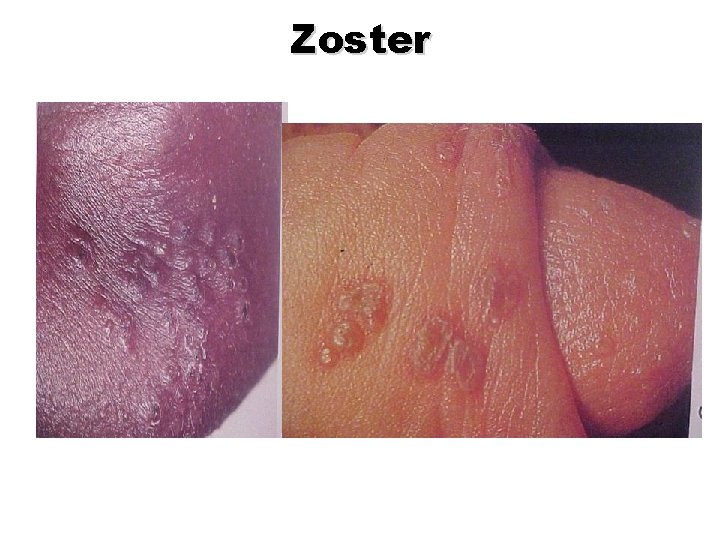
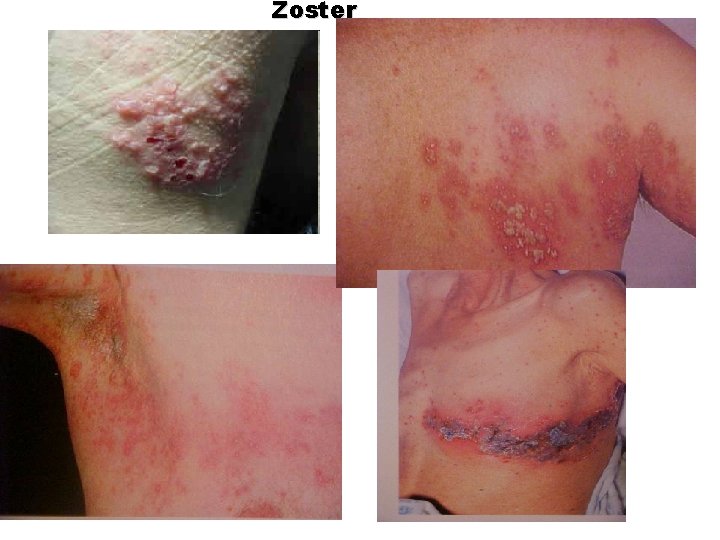
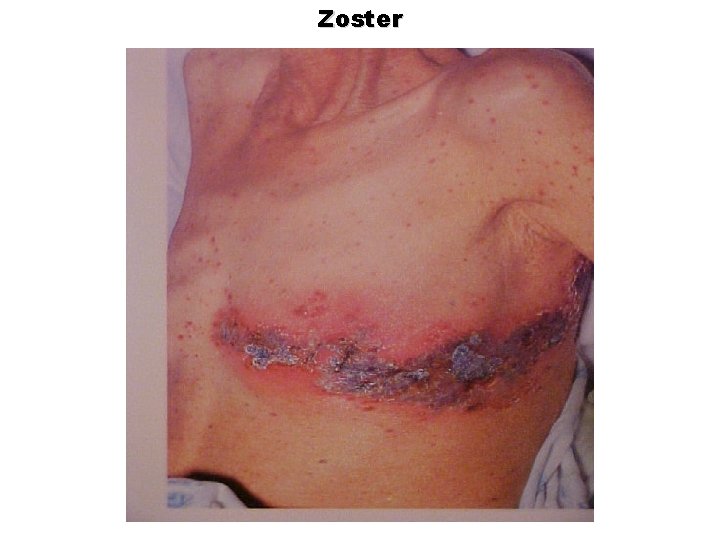
Zoster

Zoster

Zoster

Zoster

Zoster

Zoster


Neuralgia pós-herpética (qualquer dor): Em 35% dos pacientes sem terapia até 6 meses Em 15% dos pacientes sob tratamento com antivirais

Herpes zoster e neuralgia pós-herpética Às vezes graves. Problemas oftálmicos Infecções secundárias HZ disseminado Problemas motores => fisioterapia Vasculite cerebral Síndrome de Guillan–Barré Mais comum: dor

Síndrome de Varicela congênita Recém nascidos de mães com varicela no 1º trimestre de gravidez => 1, 2% Infecção entre 13ª e 20ª semana => 2% Recém nascidos que adquirem varicela entre 5 e 10 dias de vida de mães infectadas entre 5 dias antes e 2 dias após o parto=> varicela grave=> pode atingir 30% Infecção intrauterina e ocorrência de varicela antes dos 2 anos de idade => estão associados a ocorrência de zoster entre jovens


VARICELA DIAGNÓSTICO: Geralmente clínico em imunocompetentes Diagnóstico laboratorial: igual a HSV

HERPES Tratamento - Idoxuridina (IDU) uso somente tópico - Aciclovir e análogos (guanosina acíclica) ação sobre a timidina quinase viral - a longo prazo - efeito na recorrência - ocular : idoxuridina, trifluridina (tópicos) (resistentes: ácido fosfonofórmico) NENHUMA DROGA EVITA COMPLETAMENTE RECORRÊNCIAS ! NENHUMA DROGA AGE SOBRE A LATÊNCIA !

Tratamento Varicela Vacinação em até 3 dias - pode melhorar ou levar a doença maisl leve. ays after exposure may still help. 2 Immunoglobulins (IG) help the body's immune system recognize and destroy harmful bacteria and viruses in the body, such as the varicella virus. Pregnant women, newborns who are at high risk for getting chickenpox, and people who have certain immune system problems can get a shot of chickenpox IG soon after they are exposed to the virus. It can help prevent infection and help them feel better sooner. Antiviral medicine. Acyclovir, is usually used to treat adults and people who have weak immune systems. It's used after you start to have symptoms of chickenpox. Healthy children usually don't need this medicine when they have chickenpox. It isn't known whether antiviral medicines reduce a person's chances of having complications of chickenpox.

Família Herpesviridae • Subfamília: Gammaherpesvirinae – Lymphocryptovirus (vírus Epstein-Barr, EBV, ou herpesvírus humano tipo 4 (HHV-4) - Latência em células linfóides

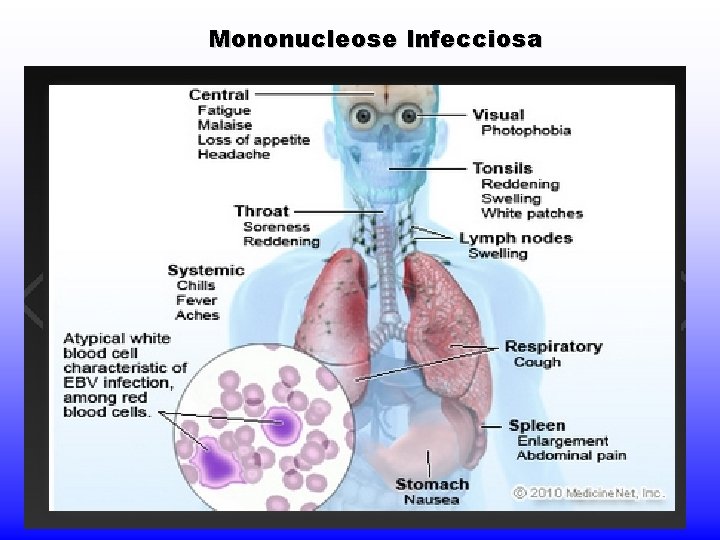
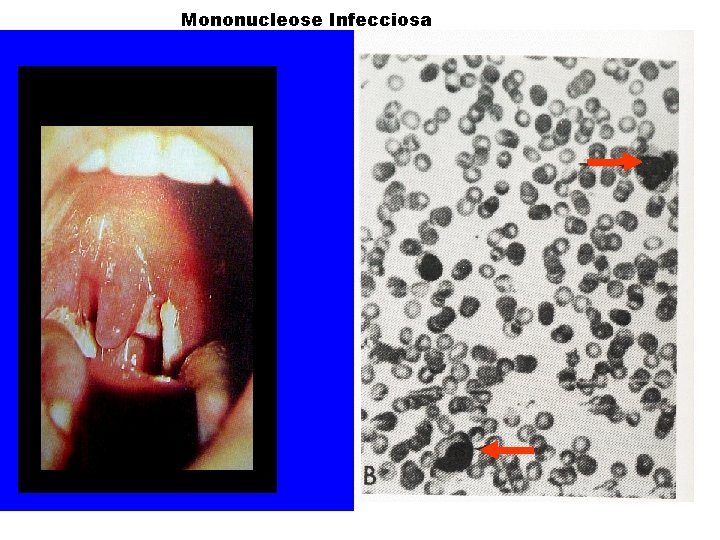
MONONUCLEOSE INFECCIOSA “Clássica” ou “Mononucleose Paul-Bunnel positiva” Definição: - Causada pelo vírus Epstein-Barr (EBV 1 e 2) gamaherpesvírus (gênero lymphocryptovirus); - HHV 4 A mononucleose = São linfócitos T atípicos, maiores, com citoplasma vacuolizado e núcleo deformado e lobulado.

Mononucleose infecciosa Transmissão / Patogenia - transmissão por saliva (90% adultos +) - vírus intermitente na saliva - 10 -5 a 10 -6 linfócitos infectados - orofaringe => linf. B => Linf T reagem => muitas cópias do genoma no citoplasma; poucas integradas no genoma.

Mononucleose infecciosa

Mononucleose Infecciosa

Mononucleose Infecciosa

Mononucleose Infecciosa Células alvo = Linfócitos B não sensibilizados - 10 genes (EBNA 1 -6, LMP 1, 2 a e 2 b, EBER 1 e 2) mantém a infecção latente em células linfóides - Linfóc. B -> estimulados a proliferar continuamente - podem se multiplicar seriadamente e dar origem a linhagens linfoblastóides - disseminação esporádica pela saliva - linfócitos infectados se comportam como linfócitos sensibilizados com Ag: secretam proteínas, Igs, sofrem trocas de classe

Mononucleose infecciosa Latência em três formas: I e II = antígenos nucleares expressos: EBNA 1; LMP 1, 2 a e 2 b III = os 6 EBNA são expressos EBNA 1: único expresso em todas as formas sem ele não há latência

Mononucleose infecciosa Diagnóstico: - Paul Bunnel (Ac heterófilos) - Ig. M específica anti-ag capsídeo viral (ACV) - Ig. G anti- ACV em elevação - anti-EBNA: 3 -4 semanas p. i. e persiste por toda a vida

Exemplos de placas de ELISAs Revelada com OPD Cor= + Sem cor= Mais cor = mais positivo

Mononucleose infecciosa - EBV Associação com cânceres linfóides: Linfoma de Burkitt em crianças africanas Carcinoma nasofaríngeo (CNF) => (China) Resto do mundo: CNF < 1/ 100 000 China: 15 a 30/ 100 000 Carcinoma de timo nos EUA Hodgkins: EBV presente em 50% dos tumores

Linfoma de Burkitt

EBV e CMV

Família Herpesviridae • Subfamília Betaherpesvirinae – Citomegalovírus (CMV ou HHV-5) – Roseolovírus (vírus da roséola, HHV-6)



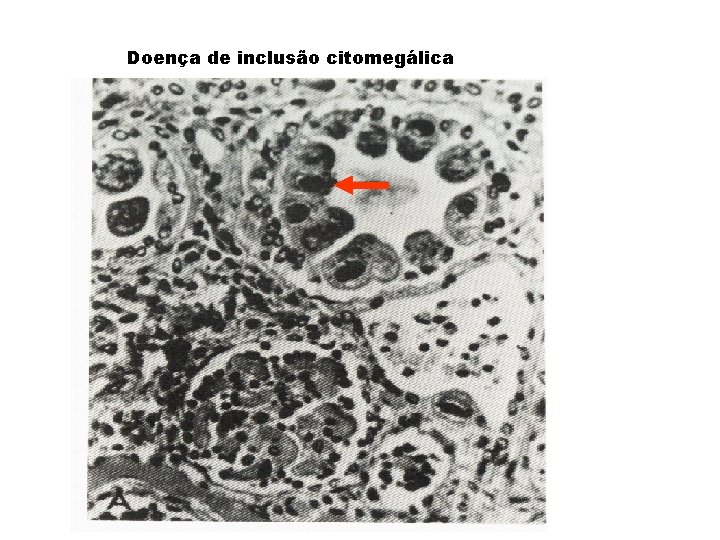
Citomegalovírus (CMV) - é um betaherpesvírus; HHV-5, um só sorotipo - infecção muito prevalente; doença muito rara - neonatos: doença de inclusão citomegálica - mononucleose infecciosa negativa para Acs. Heterófilos - pneumonia em imunocomprometidos - células gigantes => inclusão citomegálica - Latência em células linfóides

Citomegalovírus (CMV) TRANSMISSÃO E EPIDEMIOLOGIA: - Acs em ~80% adultos - eliminação de vírus esporádica - infecções: -congênita -pós-natal



CMV INFECÇÃO PRÉ-NATAL: - em qualquer estágio da gestação - risco de transmissão: 0, 2 a 2% - 5 a 15% destes podem apresentar lesões congênitas - infecção intrauterina => crianças disseminam o vírus por mais tempo - > risco = infecção 1ária na gestação - infecção prévia = risco muito baixo

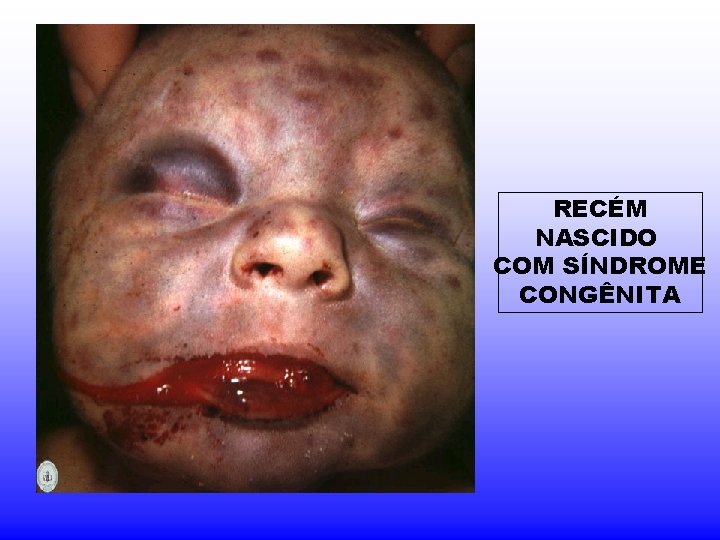
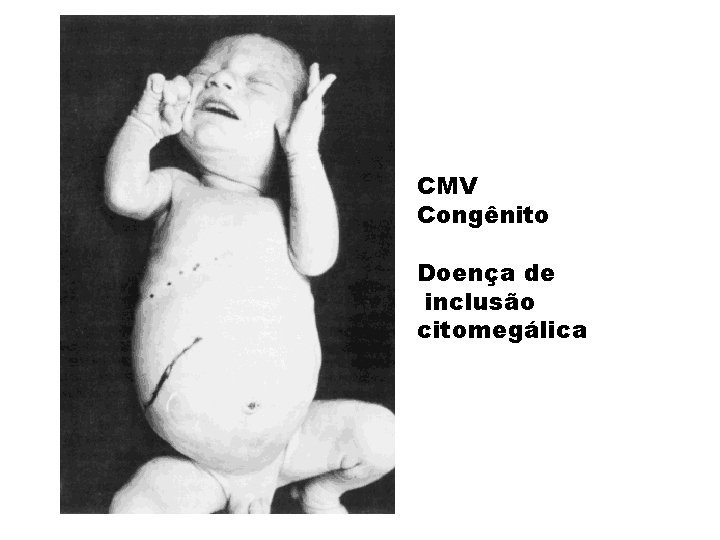
SÍNDROME CONGÊNITA • Mãe infectada com reativação do vírus, reinfecção ou persistente infecção primária. • Causa danos severos no sistema nervoso, afeta a formação de diferentes órgãos e tecidos (ouvidos, olhos, fígado, rins, pele, etc), • Anemia, trombocitopenia e leucopenia. • Pode afetar a placenta.

RECÉM NASCIDO COM SÍNDROME CONGÊNITA

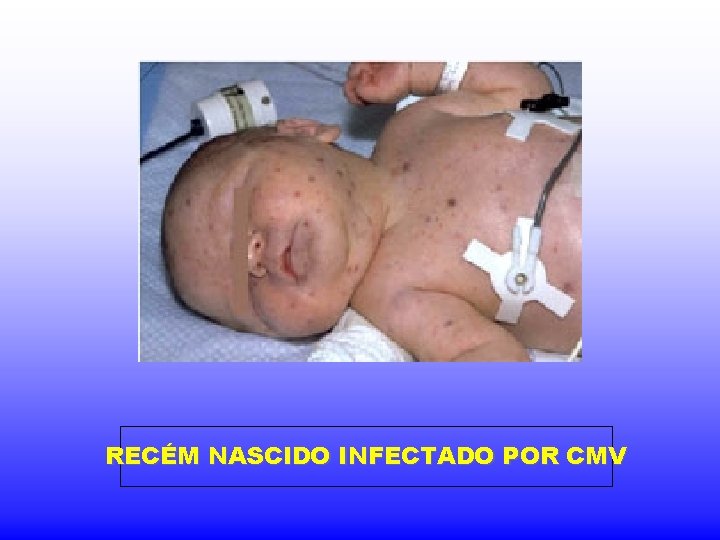
RECÉM NASCIDO INFECTADO POR CMV

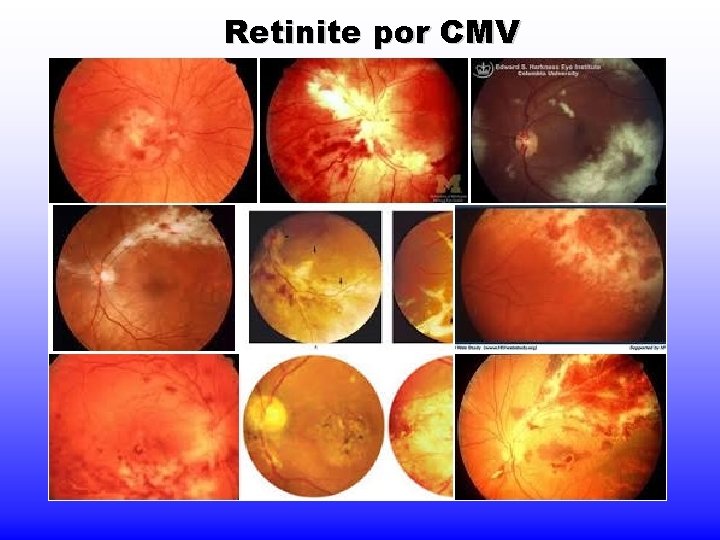
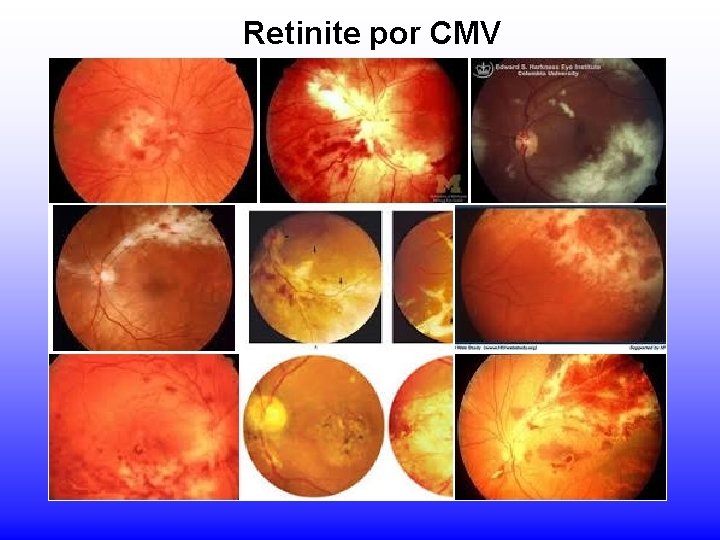
Retinite por CMV

CMV Congênito Doença de inclusão citomegálica

CMV Infecção intrauterina ou pré-natal Achados clínicos: - surdez (mais comum) - microcefalia - convulsões - icterícia - hepatosplenomegalia - deficiência mental - pode haver manifestações tardias

Transmissão vertical de CMV VIA Transplacentária Intrapartum Status da mãe Soropositiva antes da concepção 02 -2% Infec. primária na gestação 20 -40% Soropositiva Vírus no trato genital Leite Materno Taxa na criança Mãe soropositiva Virolactia 5% 50% 25% 65 -70%

INFECÇÃO PÓS-NATAL: - geralmente na infância (MI rara) - MI Paul Bunnel - negativa - infecção em adultos > chance de MI - pode ocorrer durante o parto - através do leite => mais comum - transmissão sexual (sêmen, secr. cervicais) - transmissão por hemoderivados - transplantados renais: reativação e disseminação do vírus CMV

Retinite por CMV

Doença de inclusão citomegálica

CMV Infecção pós-natal: - Mononucleose infecciosa (MI) heterófilo- negativa; - Febre, letargia, linfócitos anormais no sangue periférico; - usualmente sem faringite ou linfadenopatia -retinites - às vezes após transfusão com sangue fresco (vírus inativado em refrigeração)

CMV Em imunodeprimidos: - infecções frequentes - transplantes renais: assintomáticas - grave em transplantados de medula e coração => pneumonia intersticial e retinite

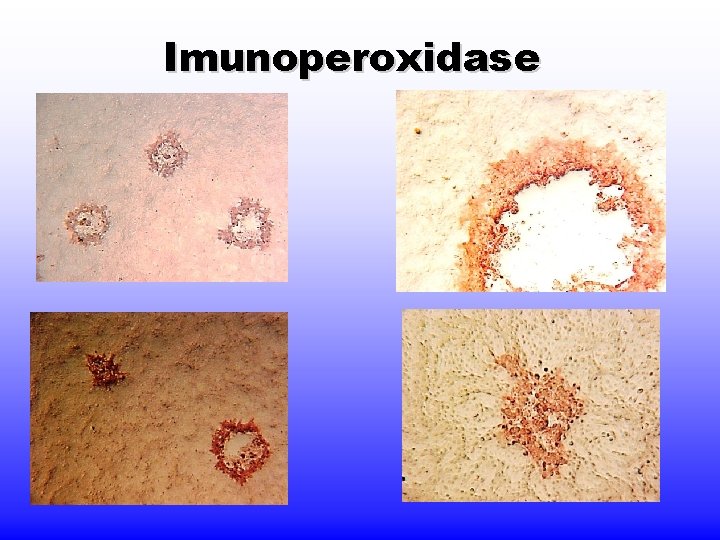
Diagnóstico laboratorial (2) 1. Teste para antigenemia (CMV) - Antígenos do CMV detectados na superfície de leucócitos polimorfonucleares por imunoperoxidase (IPX) ou imunofluorescência direta (IFD). 2. Polymerase chain reaction (PCR) – é hoje o método de escolha. 3. aumento de Ig. G e presença de Ig. M.

Imunoperoxidase

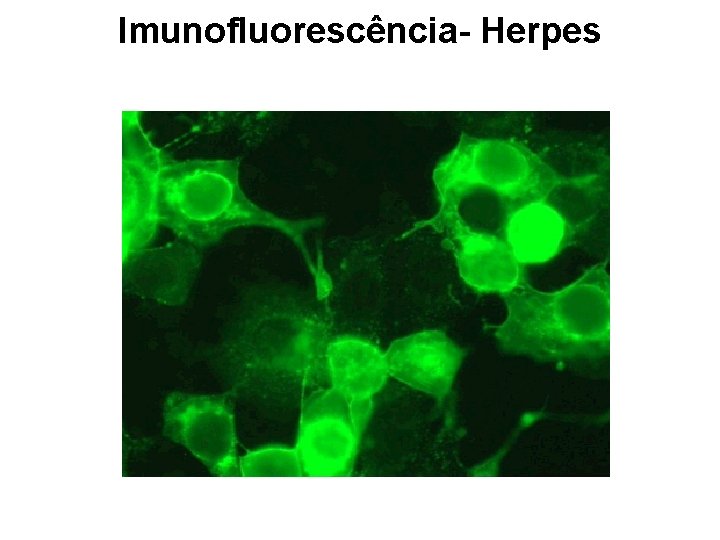
Imunofluorescência Direta anticorpo marcado sobre material infectado (suspeito) + anticorpo específico marcado com FITC + luz UV ____________________ reação colorida

Imunofluorescência- Herpes

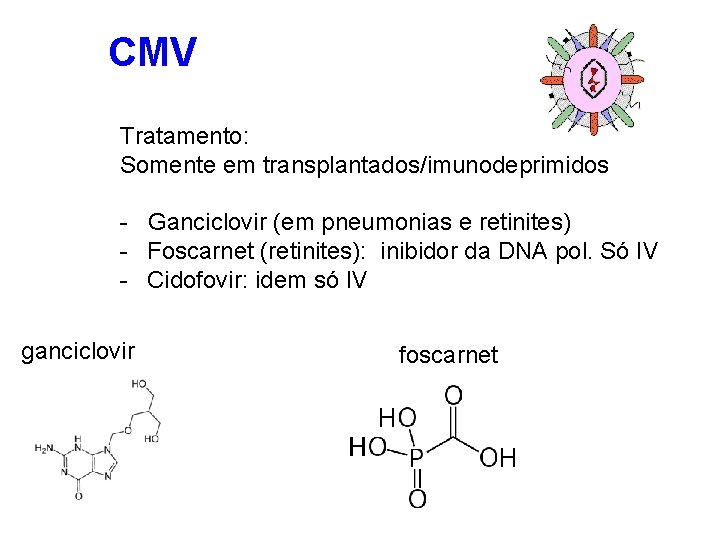
CMV Tratamento: Somente em transplantados/imunodeprimidos - Ganciclovir (em pneumonias e retinites) - Foscarnet (retinites): inibidor da DNA pol. Só IV - Cidofovir: idem só IV ganciclovir foscarnet

CMV Prevenção: - É um exame pré-natal obrigatório - Não há vacina - Tentar evitar contaminação de gestantes soronegativas - Acompanhar a evolução da infecção em transplantados e imunodeprimidos. Iniciar tratamento quando viremia ocorrer.

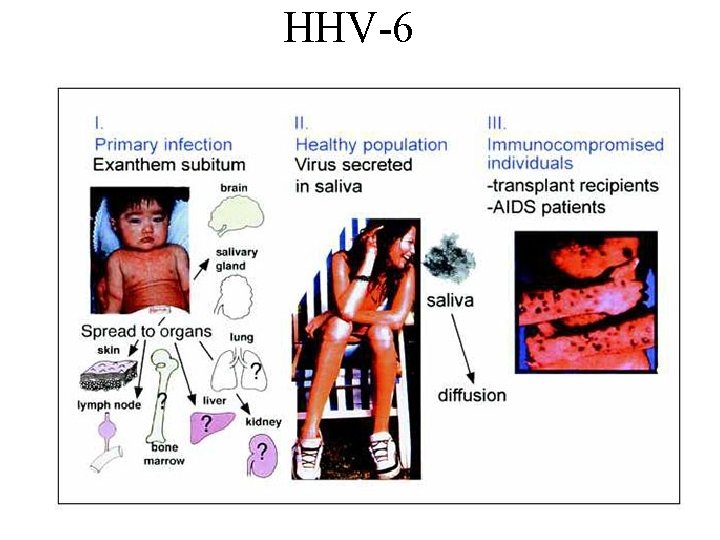
Roséola (HHV-6 e HHV-7) A apresentação clássica da roséola ocorre em crianças de 9 - a 12 meses que desenvolvem uma febre aguda e seguidamente uma convulsão febril. Após 3 dias , uma rápida defervescência ocorre e um exantema morbiliforme aparece.

HHV-6

Roséola – HHV-6 B 2 variantes: HHV-6 A & B. O HHV-6 B, é causador principal da roséola Patofisiologia Infecção primária: replicação ocorre em leucócitos e glândulas salivares => presente na saliva Cels infectadas: Linfócitos T CD 4+. Receptor: CD 46 Acredita-se que ocorra invasão precoce do CNS podendo dar origem a convulsões e complicações neurológicas. Raro na doença primária na infância=> envolvimento generalizado de órgãos: gastrointestinal, hematopático, hepatite e hepatosplenomegalia. Após infec. 1ária, => HHV-6 latente em linfócitos e monócitos HHV-6 diminui a resposta imune através de vários mecanismos: mimetismo molecular, produção de quimiocinas e receptores de quimiocinas. Associação entre HHV-6 e esclerose múltipla – ainda inconclusiva. HHV-6 pode facilitar o potencial oncogênico em linfomas e tem sido associado à síndrome de fadiga crônica.

Herpesvírus Humano 8 (HHV-8) • Tumor associado à ocorrência do Sarcoma de Kaposi e outros linfomas menos conhecidos (doença de Castleman e outros). • Tumor prevalente em homossexuais masculinos com AIDS. • DNA do vírus encontrado em 100% dos casos de KS. • A maioria dos pacientes com KS tem anticorpos anti-HHV-8. • A soroprevalência de anticorpos anti-HHV-8 é baixa na população em geral, mas alta em suscetíveis ao KS, como homossexuais masculinos. • O tratamento com anti-retrovirais leva à regressão rápida dos tumores • Diferente dos demais herpes humanos, o HHV-8 não tem distribuição ubíqua.

Fontes de pesquisa • • Labvir: http: //www. ufrgs. br/labvir/ http: //darwin. bio. uci. edu/~faculty/wagner/hsv 2 f. html www 6. ufrgs. br/labvir Wikipedia Site do CDC Site: All the virology in the web (ATV) Site de Vincent Racaniello (virology blog): www. virology. ws • courses. washington. edu/. . . /pdf. . . /401_07 • http: //bioweb. uwlax. edu/bio 203/s 2009/weisser_mich/interactions. html
 Incisivo lateral inferior derecho
Incisivo lateral inferior derecho Clima tropical de montaña costa rica
Clima tropical de montaña costa rica Generalidades del reino fungi
Generalidades del reino fungi Seudopodios
Seudopodios Generalidades de los alquenos
Generalidades de los alquenos Vascolarizzazione pancreas
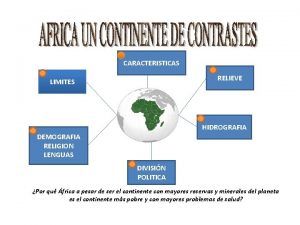
Vascolarizzazione pancreas Division politica de africa
Division politica de africa Entamoeba coli trofozoito
Entamoeba coli trofozoito Ejemplos de generalidades en un trabajo
Ejemplos de generalidades en un trabajo Generalidades de los materiales dentales
Generalidades de los materiales dentales Que es el metodo estadistico
Que es el metodo estadistico Instalaciones y sistemas industriales generalidades
Instalaciones y sistemas industriales generalidades Estrategia de producto
Estrategia de producto Como se escribe 17025
Como se escribe 17025 Generalidades de una empresa
Generalidades de una empresa Morfologia de las levaduras
Morfologia de las levaduras Generalidades de la administración financiera
Generalidades de la administración financiera Generalidades de las proteinas
Generalidades de las proteinas Generalidades de la luna
Generalidades de la luna Generalidades del metabolismo
Generalidades del metabolismo Generalidades de la lectura
Generalidades de la lectura Generalidades de las fuentes del derecho escrito
Generalidades de las fuentes del derecho escrito Generalidades de la mecanica corporal
Generalidades de la mecanica corporal Generalidades de la edad moderna
Generalidades de la edad moderna Thallo hongos
Thallo hongos Generalidades de la prospectiva
Generalidades de la prospectiva Generalidades de derecho mercantil
Generalidades de derecho mercantil Plano medio
Plano medio Função inversa
Função inversa Generalidades de la prospectiva
Generalidades de la prospectiva Características de los vasos sanguíneos
Características de los vasos sanguíneos Generalidades de la irrigación
Generalidades de la irrigación Generalidades de las proteinas
Generalidades de las proteinas Cara distal del primer molar inferior
Cara distal del primer molar inferior Generalidades de los protozoos
Generalidades de los protozoos Generalidades de la administración financiera
Generalidades de la administración financiera Dibujos de la generalidad
Dibujos de la generalidad Botridias
Botridias Generalidades de las normas iso
Generalidades de las normas iso Caracteristicas esporozoarios
Caracteristicas esporozoarios Tipos de neuronas del sistema nervioso
Tipos de neuronas del sistema nervioso Generalidades del deporte
Generalidades del deporte Tipos de herida
Tipos de herida Farmacodinamia generalidades
Farmacodinamia generalidades Generalidades de la irrigación
Generalidades de la irrigación Generalidades de una empresa
Generalidades de una empresa Emulsifican
Emulsifican Celulas del cuerpo humano
Celulas del cuerpo humano Morfologia isospora belli
Morfologia isospora belli Sintaxis
Sintaxis Afijos flexivos ejemplos
Afijos flexivos ejemplos Caule cilindrico
Caule cilindrico Autor de la imagen
Autor de la imagen Tam morfologia
Tam morfologia Morfologia urbana
Morfologia urbana Morfologia paesi bassi
Morfologia paesi bassi Circulación incompleta
Circulación incompleta Peciolo
Peciolo Morfologia celular
Morfologia celular Szerokość rozkładu płytek krwi
Szerokość rozkładu płytek krwi Morfologia urbana
Morfologia urbana Lingue sintetiche e analitiche
Lingue sintetiche e analitiche Morfologia virica
Morfologia virica Morfologia
Morfologia P
P Partes de la semilla
Partes de la semilla Morfologia del pollo
Morfologia del pollo Morfologia da cana de açucar
Morfologia da cana de açucar Morfologia radicular
Morfologia radicular Amebas
Amebas Morfologia (linguistica)
Morfologia (linguistica) Congiunzioni subordinanti e coordinanti
Congiunzioni subordinanti e coordinanti Oncocercoma
Oncocercoma Fruto agregado
Fruto agregado Permeabilità intestinale
Permeabilità intestinale Settore primario della finlandia
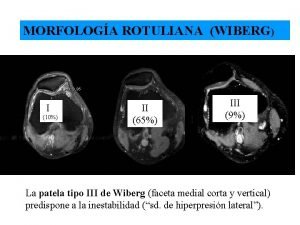
Settore primario della finlandia Clasificacion de wiberg rotula
Clasificacion de wiberg rotula Schistosoma mansoni cdc
Schistosoma mansoni cdc Escolex
Escolex Ampolas de lorenzini
Ampolas de lorenzini Partes del verbo
Partes del verbo Elementos terminales de un robot
Elementos terminales de un robot Anemia hipochromiczna
Anemia hipochromiczna Vegetal
Vegetal Hemopise
Hemopise Morfología de los robots
Morfología de los robots Substantivo abstrato
Substantivo abstrato Exemplo de morfologia em libras
Exemplo de morfologia em libras Flagelo peritrico
Flagelo peritrico Bactrias
Bactrias Morfologia
Morfologia Morfologia
Morfologia Rysy w betonie
Rysy w betonie Oq é morfema
Oq é morfema Morfologia
Morfologia Biontofaga
Biontofaga Ancylostoma duodenale morfología
Ancylostoma duodenale morfología Cariopse fruto
Cariopse fruto Taxonomia de la tilapia
Taxonomia de la tilapia Morfología visual
Morfología visual Patogenidade
Patogenidade Entamoeba histolytica morfología
Entamoeba histolytica morfología Folha composta geminada
Folha composta geminada Decapsidación
Decapsidación Mesofilo
Mesofilo Errori morfosintattici esempi
Errori morfosintattici esempi Morfología de la costa peruana
Morfología de la costa peruana Sufijo imiento
Sufijo imiento Alomorfo
Alomorfo Bacterias espirales o hélices (espiroquetas)
Bacterias espirales o hélices (espiroquetas)