Tumores del SNC Nuevos frmacos Gaspar Reyns Hospital




































- Slides: 60

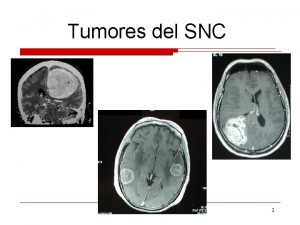
Tumores del SNC Nuevos fármacos Gaspar Reynés Hospital Universitario La Fe Valencia

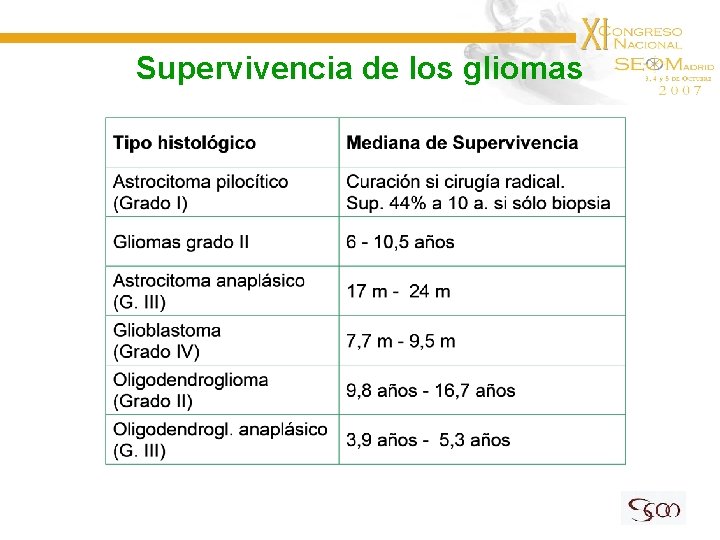
Supervivencia de los gliomas

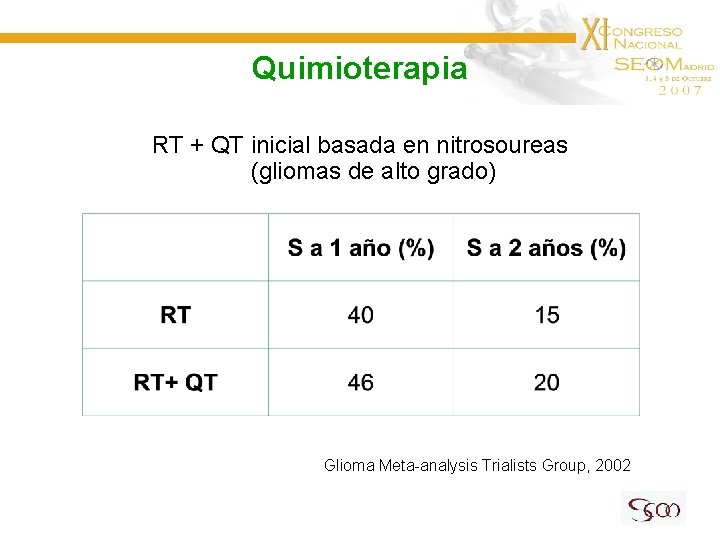
Quimioterapia RT + QT inicial basada en nitrosoureas (gliomas de alto grado) Glioma Meta-analysis Trialists Group, 2002

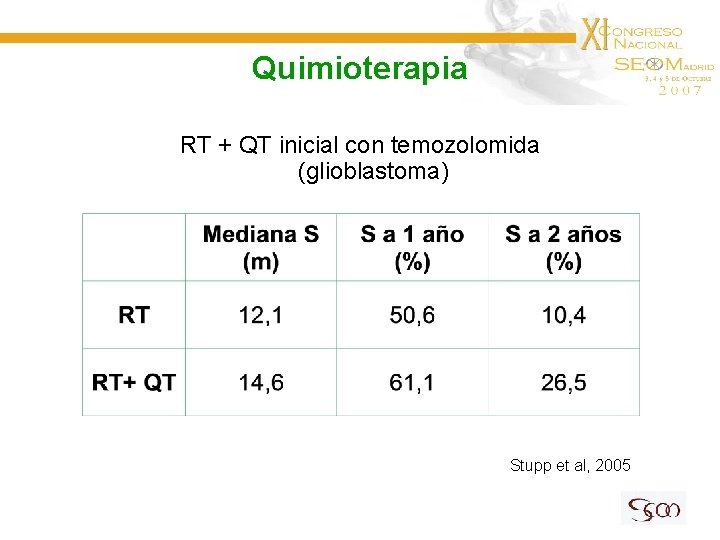
Quimioterapia RT + QT inicial con temozolomida (glioblastoma) Stupp et al, 2005

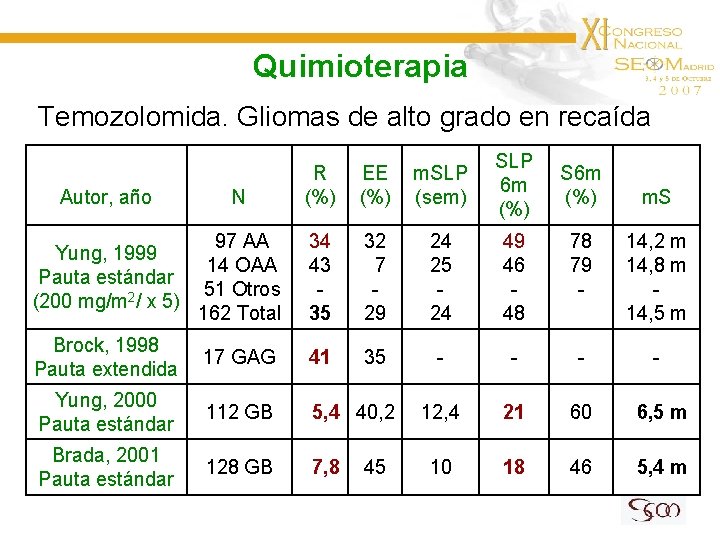
Quimioterapia Temozolomida. Gliomas de alto grado en recaída R (%) EE (%) m. SLP (sem) SLP 6 m (%) 97 AA Yung, 1999 14 OAA Pauta estándar 51 Otros (200 mg/m 2/ x 5) 162 Total 34 43 35 32 7 29 24 25 24 49 46 48 78 79 - 14, 2 m 14, 8 m 14, 5 m Brock, 1998 Pauta extendida 17 GAG 41 35 - - Yung, 2000 Pauta estándar 112 GB 5, 4 40, 2 12, 4 21 60 6, 5 m Brada, 2001 Pauta estándar 128 GB 7, 8 10 18 46 5, 4 m Autor, año N 45 S 6 m (%) m. S

Nuevos fármacos La llamada convencionalmente quimioterapia interfiere la duplicación celular por diversos mecanismos Los llamados nuevos fármacos interfieren, en general, con una o varias vías de señalización que inducen la proliferación, migración o supervivencia celular Otras aproximaciones, como la inmunoterapia, podrían incluirse en el ámbito de los nuevos fármacos

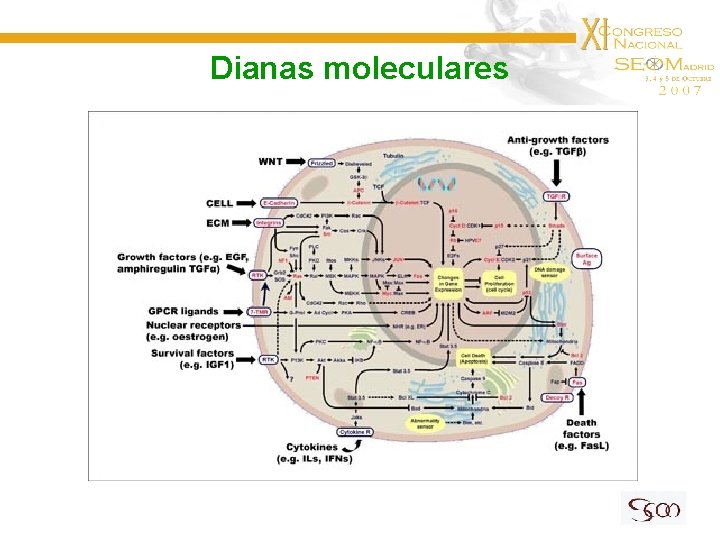
Dianas moleculares

Dianas moleculares • • • Inhibición de EGFR Inhibición de PDGFR y de KITr Inhibición de m. TOR Inhibición de la angiogénesis Otras estrategias

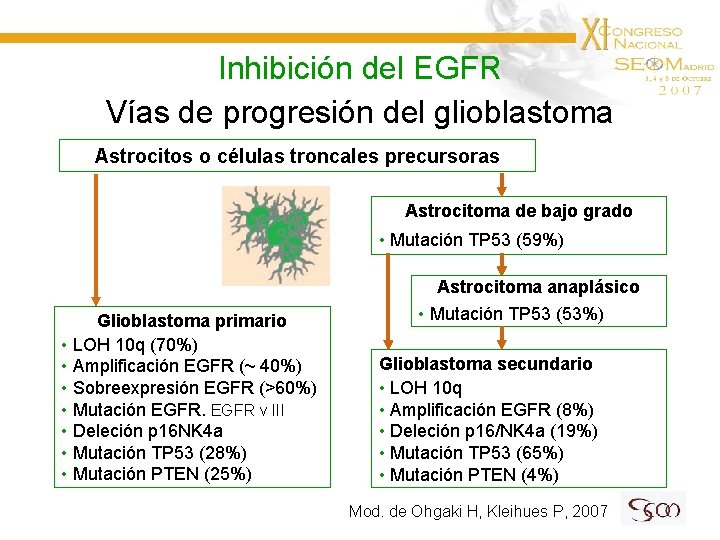
Inhibición del EGFR Vías de progresión del glioblastoma Astrocitos o células troncales precursoras Astrocitoma de bajo grado • Mutación TP 53 (59%) Glioblastoma primario • LOH 10 q (70%) • Amplificación EGFR (~ 40%) • Sobreexpresión EGFR (>60%) • Mutación EGFR v III • Deleción p 16 NK 4 a • Mutación TP 53 (28%) • Mutación PTEN (25%) Astrocitoma anaplásico • Mutación TP 53 (53%) Glioblastoma secundario • LOH 10 q • Amplificación EGFR (8%) • Deleción p 16/NK 4 a (19%) • Mutación TP 53 (65%) • Mutación PTEN (4%) Mod. de Ohgaki H, Kleihues P, 2007

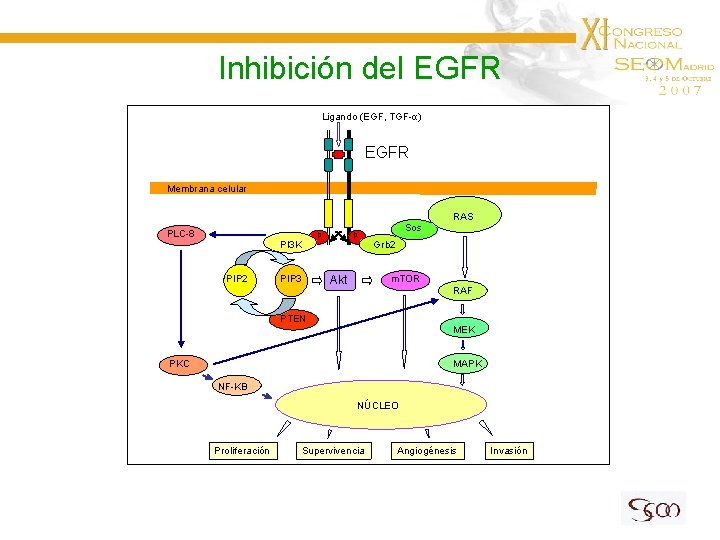
Inhibición del EGFR Ligando (EGF, TGF-α) EGFR Membrana celular RAS PLC-8 p p PI 3 K PIP 2 PIP 3 Sos Grb 2 m. TOR Akt RAF PTEN MEK PKC MAPK NF-KB NÚCLEO Proliferación Supervivencia Angiogénesis Invasión

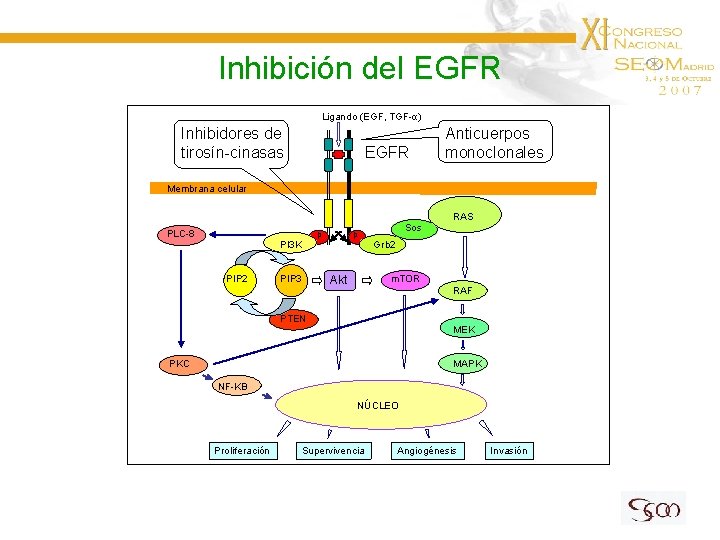
Inhibición del EGFR Ligando (EGF, TGF-α) Inhibidores de tirosín-cinasas EGFR Anticuerpos monoclonales Membrana celular RAS PLC-8 p p PI 3 K PIP 2 PIP 3 Sos Grb 2 m. TOR Akt RAF PTEN MEK PKC MAPK NF-KB NÚCLEO Proliferación Supervivencia Angiogénesis Invasión

Inhibición del EGFR

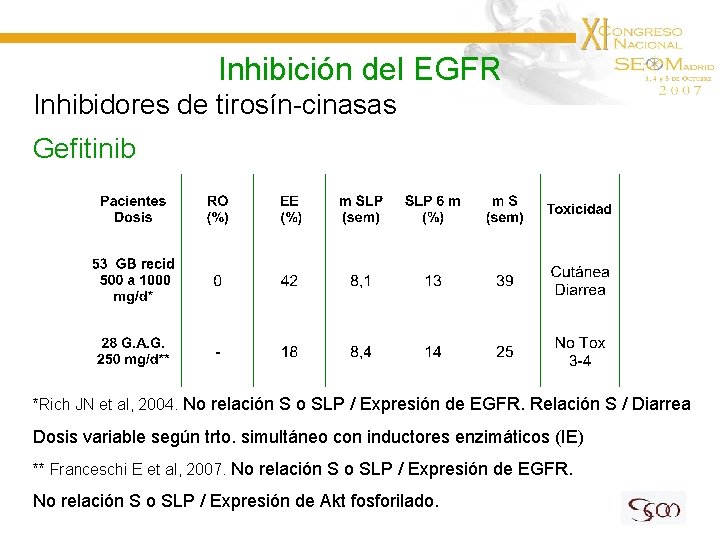
Inhibición del EGFR Inhibidores de tirosín-cinasas Gefitinib *Rich JN et al, 2004. No relación S o SLP / Expresión de EGFR. Relación S / Diarrea Dosis variable según trto. simultáneo con inductores enzimáticos (IE) ** Franceschi E et al, 2007. No relación S o SLP / Expresión de EGFR. No relación S o SLP / Expresión de Akt fosforilado.

Inhibición del EGFR Inhibidores de tirosín-cinasas Gefitinib Estudio F. I – II de Gefitinib + RT en ptes con glioblastoma. RTOG 0211 31 ptes en F I; 147 ptes en F II. DMT: 500 mg (ptes sin IE) F II: Gefitinib 500 mg/d concomitante con RT y x 18 m o progresión. 119 ptes cumplieron el protocolo. Chakravarti A et al, 2006

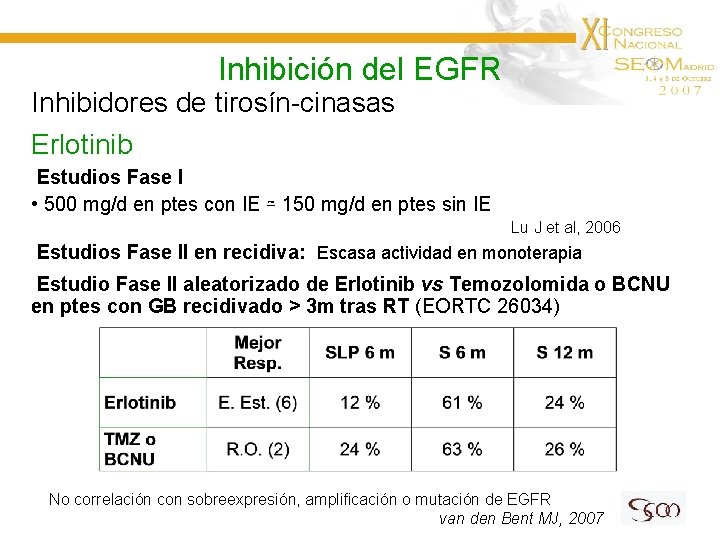
Inhibición del EGFR Inhibidores de tirosín-cinasas Erlotinib Estudios Fase I • 500 mg/d en ptes con IE ≃ 150 mg/d en ptes sin IE Lu J et al, 2006 Estudios Fase II en recidiva: Escasa actividad en monoterapia Estudio Fase II aleatorizado de Erlotinib vs Temozolomida o BCNU en ptes con GB recidivado > 3 m tras RT (EORTC 26034) No correlación con sobreexpresión, amplificación o mutación de EGFR van den Bent MJ, 2007

Inhibición del EGFR Inhibidores de tirosín-cinasas Erlotinib Estudios de concomitancia con RT+ mantenimiento. Fases I • 19 ptes con GB. Dosis máximas: Erlotinib 150 mg/d (no IE) o 200 mg/d (IE). No se alcanzó la DMT. SLP: 25 sem m. S: 55 sem. Krishnan S, 2006 • 17 ptes de 3 a 25 a. (9 GB, 4 AA, 9 otros). Escalada de dosis 90 a 120 mg/m 2. 3 ptes con estabilización > 1 a. Broniscer A, 2007

Inhibición del EGFR Inhibidores de tirosín-cinasas Erlotinib en combinación con otros fármacos Estudio F II de Erlotinib + Carboplatino en GB recidivado. Ptes con GB con ≤ 2 recidivas previas. IK ≥ 60. No IE. - Carboplatino AUC 6, día 1 - Erlotinib 150 – 200 mg/d, d 1 a 28. Cada 28 d 17 ptes evaluables en el momento de la comunicación. Fallo previo a TMZ. SLP: 15, 2 sem (IC 95%: 8 -28, 4) SLP B. D. histórica: 9 sem (IC 95%: 8, 1 -10, 1) Tox. 3 -4: astenia, leucopenia, trombocitopenia, rash. De Groot JF et al. 2007

Inhibición del EGFR Inhibidores de tirosín-cinasas Erlotinib en combinación con otros fármacos Estudio Fase I de Erlotinib ± Temozolomida en Glioma Alto Grado recidivado. Dosis recomendadas: Erlotinib: 200 mg/d (no IE) o 500 mg/d (IE) E + TMZ: 450 mg/d (IE) R. O. : 8 / 57 (14%). Tox. Leve-moderada: astenia, rash, diarrea. Prados MD et al. 2006

Inhibición del EGFR Inhibidores de tirosín-cinasas Posibles marcadores de respuesta Expresión de EGFRv. III y de PTEN Mellinghoff, 2005 Expresión de EGFR y baja expresión de p. Akt Haas-Kogan, 2005

Inhibición del EGFR Anticuerpos monoclonales Cetuximab Varios ensayos en marcha, tanto en recidiva como en primera línea concomitante con RT. Nimotuzumab 47 ptes pediátricos con glioma de alto grado recidivado. NTB 150 mg/m 2 semanal x 6 sem → semanal x 4 si no prog. 4 RP, 10 E. Est. M S: 4, 4 m. Bode U et al, 2007 En marcha estudios de concomitancia con RT

Inhibición de KIT / PDGFR Imatinib Inhibición de • ABL • ARG • BCR-ABL (T-C que activa RAS y PI 3 K en la LMC) • KIT • PDGFRα y β • FLT-3

Inhibición de KIT / PDGFR Ligando (SCF) KIT Membrana celular JAK p p PI 3 K PIP 3 PIP 2 Shc Grb 2 Akt Sos RAS m. TOR PTEN RAF STAT MEK MAPK Inhibición de la apoptosis Proliferación

Inhibición de KIT / PDGFR Expresión de KIT y PDGFR en los gliomas • Bajo nivel de expresión de KIT en las células tumorales • En las células endoteliales de los GB primarios: – Expresión fuerte en el 16% de tumores – Expresión débil en el 24% Sihto H et al 2007 • Expresión de PDGFR α en el 25% de GB • Expresión de PDGFR β en el 19% de GB Haberler C et al, 2006 • Expresión de PDGFR β en GB: en células tumorales (50%) y en células endoteliales peritumorales (65%) Barrios CH et al, 2006

Inhibición de KIT / PDGFR Imatinib Estudio Fase I – II en gliomas de alto grado recidivados • DMT: 800 mg/d (no IE) o 1200 mg/d (IE) • TLD (no IE): rash, neutropenia, ↑transaminasas Wen PY et al, 2006

Inhibición de KIT / PDGFR Imatinib Estudio Fase II en GAG (18 GB, 2 AA) recidivados con expresión de PDGFR (α: 100%; ß: 55%) • Dosis: 800 mg/d (todos IE + esteroides) Viola FS et al, 2007

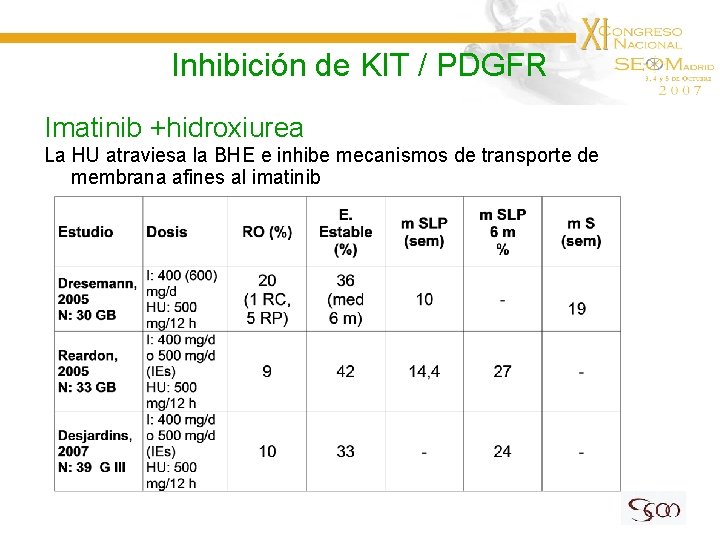
Inhibición de KIT / PDGFR Imatinib +hidroxiurea La HU atraviesa la BHE e inhibe mecanismos de transporte de membrana afines al imatinib

Inhibición de KIT / PDGFR Imatinib + hidroxiurea de mantenimiento en 30 ptes con GB en ausencia de progresión *3/6 GB secundarios y 2/24 GB primarios Dresemann G et al, 2007

Inhibición de KIT / PDGFR Imatinib + hidorxiurea en ptes con glioma bajo grado recidivado de 27 ptes (17 A, 10 ODG) I: 400 mg/d (no IE) o 500 mg/12 h (IE: 40, 7%) HU: 500 mg/12 h 20 ptes en tratamiento en el momento de la comunicación. Tox. moderada Bota DA et al, 2007

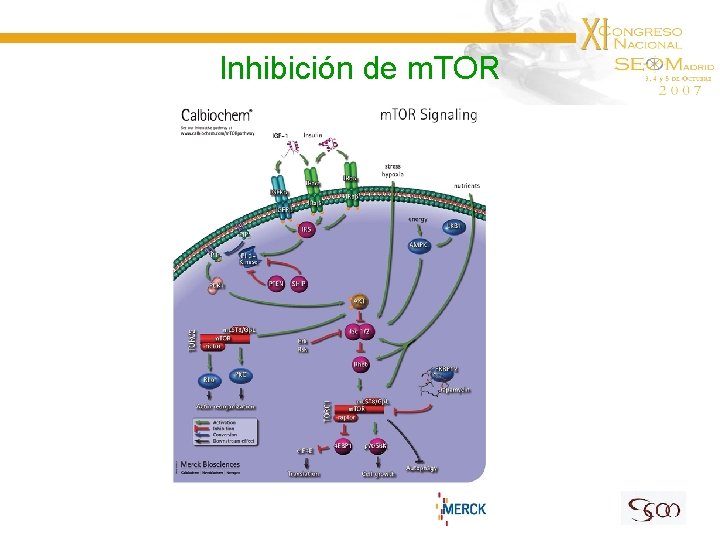
Inhibición de m. TOR

Inhibición de m. TOR Temsirolimus Análogo de sirolimus (rapamicina) con mayor hidrosolubilidad y mejores propiedades farmacocinéticas. Estudio en Fase II. 65 ptes con GB recidivado *↓ señal T 2 ± ↓ imagen captante T 1 • Hiperlipidemia ≥ G 2 asociada a respuesta • Niveles altos de p 70 S 6 K fosforilada asociados a respuesta • Tox. G 3 no hematológica: 51% (↑colesterol, triglicéridos, glucosa) • Tox. G 3 hematológica: 11% Galanis E et al, 2005

Inhibición de m. TOR Temsirolimus Estudio en Fase II. 43 ptes con GB recidivado Dosis: 250 mg/sem (IEs) o 170 mg/sem (no IEs) Chang SM et al, 2005

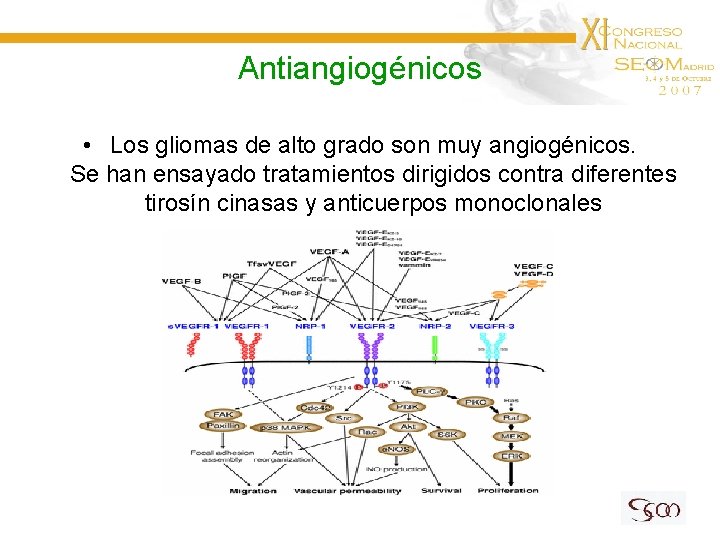
Antiangiogénicos • Los gliomas de alto grado son muy angiogénicos. Se han ensayado tratamientos dirigidos contra diferentes tirosín cinasas y anticuerpos monoclonales

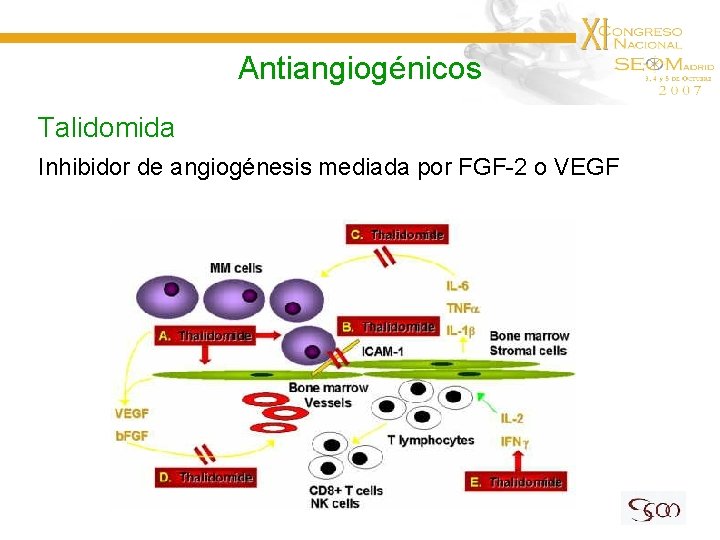
Antiangiogénicos Talidomida Inhibidor de angiogénesis mediada por FGF-2 o VEGF

Antiangiogénicos Talidomida Estudio Fase II en Glioma de Alto Grado recidivado 36 ptes evaluables. Dosis inicial: 800 mg / d. ↑ de 200 mg c/15 d → 1200 mg/d • • Nivel sérico de b. FGF rel. con SLP Tox. moderada. Sedación, estreñimiento, 1 neuropatía periférica Fine HA et al, 2000

Antiangiogénicos Talidomida + BCNU Estudio F II en Gliomas de Alto G. recidivados • 40 ptes (38 GB) • BCNU 200 mg/m 2 cada 6 sem. TAL 800 → 1200 mg/d m SLP Base de datos histórica: 9 sem. Fine HA et al, 2000

Antiangiogénicos Talidomida + Temozolomida Estudio no aleatorizado en 46 ptes, tras RT Supervivencia similar (TMZ: 12 m; TMZ+T: 13 m) Riva M et al, 2007 Talidomida + CPT 11 Estudio en Fase II en ptes con Gliomas G III recidivados Talidomida + Temozolomida + CDDP Estudio en fase I en ptes con Gliomas de Alto G.

Antiangiogénicos Inhibidores de la TK del VEGFR Vatalanib (PTK 787/ZK 222584) • Inhibe la Tirosin-Cinasa de todos los VEGFR (1, 2 y 3) y bloquea su activación por los VEGF A, B, C y D. Estudio en Fase I / II en 55 ptes con GB recidivado • Objetivo: tolerancia, respuesta, ↓ aporte sangre (por RM) • Dosis escaladas de 150 mg/d hasta 2000 mg/d • 47 ptes eval. 2 RP (4%); 31 E. E. (56%); 14 Progr. (25%) • ↓ permeabilidad vascular y volumen sanguíneo • Toxicidad: ↑ GOT/GPT, TVP, astenia, náuseas/vómitos Conrad et al, 2004

Antiangiogénicos Inhibidores de la TK del VEGFR Vatalanib + Temozolomida + RT en GB 1ª línea • Estudio en Fase I / II. Dosis recomendada: TMZ 75 mg/m 2/d. Vatalanib 1000 mg/d En marcha estudio aleatorizado • RT+TMZ+V desde inicio de QT adyuvante Brandes AA et al, 2007 Vatalanib + Imatinib + HU en GB recidivado Datos preliminares: RP 29% Sathornsumetee S et al, 2007

Antiangiogénicos Inhibidores de la TK del VEGFR Cediranib Inhibe la Tirosin-Cinasa de todos los VEGFR (1, 2 y 3) y bloquea su activación por los VEGF A, B, C y D. Estudio en Fase II en GB recidivado Batchelor T et al, 2007

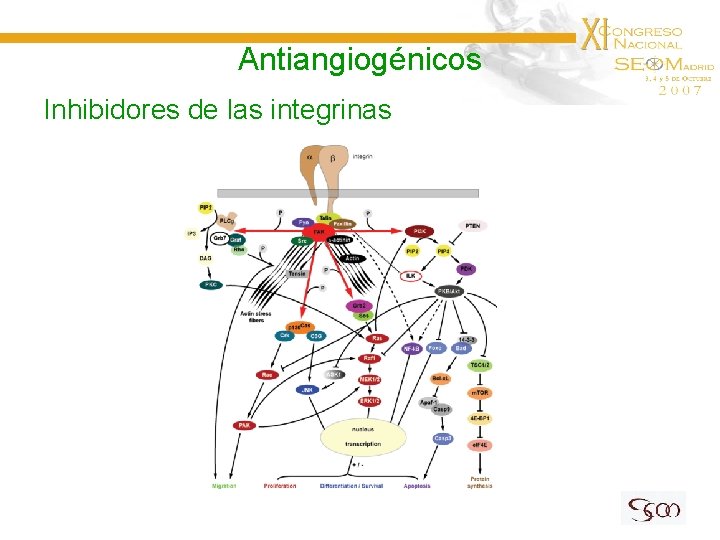
Antiangiogénicos Inhibidores de las integrinas

Antiangiogénicos Inhibidores de las integrinas Cilengitide (Inhibidor de Integrinas αvβ 3 y αvβ 5) Estudio F I en 51 ptes con G. de Alto G recidivado Se llegó a 2400 mg iv / 2 veces por semana sin TLD • R. O. : 10% E. Estable: 8% • Tox. Observada: 1 Trombosis, 1 dolor osteoarticular G 4, 1 trombocitopenia Nabors LD et al, 2007 Estudio F II randomizado en GB recidivado tras RT/TMZ 81 ptes. 500 mg vs 2000 mg, 2 /sem • SLP a 6 m: 16% • m S: 6, 5 m (200 mg) vs 9, 9 m (2000 mg) (no significativo) Reardon D et al, 2007

Antiangiogénicos Inhibidores de las integrinas Cilengitide • Estudio F II en 52 ptes con GB en 1ª línea: RT + TMZ estándar + C 500 mg iv 2/sem, desde 1 sem antes de RT/QT hasta fin QT o progresión. • Objetivo principal: SLP a 6 m ≥ 65% (con RT+TMZ: 54%) • SLP a 6 m: 65, 4% • MGMT metilado → mayor probabilidad de SLP a 6 m • Toxicidad: Linfopenia (54%), trombocitopenia (13%), neutropenia (10%) Astenia/anorexia (6%), ↑ Transaminasas (1), TVP/TEP (1) Stupp R et al, 2007

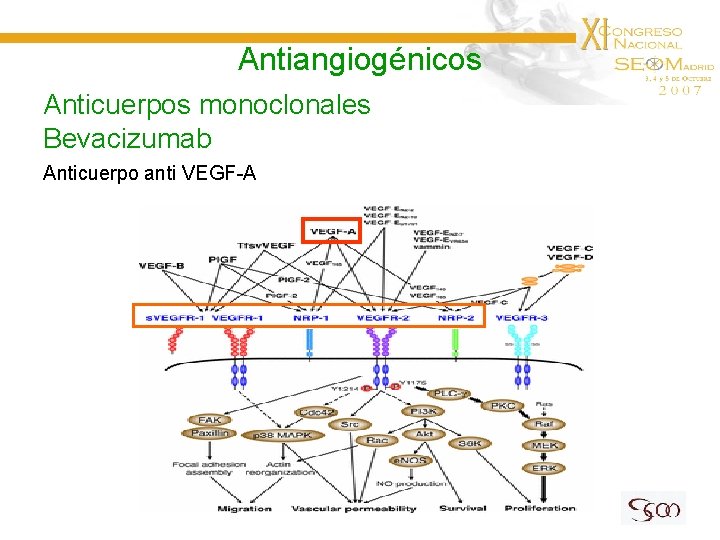
Antiangiogénicos Anticuerpos monoclonales Bevacizumab Anticuerpo anti VEGF-A

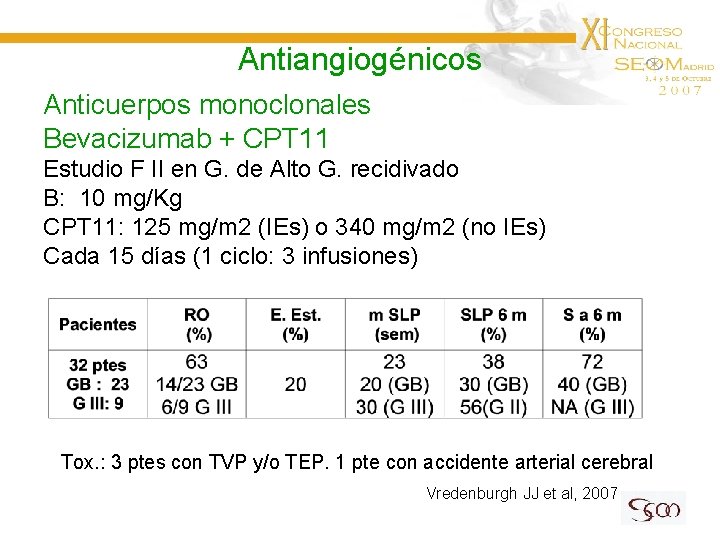
Antiangiogénicos Anticuerpos monoclonales Bevacizumab + CPT 11 Estudio F II en G. de Alto G. recidivado B: 10 mg/Kg CPT 11: 125 mg/m 2 (IEs) o 340 mg/m 2 (no IEs) Cada 15 días (1 ciclo: 3 infusiones) Tox. : 3 ptes con TVP y/o TEP. 1 pte con accidente arterial cerebral Vredenburgh JJ et al, 2007

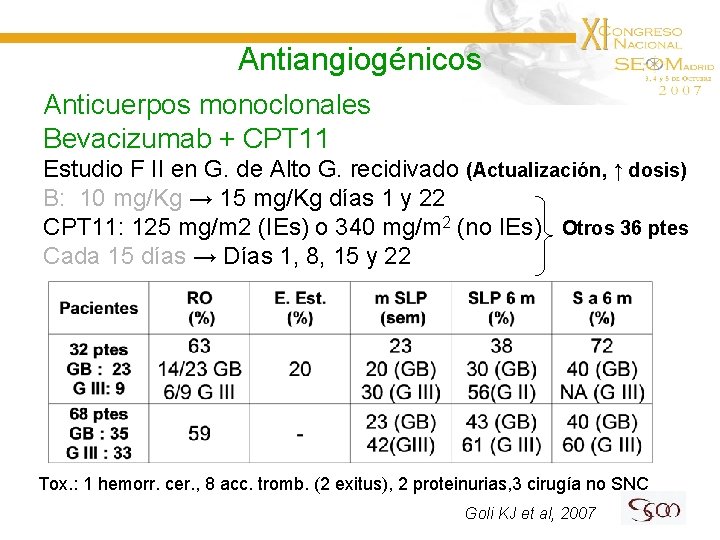
Antiangiogénicos Anticuerpos monoclonales Bevacizumab + CPT 11 Estudio F II en G. de Alto G. recidivado (Actualización, ↑ dosis) B: 10 mg/Kg → 15 mg/Kg días 1 y 22 CPT 11: 125 mg/m 2 (IEs) o 340 mg/m 2 (no IEs) Otros 36 ptes Cada 15 días → Días 1, 8, 15 y 22 Tox. : 1 hemorr. cer. , 8 acc. tromb. (2 exitus), 2 proteinurias, 3 cirugía no SNC Goli KJ et al, 2007

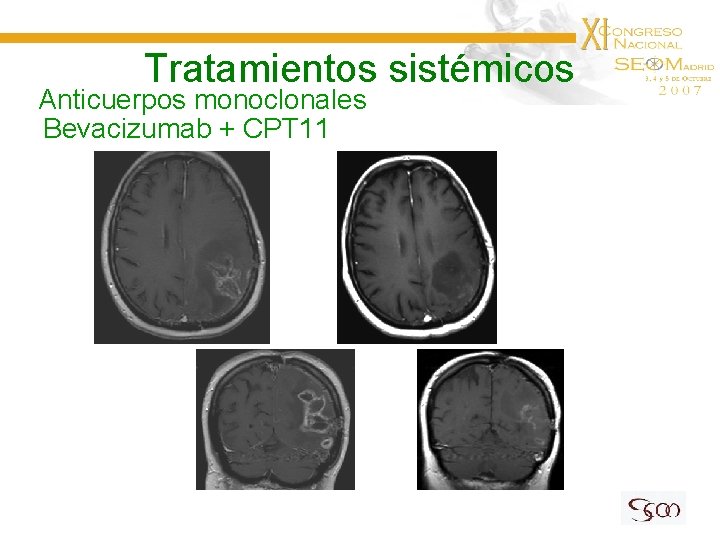
Tratamientos sistémicos Anticuerpos monoclonales Bevacizumab + CPT 11

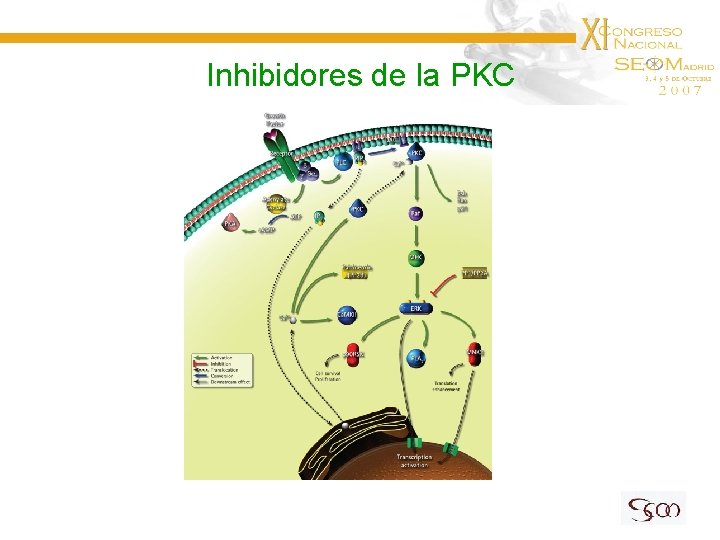
Inhibidores de la PKC

Inhibidores de la PKC Enzastaurina Estudio en F II en ptes con G. de Alto Grado recidivado 79 ptes (72% GB). E 500 mg/d R. O. en 14 ptes (10 GB): 18%. EE: 16% Fine HA et al, 2005 Un estudio aleatorizado de enzastaurina vs lomustina se cerró al no demostrarse aumento de la S en análisis interino

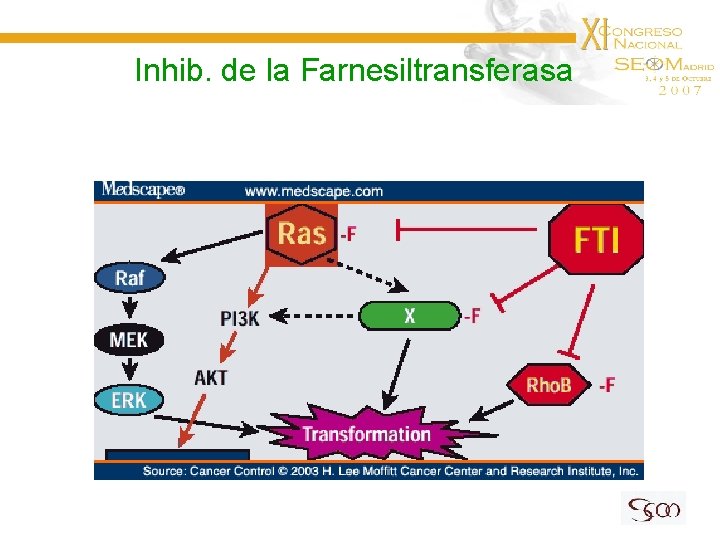
Inhib. de la Farnesiltransferasa

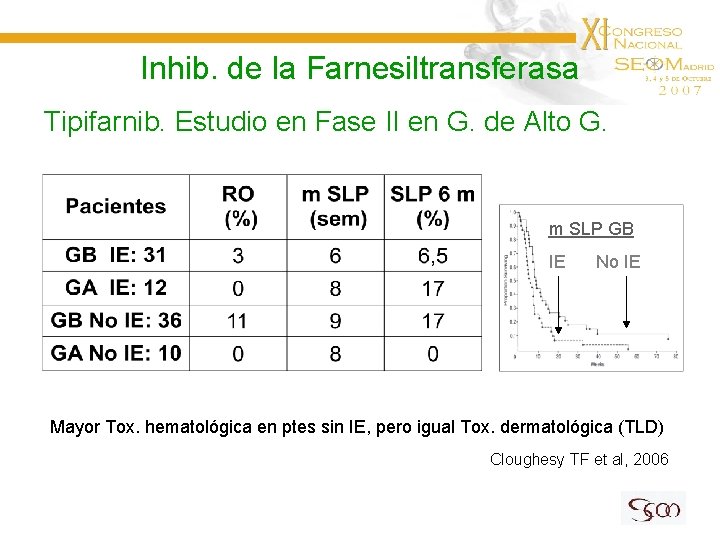
Inhib. de la Farnesiltransferasa Tipifarnib. Estudio en Fase II en G. de Alto G. m SLP GB IE No IE Mayor Tox. hematológica en ptes sin IE, pero igual Tox. dermatológica (TLD) Cloughesy TF et al, 2006

Inhib. de la Farnesiltransferasa Lonafarnib Estudio en Fase I de L + TMZ en GB recidivado • TMZ 150 mg/m 2, d 1 -7 y 15 -21 • L 100 → 200 mg BID d 8 -14 y 22 -28 cada 28 d Todas las R. O. en ptes con TMZ previa Tox. G 3 -4: hematológica, astenia, esofagitis, hipokaliemia Gilbert MR et al, 2006

Inhib. de las metaloproteasas de matriz Marimastat + Temozolomida Estudio en Fase II en 44 ptes con GB recidivado • TMZ 150 -200 mg/m 2, d 1 -5 • M 50 mg d 8 -28 cada 28 d Tox. Más importante: dolor articular-tendinoso (47%). Salida del estudio por dolor: 11% de los ptes. Groves MD et al, 2002

El problema de las múltiples vías de señalización Los inhibidores de TC de acción única tienen una eficacia antitumoral limitada debido, en parte, a la existencia de otras vías de señalización alternativas.

El problema de las múltiples vías de señalización Se ha abordado esta problema mediante dos estrategias • Combinación de varios fármacos • Fármacos multidiana

Fármacos multidiana Algunos estudios en marcha • Sorafenib (Inhib. de RAF y VEGF 2) • Vandetanib (Inhib. de RAF y VEGF 2) • Sunitinib (Inhib. de VEGFR-2, PDGFR, c-KIT y FLT-3) • Tandutinib (Inhib. de VEGFR-2, PDGFR y c-KIT) • Lapatinib (Inhib de HER 1 y HER 2)

Combinaciones de fármacos Sirolimus + Gefitinib Estudio en Fase I. 34 ptes con G. Alto G. recidivado (85% GB) Dosis recomendada S/G: 5/500 mg/d (no IEs) o 10/1000 mg/d (IEs) TLD: mucositis, diarrea, rash, trombocitopenia, hipertrigliceridemia Reardon DA et al, 2006

Combinaciones de fármacos Everolimus (RAD-001) + Gefitinib Estudio en Fase I-II. 19 ptes con GB recidivado Med. seguimiento: 5, 4 m Tox. G 1 -2: Tox. hematológica, ↑ALT, diarrea Linfopenia G 3: 42% ptes. Nguyen TD et al, 2006

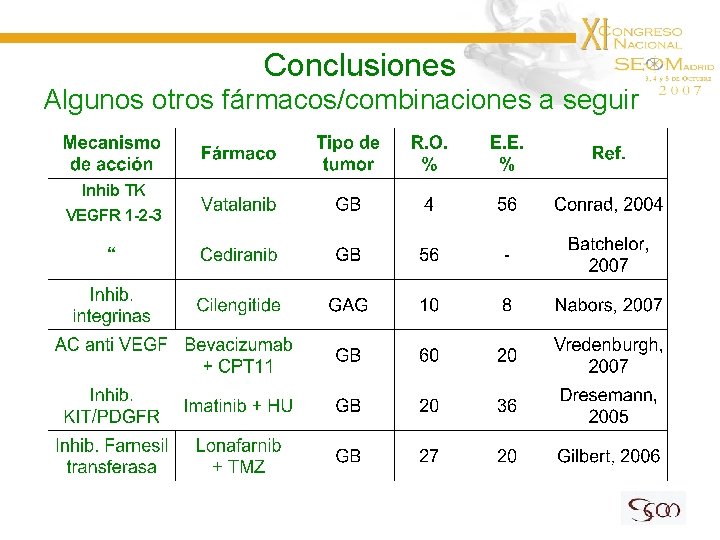
Conclusiones Algunos otros fármacos/combinaciones a seguir Inhib TK VEGFR 1 -2 -3

Conclusiones • La utilización de nuevos fármacos en tumores del SNC es aún muy reciente. Hacen faltan más estudios • Algunos fármacos y combinaciones están dando resultados muy prometedores • La interferencia con los inductores enzimáticos es muy relevante y debería llevar a seleccionar los FAEs • Los marcadores de respuesta para elegir los tratamientos más adecuados son aun insuficientes

Líneas futuras • Utilización de múltiples dianas (fármacos multidiana y/o combinaciones) • Combinaciones óptimas con QT y RT • Avances en marcadores biológicos de eficacia • Avances en evaluación por imagen • Avances en vacunas • Terapias dirigidas (toxinas, radiación) • Investigación en células troncales
 Johan reyns
Johan reyns Frmacos
Frmacos Frmacos
Frmacos Procineticos
Procineticos Cadena nucleotidica
Cadena nucleotidica Genes supresores de tumores
Genes supresores de tumores Tumores de celulas germinativas
Tumores de celulas germinativas Triada mackler
Triada mackler Tumores benignos de esofago
Tumores benignos de esofago Genes supresores de tumores
Genes supresores de tumores Tumores de fosa anterior
Tumores de fosa anterior Tumores pulmonares benignos
Tumores pulmonares benignos Skeleton hand whmis
Skeleton hand whmis Rombencefalo
Rombencefalo Snc1d chemistry
Snc1d chemistry Snc lajaa venissieux
Snc lajaa venissieux Società in nome collettivo
Società in nome collettivo Síndrome de kleeblattschädel
Síndrome de kleeblattschädel Paul mcenaney
Paul mcenaney üep
üep Varju gaspar jellemzese
Varju gaspar jellemzese Gaspar olmedo
Gaspar olmedo Cinbalos
Cinbalos Primjer serijskog spoja u kućanstvu
Primjer serijskog spoja u kućanstvu Merse ablak
Merse ablak Auto pastoril del nacimiento gil vicente
Auto pastoril del nacimiento gil vicente Croli
Croli Edificio gaspar de rodas
Edificio gaspar de rodas Cambios culturales
Cambios culturales Hospital pharmacy defination
Hospital pharmacy defination Unos verbos
Unos verbos Para vino nuevo odres nuevos
Para vino nuevo odres nuevos Etapas de desarrollo de nuevos productos
Etapas de desarrollo de nuevos productos Nuevos materiales de la edad antigua
Nuevos materiales de la edad antigua Las tic y los nuevos paradigmas educativos
Las tic y los nuevos paradigmas educativos Cuentos nuevos
Cuentos nuevos El paucar que tipo de texto es
El paucar que tipo de texto es Nuevos retos nuevas oportunidades
Nuevos retos nuevas oportunidades Nuevos comienzos en la biblia
Nuevos comienzos en la biblia Los productos no buscados
Los productos no buscados Ella necesita ir de compras para comprar calcetines nuevos.
Ella necesita ir de compras para comprar calcetines nuevos. Cefalosporinas clasificación
Cefalosporinas clasificación Nuevos inhibidores de betalactamasas
Nuevos inhibidores de betalactamasas Nuevos grados
Nuevos grados Nuevos anticonvulsivantes
Nuevos anticonvulsivantes Nuevos paradigmas educativos
Nuevos paradigmas educativos Paradigmas y modelos educativos
Paradigmas y modelos educativos Paradigma conductista
Paradigma conductista Nuevos ambientes de aprendizaje
Nuevos ambientes de aprendizaje Elementos externos del genero lirico
Elementos externos del genero lirico Hospital mesa del castillo trabajo
Hospital mesa del castillo trabajo Mapa pabellones basurto
Mapa pabellones basurto York hospital eye clinic
York hospital eye clinic Drematology
Drematology Ninewells hospital area 6 outpatients
Ninewells hospital area 6 outpatients Staqc
Staqc Umcap hospital
Umcap hospital Evangelismos laboratory
Evangelismos laboratory University hospital of pisa
University hospital of pisa Tung shin hospital
Tung shin hospital Daima artan fonksiyon delta
Daima artan fonksiyon delta