Farmacogenmica en los tumores del SNC Simposio Educacional























- Slides: 36

Farmacogenómica en los tumores del SNC Simposio Educacional 2 Alfonso Berrocal Jaime Hospital General Universitario de Valencia

Definiciones • Farmacogenética – Variaciones individuales en el metabolismo y distribución de un medicamento controlado por los genes • Farmacogenómica – Farmacogenetica + variación individual en la respuesta a un medicamento “El estudio de los factores génicos que determinan la eficacia y la toxicidad de un medicamento”

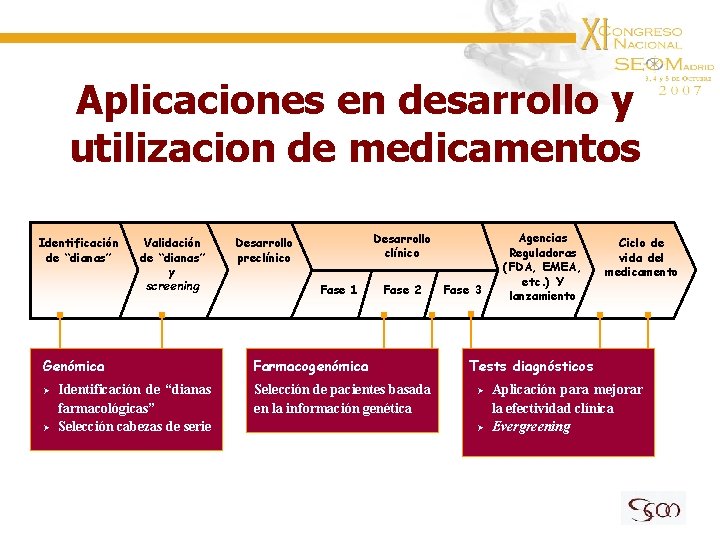
Aplicaciones en desarrollo y utilizacion de medicamentos Identificación de “dianas” Validación de “dianas” y screening Genómica Ø Ø Identificación de “dianas farmacológicas” Selección cabezas de serie Desarrollo clínico Desarrollo preclínico Fase 1 Fase 2 Farmacogenómica Selección de pacientes basada en la información genética Fase 3 Agencias Reguladoras (FDA, EMEA, etc. ) Y lanzamiento Ciclo de vida del medicamento Tests diagnósticos Ø Ø Aplicación para mejorar la efectividad clínica Evergreening

Aplicaciones • Individualización del tratamiento en base a criterios de eficacia y toxicidad – Pacientes con beneficio potencial – Pacientes con riesgo toxicidad • Reutilización fármacos rechazados como tóxicos • Mejora diseño de ensayo clínicos – Mejor selección de pacientes – Mejor interpretación de los resultados • Mejor conocimiento de la enfermedad – Identificación de subtipos genéticos – Descubrimiento de nuevas dianas

¿Que se sabe en gliomas? • Metilación de MGMT en glioblastoma • Perdida alelica 1 p y 19 q en oligodendroglioma • Amplificación/mutación de EGFR y estado de PTEN/Akt en glioblastoma

Metilación MGMT en glioblastoma

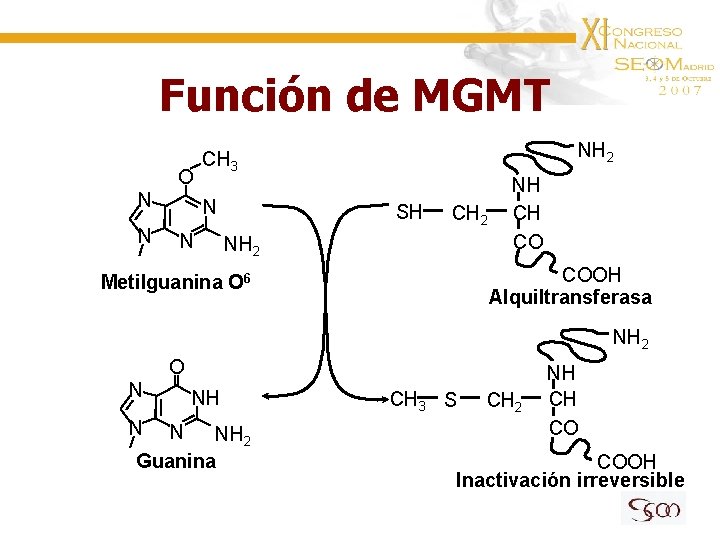
Citotoxicidad de alquilantes • La formación de aductos en posición O 6 de la guanina es la principal diana citotóxica de estos fármacos • Estos aductos son reparados por MGMT de forma suicida • Bajo nivel de MGMT en 30% de gliomas alto grado • La depleción de MGMT depende de la exposición prolongada y frecuente a fármaco • La depleción de MGMT aumenta la citotoxicidad de TMZ 1 1. - Baer JC et al. Br J Cancer 1993; 67; 1299 -1302

Función de MGMT O N N NH 2 CH 3 N N SH CH 2 NH CH CO COOH Alquiltransferasa Metilguanina O 6 NH 2 O N N NH 2 Guanina CH 3 S CH 2 NH CH CO COOH Inactivación irreversible

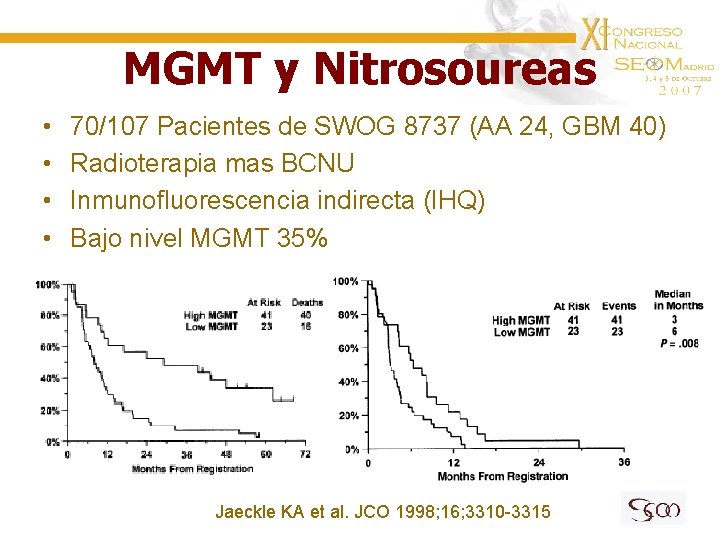
MGMT y Nitrosoureas • • 70/107 Pacientes de SWOG 8737 (AA 24, GBM 40) Radioterapia mas BCNU Inmunofluorescencia indirecta (IHQ) Bajo nivel MGMT 35% Jaeckle KA et al. JCO 1998; 16; 3310 -3315

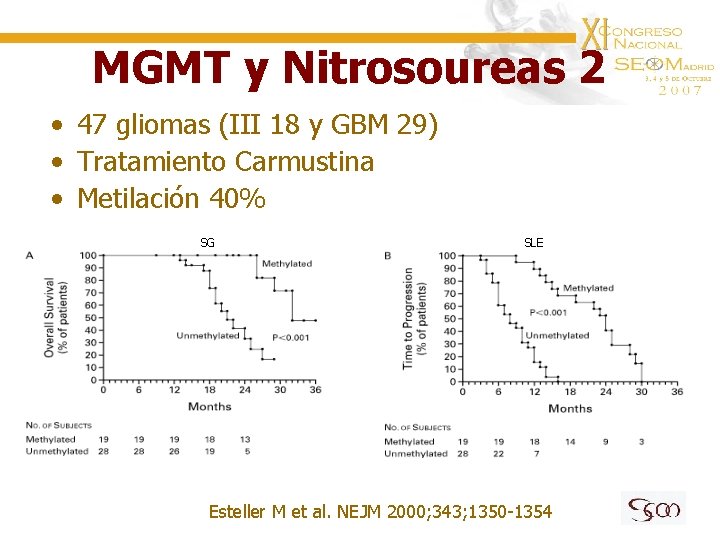
MGMT y Nitrosoureas 2 • 47 gliomas (III 18 y GBM 29) • Tratamiento Carmustina • Metilación 40% SG SLE Esteller M et al. NEJM 2000; 343; 1350 -1354

MGMT y temozolomida • • 38 gliomas de alto grado, 33 GBM Temozolomida dosis convencionales Determinación inmunohistoquimica Bajo nivel MGMT 69. 5% Friedman HS et al. JCO 1998; 16; 3851 -3857

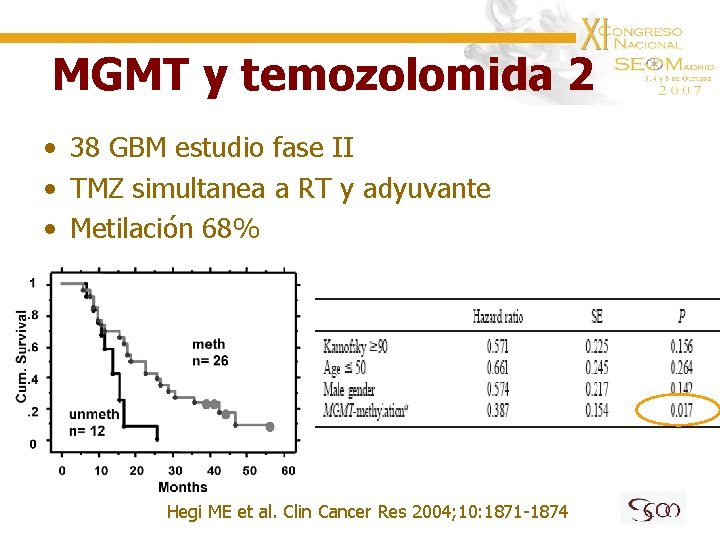
MGMT y temozolomida 2 • 38 GBM estudio fase II • TMZ simultanea a RT y adyuvante • Metilación 68% Hegi ME et al. Clin Cancer Res 2004; 10: 1871 -1874

MGMT y Temozolomida 3 • 206 GBM de fase III previo (Retrospectivo) • Temozolomida simultanea y adyuvante a RT • Metilación 45% Hegi ME et al. NEJM 2005; 352: 997 -1003

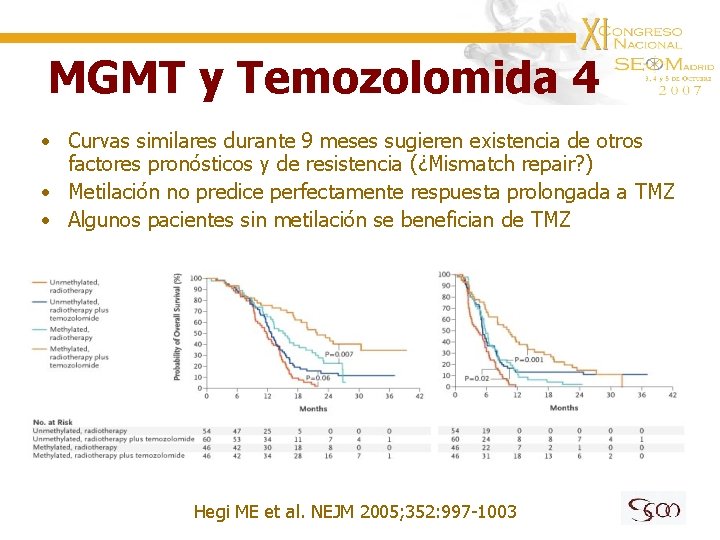
MGMT y Temozolomida 4 • Curvas similares durante 9 meses sugieren existencia de otros factores pronósticos y de resistencia (¿Mismatch repair? ) • Metilación no predice perfectamente respuesta prolongada a TMZ • Algunos pacientes sin metilación se benefician de TMZ Hegi ME et al. NEJM 2005; 352: 997 -1003

MGMT y Temozolomida 5 • • 25/35 GBM de un estudio fase II Temozolomida neoadyuvante 7 “on” / 7 “off” Determinación inmunohistoquimica 44% con bajos niveles de MGMT – Mejor respuesta – Mejor SLE y SG Chinot O et al. JCO 2007; 12: 1470 -11475

MGMT en GBM. Conclusiones • La baja expresión de MGMT o la metilación del promotor se ha demostrado repetidas veces predictivo de respuesta a alquilantes y supervivencia • No es un marcador absoluto y deben existir otros factores de respuesta y pronostico • La determinación por inmunohistoquimica se asocia a pronostico pero tiene inconvenientes – Alta expresión en linfocitos y vasos peritumorales – Expresión es inducible por el tratamiento • No podemos excluir a los pacientes del tratamiento en función de MGMT – Algunos pacientes responden – El estudio de Hegi ME et al es retrospectivo y en parte de los pacientes – No existen tratamientos alternativos fuera de ensayo clinico

Perdida alelica 1 p y 19 q en oligodendroglioma

Oligodendrogliomas • 5 a 25% de tumores cerebrales • Especialmente quimio y radiosensibles – Un tercio son resistentes a quimioterapia • Supervivencia mediana 4 años • Patrón genético característico – Perdidas alelicas 1 p y 19 q en 50 -70% – Perdidas 9 p (región del gen CDKN 2 A) – Perdidas 10 q

Patrón génico y Pronostico • 39 pacientes, 15 recidivados tras RT • Quimioterapia PCV • Perdida alelica 1 p o combinada 1 p y 19 q se asocia a respuesta y supervivencia Cairncross JG et al. JNCI 1998; 19: 1473 -1478

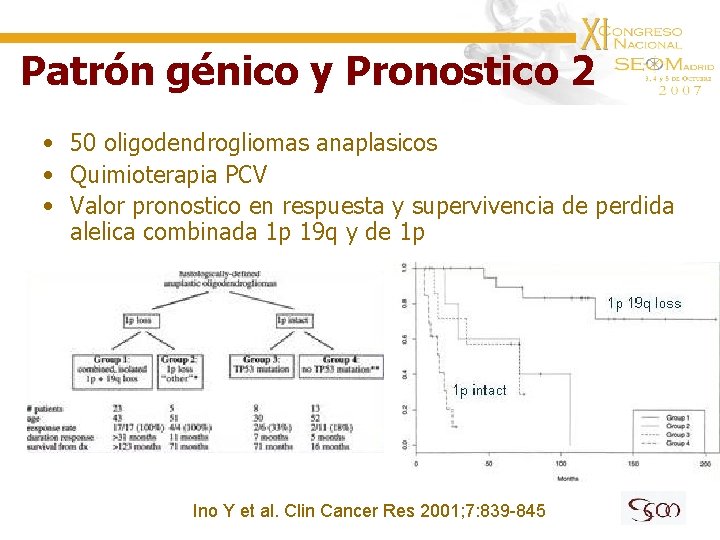
Patrón génico y Pronostico 2 • 50 oligodendrogliomas anaplasicos • Quimioterapia PCV • Valor pronostico en respuesta y supervivencia de perdida alelica combinada 1 p 19 q y de 1 p Ino Y et al. Clin Cancer Res 2001; 7: 839 -845

Patrón génico y Pronostico 3 • • 162 gliomas, 79 astrocitomas, 52 oligos, 31 mixto Tratamiento PCV Detección por FISH Valor pronostico de perdida 1 p / 19 q Smith JS et al. JCO 2000; 18: 636 -645

Patrón génico y Pronostico 4 • Todos los estudios iniciales confirman al valor pronostico de 1 p y 19 q • Se ponen en marcha 2 ensayos fase III para evaluar este factor de forma prospectiva – RTOG 94 -02 (PCV neoadyuvante) – EORTC 26951 (PCV adyuvante)

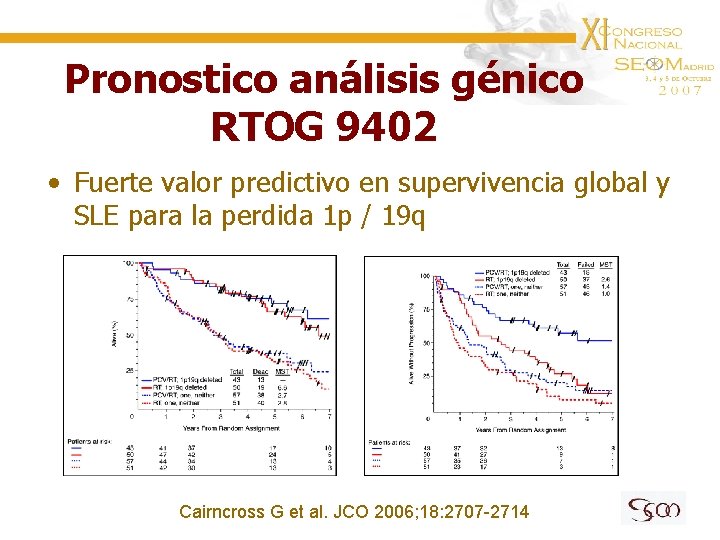
RTOG 9402 • Fase III randomizado: 4 ciclos de PCV neoadyuvante mas radiación o radiación sola • 289 pacientes incluidos • Análisis cromosómico en 202 pacientes – Perdida 1 p en 54% – Perdida 19 q en 61% – Perdida combinada en 46% Cairncross G et al. JCO 2006; 18: 2707 -2714

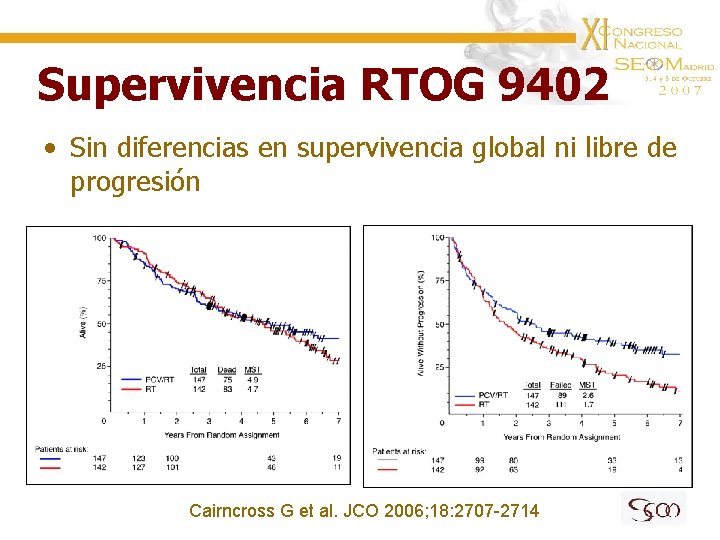
Supervivencia RTOG 9402 • Sin diferencias en supervivencia global ni libre de progresión Cairncross G et al. JCO 2006; 18: 2707 -2714

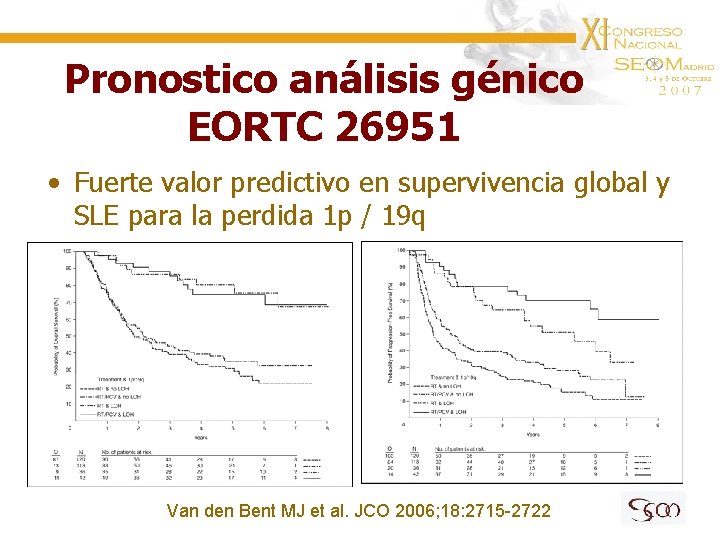
EORTC 26951 • Fase III randomizado de radioterapia frente a radioterapia mas 6 ciclos de PCV adyuvante • 368 pacientes incluidos • Análisis cromosómico en 311 pacientes – Perdida 1 p en 15. 4% – Perdida 19 q en 12% – Perdida combinada en 25. 1% Van den Bent MJ et al. JCO 2006; 18: 2715 -2722

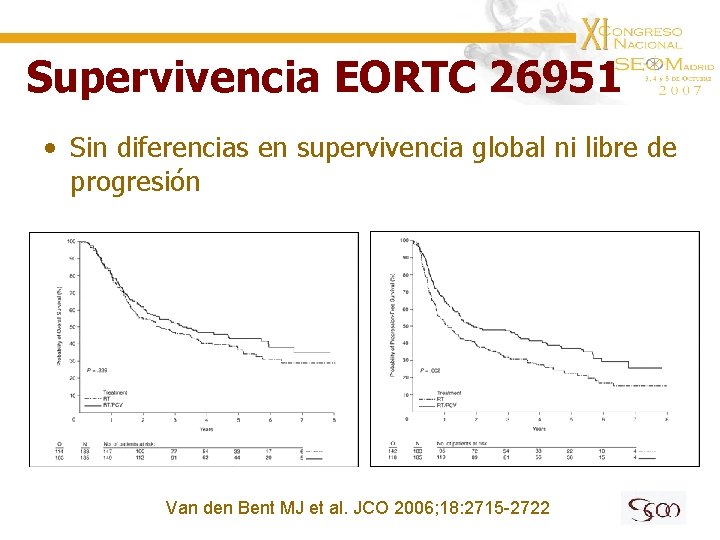
Supervivencia EORTC 26951 • Sin diferencias en supervivencia global ni libre de progresión Van den Bent MJ et al. JCO 2006; 18: 2715 -2722

Pronostico análisis génico RTOG 9402 • Fuerte valor predictivo en supervivencia global y SLE para la perdida 1 p / 19 q Cairncross G et al. JCO 2006; 18: 2707 -2714

Pronostico análisis génico EORTC 26951 • Fuerte valor predictivo en supervivencia global y SLE para la perdida 1 p / 19 q Van den Bent MJ et al. JCO 2006; 18: 2715 -2722

1 p / 19 q Conclusiones • Confirmada prospectivamente la importancia pronostica de 1 p / 19 q • El estado 1 p / 19 q determina sensibilidad al tratamiento pero no a cual • Aun no podemos excluir pacientes de tratamiento en función de 1 p / 19 q – Hay pacientes con deleccion que no responden y viceversa – Deben existir factores adicionales de pronostico

Amplificación/mutación de EGFR y estado de PTEN/Akt en glioblastoma

Generalidades EGFR en GBM • Sobre-expresión de EGFR en 40 -90% de glioblastomas • Elevada frecuencia de expresión EGFRv. III – Activador de la vía PI 3 K • Frecuente perdida de PTEN en los glioblastomas – Inhibidor de la vía PI 3 K – Asociada a mal pronostico • Dos estudios han evaluado el valor pronostico de estos marcadores

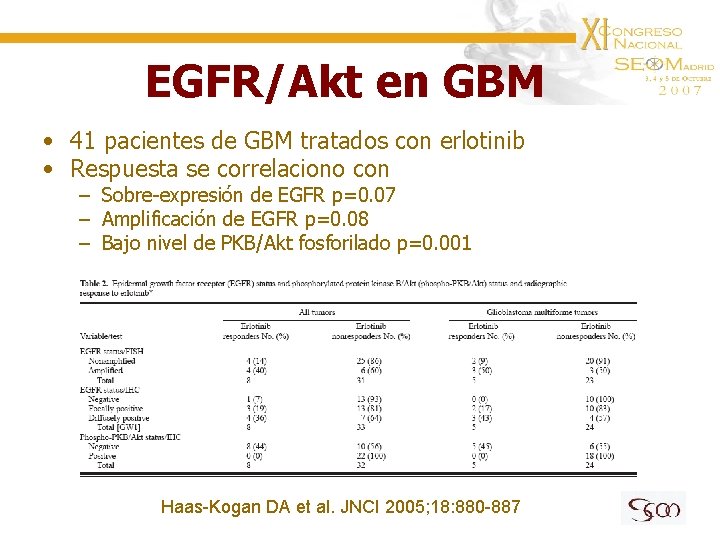
EGFR/Akt en GBM • 41 pacientes de GBM tratados con erlotinib • Respuesta se correlaciono con – Sobre-expresión de EGFR p=0. 07 – Amplificación de EGFR p=0. 08 – Bajo nivel de PKB/Akt fosforilado p=0. 001 Haas-Kogan DA et al. JNCI 2005; 18: 880 -887

EGFR/Akt en GBM • 49 gliomas recidivados tratados con inhibidores orales de quinasa de EGFR • Respuesta se relaciono con: – Coexpresion de EGFRv. III y PTEN Mellinghoff IK et al. NEJM 2005; 353: 2012 -2024

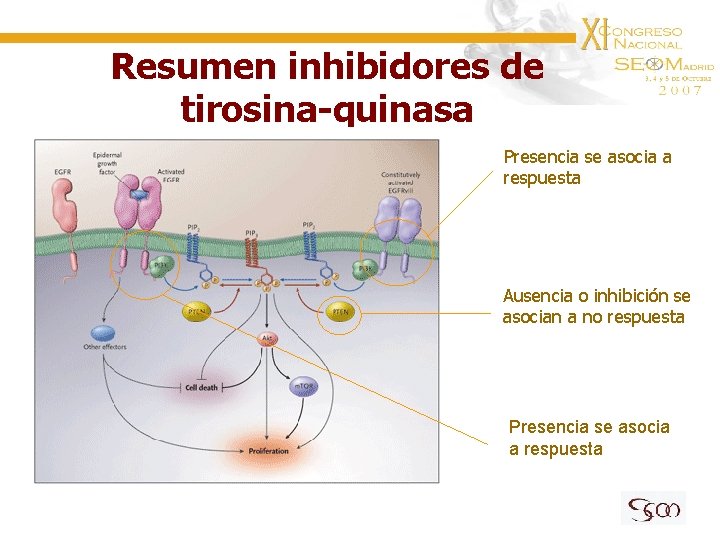
Resumen inhibidores de tirosina-quinasa Presencia se asocia a respuesta Ausencia o inhibición se asocian a no respuesta Presencia se asocia a respuesta

EGFR/Akt en GBM Conclusiones • La expresión de EGFR o su mutación EGFRv. III se asocian a respuesta • PTEN negativo o inactivado se asocia a no respuesta • No todos los pacientes EGFR y PTEN positivos responden por lo que hay factores pronósticos adicionales

Conclusiones • Se han identificado importantes factores predictivos de respuesta a tratamiento y supervivencia en los gliomas • Los futuros ensayos deben tener en cuenta estos factores pronósticos para estratificar a los pacientes • Aunque hay en marcha algunos ensayos aun no podemos ofrecer una quimioterapia a “la carta” • A falta de tratamientos alternativos eficaces se debe mantener el tratamiento estándar
 Discorso alcibiade simposio
Discorso alcibiade simposio Il simposio patti
Il simposio patti Interpretazion
Interpretazion Ventajas de simposio
Ventajas de simposio Ligações intermoleculares
Ligações intermoleculares Que es simposio
Que es simposio Genes supresores de tumores
Genes supresores de tumores Cancer de colon
Cancer de colon Tumores de celulas germinativas
Tumores de celulas germinativas Tumores neurogenicos
Tumores neurogenicos Lipoblastomalipoblastomatosis
Lipoblastomalipoblastomatosis Genes supresores de tumores
Genes supresores de tumores Tumores de fosa anterior
Tumores de fosa anterior Tumores pulmonares benignos
Tumores pulmonares benignos Household safety symbols
Household safety symbols Snc y snp diferencias
Snc y snp diferencias Water density
Water density Snc lajaa venissieux
Snc lajaa venissieux Snc
Snc Síndrome de pfeiffer tipo 2
Síndrome de pfeiffer tipo 2 Snc database
Snc database Pruebas de dominio lector fundación educacional arauco pdf
Pruebas de dominio lector fundación educacional arauco pdf Laptop educacional - tipo i - educação conectada
Laptop educacional - tipo i - educação conectada Etica educacional
Etica educacional Complejo educacional alberto widmer
Complejo educacional alberto widmer Fundacion educacional mater dei
Fundacion educacional mater dei Fundacion educacional santa bernardita
Fundacion educacional santa bernardita Autarquia educacional do vale do são francisco
Autarquia educacional do vale do são francisco Etnocentrismo educacional
Etnocentrismo educacional Intranet vale ves
Intranet vale ves Colegio particular mater dei
Colegio particular mater dei Corporacion monte aconcagua
Corporacion monte aconcagua Mesa educacional
Mesa educacional Educacional
Educacional E-blocks
E-blocks água pura
água pura Fundacion mater dei
Fundacion mater dei