Regulamentao do Sistema Nacional de Controle de Medicamentos






































- Slides: 50

Regulamentação do Sistema Nacional de Controle de Medicamentos: Diagnóstico Situacional e Mapeamento de Alternativas 20º Encontro Técnico e 16º Encontro Empresarial da Associação Brasileira de Produtores de Soluções Parenterais (ABRASP) Brasília, 21 de outubro de 2015

MOTIVAÇÃO As informações constantes desta apresentação são fruto da pesquisa realizada pela assesoria do Diretor Renato Alencar Porto para apoiar a formação de convicção a respeito do modelo de rastreabilidade estabelecido pelo normativo vigente, para implantação do SNCM, e foram apresentadas à Diretoria Colegiada em 01 de setembro de 2015.

ESTRUTURA DO RELATÓRIO Ø O Estado da Arte: marco legal e regulatório vigente, o processo de regulamentação e experiências internacionais; Ø Diagnóstico da Cadeia Farmacêutica sobre o modelo atual: perspectiva de entidades representativas da Indústria Farmacêutica e perspectiva de entidades representativas do atacado e varejo farmacêutico; Ø Proposições Legislativas em tramitação no Senado Federal; Ø Características do Mercado Farmacêutico e dos Agentes relacionados ao SNCM; Ø Discussão sobre a necessidade de ajustes ao modelo; e Ø Alternativas ao modelo: comparação das abordagens existentes.

O ESTADO DA ARTE

MARCO LEGAL Lei Nº 11. 903, de 5 de janeiro de 2009 Ø Cria o SNCM que envolve a produção, comercialização, dispensação e a prescrição médica, odontológica e veterinária; Ø Estabelece o rastreamento da produção e do consumo de medicamentos por meio de tecnologia de captura, armazenamento e transmissão eletrônica de dados; Ø Inclui todo e qualquer medicamento produzido, dispensado ou vendido no território nacional; Ø Atribui ao órgão de vigilância sanitária federal, a competência para coordenar e implantar o Sistema; e Ø Estabelece prazo gradual de 3 anos da data de publicação (jan 2012).

MARCO REGULATÓRIO RDC Nº 54/2013 E IN Nº 06/2014 Ø Estabelece o código de barras 2 D DATAMATRIX e aposição do IUM nas embalagens; Ø Banco de dados com todas as movimentações na cadeia no dententor do registro, a partir de fluxo de informações entre os elos; Ø Prevê a possibilidade de estruturação e manutenção de sistemas entre os participantes da cadeia farmacêutica; Ø Define o prazo de 2 anos para lotes pilotos (dez 2015), e de 3 anos para impantação total (dez 2016).

CONTEXTUALIZAÇÃO HISTÓRICA

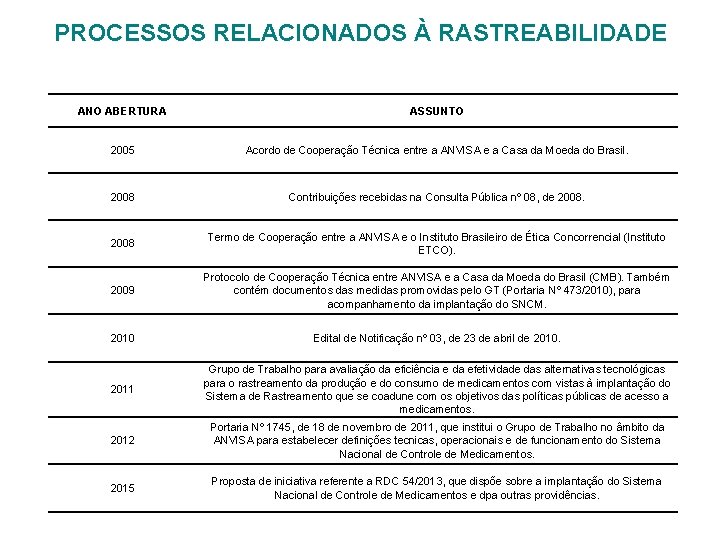
PROCESSOS RELACIONADOS À RASTREABILIDADE ANO ABERTURA ASSUNTO 2005 Acordo de Cooperação Técnica entre a ANVISA e a Casa da Moeda do Brasil. 2008 Contribuições recebidas na Consulta Pública nº 08, de 2008 Termo de Cooperação entre a ANVISA e o Instituto Brasileiro de Ética Concorrencial (Instituto ETCO). 2009 Protocolo de Cooperação Técnica entre ANVISA e a Casa da Moeda do Brasil (CMB). Também contém documentos das medidas promovidas pelo GT (Portaria Nº 473/2010), para acompanhamento da implantação do SNCM. 2010 Edital de Notificação nº 03, de 23 de abril de 2010. 2011 Grupo de Trabalho para avaliação da eficiência e da efetividade das alternativas tecnológicas para o rastreamento da produção e do consumo de medicamentos com vistas à implantação do Sistema de Rastreamento que se coadune com os objetivos das políticas públicas de acesso a medicamentos. 2012 Portaria Nº 1745, de 18 de novembro de 2011, que institui o Grupo de Trabalho no âmbito da ANVISA para estabelecer definições tecnicas, operacionais e de funcionamento do Sistema Nacional de Controle de Medicamentos. 2015 Proposta de iniciativa referente a RDC 54/2013, que dispõe sobre a implantação do Sistema Nacional de Controle de Medicamentos e dpa outras providências.

PROCESSO DE REGULAMENTAÇÃO 2003: GT para a elaboração de proposta (Portaria Nº 364/2003). 2005: Acordo de cooperação ANVISA e CMB aprimorar mecanismos de garantia de autenticidade e rastreabilidade de produtos. 2007: Instituído o Sistema Nacional de Gerenciamento de Produtos Controlados (SNGPC). 2008: CP Nº 08 sobre requisitos mínimos para a regulamentação de solução tecnológica para rastreabilidade e a autenticidade. 2008: DICOL deliberou pela adoção do selo contendo código 2 D para teste em projeto piloto. Acordo de cooperação com o Instituto ETCO para disponibilização de dados e informações técnicas para implantação do Projeto Piloto do Sistema de Rastreabilidade e Autenticidade. 2009 • Lei 11903 cria SNCM. Implantação gradual até 2012 • RDC 59 Etiquetas com códico 2 D, IUM 2010 • Portaria 473 GT Acompanhar implantação SNCM • IN 01 Etiquetas e leitores CMB, padrão serialização GS 1 • IN 08 Altera prazos IN 01 • IN 11 Altera prazos e inclui NFe • Edital Notificação 3 Coleta dados carac. linhas embalagens 2011 • Resol. CMED 2 Recomenda avaliação alternativas • Portarias 225 e 535 GT avaliação alternativas • Portaria 1745 GT definições tecnicas e operacionais 2012 • Não há registro de atos 2013 • CP 10 Nova proposta de RDC • A. Pública 2 Subsidios sobre a proposta de RDC • RDC 54 Aposição código 2 D, IUM, registro movim. bancos de dados, interface sistemas detentoras registro e ANVISA 2014 • A. Pública 05 Proposta Comitê Gestor • Portarias 176 e 177 Comitê Gestor para implant. SNCM • IN 6 especificações técnicas interface 2015 • Proposição nova IN Notação de consultas aos eventos

EXPERIÊNCIAS INTERNACIONAIS

EXPERIÊNCIAS INTERNACIONAIS Ø Estados Unidos da América (Drug Quality and Security Act, de 27/11/2013): inclusão do identificador único no formato de código bidimensional até 2017 e implantação do sistema eletrônico de captura, armazenamento, gerenciamento e transmissão de informações até novembro de 2023; Ø União Europeia (Directive 2011/62/EU, de 08/06/2011): delega aos Estados Membros a definição do modelo de implantação da rastreabilidade e estabelece a utilização de análise de risco para definição de inclusão ou exclusão de produtos (não se aplica a medicamentos isentos de prescrição); Ø França (sistema de codificação e de embalagens de 2007): Estabelece que todos os medicamentos, armazenados e distribuídos apresentem em sua embalagem um código 2 D do tipo DATAMATRIX (padrão GS 1). Cada transação deve ser registrada e armazenada por 5 anos.

EXPERIÊNCIAS INTERNACIONAIS Ø Argentina: Utilização do padrão GS 1, os participantes da cadeia informam diretamente à ANMAT, em tempo real, os códigos relacionados a produtos movimentados. O prazo estabelecido foi de 6 meses do detentor do registro para o distribuidor e mais 6 meses do distribuidor à farmácia. Inicialmente com uma lista de 80 medicamentos de alto custo e atualmente já possui pouco mais de 300. Ø Turquia: Aposição do código de barras 2 D no padrão DATAMATRIX (composto por GTIN, número de série, data de validade e o número do lote) em todos os medicamentos comercializados no país (exceto isentos de prescrição, radiofármacos, os soros e manipulados). Banco de dados Centralizado no Governo.

DIAGNÓSTICO DA CADEIA

DIAGNÓSTICO DA CADEIA Ø Foram realizadas reuniões com as principais associações representativas dos agentes regulados e afetados pela norma e oportunizada a entrega de documentos com percepções, avaliações, e proposições ao modelo atual: Da indústria farmacêutica: Interfarma, Pro Genéricos, ALANAC, SINDUSFARMA, Grupo Farma Brasil, SINDIFARGO. Das associações representativas do atacado e do varejo farmacêutico: ABRADILAN, ABRAFARMA, e ABAFARMA; Ø Unanimidade de entendimento quanto a importância e necessidade de implantação do SNCM; Ø Existem agentes que afirmam estar de acordo com o modelo estabelecido e já possuir condições para atendimento das determinações estabelecidas para rastreabilidade (Interfarma); e Ø Existem agentes que apresentam questionamentos relacionados ao modelo atual (demais entidades).

DIAGNÓSTICO DA CADEIA Observou-se certa convergência entre os apontamentos apresentados pelos setores do varejo, do atacado farmacêutico e por grande parte dos detentores de registro: QUESTÕES APONTADAS PRINCIPAIS ALEGAÇÕES Necessidade de centralização de informações no detentor do registro a partir de fluxo de dados entre os elos da cadeia Ausência de escalonamento na implantação Prazos estabelecidos considerados inexequíveis Atribuição de responsabilidade ao detentor do registro por atos que não estão dentro de sua governabilidade; Expõe informações comercialmente sensíveis; Potencial prejuízo às relações comerciais e ao bem estar-social; Nas experiências internacionais, cada elo envia os dados diretamente para o agente regulador. PROPOSTAS Encaminhamento de informações de forma independente pelos entes da cadeia para um repositório central de dados: sugestão de posse e gestão governamental, ou de criação de um sistema nacional efetuado por empresa privada. Todas as etapas de desenvolvimento devem ser realizadas desde o inicio em todos os elos da cadeia Operação de abastecimento de medicamentos é complexa e desigual; Necessidade de implantação para todos os medicamentos comercializados ao mesmo tempo; Experiencias internacionais prevêem modelos escalonados. Implantação gradual por fases: serialização, sincronização de dados, rastreabilidade completa. Também foi sugerida a inclusão gradativa de medicamentos ao rol de produtos sujeitos ao SNCM. Estabelecimento de prazo de 2 anos para implantação da rastreabilidade de todos os medicamentos comercializados no país; Necessidade de maior prazo para desenvolvimento dos sistemas e soluções informatizadas; Um dos modelos mais complexos e um dos prazos de implantação mais curtos do mundo; Existência de projeto de Lei em tramitação para extenção dos prazos. Ampliação e redefinição dos prazos por fase de implantação: prazos sugeridos variam de 6 a 9 anos para implantação completa.

PROPOSIÇÕES LEGISLATIVAS EM TRAMITAÇÃO

PROPOSIÇÕES LEGISLATIVAS NO SENADO Ø Consta em tramitação no Senado Federal o Projeto de Lei do Senado Nº 276/2015: • • • Relatoria Senador Humberto Costa; Proposta de alteração da Lei Nº 11. 903/2009; Aumentar os prazos de implantação do SNCM (gradual 10 anos); Outras alterações; Em tramitação na Comissão de Meio Ambiente, Defesa do Consumidor e Fiscalização e Controle (CMA). Ø Consta em tramitação no Senado Federal o Prejeto de Decreto Legislativo Nº 269/2015: • Autoria do Senador Valdir Raupp; • Sustação de ato do Poder Executivo (RDC Nº 54/2013 e IN Nº 06/ 2014); • Extrapolou seu poder regulamentar ao criar obrigação para o detentor do registro de manter banco de dados com informações dos outros elos; • Aguardando relator na Comissão de Constituição, Justiça e Cidadania.

PONDERAÇÕES A RESPEITO DO MERCADO FARMACÊUTICO

CARACTERÍSTICAS DO MERCADO Ø O mercado farmacêutico apresenta características específicas que impedem a alocação eficiente de recursos e levam à concorrência imperfeita (desvios de eficiência); Ø Nesse mercado, os requisitos da competição não podem vigorar em função dos “desvios de eficiência”; e Ø As razões para os desvios de eficiência são tratadas por muitos autores como “falhas de mercado”, sendo as mais citadas: • • • Essencialidade do produto (demanda inelástica), Concentração de mercado (oligopólio diferenciado), Presença do consumidor substituto, Assimetria de informação, Riscos e incertezas, e Existência de barreiras à entrada

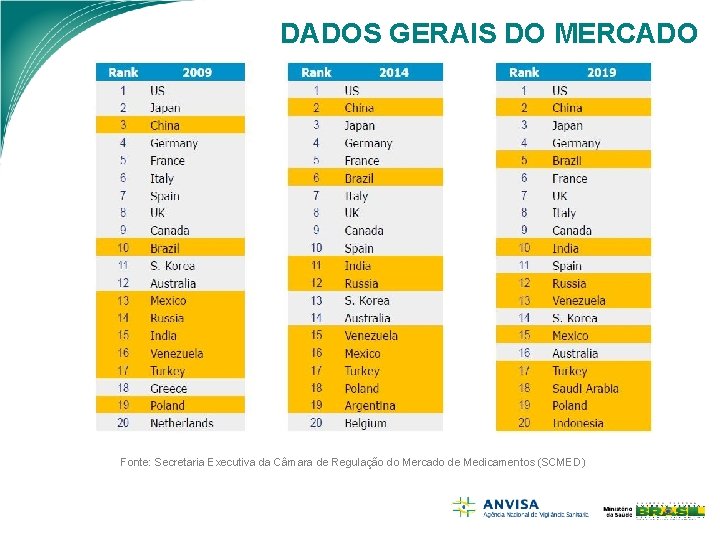
DADOS GERAIS DO MERCADO Fonte: Secretaria Executiva da Câmara de Regulação do Mercado de Medicamentos (SCMED)

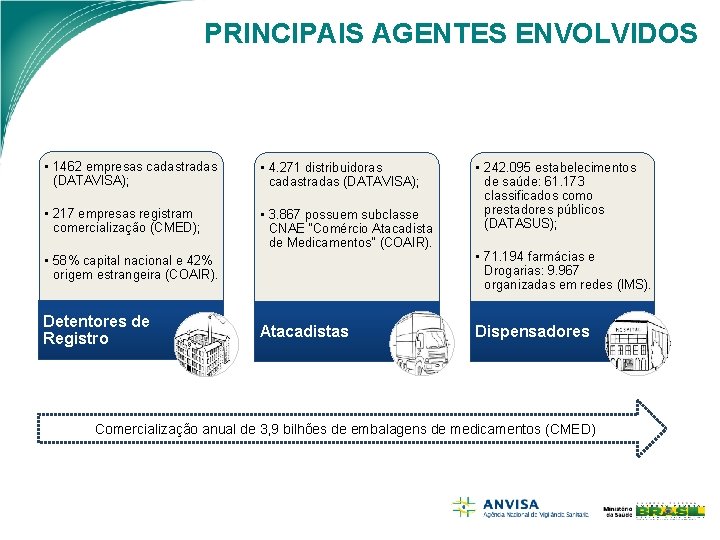
PRINCIPAIS AGENTES ENVOLVIDOS DETENTORES DE REGISTRO Ø • • • Dados recentes do DATAVISA: 438 empresas cadastradas na ANVISA com AFE para produzir; 1311 empresas com AFE para importar e 1462 empresas com AFE para produzir ou importar. Ø • • Dados da CMED: 217 empresas comercializaram medicamentos em 2014 6 mil produtos; 13 mil tipos de apresentações; 3, 9 bilhões de embalagens de medicamentos e Faturamento de 49, 2 bilhões de reais. Ø Estudo COAIR: 58% empresas de capital nacional e 42% de origem estrangeira. • Empresas nacionais detém 87% mercado de genéricos; • Empresas estrangeiras detém 67% do mercado de medicamentos similares e de referência.

PRINCIPAIS AGENTES ENVOLVIDOS ATACADISTAS (DISTRIBUIDORES) Ø Dados recentes do DATAVISA: 4. 271 empresas cadastradas na ANVISA com AFE para distribuir medicamentos. Ø Dados COAIR: 3. 867 empresas cadastradas no DATAVISA possuem Classificação Nacional da Atividade Econômica correspondente à descrição “Comércio Atacadista de Medicamentos e Drogas de Uso Humano” (subclasse CNAE nº 4644 -3/01). Ø Publicação da Pricewaterhouse. Coopers (Pw. C): a distribuição é marcada pela elevada concentração nas mãos de poucos grupos regionais e nacionais. • 65 a 75% da distribuição dos medicamentos é feita por distribuidores locais; e • 25 a 35% dos produtos são diretamente entregues ao varejo.

PRINCIPAIS AGENTES ENVOLVIDOS DISPENSADORES Ø • • Dados do IMS: 71. 194 farmácias privadas 9. 967 são organizadas em redes, Farmácias de rede têm maior predominância em regiões de renda alta e média, Farmácias independentes têm maior predominância nas regiões de baixa renda, Faturamento das farmácias independentes é aproximadamente 10 vezes menor que o das farmácias de rede. Ø Dados ABRAFARMA: as 5. 670 farmácias de rede associadas realizaram, em 2014, mais de 800 milhões de atendimentos. • Atuam em apenas 10% dos municípios brasileiros. Ø Estatísticas do DATASUS: 278. 402 estabelecimentos de saúde, privados e públicos (nas esferas federal, estadual e municipal) • 242. 095 são estabelecimentos potencialmente dispensadores de medicamentos. • Destes, 61. 173 são classificados como prestadores públicos.

PRINCIPAIS AGENTES ENVOLVIDOS • 1462 empresas cadastradas (DATAVISA); • 4. 271 distribuidoras cadastradas (DATAVISA); • 217 empresas registram comercialização (CMED); • 3. 867 possuem subclasse CNAE "Comércio Atacadista de Medicamentos" (COAIR). • 58% capital nacional e 42% origem estrangeira (COAIR). Detentores de Registro Atacadistas • 242. 095 estabelecimentos de saúde: 61. 173 classificados como prestadores públicos (DATASUS); • 71. 194 farmácias e Drogarias: 9. 967 organizadas em redes (IMS). Dispensadores Comercialização anual de 3, 9 bilhões de embalagens de medicamentos (CMED)

PONDERAÇÕES A RESPEITO DO MODELO ESTABELECIDO

CENTRALIZAÇÃO DE INFORMAÇÕES NO DETENTOR DO REGISTRO Ø Ponto mais relevante a respeito dos questionamentos ao modelo atual Ø O modelo implica atribuição de responsabilidade aos detentores de registro por atos que não estão dentro da sua total governabilidade; Ø Existe forte resistência dos atacadistas e varejistas em fornecer ao detentor do registro as informações a respeito das movimentações; Ø Antecipação de tutela ação impetrada pela ABRAFARMA; Ø Em diversos momentos do processo de regulamentação observaram-se manifestações nesse sentido (GTs instituídos, CP, Audiência Pública, Procuradoria, Comitê Gestor); e Ø Nenhum país prevê a existência de Banco de Dados de informações consolidadas não governamental.

CENTRALIZAÇÃO DE INFORMAÇÕES NO DETENTOR DO REGISTRO Questões concorrenciais (relações horizontais) Ø Em um mercado oligopolista as empresas são interdependentes e quanto menor a rivalidade e maior a colaboração entre as empresas, maior será a probabilidade das empresas adotarem práticas colusivas e condutas anticompetitivas; Ø O sucesso do acordo está vinculado à capacidade de promover seu cumprimento (mecanismos que permitam o monitoramento, a identificação de desvio de conduta e a punição); Ø A troca de informações entre as empresas pode favorecer a identificação de entendimentos para acordos, facilitar o monitoramento dos termos dos acordos e instrumentar a aplicação de punição de desvios. Ø A disponibilização de informações aos agentes econômicos tem o potencial de oportunizar comportamento colaborativo, criando incentivos adicionais à formação e à estabilidade de conluio;

CENTRALIZAÇÃO DE INFORMAÇÕES NO DETENTOR DO REGISTRO Questões concorrenciais (relações horizontais) Ø A permissão de que os sistemas informatizados sejam estruturados e mantidos mediante mecanismo estabelecido entre os prestadores de serviço, pode abrir a possibilidade para que um único agente privado, mantido pelas empresas da cadeia, centralize as informações de todo o mercado. Ø A respeito da troca de informações no âmbito de associações, o CADE entende que: “Informações recentes e desagregadas relativas a preço, condições de venda e identificação de clientes são informações comercialmente sensíveis que não podem ser trocadas entre concorrentes sob pena de se lesar a concorrência. Se a associação consolidar os dados do setor anualmente, é importante que os dados sejam recebidos por agente independente, que não seja funcionário de qualquer dos associados, de modo a garantir a confidencialidade das informações desagregadas. ” Ø Não se pode afastar a possibilidade de que a centralização em um único agente privado de informações, que possuem tamanha proporção e de um dos maiores mercados mundiais de produtos farmacêuticos, tenha o potencial de ocasionar situações indesejáveis com repercussão internacional, como a adoção de práticas anticompetitivas de âmbito global.

CENTRALIZAÇÃO DE INFORMAÇÕES NO DETENTOR DO REGISTRO Questões concorrenciais (relações verticais) Ø Condutas verticais anticompetitivas também podem ser oportunizadas à partir da disponibilização de informação aos agentes econômicos; Ø A importância do universo de dados: aquele que vê o todo pode perceber tendências que os agentes que só vêem partes não conseguiriam perceber (vantagem estratégica); Ø Práticas que envolvem restrições impostas por fornecedores a seus clientes, como, por exemplo, acordo de exclusividade, recusa a contratar, e discriminação de preços; Ø Podem aumentar o poder de mercado ao produzir efeitos como o aumento de custos para empresas concorrentes e o aumento de barreiras à entrada.

CENTRALIZAÇÃO DE INFORMAÇÕES NO DETENTOR DO REGISTRO A questão mais crítica está ligada à exposição do SUS: Ø O SUS é o maior comprador e dispensador de medicamentos do país; Ø Ainda possui desafios significativos na aquisição, especialmente nas esferas estaduais e municipais (considerando o amplo poder de mercado dos agentes privados envolvidos no fornecimento de medicamentos); Ø De posse de informações a respeito dos estoques públicos de medicamentos, os fornecedores poderão ter incentivos à adoção de condutas anticompetitivas que podem levar, por exemplo, a restrições que afetem os preços e as quantidades ofertadas ao SUS; Ø A obrigatoriedade de fornecimento de informações aos distribuidores e aos detentores de registro expõe o SUS ao agravamento das dificuldades relacionadas à compra pública de medicamentos e à ampliação dos desafios para a assistência farmacêutica no país.

CENTRALIZAÇÃO DE INFORMAÇÕES NO DETENTOR DO REGISTRO Em síntese, pode-se considerar que tanto os detentores do registro como os distribuidores, de posse de informações sensíveis e já portadores de certo poder de mercado, poderão (em tese) se valerem de práticas anticompetitivas em detrimento de consumidores privados e públicos.

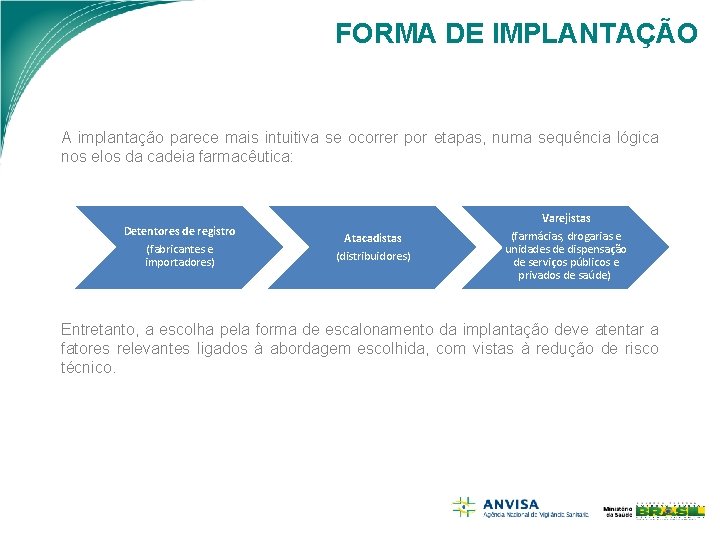
FORMA DE IMPLANTAÇÃO A implantação parece mais intuitiva se ocorrer por etapas, numa sequência lógica nos elos da cadeia farmacêutica: Detentores de registro (fabricantes e importadores) Atacadistas (distribuidores) Varejistas (farmácias, drogarias e unidades de dispensação de serviços públicos e privados de saúde). Entretanto, a escolha pela forma de escalonamento da implantação deve atentar a fatores relevantes ligados à abordagem escolhida, com vistas à redução de risco técnico.

PRAZO IMPLANTAÇÃO Ø O prazo estabelecido na Lei já se encontra expirado (jan 2012); Ø Proposta de alteração à Lei para aumentar os prazos de implantação do SNCM (PLS nº 276/2015); e Ø Detentores de registro foram os primeiros com obrigações assumidas e já possuem os parâmetros necessários à implantação da serialização (etapa que não tem sido questionada quanto ao mérito e que dificilmente sofrerá modificações relevantes em caso de mudança do modelo).

IDENTIFICAÇÃO DO CONSUMIDOR A Lei inclui o consumidor/paciente como parte integrante do SNCM; A norma vigente aplica-se até o consumidor final apenas classes de medicamentos sujeitas ao SNGPC; Não há registro da saída do medicamento da unidade dispensadora: o modelo capta a movimentação da saída no detentor do registro até a entrada no dispensador; Os modelos de outros países conferem todas as etapas da cadeia farmacêutica (da produção/importação até o consumidor); A Procuradoria se manifestou pela necessidade de motivação expressa e clara para a não identificação do consumidor final em todos os casos, mas, não consta do processo esclarecimentos à esse respeito; A identificação do consumidor final implica em aumentar ainda mais a complexidade de implementação da rastreabilidade, mas é essencial para atuação sanitária nos casos de risco à saúde; e Faz-se necessário, pelo menos, que o modelo atual seja capaz de detectar que a unidade do medicamento foi dispensada ao consumidor, mesmo que ainda não seja possível sua identificação.

APOSIÇÃO DO CÓDIGO EM TERRITÓRIO NACIONAL Ø Existe uma proposta de iniciativa para alteração da RDC 54/2013 para incluir a permissão para aposição do código 2 D DATAMATRIX em território nacional nas embalagens secundárias de medicamentos importados; Ø Contemplaria situações de restrição, de carácter operacional e econômico, na implantação dos requisitos normativos nacionais para rastreamento do medicamento em fabricante no exterior que exportem produtos para o Brasil.

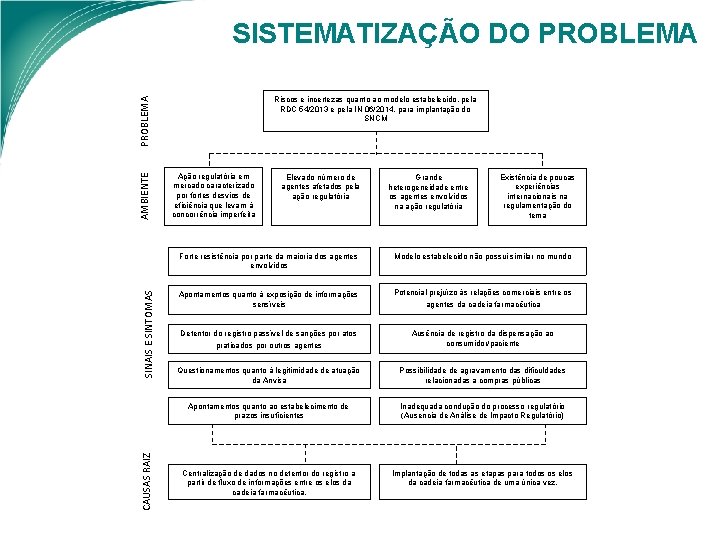
SISTEMATIZAÇÃO DO PROBLEMA AMBIENTE PROBLEMA Riscos e incertezas quanto ao modelo estabelecido, pela RDC 54/2013 e pela IN 06/2014, para implantação do SNCM Ação regulatória em mercado caracterizado por fortes desvios de eficiência que levam à concorrência imperfeita Elevado número de agentes afetados pela ação regulatória Grande heterogeneidade entre os agentes envolvidos na ação regulatória CAUSAS RAIZ SINAIS E SINTOMAS Forte resistência por parte da maioria dos agentes envolvidos Existência de poucas experiências internacionais na regulamentação do tema Modelo estabelecido não possui similar no mundo Apontamentos quanto à exposição de informações sensíveis Potencial prejuízo às relações comerciais entre os Detentor do registro passível de sanções por atos Ausência de registro da dispensação ao consumidor/paciente praticados por outros agentes da cadeia farmacêutica Questionamentos quanto à legitimidade de atuação da Anvisa Possibilidade de agravamento das dificuldades relacionadas a compras públicas Apontamentos quanto ao estabelecimento de prazos insuficientes Inadequada condução do processo regulatório (Ausencia de Análise de Impacto Regulatório) Centralização de dados no detentor do registro a partir de fluxo de informações entre os elos da cadeia farmacêutica. Implantação de todas as etapas para todos os elos da cadeia farmacêutica de uma única vez.

CONVENIÊNCIA E OPORTUNIDADE DE AJUSTES AO MODELO Fortes indícios de que o modelo pode impactar de forma negativa na relação entre os agentes da cadeia, com possibilidade de reflexos prejudiciais ao SUS e ao consumidor final. Pode-se considerar que o problema quanto às incertezas em relação ao modelo vem assumindo relevância pública e, portanto, deve ser objeto de ação da Anvisa. Ø Na eminência de findar o prazo para a disponibilização dos lotes pilotos, o modelo continua a receber consideráveis questionamentos quanto a sua estrutura; Ø Tendo em vista a natureza dos apontamentos e o grande número de agentes envolvidos, resta claro que não se tratada de uma resistência comum à intervenção regulatória; Ø As características do problema são significativas o suficiente para diferenciá-lo de outros problemas mais gerais; e Ø O problema tem desencadeado ações relacionadas à legitimidade de atuação da Agência. Mais uma alteração na regulamentação para implantação do SNCM sacrifica a estabilidade regulatória (que é essencial para viabilizar a atuação futura dos agentes regulados). Contudo, as possibilidade de impactos negativos do modelo atual se sobressaem quando ponderados em relação aos da instabilidade regulatória, deixando evidente a necessidade de agir.

ALTERNATIVAS AO MODELO

ALTERNATIVAS AO MODELO Com vistas a trazer elementos ao processo de tomada de decisão para resolução do problema foram mapeadas as alternativas possíveis ao redesenho do modelo de rastreabilidade. De acordo com pesquisa realizada pela área de Tecnologia da Informação da ANVISA, existem quatro abordagens de armazenamento e recuperação de dados de eventos de rastreabilidade: Ø Ø Centralizada, Semicentralizada, Distribuida e Epedigree

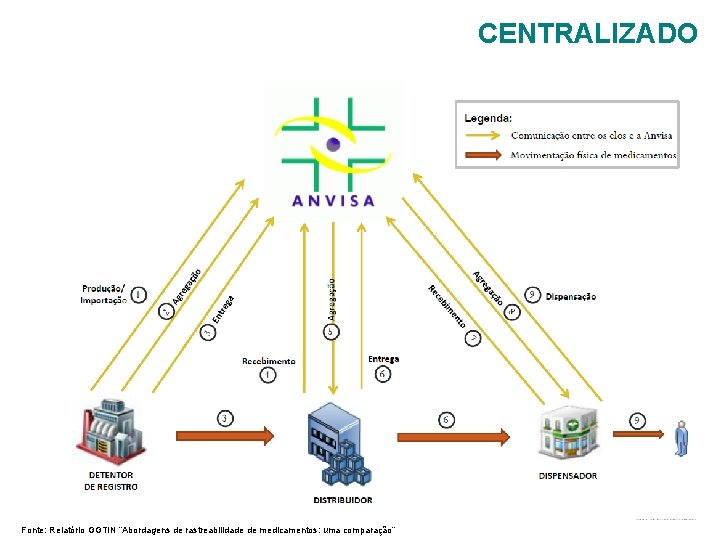
CENTRALIZADO Fonte: Relatório GGTIN “Abordagens de rastreabilidade de medicamentos: uma comparação”

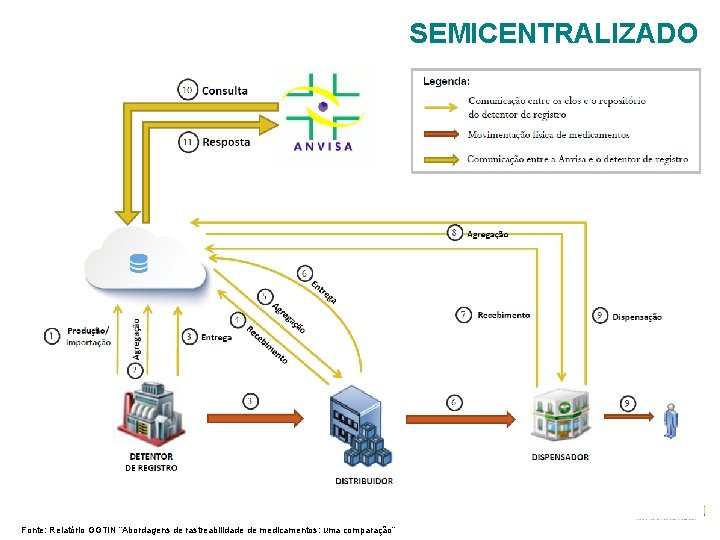
SEMICENTRALIZADO Fonte: Relatório GGTIN “Abordagens de rastreabilidade de medicamentos: uma comparação”

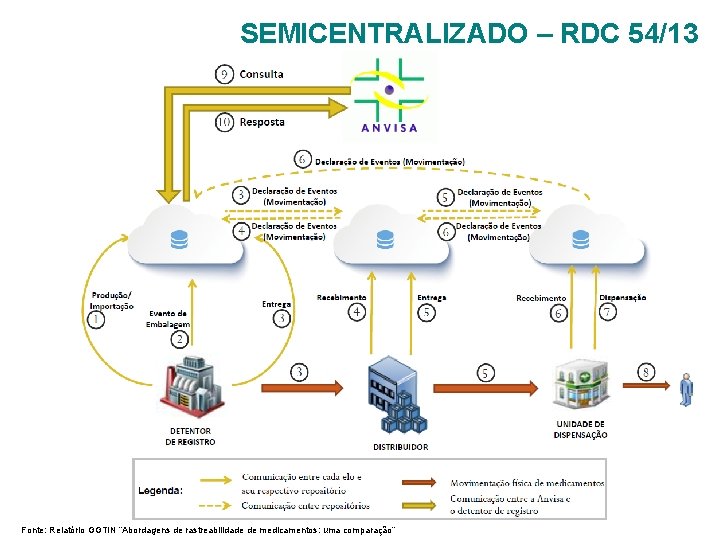
SEMICENTRALIZADO – RDC 54/13 Fonte: Relatório GGTIN “Abordagens de rastreabilidade de medicamentos: uma comparação”

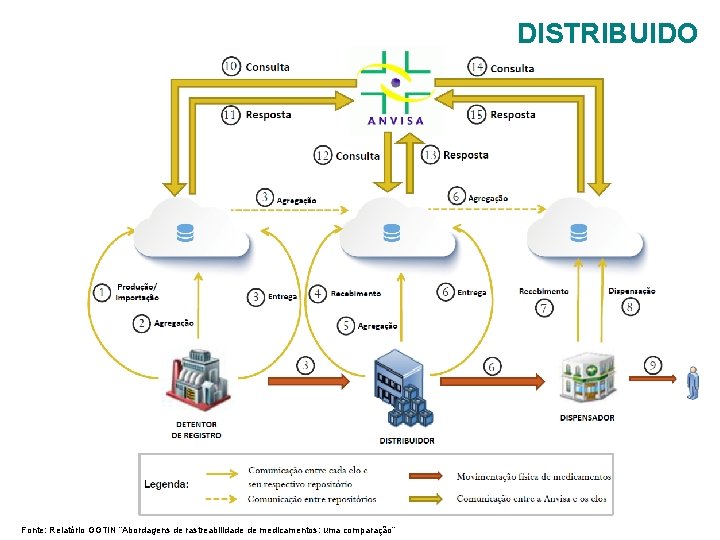
DISTRIBUIDO Fonte: Relatório GGTIN “Abordagens de rastreabilidade de medicamentos: uma comparação”

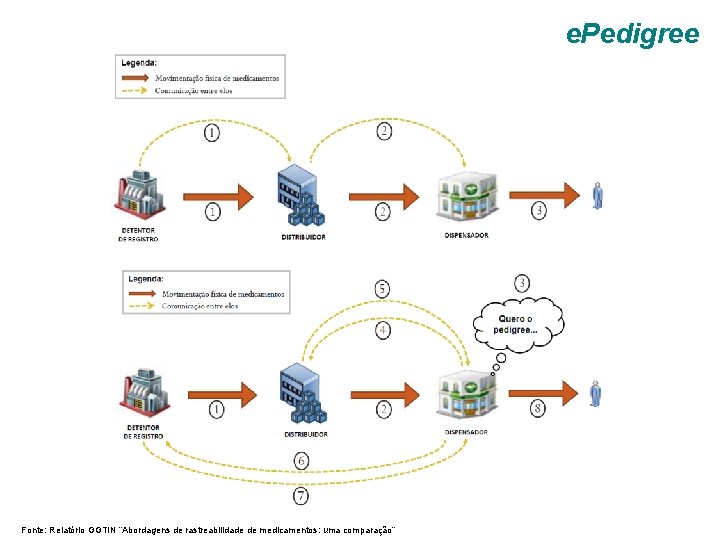
e. Pedigree Fonte: Relatório GGTIN “Abordagens de rastreabilidade de medicamentos: uma comparação”

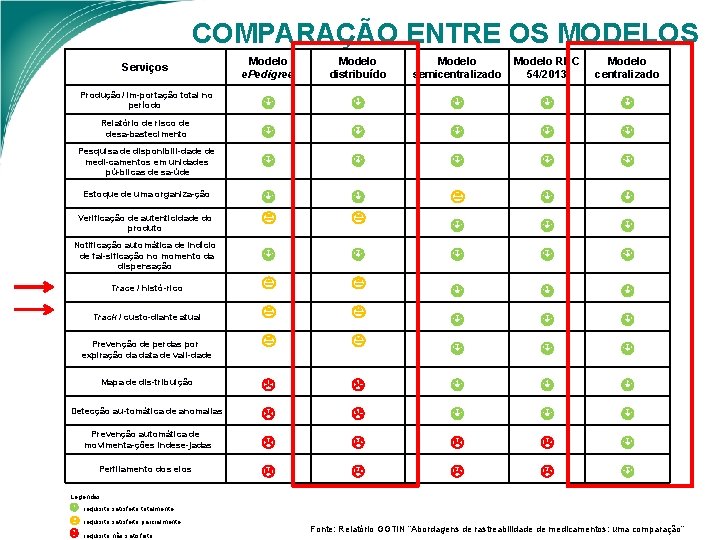
COMPARAÇÃO ENTRE OS MODELOS Modelo e. Pedigree Modelo distribuído Modelo semicentralizado Modelo RDC 54/2013 Modelo centralizado Produção/ im portação total no período Relatório de risco de desa bastecimento Pesquisa de disponibili dade de medi camentos em unidades pú blicas de sa úde Trace / histó rico Track / custo diante atual Mapa de dis tribuição Detecção au tomática de anomalias Prevenção automática de movimenta ções indese jadas Serviços Estoque de uma organiza ção Verificação de autenticidade do produto Notificação automática de indício de fal sificação no momento da dispensação Prevenção de perdas por expiração da data de vali dade Perfilamento dos elos Legendas: : requisito satisfeito totalmente : requisito satisfeito parcialmente : requisito não satisfeito Fonte: Relatório GGTIN “Abordagens de rastreabilidade de medicamentos: uma comparação”

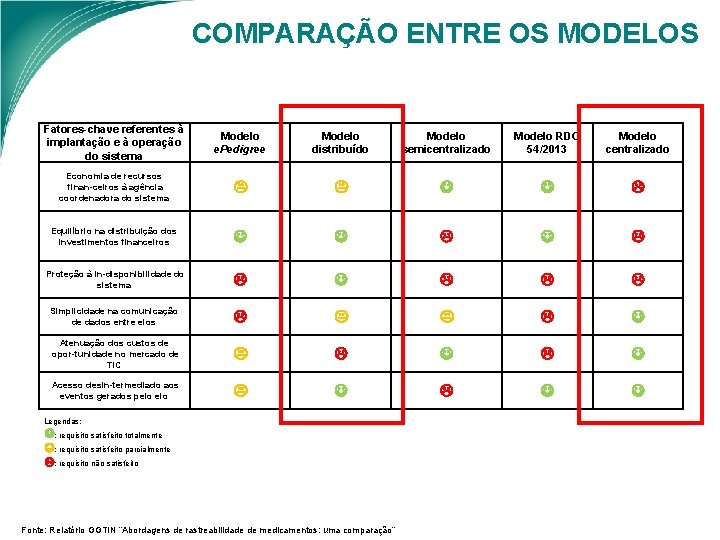
COMPARAÇÃO ENTRE OS MODELOS Fatores chave referentes à implantação e à operação do sistema Modelo e. Pedigree Modelo distribuído Modelo semicentralizado Modelo RDC 54/2013 Modelo centralizado Economia de recursos finan ceiros à agência coordenadora do sistema Equilíbrio na distribuição dos investimentos financeiros Proteção à in disponibilidade do sistema Simplicidade na comunicação de dados entre elos Atenuação dos custos de opor tunidade no mercado de TIC Acesso desin termediado aos eventos gerados pelo Legendas: : requisito satisfeito totalmente : requisito satisfeito parcialmente : requisito não satisfeito Fonte: Relatório GGTIN “Abordagens de rastreabilidade de medicamentos: uma comparação”

COMPARAÇÃO ENTRE OS MODELOS Ø Cada modelo permite uma quantidade e uma variedade de serviços diferentes. As abordagens também possuem diferenças quanto à implantação e operação do sistema; Ø O modelo centralizado é o único que não exige comunicação entre os elos. Ø No modelo distribuído, apesar das informações ficarem armazenadas em repositórios dos próprios declarantes dos eventos, os bancos de dados elos parceiros precisam compartilhar uns com os outros o conteúdo das embalagens de transporte movimentadas; Ø O modelo centralizado é o que permite oferecer à maior quantidade de serviços, e a menor quantidade de comunicações de dados entre os elos da cadeia, contudo, quando se compara outros critérios referentes à implantação e operacionalização, esse modelo pode não ser o mais vantajoso. Ø O que vai determinar a vantagem de cada modelo é a importância relativa a ser atribuída pelos tomadores de decisão a cada critério.

DECISÃO DA DIRETORIA COLEGIADA

REUNIÃO ORDINÁRIA PÚBLICA Nº 19/2015 Ø Não Aprovar a Proposta de Instrução Normativa (notação de consulta aos eventos); Ø Revogar a Instrução Normativa nº 06, de 18 de agosto de 2014 (especificações técnicas de interface); Ø Aprovar Proposta de RDC para suspender a eficácia do Inciso II do Art. 23 da RDC 54/2013; e Ø Aprovar Proposta de Iniciativa para revisão da RDC 54/2013. Regime de tramitação: Comum. Relator sorteado: Ivo Bucaresky.

OBRIGADA! Gabrielle Cunha Barbosa Cavalcanti e Cysne Troncoso Agência Nacional de Vigilância Sanitária - Anvisa SIA Trecho 5 - Área especial 57 - Lote 200 CEP: 71205 -050 Brasília - DF Telefone: 61 3462 6000 www. anvisa. gov. br www. twitter. com/anvisa_oficial Anvisa Atende: 0800 -642 -9782 ouvidoria@anvisa. gov. br Diretoria de Autorização e Registro Sanitários autorizacaoeregistro@anvisa. gov. br
 Tipo de controle
Tipo de controle Controle executivo
Controle executivo Mioglobina e hemoglobina
Mioglobina e hemoglobina Cavidad nasal
Cavidad nasal Ley marco del sistema nacional de gestión ambiental
Ley marco del sistema nacional de gestión ambiental Sistema nacional del registro civil
Sistema nacional del registro civil Banner universidad nacional
Banner universidad nacional Que es el sistema nacional de presupuesto
Que es el sistema nacional de presupuesto Sistema financeiro nacional estrutura
Sistema financeiro nacional estrutura Normas profesionales de auditoría
Normas profesionales de auditoría El sistema educativo mexicano
El sistema educativo mexicano Sistema nacional de contabilidad
Sistema nacional de contabilidad Manual sobre el sistema nacional anticorrupción
Manual sobre el sistema nacional anticorrupción Sistema nacional de control
Sistema nacional de control Estrutura do sfn
Estrutura do sfn Cadastro de clientes do sistema financeiro nacional
Cadastro de clientes do sistema financeiro nacional Sistema nacional de contabilidad
Sistema nacional de contabilidad Sistema financiero nacional
Sistema financiero nacional Sistema nacional para la calidad
Sistema nacional para la calidad Estructura del sistema de salud
Estructura del sistema de salud Como se integra el sistema nacional anticorrupcion
Como se integra el sistema nacional anticorrupcion Estrutura do sistema financeiro nacional
Estrutura do sistema financeiro nacional Integra o sistema financeiro nacional
Integra o sistema financeiro nacional Esquema sistema financeiro nacional
Esquema sistema financeiro nacional Sistema estadistico nacional
Sistema estadistico nacional Organigrama del sistema nacional de seguridad pública
Organigrama del sistema nacional de seguridad pública Sistema nacional de control
Sistema nacional de control Sistema nacional de educación terciaria
Sistema nacional de educación terciaria Dm
Dm Integration terrain non controlé
Integration terrain non controlé Caso controle
Caso controle Objectifs controle de gestion
Objectifs controle de gestion Esspc
Esspc Zonas de puncion
Zonas de puncion Analisis de medicamentos
Analisis de medicamentos Conclusión de medicamentos
Conclusión de medicamentos Sistemas de controle
Sistemas de controle Irbesartran
Irbesartran Eritema multiforme por medicamentos
Eritema multiforme por medicamentos Contrôle financier
Contrôle financier Modalidades de controle de constitucionalidade
Modalidades de controle de constitucionalidade Kor noix de cajou
Kor noix de cajou Reacciones adversas a medicamentos antituberculosos
Reacciones adversas a medicamentos antituberculosos Como tomar los medicamentos para el helicobacter pylori
Como tomar los medicamentos para el helicobacter pylori Biguanidas
Biguanidas Grupo controle importancia
Grupo controle importancia Controle
Controle Diferencia entre adsorcion y absorcion
Diferencia entre adsorcion y absorcion Medicamentos anticoagulantes
Medicamentos anticoagulantes Frequencia natural
Frequencia natural Flowchart controle interne
Flowchart controle interne









































































