COLECCIN UNIDAD FARMACOLOGIA SIMPLIFICADA 5 PRINCIPIOS DE FARMACOLOGIA









































- Slides: 47

“COLECCIÓN” UNIDAD FARMACOLOGIA SIMPLIFICADA 5 PRINCIPIOS DE FARMACOLOGIA BIOFARMACIA Y FARMACOCINETICA: BIODISPONIBILIDAD Y BIOEQUIVALENCIA DE FARMACOS Jorge Luis Maya Benavides Q. F. www. farmacus. com. co

CONTENIDO Unidad 5 5. 1. Definiciones 5. 2. Biodisponibilidad 5. 3. Factores condicionantes de la Biodisponibilidad 5. 4. Cuando se realizan los estudios de Bioequivalencia 5. 5. Fases y requisitos de los estudios de Bioequivalencia 5. 6. Marco regulatorio en Colombia 5. 7. Recomendaciones 5. 8. Los medicamentos Genéricos 5. 8. 1 Garantía de calidad, eficacia y seguridad de los medicamentos genéricos 5. 9. Ventana terapéutica Este tema no constituye en modo alguno un sistema de diagnostico y mucho menos de recomendación terapéutica, por lo tanto no se debe utilizar esta información para auto medicarse, solo es con fines académicos

Unidad 5 BIODISPONIBILIDAD Y BIOEQUIVALENCIA

5. 1. DEFINICIONES (Resolución 1400 agosto 24 de 2001) BIODISPONIBILIDAD: Es la medida de velocidad y de la cantidad que del ingrediente terapéuticamente activo o fármaco contenido en un medicamento, alcanza la circulación general. BIOEQUIVALENCIA: Dos productos farmacéuticos son equivalentes si ellos son farmacéuticamente equivalentes y su Biodisponibilidad luego de su administración en la misma dosis molar son similares en tal grado que puede esperarse que sus efectos sean esencialmente los mismos. Los estudios de Bioequivalencia son estudios de Biodisponibilidad comparativa entre dos o mas medicamentos, del mismo fármaco y evaluados bajo el mismo diseño experimental. Los estudios de Bioequivalencia se utilizan como herramienta para demostrar que un medicamento genérico tiene la misma eficacia terapéutica que el medicamento innovador de referencia. “En la practica los estudios de Bioequivalencia son el método mas apropiado para demostrar la equivalencia terapéutica entre dos medicamentos y en la actualidad es la vara de medida para la autorización de los medicamentos genéricos en numerosos países, si se demuestra la Bioequivalencia, entonces existe la posibilidad de la intercambiabilidad” ¿Que tan similares deben ser? . . . Es arbitrario pero por consenso se acepta que no difieran en mas del 20%. (Abad Santos, F; Martínez Sancho, E; Gálvez Múgica, M A: Estudios de bioequivalencia: análisis y aspectos metodológicos. Cap. 4 en El ensayo clínico en España. García, A; Gandía, L. Serie científica. Farmaindustria. Madrid, 2001).


5. 1. DEFINICIONES (Resolución 1400 agosto 24 de 2001) EQUIVALENCIA QUIMICA: Medicamentos que contienen el mismo principio activo o fármaco en la misma sal, ester o derivado químico y son idénticos en potencia o concentración y forma de dosificación. EQUIVALENCIA FARMACEUTICA: Medicamentos que contienen el mismo principio activo o fármaco en la misma sal, ester o derivado químico y son idénticos en potencia o concentración, forma de dosificación y vía de administración. Los medicamentos equivalentes químicos son equivalentes farmacéuticos y como aquellos pueden diferir en su excipiente pero deben cumplir los mismos estándares de potencia, calidad, pureza e identidad, también pueden diferir en características como color, sabor, forma, marcas de configuración, preservantes, empaques, tiempo de vida útil y dentro de ciertos limites, en el etiquetado. Sin embargo, “la equivalencia farmacéutica no necesariamente implica equivalencia terapéutica”: diferencias en los excipientes, en el proceso de elaboración, u otras, pueden determinar disparidades en el comportamiento de los productos (OMS). Ejemplo : Metoclopramida 0, 2% gotas marca A y Metoclopramida 0, 2% gotas marca B. EQUIVALENTES TERAPÉUTICOS: Son medicamentos que contienen el mismo fármaco terapéuticamente activo, producen el mismo efecto terapéutico y presentan la misma potencialidad de efectos adversos. Los medicamentos equivalentes terapéuticos pueden diferir en ciertas características tales como color, marcado, sabor, configuración, agentes de preservación, empaque y fecha de expiración. Los medicamentos Equivalentes terapéuticos deben ser productos (1) Seguros y Efectivos, (2) Bioequivalentes, (3) adecuadamente etiquetados y (4) manufacturados en cumplimiento con las buenas Prácticas de Manufactura Vigentes. Ejemplo: Lansoprazol 30 mg/día = Pantoprazol 40 mg/día = Rabeprazol 20 mg/día

5. 1. DEFINICIONES (Resolución 1400 agosto 24 de 2001) ALTERNATIVA FARMACÉUTICA Medicamentos que contienen la misma sustancia o principio terapéuticamente activo, pero en forma de diferente derivado (sal, éster o complejos) o diferentes formas de dosificación y potencia o concentración dentro de una línea de producto de un mismo fabricante, son alternativas farmacéuticas poseyendo la misma vía de administración, la misma indicación Terapéutica y la misma posología. Ejemplo 1: suspensiones de palmitato de cloranfenicol y suspensión de estearato de cloranfenicol Ejemplo 2: cápsulas de 250 mg de ampicilina con cápsulas de 500 mg de ampicilina. Ejemplo 3: Amoxicilina 500 mg cápsulas y Amoxicilina 500 mg / 5 ml suspensión. Ejemplo 4: Diclofenaco sódico 75 mg comprimidos y Diclofenaco potásico 50 mg comprimidos ALTERNATIVA TERAPÉUTICA Medicamentos que contienen diferentes principios activos que son indicados para el mismo objetivo terapéutico o clínico. En las alternativas terapéuticas, los componentes o principios activos o fármacos pertenecen a la misma clase farmacológica, comparten la misma indicación y se espera que tengan el mismo efecto terapéutico cuando se administran a los pacientes en la condición indicada para su empleo. Se espera que los efectos terapéuticos sean similares cuando se administren en dosis terapéuticas equivalentes. Ejemplo 1: Ketorolac 10 mg comprimidos y Diclofenaco 50 mg comprimidos. Ejemplo 2: Pantoprazol 20 mg cápsulas y Omeprazol 10 mg comprimidos .

5. 2 BIODISPONIBILIDAD Las formas farmacéuticas solidas deben liberar su principio activo en el organismo de modo que éste pueda ser absorbido en óptimas condiciones y llegar, por este mecanismo, al sitio de acción. Se ha demostrado que las diferencias en formulación y método de manufactura de un Medicamento, inciden en la variabilidad de la respuesta alcanzada con el mismo, medida esta variabilidad en términos del inicio, la duración y la intensidad de la respuesta obtenida. De este modo, una inyección intravenosa no involucra proceso de absorción y la dosis administrada llega en forma casi instantánea y completa(100%) a la circulación sistémica. Por este motivo, la inyección intravenosa se emplea corrientemente como punto de referencia para evaluar la Biodisponibilidad absoluta de un fármaco en una forma farmacéutica particular.



La distribución, el metabolismo y la eliminación dependen de la naturaleza química del fármaco y de la genética del paciente. Cuando se hace un estudio comparativo estas tres variables son constantes en un mismo paciente. Entonces en un estudio comparativo de dos productos con el mismo principio activo, la diferencia entre estos dos productos sólo va estar dado por diferencias en la absorción y esta depende de la naturaleza química del fármaco y de las características del producto farmacéutico o diferencias en la formulación. Entonces: Las diferencias de absorción, metabolismo, distribución y eliminación entre distintas personas aumentan la variabilidad en la concentración plasmática La concentración plasmática de una droga determina el número de moléculas que llega al receptor y por ende su efecto terapéutico. La concentración plasmática está gobernada por la absorción, distribución, metabolismo y eliminación de la droga. . Zanen, P. Bioequivalence and generics medicines. www. math. umbc. edu/caoli/bioequ. pdf. Acceso 23. 06. 04 Dependen de: Naturaleza de la Formulación Receptor Concentración del Fármaco Efecto


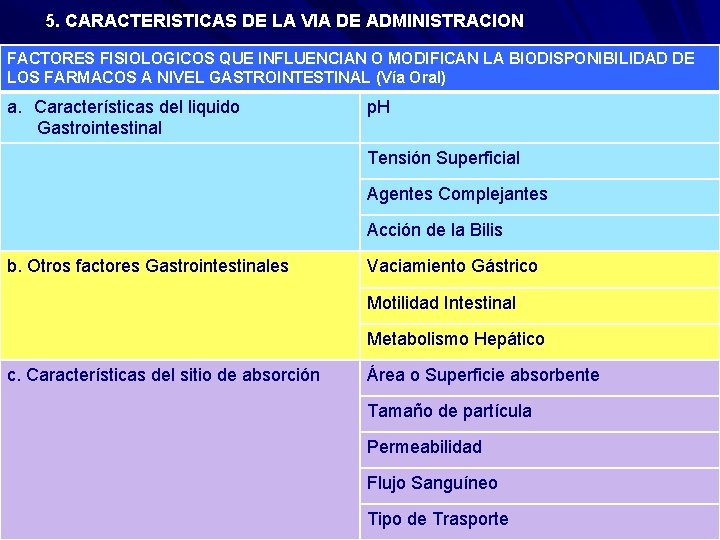
5. CARACTERISTICAS DE LA VIA DE ADMINISTRACION FACTORES FISIOLOGICOS QUE INFLUENCIAN O MODIFICAN LA BIODISPONIBILIDAD DE LOS FARMACOS A NIVEL GASTROINTESTINAL (Vía Oral) a. Características del liquido Gastrointestinal p. H Tensión Superficial Agentes Complejantes Acción de la Bilis b. Otros factores Gastrointestinales Vaciamiento Gástrico Motilidad Intestinal Metabolismo Hepático c. Características del sitio de absorción Área o Superficie absorbente Tamaño de partícula Permeabilidad Flujo Sanguíneo Tipo de Trasporte


(*) POLIMORFISMO FARMACÉUTICO Polimorfismo farmacéutico es la capacidad de los principios activos para adoptar diferentes configuraciones espaciales y que tienen su origen en las condiciones fisicoquímicas especificas en las que se realiza la síntesis en el laboratorio, en tal sentido que Fármacos químicamente idénticos pueden dar compuestos físicamente diferentes y consecuentemente, las características que derivan de su estructura en estado sólido también difieren desde el punto de vista físico, fisicoquímico, tecnológico y farmacológico, a saber: 1. FÍSICO: dureza, densidad, conductividad eléctrica a térmica. 2. FÍSICO QUÍMICO: absorción, estabilidad, punto de fusión. 3. QUÍMICO: reactividad, estabilidad, solubilidad, superficie específica. 4. TECNOLÓGICO: piezoelectricidad, magnetismo, refracción, reflexión y absorción de la luz. 5. FARMACOLÓGICO: Biodisponibilidad, inefectividad, tolerabilidad y toxicidad. Ejemplos de polimorfismo en fármacos. Aspirina, Amoxicilina, Diclofenaco, , Nifedipina

COMPOSICION FARMACEUTICA CUALITATIVA comparación de dos comprimidos antihipertensivos cada comprimido contiene 5 mg de Amlodipino (anexo lista de excipientes) Medicamento “A” Forma Farmacéutica: comprimidos 1. Principio activo: Amlodipino 5 mg 2. Excipientes: Celulosa de magnesio Celulosa microcristalina Cera carnauba Croscaramelosa sódica NF Lactosa monohidrato Hidroxipropilcelulosa Estearato de magnesio Laurilsulfato de sodio Opadry amarillo Medicamento “B” Forma Farmacéutica: comprimidos 1. Principio activo: Amlodipino 5 mg 2. Excipientes: Almidón glicolato sódico Estearato de magnesio Lactosa anhidra Celulosa microcristalina PH 102 Dióxido de silicio Polivinilpirrolidona K 30 Opadry 285 G 28725 Dióxido de titanio Talco PROCESO DE FABRICACION (FARMACOTECNIA) Aunque dos medicamentos tengan los mismos principios activos, en la misma concentración y en la misma forma farmacéutica, por el hecho de cambiar el proceso de fabricación se podría modificar la disolución o la absorción del medicamento (Biodisponibilidad)

COMPOSICION FARMACEUTICA CUALITATIVA comparación de dos comprimidos antihipertensivos cada comprimido contiene 5 mg de Amlodipino Medicamento “A” Forma Farmacéutica: comprimidos 1. Principio activo: Amlodipino 5 mg Medicamento “B” Forma Farmacéutica: comprimidos 1. Principio activo: Amlodipino 5 mg EMPLEO DE DISTINTOS EXCIPIENTES No es obligatorio emplear en un medicamento genérico la misma composición de excipientes que los empleados en el medicamento de referencia. A pesar de ello, conviene tener en cuenta y valorar los excipientes empleados en el medicamento de referencia porque en ocasiones la presencia de un excipiente puede condicionar la cinética del medicamento y ser la causa de la no Bioequivalencia. 1. DOS MEDICAMENTOS, QUÍMICAMENTE EQUIVALENTES (PRINCIPIO ACTIVO Y CONCENTRACIÓN IGUALES), SON BIOEQUIVALENTES, SI TIENEN LA MISMA BIODISPONIBILIDAD 2. EQUIVALENCIA QUIMICA NO NECESARIAMENTE IMPLICA BIOEQUIVALENCIA 3. BIOEQUIVALENCIA NO NECESARIAMENTE IMPLICA EQUIVALENCIA TERAPEUTICA

Medicamentos con problemas potenciales conocidos de Biodisponibildad y de Estabilidad Fuente: Managing Drug Supply (MSH 1997), pag. 273 PROBLEMAS DE BIODISPONIBILIDAD Aminofilina Ampicilina Cabamazepina Cloranfenicol Cloroquina Clorpromazina Dihidroergotamina Eritromicina Furosemida Glibenclamida PROBLEMAS DE BIODISPONIBILIDAD Nitrofurantoina Estrógenos Fenitoina Prednisolona Quinidina Rifampicina Espironolactona Griseofulvina Sulfato Ferroso Levodopa Metrotexato Metildopa PROBLEMAS DE ESTABILIDAD Comprimidos de acido acetil salicílico Comprimidos de amoxicilina Comprimidos de Ampicilina Comprimidos de Penicilina V Comprimidos de Retinol Paracetamol Liquido Suspensión de Penicilina V Inyección de Ergometrina Inyección de Metilergometrina

5. 4. CUANDO SE REALIZAN LOS ESTUDIOS DE BIOEQUIVALENCIA 5. 4. Un estudio de Bioequivalencia compara cómo dos fármacos con el mismo principio activo liberan el mismo a la circulación sistémica. Además, la absorción depende solamente de las características del fármaco y del paciente. Entonces, en realidad el medicamento es sólo responsable de liberar el fármaco en el organismo para que ésta se absorba. Un estudio de bioequivalencia compara cómo dos medicamentos, idénticos desde el punto de vista de su composición y administración, liberan el fármaco y la dejan en disponibilidad de ser absorbida por el organismo. Por lo tanto, si el fármaco en el medicamento esta solubilizada, no tiene sentido realizar estudios de Bioequivalencia. Si el fármaco es muy soluble, no es necesario realizar esta experimentación "in vivo" (en voluntarios sanos), sólo se realizan evaluaciones “in vitro” (en ensayos de laboratorio). Fármaco 1= muy soluble, muy permeable Fármaco 2= poco soluble, poco permeable In-Vitro 1 In-Vitro/ In-Vivo 2

Actualmente no se exige estudios de Bioequivalencia para formas parenterales (inyectables) que se den en solución, porque el fármaco ya ingresa solubilizada al organismo. Es importante aclarar que en un producto liofilizado o un polvo estéril, no es necesario constatar Bioequivalencia porque si bien el fármaco está en estado sólido se debe solubilizar para inyectar al organismo. Tampoco se realizan estudios de Bioequivalencia para productos orales que se administran en solución. Ejemplos de esto pueden ser los jarabes o soluciones, o polvos para reconstituir que una vez reconstituidos, se solubilizan completamente. En el caso de productos de acción local, no se exigen estudios de Bioequivalencia porque la droga para ser efectiva no ingresa a la circulación sistémica, pero si se exigen para los parches transdermicos y supositorios, ya que actúan sistémicamente. Se exigen estudios de Bioequivalencia para formas orales sólidas, por ejemplo comprimidos, cápsulas o suspensiones orales y para los productos orales de liberación sostenida o retardada. También para otras formas farmacéuticas, por ejemplo polvos inhalatorios o aerosoles inhalatorios, donde el fármaco ingresa al organismo en forma sólida y que actúan por absorción sistémica. Si bien en los casos mencionados anteriormente, se exigen estudios de Bioequivalencia teniendo en cuenta las características de solubilidad y permeabilidad del fármaco, en algunas situaciones es suficiente con probar la Bioequivalencia "in vitro".

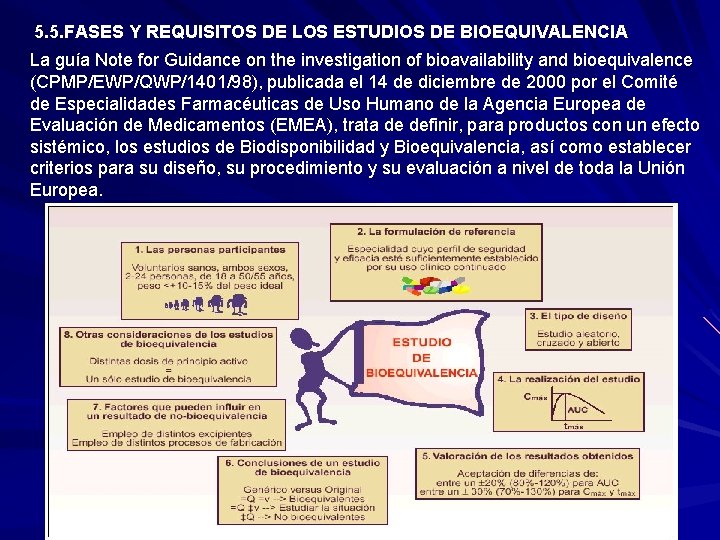
5. 5. FASES Y REQUISITOS DE LOS ESTUDIOS DE BIOEQUIVALENCIA La guía Note for Guidance on the investigation of bioavailability and bioequivalence (CPMP/EWP/QWP/1401/98), publicada el 14 de diciembre de 2000 por el Comité de Especialidades Farmacéuticas de Uso Humano de la Agencia Europea de Evaluación de Medicamentos (EMEA), trata de definir, para productos con un efecto sistémico, los estudios de Biodisponibilidad y Bioequivalencia, así como establecer criterios para su diseño, su procedimiento y su evaluación a nivel de toda la Unión Europea.

5. 5. FASES Y REQUISITOS DE LOS ESTUDIOS DE BIOEQUIVALENCIA 1. PERSONAS PARTICIPANTES Las personas participantes en el estudio de Bioequivalencia se deben escoger cuidadosamente con el fin de minimizar al máximo la variabilidad de los resultados permitiendo a su vez que se puedan detectar diferencias entre los medicamentos que se comparan. El tipo de participantes requeridos para los estudios de Bioequivalencia son voluntarios sanos de ambos sexos, con edades comprendidas entre 18 y 50 55 años, y con un peso que no supere un ± 10 15% del peso ideal para su altura y sexo. Además, se prefiere escoger participantes no fumadores, sin historia previa de alcoholismo ni toma de drogas, factores que podrían interferir en los resultados obtenidos del estudio. También para determinados fármacos es interesante prestar atención a si los participantes son o no personas con un fenotipo/genotipo metabólico característico. En general, suelen ser de 12 a 24 los participantes en el estudio, siempre dependiendo de la variabilidad cinética del fármaco. Estas personas deben firmar específicamente su consentimiento a participar en el estudio y se les asegura la confidencialidad de los datos y la protección con una póliza de seguros por los posibles daños que se les pueda causar

5. 5. FASES Y REQUISITOS DE LOS ESTUDIOS DE BIOEQUIVALENCIA 2. FORMULACIÓN DE REFERENCIA La elección de la formulación de referencia con la que se va a comparar la formulación genérica debe tener un perfil de seguridad establecido por su uso clínico continuado. 3. TIPO DE DISEÑO 3. Aprobación por un Comité Ético de Investigación Clínica (CEIC), además de la autorización del Ministerio de Sanidad. El estudio debe respetar los principios básicos de la Declaración de Helsinki. Cumplir las normas de Buena Práctica Clínica y las normas de Buena Práctica de Laboratorio para asegurar que los datos resultantes del estudio son fiables. El tipo de diseño suele ser aleatorio, cruzado y abierto: Las condiciones en las que se realiza el estudio deben estar debidamente estandarizadas para todas las personas, con el fin de minimizar las variaciones debidas a otros factores distintos de la toma de los medicamentos que se comparan. De este modo, se controla que la administración de los fármacos se realiza en ayunas de por lo menos la noche anterior para alimentos, que el volumen de agua ingerido con el fármaco es el mismo siempre (unos 100 240 ml) y se controlan las condiciones de alimentos, bebida, ejercicio, postura y la no toma de otros medicamentos

5. 5. FASES Y REQUISITOS DE LOS ESTUDIOS DE BIOEQUIVALENCIA 4. REALIZACIÓN DEL ESTUDIO Después de la administración del fármaco, se realizan extracciones de sangre a distintos tiempos (según la semivida de eliminación del fármaco) y se determinan las concentraciones del principio activo en sangre. Durante el estudio se controlarán en todo momento las constantes vitales de las personas y se evaluará la posible aparición de efectos indeseados. La determinación de las concentraciones en sangre permite calcular los parámetros cinéticos de Biodisponibilidad que nos van a permitir determinar la Bioequivalencia entre el fármaco genérico y el de referencia. Se asume que las concentraciones del fármaco en sangre son representativas de las concentraciones del fármaco en el lugar donde ejerce la acción. Los parámetros cinéticos de Biodisponiblidad que se determinan más frecuentemente para evaluar la Bioequivalencia entre dos formulaciones son los siguientes: AUC. Área bajo la curva de las concentraciones del fármaco en sangre respecto al tiempo (parámetro de cantidad). Este parámetro proporciona información acerca de la cantidad total de principio activo que llega al torrente circulatorio. Cmáx. Concentración en sangre máxima alcanzada (parámetro de velocidad). Tmáx. Tiempo en que se alcanza la Cmáx (parámetro de velocidad). La bioequivalencia es, en general, el método más apropiado para constatar la equivalencia terapéutica entre dos medicamentos.

5. 5. FASES Y REQUISITOS DE LOS ESTUDIOS DE BIOEQUIVALENCIA 5. VALORACIÓN DE LOS RESULTADOS OBTENIDOS Se aceptan como Bioequivalentes dos especialidades con la misma composición cualitativa y cuantitativa, cuyas diferencias en los parámetros farmacinéticos exigidos se encuentren: Entre un ± 20% (80 120%) para el parámetro farmacocinético AUC. Entre un ± 30% (70 130%) para los parámetros farmacocinéticos Cmáx y Tmáx. Obviamente, estos rangos no son aceptados para fármacos con un estrecho margen terapéutico en los que estas variaciones porcentuales tendrían una repercusión clínica, ya sea de eficacia o de seguridad.

5. 5. FASES Y REQUISITOS DE LOS ESTUDIOS DE BIOEQUIVALENCIA 6. CONCLUSIONES DE UN ESTUDIO DE BIOEQUIVALENCIA De los resultados obtenidos en un estudio de Bioequivalencia se pueden extraer tres conclusiones: Fármacos genérico y original son iguales en cantidad absorbida y velocidad de absorción. Este resultado implica que la especialidad genérica y la original son bioequivalentes. Fármacos genérico y original son iguales en cantidad absorbida, pero no en velocidad de absorción. Este resultado no implica necesariamente la no Bioequivalencia, pero se tiene que estudiar muy bien la situación dependiendo del fármaco del que se trate. Fármacos genérico y original no son iguales en cantidad. Si el resultado es de infrabiodisponibilidad, eso significa que los fármacos genérico y original son no Bioequivalentes. Si el resultado es de supradisponibilidad, eso implica que genérico y original son no Bioequivalentes. En cualquier caso, la calificación última de los estudios de Bioequivalente o no Bioequivalente de un Genérico con respecto al de referencia para su posterior comercialización en Colombia es ejercido por el Instituto de Vigilancia de Medicamentos y Alimentos (INVIMA)

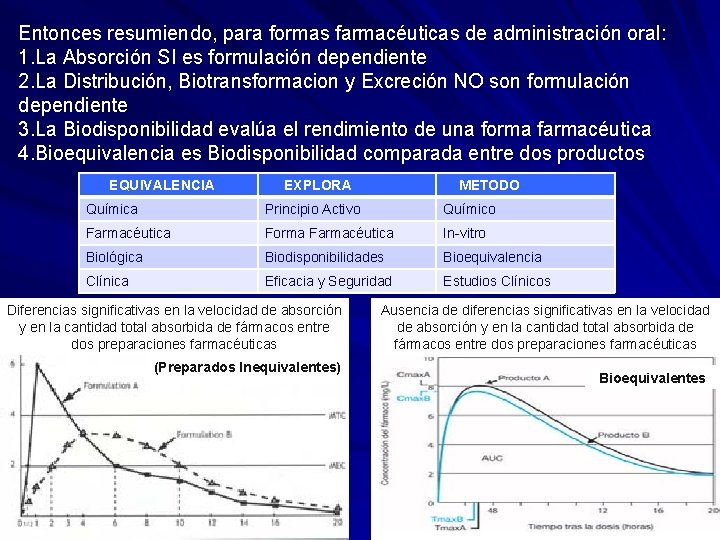
Entonces resumiendo, para formas farmacéuticas de administración oral: Entonces resumiendo, 1. La Absorción SI es formulación dependiente 2. La Distribución, Biotransformacion y Excreción NO son formulación dependiente 3. La Biodisponibilidad evalúa el rendimiento de una forma farmacéutica 4. Bioequivalencia es Biodisponibilidad comparada entre dos productos EQUIVALENCIA EXPLORA METODO Química Principio Activo Químico Farmacéutica Forma Farmacéutica In vitro Biológica Biodisponibilidades Bioequivalencia Clínica Eficacia y Seguridad Estudios Clínicos Diferencias significativas en la velocidad de absorción y en la cantidad total absorbida de fármacos entre dos preparaciones farmacéuticas (Preparados Inequivalentes) Ausencia de diferencias significativas en la velocidad de absorción y en la cantidad total absorbida de fármacos entre dos preparaciones farmacéuticas Bioequivalentes


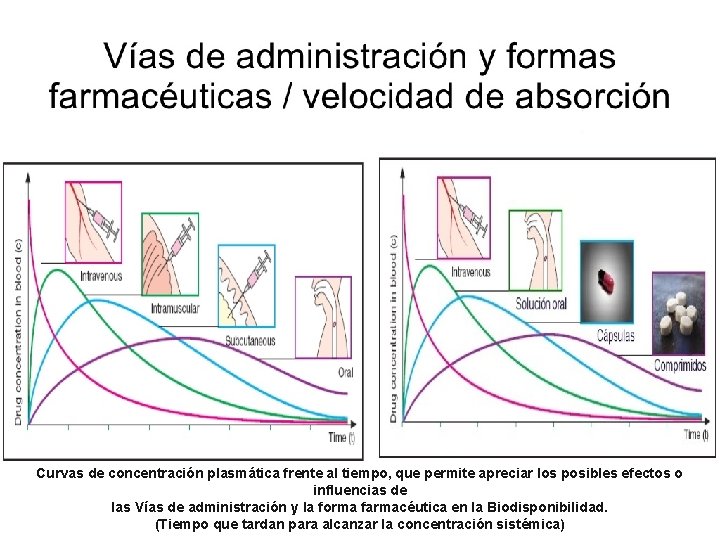
FARMACOCINETICA Curvas de concentración plasmática frente al tiempo, que permite apreciar los posibles efectos o influencias de las Vías de administración y la forma farmacéutica en la Biodisponibilidad. (Tiempo que tardan para alcanzar la concentración sistémica)


5. 6. MARCO REGULATORIO EN COLOMBIA RESOLUCION 1400 DE 2001 Por el cual se establece la Guía de Biodisponibilidad y de Bioequivalencia de Medicamentos que trata el Decreto 677 de 1995. PROPOSITO DE LA GUIA. Diseño y la evaluación de los estudios de Biodisponibilidad y de Bioequivalencia de medicamentos que contienen fármacos de acción sistémica, o sea aquellos que requieren de un proceso de absorción y cuya respuesta terapéutica, está íntimamente relacionada con los niveles sanguíneos del mismo. Se exigirá la presentación de los estudios de Biodisponibilidad absoluta para los medicamentos que pertenezcan a los grupos farmacológicos aquí relacionados, además de los contemplados en la Guía de Biodisponibilidad acogida mediante la presente resolución así : a) Antineoplásicos; b) Anticoagulantes; c) Antiarri tmicos; d) Anticonvulsivantes; e) Antiparkinsonianos; f) Digita licos; g) Inmunosupresores; h) Teofilina y sus sales; i) Antirretrovirales; .

5. 6. MARCO REGULATORIO EN COLOMBIA RESOLUCION 1400 DE 2001 Por el cual se establece la Guía de Biodisponibilidad y de Bioequivalencia de Medicamentos que trata el Decreto 677 de 1995. Se exigirán estudios de Bioequivalencia para los medicamentos que se comercializan en Colombia bajo denominación genérica o de marca, cuando el productor interesado solicite la certificación de intercambiabilidad con el innovador en el mercado. Se exigirá Bioequivalencia “in vivo” a los siguientes grupos farmacológicos: a) Anticonvulsivantes; b) Inmunosupresores; Y demás Medicamentos definidos por el INVIMA cuando lo considere pertinente por sus características de alto riesgo, tales como, toxicidad, margen terapéutico estrecho y comportamiento farmacocinética, previo concepto y sustentación científica de la Comisión Revisora, Sala Especializada de Medicamentos.

5. 6. MARCO REGULATORIO EN COLOMBIA RESOLUCION 1400 DE 2001 CRISTERIOS BIOFARMACEUTICOS PARA NO EXIGIR ESTUDIOS DE BIOEQUIVALENCIA. En determinadas situaciones se puede asegurar que un medicamento genérico es bioequivalente con un medicamento original sin la necesidad de tener que realizar estudios de Bioequivalencia en humanos. De acuerdo con las recomendaciones de la OMS informe de 1996 se consideran exentos de estudios de Bioequivalencia a: A. Los productos destinados a ser administrados parenteralmente (por ejemplo: vía intravenosa, intramuscular o intratecal) en solución acuosa que contengan el o los mismos fármacos en la misma concentración. B. Soluciones para administración por vía oral que contengan el o los mismos fármacos en la misma concentración y no contengan un excipiente que se conozca o se sospeche afecta el tránsito gastrointestinal o la absorción del principio activo. C. Medicamentos presentados como gases o vapores. D. Polvos y/o granulados para reconstitución como solución, cuando cumpla con lo anotado en A y B. E. Productos otológicos u oftalmológicos que contengan el o los mismos fármacos en la misma concentración y esencialmente los mismos excipientes.

5. 6. MARCO REGULATORIO EN COLOMBIA RESOLUCION 1400 DE 2001 F. Productos para empleo tópico, líquidos, que contengan el o los mismos fármacos y esencialmente los mismos excipientes. G. Formas farmacéuticas de aplicación tópica (crema, pomada, gel, loción, etc. ), de uso externo, sólidas, que contengan el o los mismos fármacos y esencialmente los mismos excipientes. H. Productos destinados a ser utilizados por inhalación o aerosoles nasales que sean administrados con o sin esencialmente el mismo dispositivo, sean preparados como soluciones acuosas y que contengan el o los mismos fármacos y esencialmente los mismos excipientes en concentraciones comparables. I. Productos que contienen principios activos de administración oral que no deban absorberse. NOTA: Se considera “esencialmente los mismos excipientes” a excipientes del mismo tipo en cuanto a que posean la misma función en la formulación (dispersante, aglomerante, espesante, etc. ), aunque no se trate de la misma molécula y que los excipientes que contengan no afecten el transito gastrointestinal, la absorción o la estabilidad del principio activo. Para los medicamentos cuyo efecto se ejerce a nivel local sin absorción sistémica (administración dérmica, nasal, vaginal, colirios, gotas oticas, etc. ) no se pueden realizar estudios de Bioequivalencia. En estos casos se realizan estudios clínicos comparativos para demostrar la Bioequivalencia.

5. 7. RECOMENDACIONES Aunque nacional e internacionalmente se acepte que existen formas farmacéuticas que por sus características, no requieren estudios de Bioequivalencia (Res. 1400 de 2001) (OMS, 1996), de acuerdo a las características de solubilidad y permeabilidad (absorción), puede existir excepciones(FDA, 2000, “Dispensa de estudios de biodisponibilidad y bioequivalencia in vivo para formas farmacéuticas orales sólidas de liberación inmediata”) CLASIFICACION BIOFARMACEUTICA Clase 1: alta solubilidad y alta permeabilidad Clase 2: baja solubilidad y alta permeabilidad Clase 3: alta solubilidad y baja permeabilidad Clase 4: baja solubilidad y baja permeabilidad (Kasim, NA, et al: Molecular proprierties of WHO essential drugs and provisional Biopharmaceutical Classification. Molecular Pharmaceutics 2004: 1(1) 85 96 En este documento se establece que la demostración de Bioequivalencia puede no ser necesaria para medicamentos que contienen principios activos comprendidos en la Clase 1 (alta solubilidad y alta permeabilidad).

Esta es la razón por la cual el control de calidad sugerido por la farmacopea para formas de dosificación oral no asegura en muchos casos la Bioequivalencia. Por ello en este tipo de fármacos el estudio de disolución in vitro no puede sustituir al estudio de Bioequivalencia, hasta tanto no sea relacionado con datos in vivo. El test de disolución in vitro tiene que ser optimizado para que sea sensible a los cambios en las variables críticas de manufactura, dentro de un rango de valores establecidos durante el proceso de elaboración. Esto asegura que las variaciones entre lotes no resulten Bioinequivalentes Dayami Carrión Recio. Rev Cubana Farm 1999; 33: 137 -42. “Cuando los países carecen de los medios para aplicar plenamente el estándar (de Bioequivalencia), se recomienda que se aplique gradualmente”. Consultation of Experts on Bioequivalence of Pharmaceutical Products. Caracas, Venezuela, Enero 13 15 de 1999. Documento OMS OPS, Junio de 1999. Es fácil comprender que la implementación de un programa de Biodisponibilidad/Bioequivalencia es un proceso gradual y progresivo, de acuerdo a las características de cada país.

En la reunión de caracas de 1999 se recomendó el abordaje de la problemática de la Bioequivalencia, teniendo en cuenta el concepto de RIESGO SANITARIO. En algunos países para la selección de principios activos que deben ser sometidos a estudios de Bioequivalencia, se tienen en cuenta dos aspectos: 1. El riesgo sanitario 2. Fármacos en los que se les exige Bioequivalencia y cada tipo de riesgo se le asignó un puntaje de acuerdo a su gravedad (alto: 3 puntos; intermedio: 2 puntos; bajo: 1 punto). Las categorías adoptadas fueron las siguientes a) Riesgo sanitario alto: complicaciones graves o RAMS graves b) Riesgo sanitario intermedio: complicaciones y RAMS no graves c) Riesgo sanitario bajo: complicaciones y RAMS menores La aplicación de este modelo dio como resultado una categorización de los fármacos, que se vio plasmada en un listado. Allí, naturalmente, figuran en primer lugar aquellas drogas con ventana terapéutica estrecha (igual o menor que 2).

Según el riesgo sanitario de cada fármaco, la equivalencia química (principios activos “idénticos”, igual concentración y forma farmacéutica similar) no es suficiente y se requiere Bioequivalencia para disminuir al mínimo la probabilidad de alteraciones en las respuestas terapéuticas por cambios debidos a factores condicionantes de la Biodisponibilidad Seria un error pensar que todos los medicamentos químicamente equivalentes y con similar forma farmacéutica tienen la misma Biodisponibilidad, eficacia y seguridad independientemente de su fabricante. Teniendo en cuenta que la problemática de la Bioequivalencia es dinámica y adaptable a la evolución del conocimiento científico, a las necesidades sanitarias y la normatividad de cada país esto no constituye un sistema cerrado sino abierto a modificaciones y nuevas incorporaciones. Aun existen detalles mejorables de la normatividad y el impacto de los estudios de Bioequivalencia sobre los hábitos de prescripción, el mercado farmacéutico en Colombia y la accesibilidad a medicamentos genéricos eficaces y seguros.

FARMACOS CON RIESGO SANITARIO RIESGO ALTO RIESGO INTERMEDIO Carbamazepina Azatioprina Ciclosporina Biperideno HCl Fenitoina sodica Carbidopa Litio carbonato Etambutol HCl Procainamida Etinilestradiol Tolbutamida Etoposido Valproato sodico Flucitosina Verapamilo sodico Fludrocortisona Etosuximida Levodopa Insulina Levonorgestrel Quinidina Mefloquina HCl Warfarina Metotrexato sodico Propranolol Rifampicina Salbutamol Atenolol Diazepam Metildopa

5. 8. LOS MEDICAMENTOS GENERICOS La exigencia de demostración de la intercambiabilidad de medicamentos genéricos en relación con los innovadores comenzó en el mundo desarrollado en la década de 1970, cuando se constataron problemas de Bioequivalencia. Luego a principios de la primera década de este siglo, impulsado por un grupo de trabajo de la Organización Panamericana de la Salud (OPS) se comenzó a legislar sobre esta materia. ¿POR QUÉ SON MÁS BARATOS LOS MEDICAMENTOS GENÉRICOS? 1. No hay investigación preclínica ni clínica por lo que no deben soportar los importantes gastos en I+D. 2. No hay recursos para demostrar la seguridad y eficacia ya que son las mismas que el original y en muchas ocasiones no asume costos de investigación de Bioequivalencia. 3. Se dedican pocos recursos a la promoción farmacéutica 4. Los procesos de registro legal son más simples mas rápidos y menos costosos. En ningún caso, UN MEDICAMENTO GENERICO como consecuencia de calidad, eficacia y/o seguridad debe ser inferiores respecto al medicamento innovador o de referencia. Sólo en un mercado de medicamentos de calidad incuestionable, se puede elegir por precio porque la intercambiabilidad está garantizada.

5. 8. 1. GARANTIA DE LA CALIDAD, EFICACIA Y SEGURIDAD DE LOS MEDICAMENTOS GENÉRICOS “La calidad de un medicamento se mide por la capacidad de ejercer el efecto terapéutico que de él se espera. Esa capacidad es determinada por las propiedades que influencian en los resultados, como su identidad, pureza, contenido o potencia, las propiedades químicas, físicas y biológicas o de su proceso de fabricación Estrategia de los medicamentos genericos de los paises de la subregion andina (Julio 2012) Los prescriptores y el público pueden estar seguros que si la FDA declara que un medicamento genérico es terapéuticamente equivalente al original, ambos productos proporcionarán los mismos efectos clínicos esperados. Jane E. Henney (Commissioner of Food and Drugs); JAMA 1999 Aproximadamente, el 50 % de los medicamentos que se prescriben en Estados Unidos son genéricos. Todos los productos que fueron aprobados por la FDA cumpliendo las especificaciones de la USP han mostrado ser Bioequivalentes. Jerome P. Skelly. 2005 President, American Association of Pharmaceutical Scientist. Drug Discovery Today; 2005, 10: 682 685

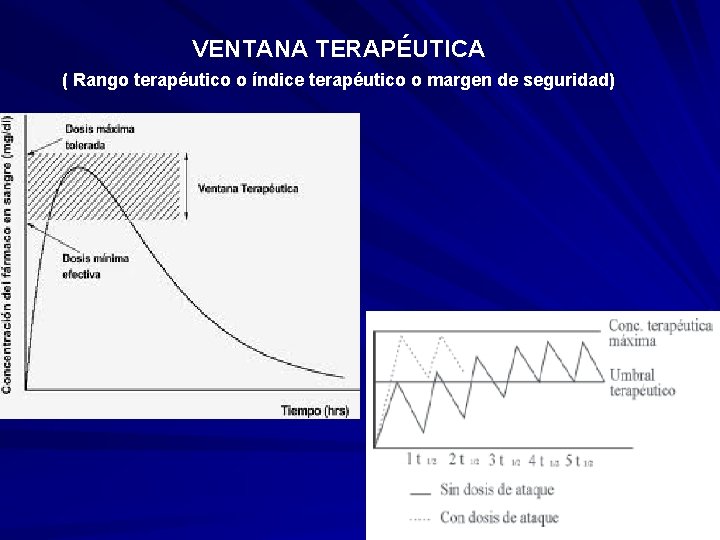
5. 9. VENTANA TERAPÉUTICA ( Rango terapéutico o índice terapéutico o margen de seguridad) La ventana terapéutica es el rango en el cual se puede utilizar un fármaco sin provocar efectos tóxicos o letales en el organismo vivo. se establece bajo un margen superior, en el cual se corre el riesgo que durante el uso de un fármaco, éste cause un efecto tóxico; y un rango mínimo bajo el cual, el uso del fármaco tendrá un efecto ineficaz en el individuo. es un valor que se establece matemáticamente como la relación entre la dosis con la cual se produce un daño en el 50% de la población (DT 50 o DL 50) y la dosis con la cual se obtiene un efecto terapéutico en el 50% de la población muestra (DE 50) de tal forma que se obtiene un valor numérico. En este contexto, si el valor obtenido de la razón llamada Índice Terapéutico es cercano a "1" se corre un riesgo muy alto de producir un efecto tóxico en el uso del fármaco, entonces, a medida que el valor obtenido se aleja de la unidad la seguridad relativa, es decir, la seguridad en el uso de cierto fármaco, es mayor, de tal forma que su uso no causaría tan rápidamente un efecto tóxico, por lo cual el efecto terapéutico es más seguro, y la dosis a usar pueden ser más amplias Cociente entre la Concentración Máxima Efectiva (No tóxica) y la Concentración Mínima Efectiva. Se estima que debe realizarse el seguimiento de dosificación de los pacientes que reciben principios activos con una Ventana Terapéutica igual o menor que 2 (dos) Ej. digoxina, litio, teofilina, fenitoina y warfarina

VENTANA TERAPÉUTICA ( Rango terapéutico o índice terapéutico o margen de seguridad)



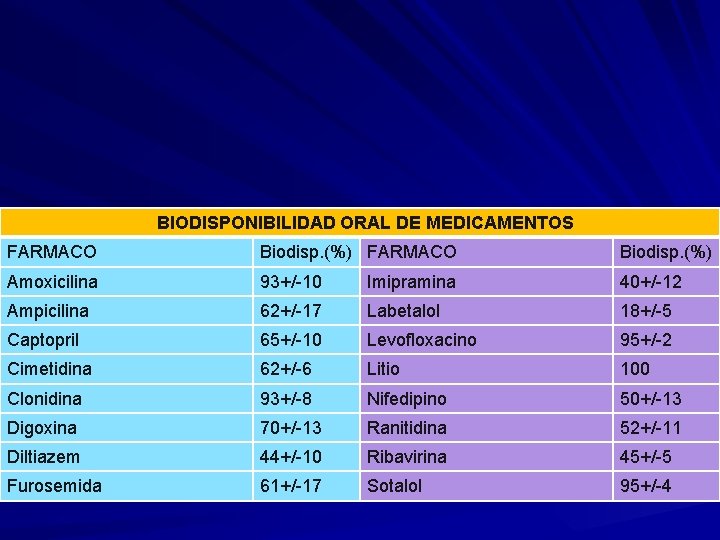
BIODISPONIBILIDAD ORAL DE MEDICAMENTOS FARMACO Biodisp. (%) Amoxicilina 93+/ 10 Imipramina 40+/ 12 Ampicilina 62+/ 17 Labetalol 18+/ 5 Captopril 65+/ 10 Levofloxacino 95+/ 2 Cimetidina 62+/ 6 Litio 100 Clonidina 93+/ 8 Nifedipino 50+/ 13 Digoxina 70+/ 13 Ranitidina 52+/ 11 Diltiazem 44+/ 10 Ribavirina 45+/ 5 Furosemida 61+/ 17 Sotalol 95+/ 4

BIBLIOGRAFIA Brunton, L; Lazo, J; Parker, K. Goodman & Gilman. Las bases farmacológicas de la terapéutica. Mc Graw Hill. 11 edición, 2007 Helman, José. Farmacotecnia. Teoría y practica. Editorial continental. 1982 Resolución 1400 (agosto 24) de 2001 Resolución 1890 de 2001(modifica la resolución 1400 de 2001) Note for Guidance on the investigacion of bioavailability and bioequivalence (CPMP/EW/QWP/1401/98). EMEA, 2000 http: //apps. who. int/gb/archive/pdf_files/WHA 54/sa 5417. pdf www. facebook. com/farmacus. grupodecapacitacion NOTA: Recuerda que las leyes y las interpretaciones cambian. Esta presentación que estas leyendo solo refleja lo que opine el día de su publicación. Algunas imágenes publicadas han sido extraídas de internet por lo que damos nuestros mas sinceros agradecimientos a las fuentes. En todo caso no es nuestra intención atribuirse la autoría de ellas, solo se utilizan para crear un concepto grafico asociado al tema. www. farmacus. com. co Síguenos en twitter: @GRUPOFARMACUS Búscanos en Facebook: farmacus. grupodecapacitacion
 Discriminante
Discriminante Adjudicacion simplificada
Adjudicacion simplificada Fatura simplificada regras
Fatura simplificada regras Casos notaveis
Casos notaveis Trombosis venosa profunda
Trombosis venosa profunda U
U Unidad decena centena unidad de mil para niños
Unidad decena centena unidad de mil para niños Farmacologia
Farmacologia Farmacologia oncologica
Farmacologia oncologica Mirabegrn
Mirabegrn Define bioavailability in pharmacology
Define bioavailability in pharmacology Finestra terapeutica
Finestra terapeutica Que es un antagonista en farmacologia
Que es un antagonista en farmacologia Dicloroacetamidas
Dicloroacetamidas Farmacologia
Farmacologia Cinetica di ordine zero farmacologia
Cinetica di ordine zero farmacologia Farmacologia
Farmacologia Antagonista farmacologia
Antagonista farmacologia Hiperplasia benigna de prostata
Hiperplasia benigna de prostata Aclaramiento plasmatico
Aclaramiento plasmatico Diferencia entre excipiente y principio activo
Diferencia entre excipiente y principio activo Farmacologia sistema nervoso autonomo
Farmacologia sistema nervoso autonomo Quimica medicinal
Quimica medicinal Cinetica di ordine zero farmacologia
Cinetica di ordine zero farmacologia Farmacologia
Farmacologia Trampa ionica farmacologia
Trampa ionica farmacologia Farmacologia
Farmacologia Farmacologia
Farmacologia Effetto tetto farmacologia
Effetto tetto farmacologia Legge di fick farmacologia
Legge di fick farmacologia Durata digestione
Durata digestione Farmacología
Farmacología Conclusion farmacologia
Conclusion farmacologia Farmacologia
Farmacologia Farmacologia definizione
Farmacologia definizione Objetivo de la farmacología
Objetivo de la farmacología Farmacologia na enfermagem
Farmacologia na enfermagem Conceptos basicos de farmacologia
Conceptos basicos de farmacologia Ce este farmacologia
Ce este farmacologia Como calcular el calor desprendido
Como calcular el calor desprendido Unidad de análisis ejemplos
Unidad de análisis ejemplos Tabla de unidades unidad decena centena
Tabla de unidades unidad decena centena Funciones sintacticas de la oracion
Funciones sintacticas de la oracion Padres.unidadejecutiva.ml/escuelas
Padres.unidadejecutiva.ml/escuelas Unidad rea
Unidad rea Unidad fundamental de la vida
Unidad fundamental de la vida Microglio
Microglio Educamos villamil
Educamos villamil