Estrutura Molecular e Ligao Estruturas de Lewis A























































- Slides: 61

Estrutura Molecular e Ligação

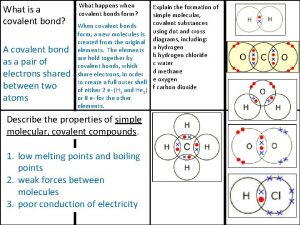
Estruturas de Lewis • A compreensão da química inorgânica depende da correlação entre as propriedades químicas dos compostos e as suas estruturas eletrônicas. A discussão no nível mais elementar da ligação covalente se baseia no compartilhamento de pares de elétrons. Esta abordagem foi proposta por G. N. Lewis em 1916 e todo o entendimento moderno captura parte do espírito desta primeira iniciativa.

• Lewis propôs que a ligação covalente é formada quando dois átomos vizinhos compartilham um par de elétrons. Em uma ligação simples, um par de elétrons é compartilhado (A: B), simbolizada por A-B. Em uma ligação dupla, dois pares são compartilhados (A: : B), representada por A=B. Numa ligação tripla, são três pares (A: : : B), ou seja A≡B.

• Um par de elétrons de valência não compartilhado em um átomo (A: ) é chamado de par isolado. Embora estes pares isolados não contribuam diretamente para a ligação, eles influenciam a forma da molécula e as suas propriedades químicas.

Regra do Octeto • Lewis descobriu que poderia explicar a existência de uma grande variedade de moléculas propondo a regra do octeto: Cada átomo compartilha elétrons com seus átomos vizinhos para alcançar um total de oito elétrons de valência (“octeto”).

• Sabemos que a configuração de camada fechada (como a dos gases nobres) é atingida quando oito elétrons ocupam as subcamadas s e p da camada de valência. Uma exceção é o átomo de hidrogênio, o qual preenche sua camada de valência, o orbital 1 s, com dois elétrons (“dubleto”). • A regra do octeto permite que se construa facilmente uma estrutura de Lewis, ou seja, um diagrama que mostra o esquema das ligações e dos pares isolados numa molécula.

• Na maioria dos casos, construimos uma estrutura de Lewis em três etapas: 1) Determine o número de elétrons a serem incluídos na estrutura somando todos os elétrons de valência fornecidos pelos átomos. 2) Escreva os símbolos químicos dos átomos num arranjo que mostre quais átomos estão ligados entre si. 3) Distribua os elétrons em pares, de forma que haja um par de elétrons formando uma ligação simples entre cada par de átomos ligados entre si e então acrescente pares de elétrons (formando pares isolados ou ligações múltiplas) até que cada átomo tenha um octeto.

• Exemplo. • Escreva a estrutura de Lewis do BF 4 -. • Os átomos fornecem 3 + (4 x 7)=31 elétrons de valência; a carga negativa adiciona um elétron. Temos que acomodar 32 elétrons (16 pares) ao todo. Uma solução é mostrada ao lado. Note-se que a carga negativa não está sobre nenhum átomo em particular e sim sobre toda a espécie.

• Estruturas de Lewis de algumas moléculas simples:

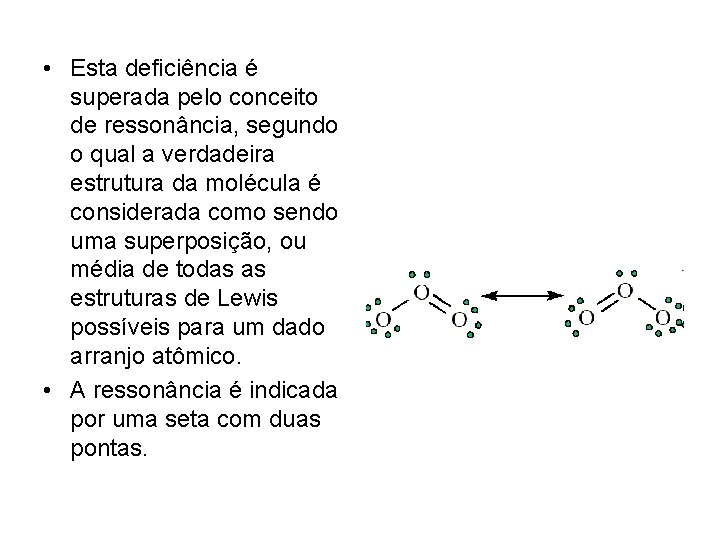
• Ressonância • Frequentemente, uma única estrutura de Lewis é inadequada para uma molécula. A estrutura de Lewis para o O 3, por exemplo, sugere que uma ligação O-O é diferente da outra, embora elas sejam idênticas e tenham um comprimento intermediário (128 pm) entre uma ligação simpes (148 pm) e uma dupla (121 pm).

• Esta deficiência é superada pelo conceito de ressonância, segundo o qual a verdadeira estrutura da molécula é considerada como sendo uma superposição, ou média de todas as estruturas de Lewis possíveis para um dado arranjo atômico. • A ressonância é indicada por uma seta com duas pontas.

• A ressonância deve ser entendida como uma mistura de estruturas, não uma alternância entre elas. A estrutura mista entre duas ou mais estruturas de Lewis é chamada de híbrido de ressonância. Observe que a ressonância ocorre somente entre estruturas que diferem apenas na alocação dos elétrons. Não há ressonância nas estruturas nas quais os átomos estejam em posições diferentes.

• A ressonância tem dois efeitos principais: 1) A ressonância distribui a ligação por toda a molécula. 2) A energia de um híbrido de ressonância é menor do que a de qualquer das estruturas isoladas. A ressonância é mais importante quando podemos escrever várias estruturas, com energias idênticas para descrever a molécula, como ocorre com o O 3.

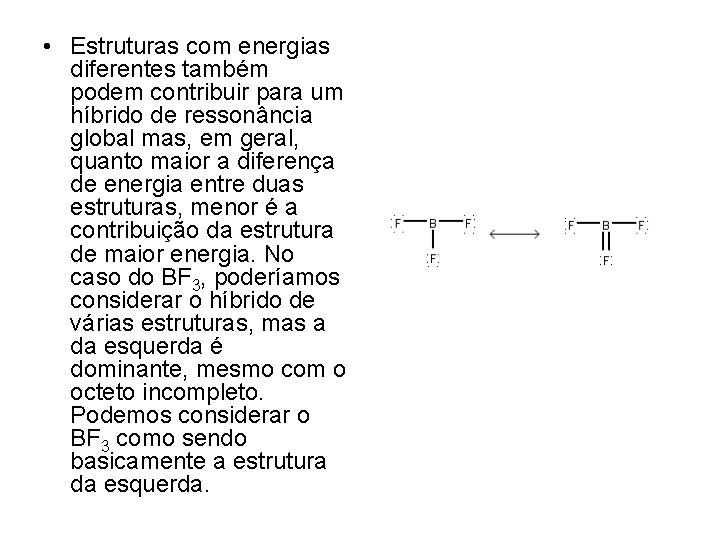
• Estruturas com energias diferentes também podem contribuir para um híbrido de ressonância global mas, em geral, quanto maior a diferença de energia entre duas estruturas, menor é a contribuição da estrutura de maior energia. No caso do BF 3, poderíamos considerar o híbrido de várias estruturas, mas a da esquerda é dominante, mesmo com o octeto incompleto. Podemos considerar o BF 3 como sendo basicamente a estrutura da esquerda.

• Carga Formal A decisão de como arranjar os elétrons para formar a estrutura de menor energia pode ser feita considerando-se a carga formal, f, sobre cada átomo. Esta é a carga que o átomo teria se a ligação fosse perfeitamente covalente, com cada par de elétrons sendo compartilhado igualmente entre os dois átomos ligados. Isto é, considera-se que cada átomo “possui” um elétron de cada par ligante.

• Cada par isolado pertence unicamente ao átomo no qual este par reside. A carga formal é a carga do átomo baseada neste modelo de ligação de compartilhamento perfeito e covalência pura. • f=V-L- ½P onde V é número original de elétrons de valência do átomo, L é o número de elétrons isolados no átomo e P é o número de elétrons compartilhados.

• A carga formal é a diferença entre o número de elétrons de valência no átomo livre e o número de elétrons que o átomo tem na molécula. Por exemplo, seja o íon amônio, NH 4+, O nitrogênio tem cinco elétrons de valência, não há pares isolados e há oito elétrons compartilhados nas quatro ligações N-H. Portanto, a carga formal do nitrogênio é 5 -0 -4=+1.

• A soma das cargas formais em uma estrutura de Lewis deve ser igual a carga total da espécie. • Geralmente, a estrutura de Lewis de menor energia é aquela com a menor carga formal nos átomos e aquela na qual o elemento mais eletronegativo possui uma carga formal negativa e o elemento menos eletronegativo possui carga formal positiva.

• Estados de oxidação A carga formal é um parâmetro obtido exagerando-se o caráter covalente de uma ligação. O número de oxidação (w) é um parâmetro obtido exagerando-se o caráter iônico de uma ligação. Ele pode ser considerado a carga que o átomo teria se o átomo mais eletronegativo de uma ligação ficasse com os dois elétrons de uma ligação. O estado de oxidação é o estado físico de um elemento correspondente ao seu número de oxidação.

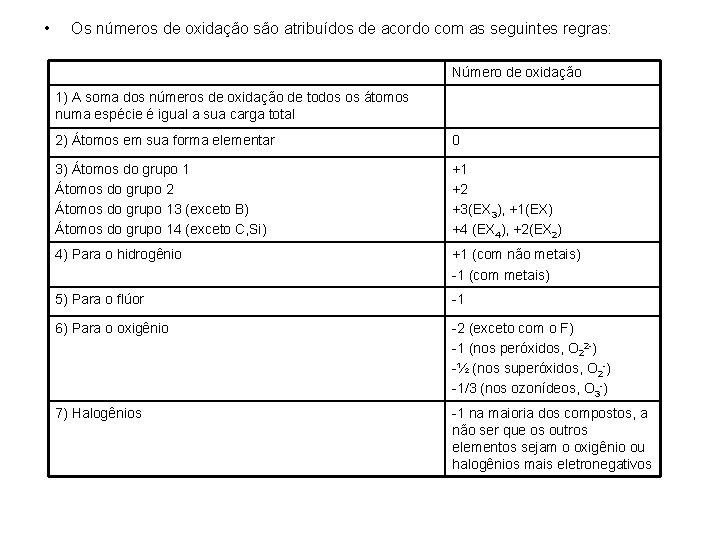
• Os números de oxidação são atribuídos de acordo com as seguintes regras: Número de oxidação 1) A soma dos números de oxidação de todos os átomos numa espécie é igual a sua carga total 2) Átomos em sua forma elementar 0 3) Átomos do grupo 1 Átomos do grupo 2 Átomos do grupo 13 (exceto B) Átomos do grupo 14 (exceto C, Si) +1 +2 +3(EX 3), +1(EX) +4 (EX 4), +2(EX 2) 4) Para o hidrogênio +1 (com não metais) -1 (com metais) 5) Para o flúor -1 6) Para o oxigênio -2 (exceto com o F) -1 (nos peróxidos, O 22 -) -½ (nos superóxidos, O 2 -) -1/3 (nos ozonídeos, O 3 -) 7) Halogênios -1 na maioria dos compostos, a não ser que os outros elementos sejam o oxigênio ou halogênios mais eletronegativos

• Para determinar um número de oxidação, siga as regras na ordem dada. Pare tão logo um número de oxidação tenha sido atribuído. Estas regras não estão completas, mas se aplicam a uma grande variedade de compsotos.

• Exercícios: Qual o número de oxidação do a) S no H 2 S? b) Mn no permanganato (Mn. O 4 -)?

• Hipervalência • Os elementos do segundo período (Li Ne) seguem bem a regra do octeto, mas os elementos dos períodos seguintes apresentam desvios. Por exemplo, no PCl 5, o P tem 10 elétrons na camada de valência. Da mesma forma, mo SF 6 deve ter 12 elétrons. Espécies deste tipo são denominadas hipervalentes.

• A explicação tradicional para a hipervalência invoca a disponibilidade de orbitais d parcialmente preenchidos de baixa energia, os quais podem acomodar os elétrons adicionais.

Estrutura e propriedades de ligação • Comprimento de ligação: • No equilíbrio, o comprimento de ligação em uma molécula é a separação internuclear de dois átomos ligados. • Numa primeira aproximação, os comprimentos de ligação no equilíbrio podem ser separados nas contribuições de cada átomo desse par ligado. A contribuição de um átomo par numa ligação covalente é denominada raio covalente do elemento.


• Podemos usar os raios covalentes da literatura para prever que o comprimento de uma ligação P-N é 106 pm + 75 pm = 181 pm; experimentalmente, este valor é próximo de 180 pm em vários compostos. Os valores experimentais devem ser usados sempre que possível, mas os raios covalentes são úteis para se fazer estimativas cautelosas quando os dados experimentais não estão disponíveis.

• Os raios covalentes variam ao longo da tabela periódica da mesma forma e pelas mesmas razões que os raios iônicos e metálicos e são menores quanto mais próximos de F. Os raios covalentes são aproximadamente iguais a separação dos núcleos quando as camadas mais internas dois átomos estão em contato: os elétrons de valência puxam os dois átomos um para o outro até que a repulsão entre as camadas internas começa a dominar. Um raio covalente expressa a menor distância de aproximação de átomos ligados.

• A menor distância de aproximação de átomos não ligados em moléculas vizinhas em contato é expressa em temos do raio de van der Waals do elemento, que é a separação intermolecular quando as camadas de valência dos dois átomos estão em contato não-ligante. Os raios de van der Waals são cruciais para se entender o empacotamento de compostos moleculares em cristais, as conformações adotadas pelas moléculas pequenas mas flexíveis e as formas das macromoléculas biológicas.

• Força de ligação: uma medida termodinâmica conveniente da força de uma ligação AB é a entalpia de dissociação da ligação, ou seja, a entalpia padrão de reação para o processo: AB(g) A(g) + B(g) A entalpia média de ligação, L, é a entalpia média de dissociação da ligação, calculada para uma série de ligações A-B em moléculas diferentes.


• As entalpias médias de ligação podem ser usadas para estimar as entalpias de reação. Entretanto, os dados termodinâmicos das espécies verdadeiras devem ser usados sempre que possível, em vez dos valores médios, porque estes últimos podem ser enganosos.

• Exemplo: • Estime a entalpia de reação para a formação do SF 6(g) a partir do SF 4(g), dado que as entalpias médias de ligação do F 2, SF 4 e SF 6 são +158, +343 e +327 k. J/mol, respectivamente, a 25ºC.

• Resposta: • A reação é SF 4(g) + F 2(g) SF 6(g) Neste caso, um mol de ligações F-F e 4 mols de ligações S-F (no SF 4) devem ser quebradas, correspondendo a uma variação de entalpia de 158+(4 x 343)=1530 k. J. Este valor é positivo pois representa a energia que deve ser usada para quebrar as ligações. Em seguida, seis mols de ligações S-F (no SF 6) devem ser formadas, correspondendo a uma variação de entalpia de 6 x(-327)=-1962 k. J. Este valor é negativo pois representa a energia liberada quando as ligações são formadas.

• A variação de entalpia total é, portanto DHӨ=+1530 -1962 k. J = -432 k. J Consequentemente, a reação é fortemente exotérmica. O valor experimental para esta reação é -434 k. J, o que está em excelente concordância com o valor estimado.

• Exercício: • Estime a entalpia de formação do H 2 S a partir do S 8(molécula cíclica) e do H 2.

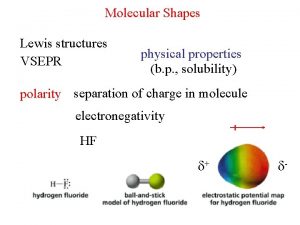
• Eletronegatividade e entalpia de ligação: A eletronegatividade é a capacidade que um átomo de um elemento tem de atrair elétrons para si quando é parte de um composto. Quanto maior a diferença de eletronegatividade entre dois elementos A e B, maior o caráter iônico da ligação A-B.

• A formulação original de Pauling utilizou conceitos relacionados às energias de formação das ligações, p. ex. , na formação de AB a partir das moléculas diatômicas A 2 e B 2. A 2(g) + B 2(g) 2 AB(g) Ele considerou que o excesso de energia, DE, de uma ligação A-B em relação à energia média das ligações A-B e B-B pode ser atribuído à presença de uma conribuição iônica além da ligação covalente.

Ele definiu a diferença de eletronegatividade como |c. P(A)-c. P(B)| = 0, 102(DE)½ ; DE em k. J/mol. Onde DE = L (A-B) – ½{L(A-A)+L(B-B)}; com L(A-B) significando a entalpia da ligação AB. Assim, se a entalpia da ligação A-B for significativamente maior do que a média das ligações apolares A-A e B-B, presume-se que exista uma contribuição iônica substancial para a função de onda e, consequentemente, uma grande diferença de eletronegatividade enre os dois átomos.

• As eletronegatividades de Pauling são úteis para estimar as entalpias de ligação entre elementos de eletronegatividades diferentes e para estimar qualitativamente a polaridade das ligações. Compostos binários nos quais a diferença de eletronegatividade entre os elementos é maior do que 1, 7 podem ser considerados como iônicos.

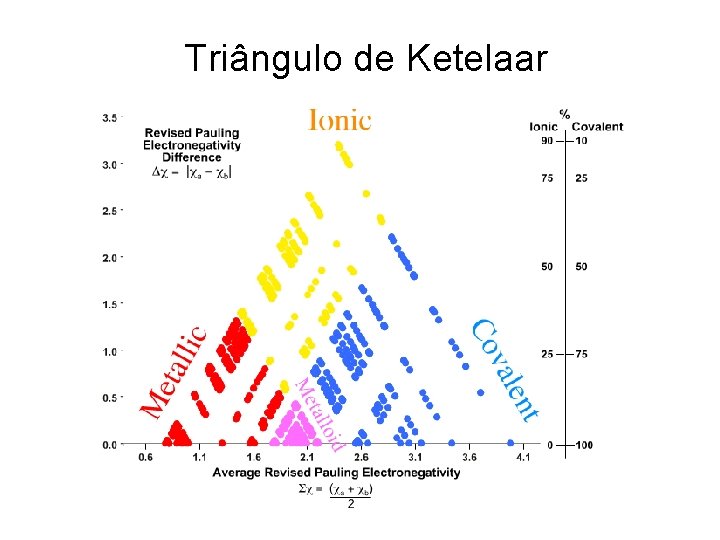
• Essa definição foi aprimorada na década de 40, por Anton van Arkel e Jan Ketelaar, quando eles apresentaram um triângulo onde os vértices representam as ligações iônica, covalente e metálica. O triângulo de Ketelaar foi aperfeiçoado por Gordon Sproul, que construiu um outro triângulo baseado na diferença de eletronegatividade dos elementos em compostos binários e sua eletronegatividade média.

Triângulo de Ketelaar

• A ligação iônica é caracterizada pela grande dieferença de eletronegatividade. Uma vez que uma grande diferença indica que a eletronegatividade de um elemento é alta e a do outro é baixa, a média deve ser um valor intermediário. A ligação covalente é caracterizada por uma pequena diferença de eletronegatividade. Tais compostos situam-se na base do triângulo. Compostos binários que são predominantemente covalentes são formados geralmente entre não-metais, os quais têm alta eletronegatividade. Assim, a região covalente do triângulo é o canto inferior direito. Este vértice do triângulo é ocupado pelo F 2, que tem Dc=0 e cmédio=3, 98.

• A ligação metálica também é caracterizada por uma pequena diferença de eletronegatividade e também situa-se próximo da abse do triângulo. Na ligação metálica, entretanto, as eletronegatividades são baixas, sendo portanto, o valor médio também baixo e, consequentemente a ligação metálica ocupa o vértice inferior esquerdo do triângulo.

• Exemplo: • Usando os valores de eletronegatividade e o triângulo de Ketelaar, preveja que tipo de ligação é dominante no Ca. O. • R. : No Ca. O, Dc=3, 44 -1, 00=2, 44 e cmédio=2, 22. Esses valores colocam o Ca. O na região iônica do triângulo.

• Exercício: • Preveja que tipo de ligação é provavelmente dominante no P 2 O 5.

Modelo RPECV • O modelo da repulsão dos pares de elétrons da camada de valência (RPECV) considera que regiões de maior densidade eletrônica, ou seja, os pares ligantes, os pares isolados ou as concentrações de elétrons associados com as ligações múltiplas, assumesm posições tão separadas o quanto possível, de modo que as repulsões entre elas sejam minimizadas.

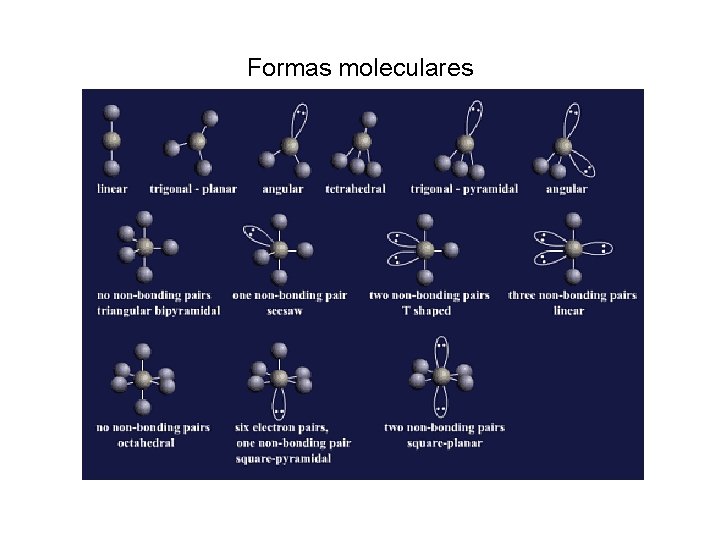
Arranjos básicos das regiões de densidade eletrônica, de acordo com o modelo RPECV Número de regiões de elétrons 2 Arranjo Linear 3 Trigonal plano 4 Tetraédrico 5 Bipiramidal trigonal 6 Octaédrico

• Embora o arranjo das regiões de densidade eletrônica overne a forma da molécula, seam estas regiões ligantes ou associadas com pares isoladas, o nome da forma é determinado pelo arranjo dos átomos e não pelo arranjo das regiões de denisdade eletrônica.

• Por exemplo, a molécula de NH 3 tem quatro pares de elétrons que estão dispostos tetraédricamente, mas como um deles é um par isolado, a molécula é classificada como piramidal trigonal. O topo da pirâmide está ocupado pelo par isolado. Da mesma forma, o H 2 O tem um arranjo tetraédrico de seus paers de elétrons, mas como dois desses pares são siolados, a molécula é classificada como angular

Formas moleculares

• Como aplicar o modelo RPECV: 1) Escrever a estrutura de Lewis e identificar o átomo central; 2) Contar o número de átomos e pares isolados em torno de cada átomo pois cada átomo e cada par isolado conta como uma região de alta densidade eletrônica; 3) Identificar a forma básica usando a tabela de arranjos básicos 4) Verificar as posições dos átomos e identificar a forma da molécula na tabela de formas moleculares.

• Assim, a molécula de SF 6, com seis ligações simples ao redor do átomo central, S, é prevista (e verificada) como sendo octaédrica.

• Exemplo: • Preveja a forma de (a) uma molécula de BF 3; (b) um íon SO 32 -. • R. : (a) Pela estrutura de Lewis do BF 3, vê-se que o átomo central de B está ligado a três átomos de F, mas não há nenhum par isolado. O arranjo básico das três regiões de densidade eletrônica é trigonal plano.

• (b) Duas estruturas de Lewis para o SO 32 - são mostradas ao lado. Elas são representativas de uma variedade de estruturas que contribuem para a estrutura de ressonância global. Em cada caso, há três átomos ligados ao S central e um par isolado, correspondendo a quatro regiões de densidade eletrônica. O arranjo básico dessas regiões é tetraédrico. Três dessas posições correspondem a átomos, assim a forma do íon é piramidal trigonal. Note que a geometria deduzida desta forma independe da estrutura de ressonância considerada.

• Modificações das formas báscias • Uma vez que a forma básica da molécula foi identificada, são feitos ajustes considerando-se as diferenças de repulsão eletrostática entre regiões ligantes e pares isolados. Assume-se que estas repulsões apresentam o seguinte ordenamento • Par isolado/par isolado > par isolado/região ligante> região ligante/região ligante

• Não se sabe exatamente a natureza desta diferença entre as repulsões. Um detalhe adicional sobre esta ordem de repulsão é que, havendo possibilidade de escolher entre um sítio axial e um equatorial para um par isolado em um arranjo bipiramidal trigonal, o par isolado ocupará o sítio equatorial. Enquanto no sítio equatorial o par isolado sofrerá repulsão de dois pares ligantes a 90º, na posição axial o par isolado sofrerá repulsão de três pares ligantes a 90º.

• Na forma básica octaédrica, um único par isoaldo pode ocupar qualquer posição, mas um segundo par isolado irá ocupar a posiçao diametralmente oposta, trans, ao primeiro, o que resultará numa estrutura quadrática plana.

• Em uma molécula com dois pares ligantes adjacentes e um ou mais pares isolados, o ângulo de ligação diminui relativamente ao que é esperado quando todos os pares são ligantes. Assim o ângulo HNH no NH 3 diminui do ângulo tetraédrico (109, 5º) da sua forma básica para um ângulo menor. Esta diminuição é consistente com o ângulo HNH de 107º observado.

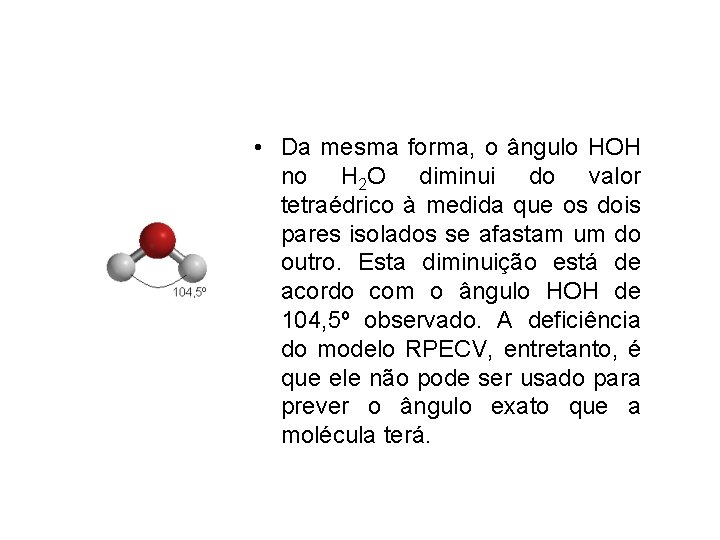
• Da mesma forma, o ângulo HOH no H 2 O diminui do valor tetraédrico à medida que os dois pares isolados se afastam um do outro. Esta diminuição está de acordo com o ângulo HOH de 104, 5º observado. A deficiência do modelo RPECV, entretanto, é que ele não pode ser usado para prever o ângulo exato que a molécula terá.

• Exercício: • Preveja a forma do SF 4.
 Ligão ou ligam
Ligão ou ligam Ligão ou ligam
Ligão ou ligam What is a covalent bond simple definition
What is a covalent bond simple definition Giant molecular structure vs simple molecular structure
Giant molecular structure vs simple molecular structure Giant molecular structure vs simple molecular structure
Giant molecular structure vs simple molecular structure Ch2o molecular geometry
Ch2o molecular geometry O3 lewis structure molecular geometry
O3 lewis structure molecular geometry Pf3 number of vsepr electron groups
Pf3 number of vsepr electron groups Nocl3 lewis structure
Nocl3 lewis structure Vsepr notation
Vsepr notation I3- point group
I3- point group Estrutura estaticamente indeterminada
Estrutura estaticamente indeterminada Mecanismo de frank starling
Mecanismo de frank starling Estruturas naturais e artificiais
Estruturas naturais e artificiais Esforos
Esforos Teoria das estruturas
Teoria das estruturas Estruturas e formas de relevo
Estruturas e formas de relevo Estruturas homólogas e análogas
Estruturas homólogas e análogas Eu sou o l
Eu sou o l Flambagem
Flambagem Teoria das estruturas
Teoria das estruturas Estrutura geologica da terra
Estrutura geologica da terra Paratireoide
Paratireoide Cerebelo
Cerebelo A grécia antiga não conheceu um estado centralizado
A grécia antiga não conheceu um estado centralizado Homologia
Homologia Identifique os órgãos do sistema respiratório
Identifique os órgãos do sistema respiratório Estruturas sequenciais
Estruturas sequenciais Estruturas sensoriais
Estruturas sensoriais Mapa das estruturas geologicas do brasil
Mapa das estruturas geologicas do brasil Estruturas naturais e artificiais
Estruturas naturais e artificiais Estrutura linear
Estrutura linear Exemplos de orações coordenadas copulativas
Exemplos de orações coordenadas copulativas Estrutura resistente
Estrutura resistente Estabilidade das estruturas
Estabilidade das estruturas Teoria das estruturas
Teoria das estruturas Desenho de estruturas
Desenho de estruturas Estrutura de uma carta informal
Estrutura de uma carta informal Estrutura sfn
Estrutura sfn Anucleadas
Anucleadas Rasgos del texto argumentativo
Rasgos del texto argumentativo Rede organizacional
Rede organizacional Estrutura e superestrutura
Estrutura e superestrutura Textos expositivos ejemplos
Textos expositivos ejemplos Instituição e toda forma ou estrutura
Instituição e toda forma ou estrutura Como se escribe lugar y fecha en una carta
Como se escribe lugar y fecha en una carta Estrutura interna farsa de ines pereira
Estrutura interna farsa de ines pereira Estrutura da reportagem
Estrutura da reportagem Estrutura funcional da escola
Estrutura funcional da escola Estrutura de madeira
Estrutura de madeira Estrutura linear
Estrutura linear Estrutura organizacional ambev
Estrutura organizacional ambev Pelergo
Pelergo Estrutura do regulamento escolar
Estrutura do regulamento escolar Dmpl estrutura
Dmpl estrutura Estrutura do sistema financeiro nacional
Estrutura do sistema financeiro nacional Estrutura de controle sequencial
Estrutura de controle sequencial Vinheta banda desenhada
Vinheta banda desenhada Estrutura de trabalho cientifico
Estrutura de trabalho cientifico Estrutura da resenha crítica abnt
Estrutura da resenha crítica abnt Ejemplo de estructura repetitiva
Ejemplo de estructura repetitiva Estrutura de dados
Estrutura de dados