Ligao Qumica Como se ligam os tomos Ligao











- Slides: 13

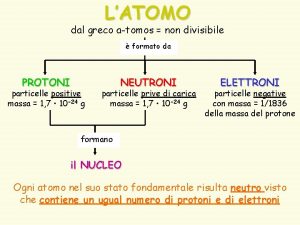
Ligação Química

Como se ligam os átomos? Ligação química Covalente Iónica Metálica Ligação covalente – entre átomos de não metais. Ligação iónica – entre átomos de metais e de alguns não metais. Ligação metálica – entre átomos de metais.

Ligação covalente Ligação química é feita por partilha de pares de electrões entre os núcleos dos átomos constituintes da molécula. Os electrões de valência, são os intermediários no «acasalamento» entre átomos. A ligação covalente é portanto, a partilha de electrões entre não-metais

Ligações entre átomos Os gases nobres são formados por átomos estáveis, ou seja, por átomos que muito dificilmente estabelecem ligações com outros átomos. Mas a maioria dos átomos não é estável, necessitando assim de estabelecerem ligações uns com os outros. Estas ligações são devidas a forças eléctricas, que condicionam assim a propriedade das substâncias.

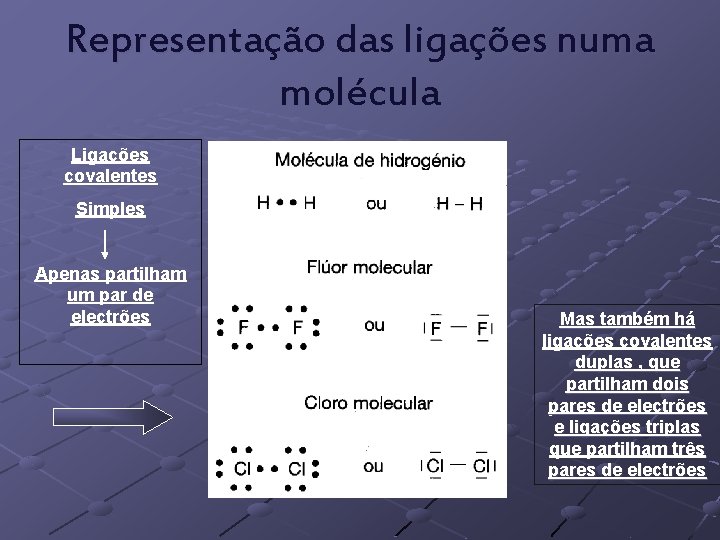
Representação das ligações numa molécula Para se representar as ligações numa molécula, utilizase a notação de Lewis. Neste diagrama apenas participam os electrões de valência, pois só estes é que podem estabelecer as ligações químicas covalentes. O par electrónico compartilhado pertence aos dois átomos que estão ligados. Cada electrão desemparelhado que o átomo possuir representará uma ligação covalente que deverá ocorrer. Exemplo:

Representação das ligações numa molécula Ligações covalentes Simples Apenas partilham um par de electrões Mas também há ligações covalentes duplas , que partilham dois pares de electrões e ligações triplas que partilham três pares de electrões

Moléculas Polares e Apolares Uma molécula é uma partícula neutra. Mas em algumas moléculas, a nuvem electrónica está desigualmente distribuída porque determinados átomos atraem a carga da nuvem com maior intensidade que outros. Molécula Apolar – Não há nenhuma zona da molécula em que se possa dizer que está mais negativa ou mais positiva. São moléculas simétricas. Molécula Polar – Quando se forma um pólo negativo e um pólo positivo. Para se formar uma molécula polar, é necessário átomos diferentes. Nestas não existe simetria.

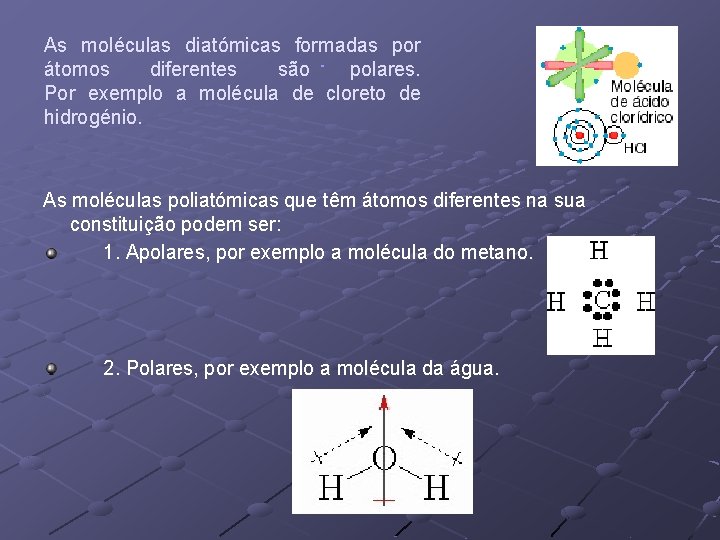
As moléculas diatómicas formadas por átomos iguais são apolares. Por exemplo a molécula de cloro.

As moléculas diatómicas formadas por átomos diferentes são polares. Por exemplo a molécula de cloreto de hidrogénio. As moléculas poliatómicas que têm átomos diferentes na sua constituição podem ser: 1. Apolares, por exemplo a molécula do metano. 2. Polares, por exemplo a molécula da água.

Ligação iónica Os átomos dos metais têm uma certa tendência a perder os seus electrões de valência para ficar mais estáveis. Formam iões positivos. Os átomos dos não-metais têm tendência a completar o seu último nível, ganhando electrões. Formam iões negativos. Forma-se assim substâncias iónicas, cujas unidades estruturais são iões.

Ligação Metálica O que é um metal? Um metal é uma substância elementar, pois os seus átomos são todos iguais. A sua estrutura Os metais são maleáveis e são dúcteis (sem alterar a estrutura cristalina). As camadas de átomos na rede podem «deslizar» umas sobre as outras.

Ligação Metálica Os átomos metálicos tem poucos electrões de valência. Estes electrões de valência são partilhados pelos outros átomos, formando assim uma espécie de “mar de electrões”. É pois este “mar de electrões” que assegura a ligação entre os átomos. Os metais são formados por iões positivos mergulhados num “mar de electrões” livres.

Metal Modelo do “mar de electrões”