Determinacin de la Velocidad de Corrosin en Armaduras








































- Slides: 76

Determinación de la Velocidad de Corrosión en Armaduras Mediante Técnicas Cuantitativas de Análisis Electroquímico Máster en Edificación - Tesis Final de Máster Tutores: Juan Soto Camino – Jose Manuel Gandía Romero Alumno: Pablo Monzón Bello

Objetivos: Ø Utilizar dos técnicas electroquímicas para la determinación de la velocidad de corrosión en armaduras. ØDeterminar el mejor inhibidor. Ø Comparar los resultados. Ø Utilizar las dos técnicas conjuntamente en un ensayo no destructivo.

Durabilidad La EHE-08, en su artículo nº 37, establece el concepto de durabilidad. Los principales factores físico-químicos que limitan la durabilidad del hormigón son: 1. - Ciclos de hielo-deshielo. 2. - Ciclos térmicos y de humedad. 3. - Iones sulfato y cloruros. 4. - Medios ácidos. 5. - Corrosión de armaduras.

¿Qué es la corrosión? Es la reacción de un metal o aleación con el medio que le rodea. En este proceso los metales pasan de su estado elemental a su estado combinado que presentan en la naturaleza.

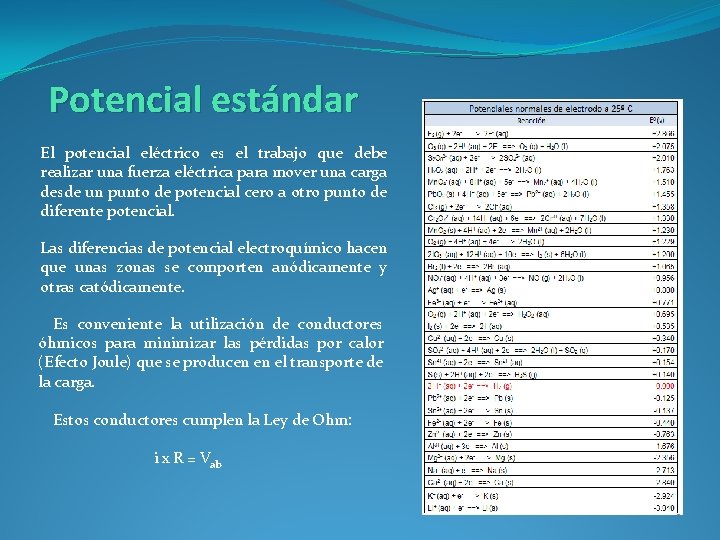
Potencial estándar El potencial eléctrico es el trabajo que debe realizar una fuerza eléctrica para mover una carga desde un punto de potencial cero a otro punto de diferente potencial. Las diferencias de potencial electroquímico hacen que unas zonas se comporten anódicamente y otras catódicamente. Es conveniente la utilización de conductores óhmicos para minimizar las pérdidas por calor (Efecto Joule) que se producen en el transporte de la carga. Estos conductores cumplen la Ley de Ohm: i x R = Vab

Diagramas de Pourbaix Indican el estado en el que se encuentran los metales y disoluciones, en función de los cambios en el p. H y el potencial. Zona de pasividad. Zona de inmunidad. Zona de corrosión.

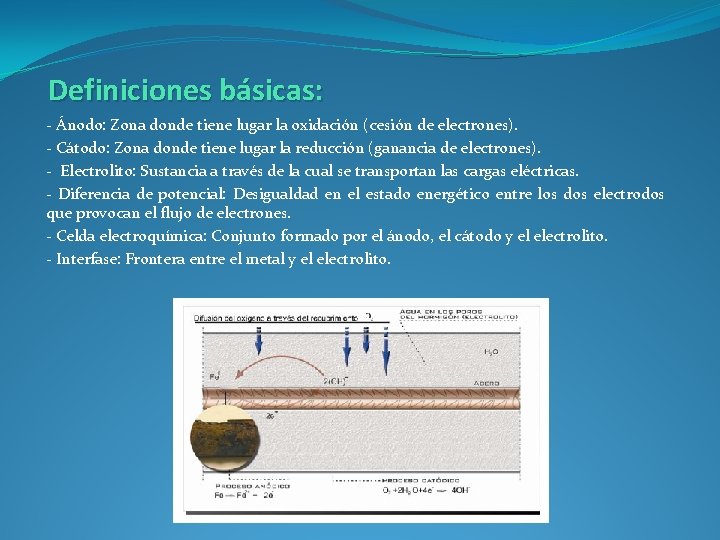
Definiciones básicas: - Ánodo: Zona donde tiene lugar la oxidación (cesión de electrones). - Cátodo: Zona donde tiene lugar la reducción (ganancia de electrones). - Electrolito: Sustancia a través de la cual se transportan las cargas eléctricas. - Diferencia de potencial: Desigualdad en el estado energético entre los dos electrodos que provocan el flujo de electrones. - Celda electroquímica: Conjunto formado por el ánodo, el cátodo y el electrolito. - Interfase: Frontera entre el metal y el electrolito.

Proceso de corrosión en disolución 1. - Absorción del O 2 atmosférico hacia la disolución. 2. - Transporte, por convección o difusión. 3. - Adsorción del O 2 (aq), sobre la superficie del electrodo de trabajo. 4. - Transferencia electrónica. 5. - Desorción de los productos de la superficie del electrodo. 6. - Difusión de los productos formados.

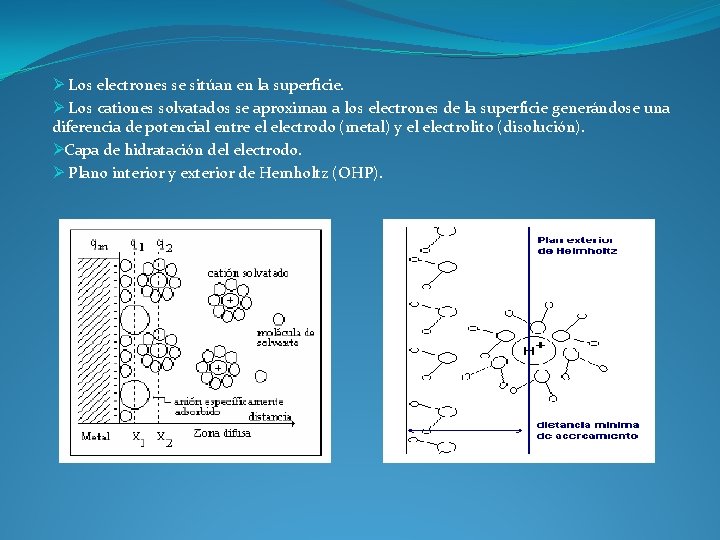
Ø Los electrones se sitúan en la superficie. Ø Los cationes solvatados se aproximan a los electrones de la superficie generándose una diferencia de potencial entre el electrodo (metal) y el electrolito (disolución). ØCapa de hidratación del electrodo. Ø Plano interior y exterior de Hemholtz (OHP).

Circuito equivalente - Resistencia: Elemento físico que se opone al paso de corriente y que disipa energía en forma de calor. - Capacitancia o condensador: Elemento que acumula energía en forma de campo eléctrico. - Inductancia: Elemento que acumula energía en forma de campo magnético. Resistencia Capacitancia Inductancia

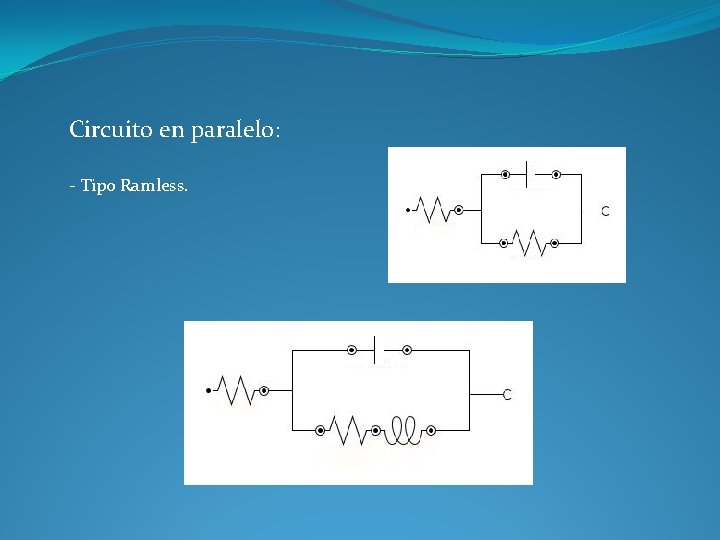
Circuito en paralelo: - Tipo Ramless.

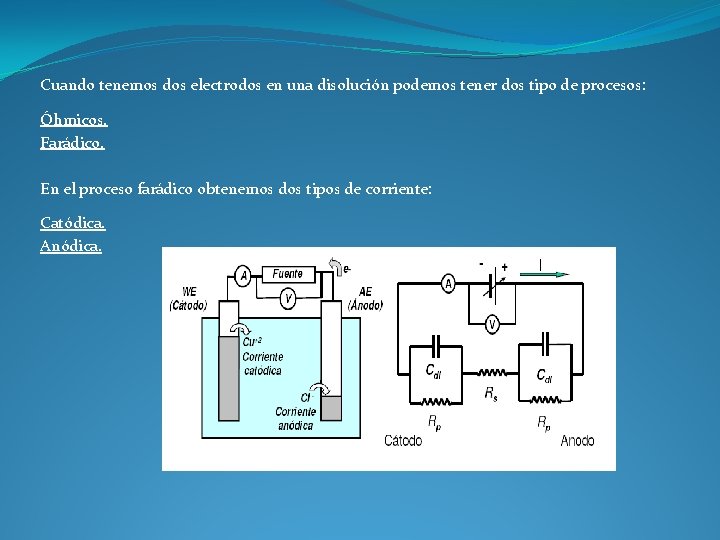
Cuando tenemos dos electrodos en una disolución podemos tener dos tipo de procesos: Óhmicos. Farádico. En el proceso farádico obtenemos dos tipos de corriente: Catódica. Anódica.

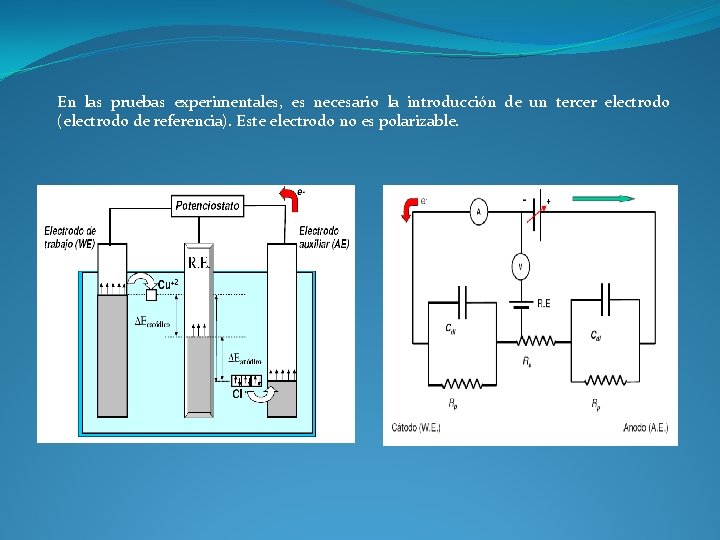
En las pruebas experimentales, es necesario la introducción de un tercer electrodo (electrodo de referencia). Este electrodo no es polarizable.

Condicionantes El p. H propio del hormigón, una vez puesto en obra, es aproximadamente de 13, por lo que, según hemos podido comprobar en el diagrama de Pourbaix del Fe, los estados posibles del acero son los de pasivación o de inmunidad. Existen dos factores principales que provocan la disminución del p. H: 1. - La carbonatación del hormigón. 2. - La presencia de iones despasivantes.

Carbonatación Se trata de la reacción que se produce entre el CO 2 del aire y el hidróxido de calcio resultante de la hidrólisis del cemento. Este proceso reduce el p. H, desplazando a las armaduras de acero de la zona de pasivación a la zona de corrosión. En términos simplificados, se produce la siguiente reacción:

Iones despasivantes Ø Rompen localmente las películas de óxido estables que protegen inicialmente al acero. Ø Forman una celda de corrosión. Ø Picaduras

Factores acelerantes Ø La presencia del agua es necesaria para que la corrosión tenga lugar pero es insuficiente por si sola para provocar el fenómeno. Son necesarios valores superiores al 50% de humedad. Ø La resistividad del hormigón. Ø La temperatura.

Factores retardadores Ø Protección catódica Ø Protección anódica. Ø Inhibidores. Ø Armaduras acero inoxidable. Ø Armaduras acero galvanizado. Ø Armaduras no metálicas. ØArmaduras compuestas.

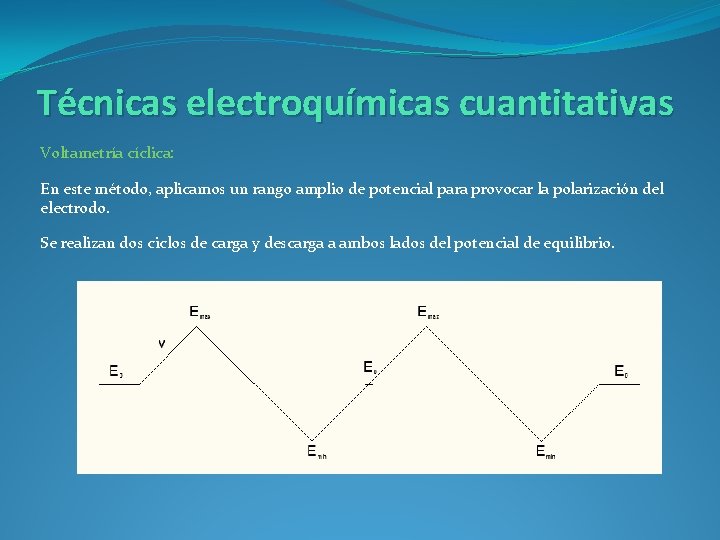
Técnicas electroquímicas cuantitativas Voltametría cíclica: En este método, aplicamos un rango amplio de potencial para provocar la polarización del electrodo. Se realizan dos ciclos de carga y descarga a ambos lados del potencial de equilibrio.

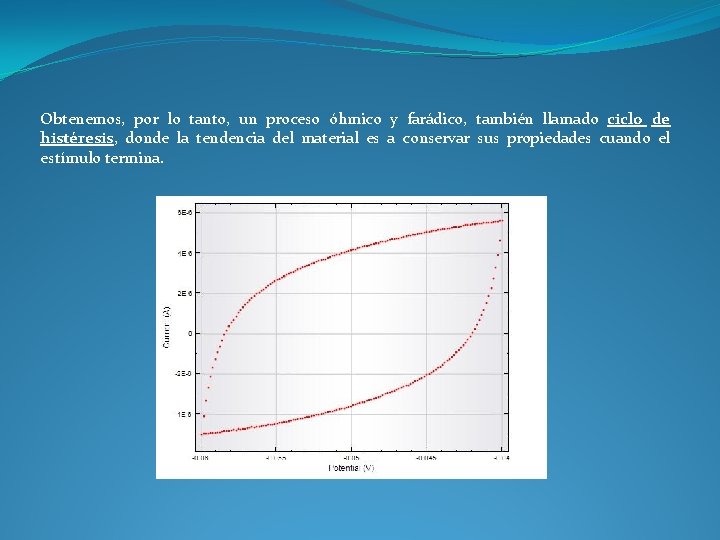
Obtenemos, por lo tanto, un proceso óhmico y farádico, también llamado ciclo de histéresis, donde la tendencia del material es a conservar sus propiedades cuando el estímulo termina.

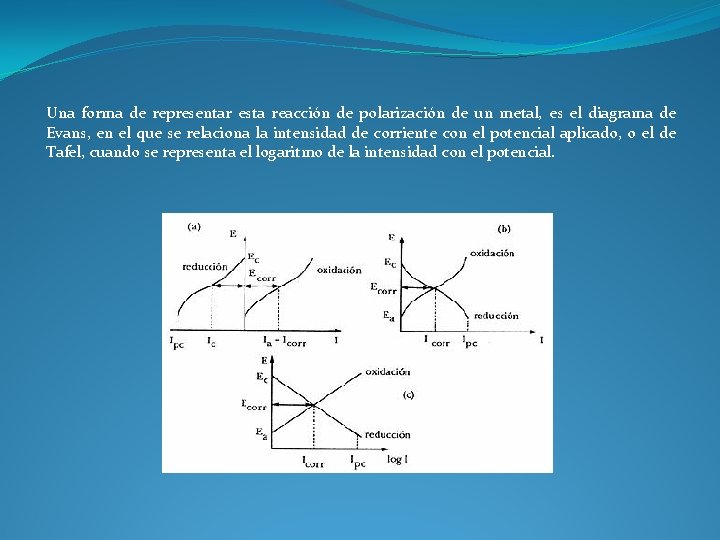
Una forma de representar esta reacción de polarización de un metal, es el diagrama de Evans, en el que se relaciona la intensidad de corriente con el potencial aplicado, o el de Tafel, cuando se representa el logaritmo de la intensidad con el potencial.


Espectroscopía de impedancia: Ø Se trata de una técnica cuantitativa de corriente alterna. Ø Aplicación de una perturbación sinusoidal de pequeña amplitud sobre el potencial del electrodo de trabajo. Ø A cada frecuencia aplicada se recoge una respuesta de corriente de onda sinusoidal, diferente al aplicado.

El flujo de corriente pasa a través de los diferentes componentes obteniéndose una respuesta en impedancia (Z), que se define como la oposición al paso de la señal eléctrica. La impedancia (Z) se puede representar en función de su componente real (Z’) e imaginaria (Z’’).

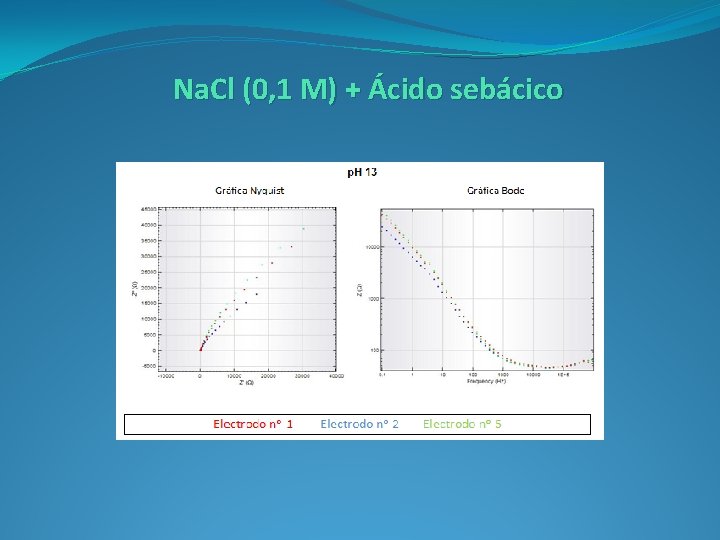
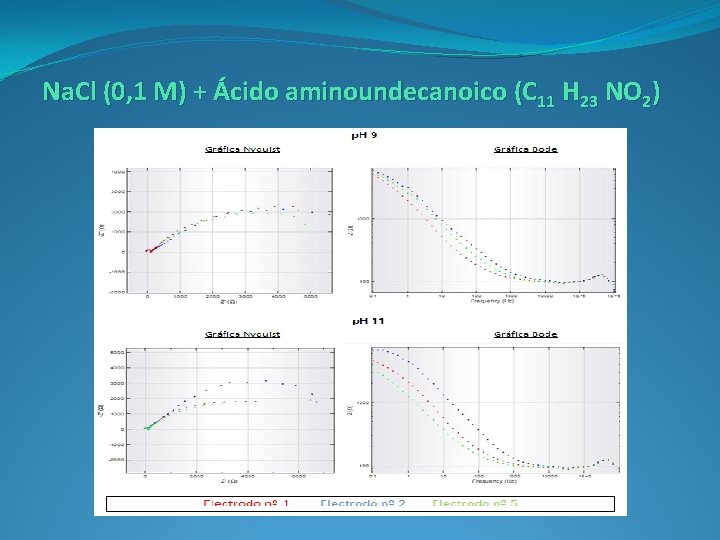
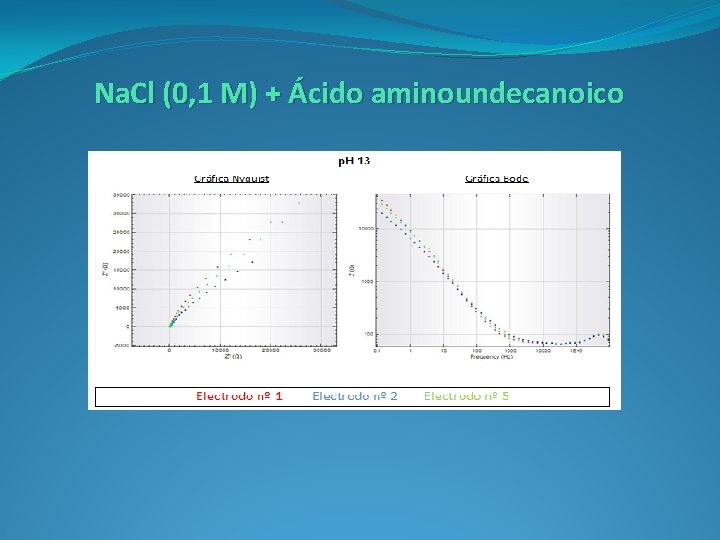
Diagrama Nyquist: Representamos la componente real (Z’) e imaginaria (-Z’’), multiplicada por -1, de la impedancia (Z). Nos aporta información sobre la parte cinética de la reacción, obteniendo los valores de resistencia de la disolución y del electrodo durante el proceso de transferencia de carga.

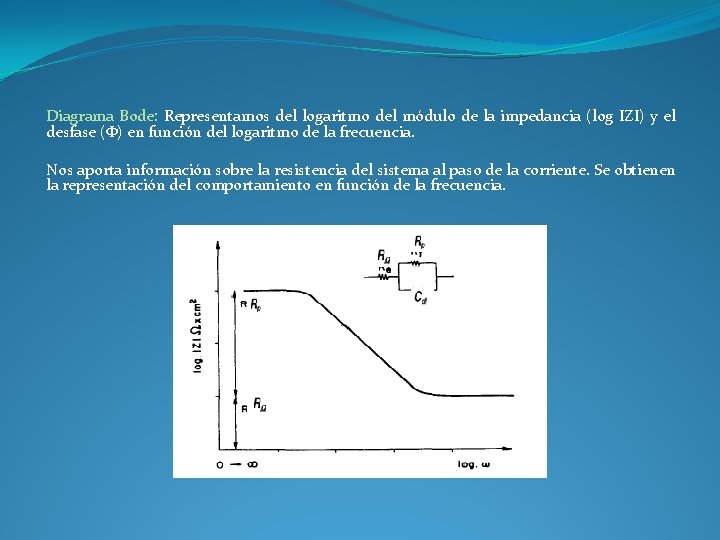
Diagrama Bode: Representamos del logaritmo del módulo de la impedancia (log IZI) y el desfase (Φ) en función del logaritmo de la frecuencia. Nos aporta información sobre la resistencia del sistema al paso de la corriente. Se obtienen la representación del comportamiento en función de la frecuencia.

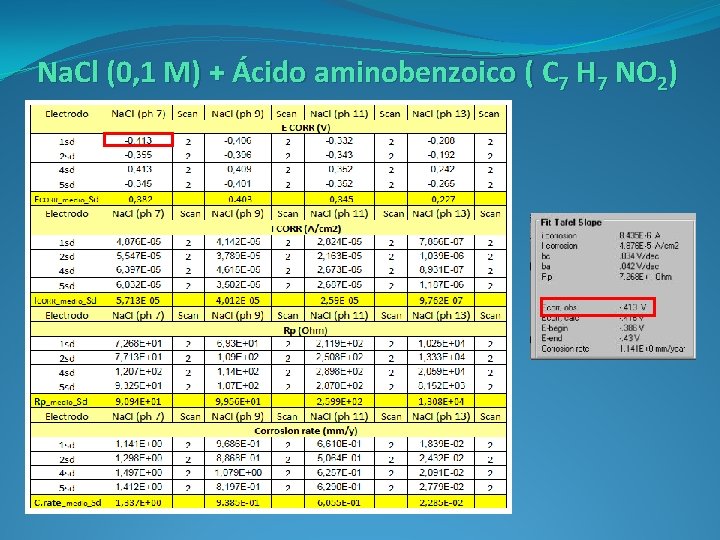
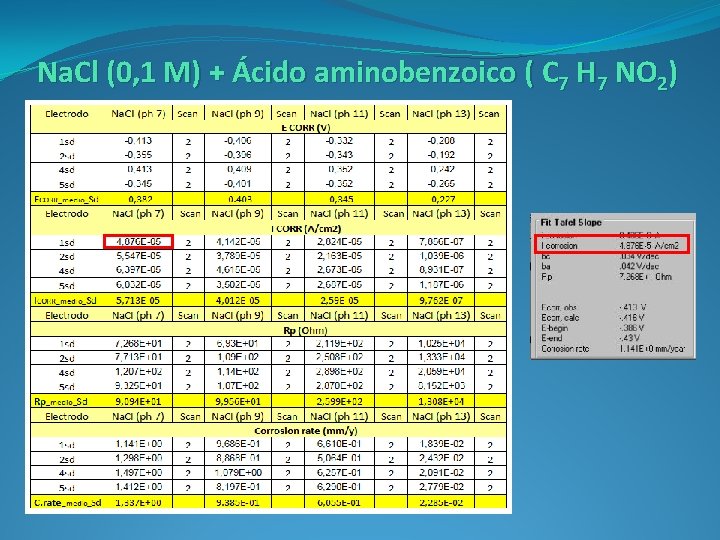
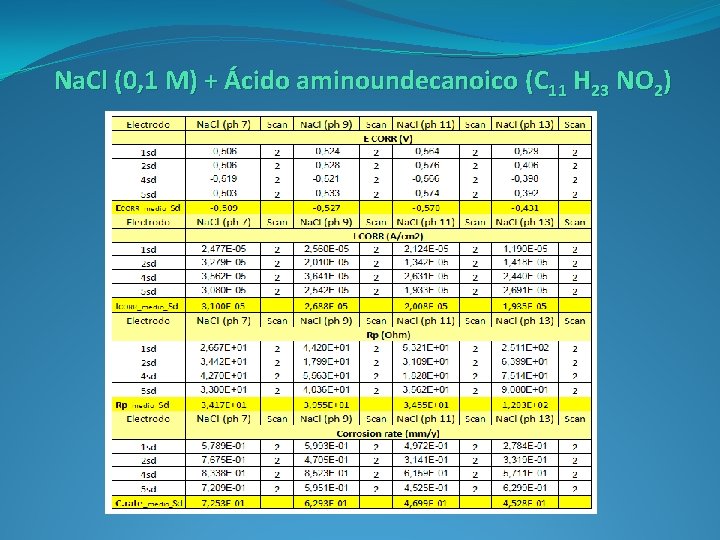
Fase experimental En la fase experimental se realizan dos métodos de ensayos diferentes: o Electrodos inmersos en diluciones con inhibidor. o Armadura en probeta de mortero embebida en disolución con inhibidor. Los electrodos estarán embebidos en una disolución de Na. Cl (0, 1 M). Se añade uno de los siguientes inhibidores orgánicos: o Ácido Aminobenzoico ( C 7 H 7 NO 2) o Ácido Sebácico ( C 10 H 18 O 4) o Ácido Aminoundecanoico (C 11 H 23 NO 2) La proporción de inhibidor es del 7‰, cantidad recomendada por los fabricantes. Las disoluciones se ajustan a cuatro p. H’s: 7, 9, 11 y 13.





Ø Se utiliza un electrodo de referencia de calomelanos y un contraelectrodo de platino. Ø Se utiliza un electrodo de trabajo rotatorio. Se aplica un rotación de 1. 500 r. p. m. Ø En el ensayo de voltametría, la variación de potencial se realizará a 0, 01 V/s. El barrido de potencial se establece en el rango de -0, 80 V a +0, 40 V. Ø La disulución se encuentra a 25º C. Ø Después de cada ensayo, al haberse polarizado el extremo del electrodo, se eliminan los productos de corrosión con lija de gramaje pequeño. Ø Se realizarán dos escaneos (barridos) de cada ensayo.

Ø Se utiliza un electrodo de referencia de calomelanos y un contraelectrodo de acero inoxidable. El electrodo de trabajo no es rotatorio. Ø Se utiliza un termostatador que hace circular líquido refrigerante por el interior de la celda de ensayo. Ø Las probetas se dejan embebidas en la disolución un mínimo de 24 horas. Ø Se coloca el recipiente de ensayo dentro de una jaula de Faraday. ØSe utiliza un equipo SAI. Ø Se realizarán dos escaneos de cada ensayo. Ø Se realizará con frecuencias entre 900. 000 Hz. a 0, 10 Hz. La amplitud es de 0, 01 V y el número de frecuencia emitidas se fija en 50.

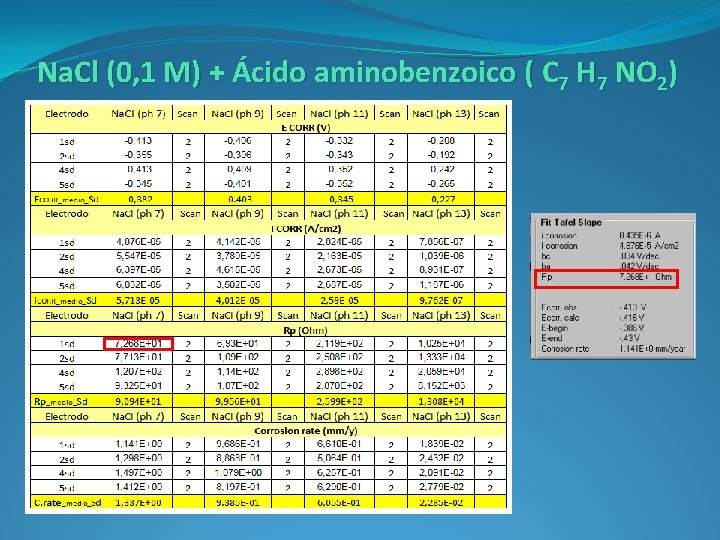
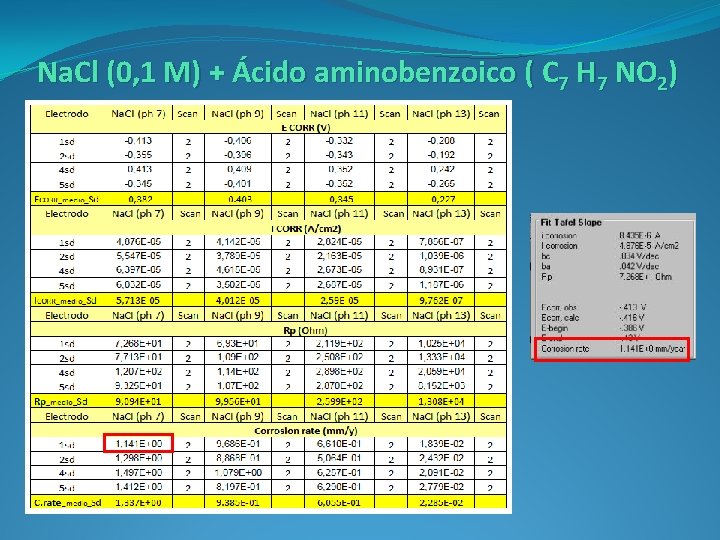
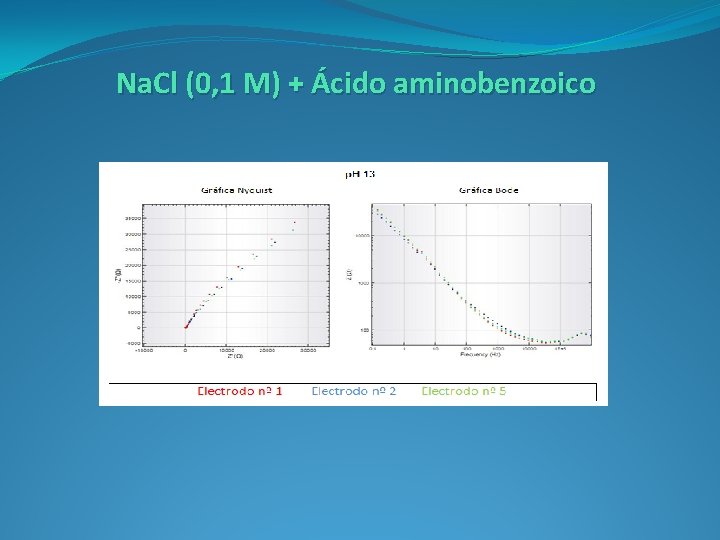
Na. Cl (0, 1 M) + Ácido aminobenzoico ( C 7 H 7 NO 2)

Na. Cl (0, 1 M) + Ácido aminobenzoico ( C 7 H 7 NO 2)

Na. Cl (0, 1 M) + Ácido aminobenzoico ( C 7 H 7 NO 2)

Na. Cl (0, 1 M) + Ácido aminobenzoico ( C 7 H 7 NO 2)

Na. Cl (0, 1 M) + Ácido aminobenzoico ( C 7 H 7 NO 2)




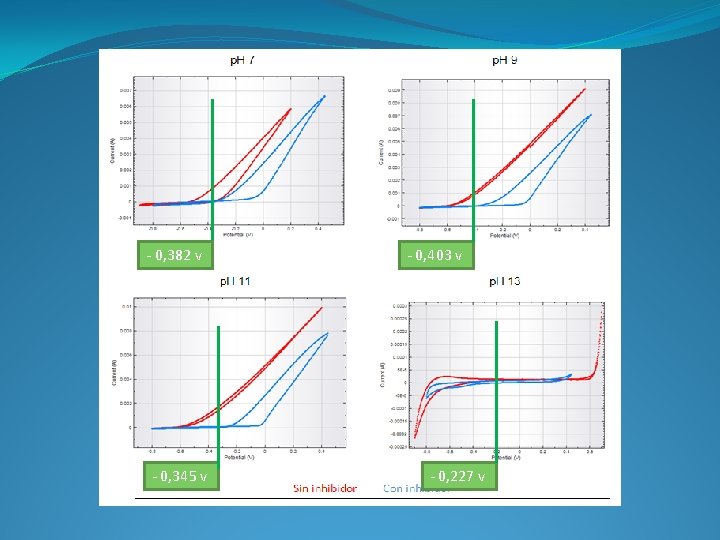
- 0, 382 v - 0, 345 v - 0, 403 v - 0, 227 v

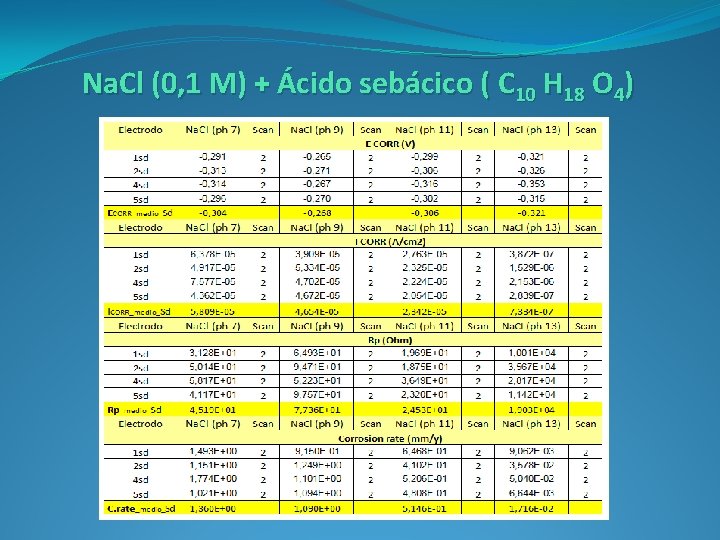
Na. Cl (0, 1 M) + Ácido sebácico ( C 10 H 18 O 4)




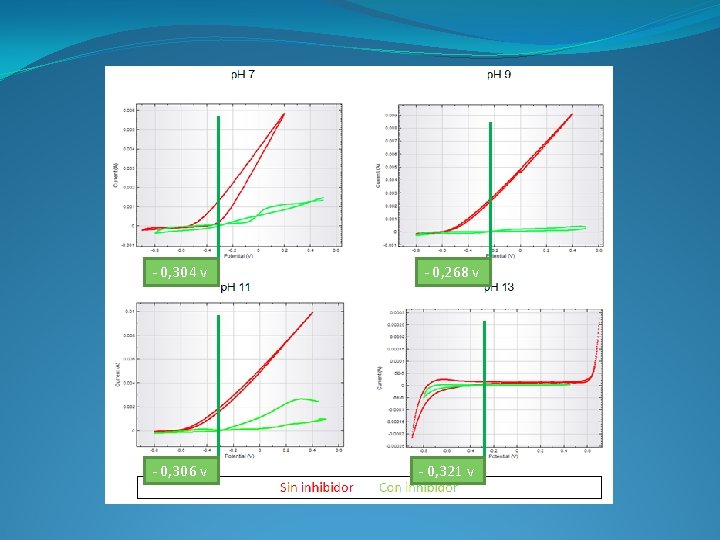
- 0, 304 v - 0, 306 v - 0, 268 v - 0, 321 v

Na. Cl (0, 1 M) + Ácido aminoundecanoico (C 11 H 23 NO 2)



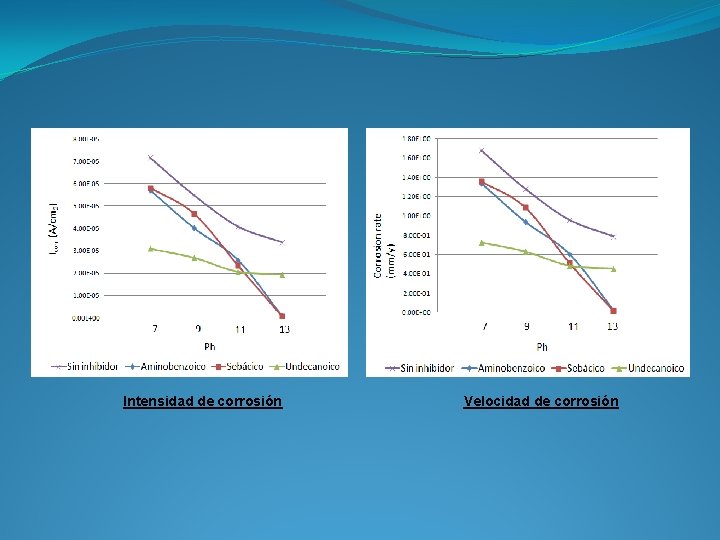
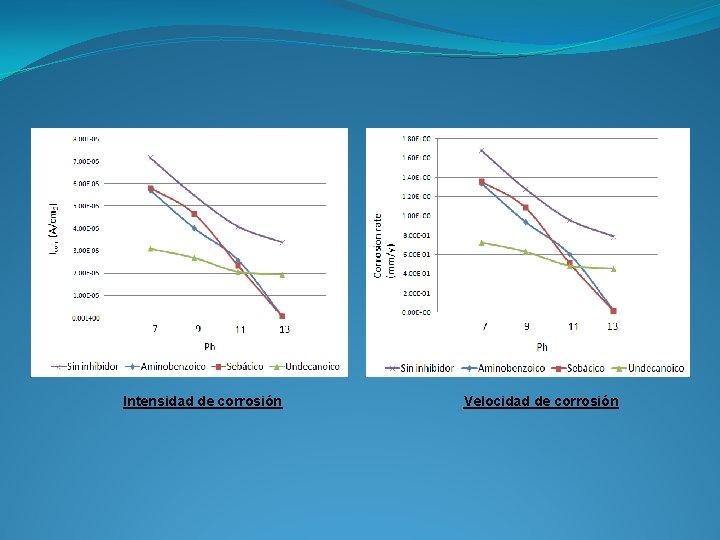
Intensidad de corrosión Velocidad de corrosión

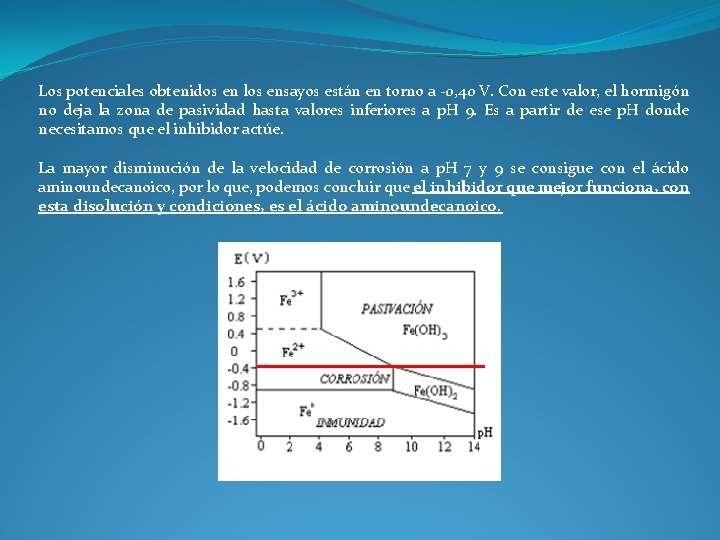
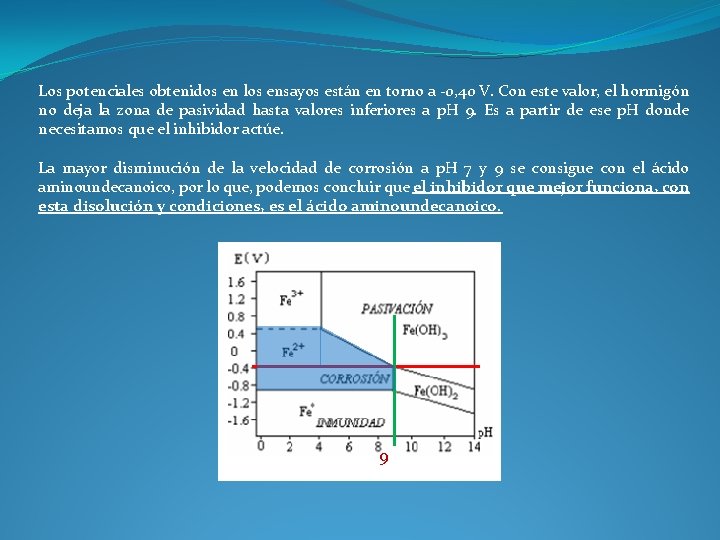
Los potenciales obtenidos en los ensayos están en torno a -0, 40 V. Con este valor, el hormigón no deja la zona de pasividad hasta valores inferiores a p. H 9. Es a partir de ese p. H donde necesitamos que el inhibidor actúe. La mayor disminución de la velocidad de corrosión a p. H 7 y 9 se consigue con el ácido aminoundecanoico, por lo que, podemos concluir que el inhibidor que mejor funciona, con esta disolución y condiciones, es el ácido aminoundecanoico.

Los potenciales obtenidos en los ensayos están en torno a -0, 40 V. Con este valor, el hormigón no deja la zona de pasividad hasta valores inferiores a p. H 9. Es a partir de ese p. H donde necesitamos que el inhibidor actúe. La mayor disminución de la velocidad de corrosión a p. H 7 y 9 se consigue con el ácido aminoundecanoico, por lo que, podemos concluir que el inhibidor que mejor funciona, con esta disolución y condiciones, es el ácido aminoundecanoico.

Los potenciales obtenidos en los ensayos están en torno a -0, 40 V. Con este valor, el hormigón no deja la zona de pasividad hasta valores inferiores a p. H 9. Es a partir de ese p. H donde necesitamos que el inhibidor actúe. La mayor disminución de la velocidad de corrosión a p. H 7 y 9 se consigue con el ácido aminoundecanoico, por lo que, podemos concluir que el inhibidor que mejor funciona, con esta disolución y condiciones, es el ácido aminoundecanoico. 9

Los potenciales obtenidos en los ensayos están en torno a -0, 40 V. Con este valor, el hormigón no deja la zona de pasividad hasta valores inferiores a p. H 9. Es a partir de ese p. H donde necesitamos que el inhibidor actúe. La mayor disminución de la velocidad de corrosión a p. H 7 y 9 se consigue con el ácido aminoundecanoico, por lo que, podemos concluir que el inhibidor que mejor funciona, con esta disolución y condiciones, es el ácido aminoundecanoico. 9

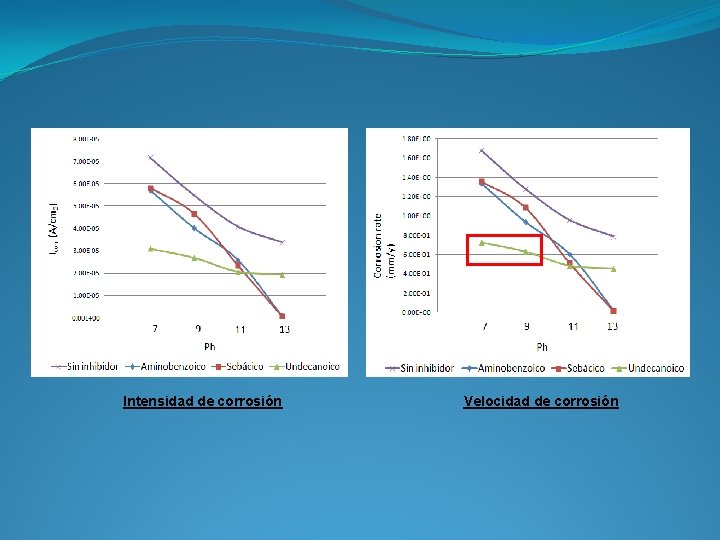
Intensidad de corrosión Velocidad de corrosión

Intensidad de corrosión Velocidad de corrosión

Na. Cl (0, 1 M) + Ácido aminobenzoico ( C 7 H 7 NO 2)

Na. Cl (0, 1 M) + Ácido aminobenzoico

Na. Cl (0, 1 M) + Ácido sebácico ( C 10 H 18 O 4)

Na. Cl (0, 1 M) + Ácido sebácico

Na. Cl (0, 1 M) + Ácido aminoundecanoico (C 11 H 23 NO 2)

Na. Cl (0, 1 M) + Ácido aminoundecanoico

Disolución Na. Cl (0, 1 M) con inhibidor ácido aminobenzoico ( C 7 H 7 NO 2) Realizamos el ajuste del ensayo mediante la obtención de un circuito equivalente. Se incorpora un impedancia de Warburg que tiene presente las limitaciones cinéticas de las reacciones redox. Completan el circuito un condensador y la resistencia de la disolución.

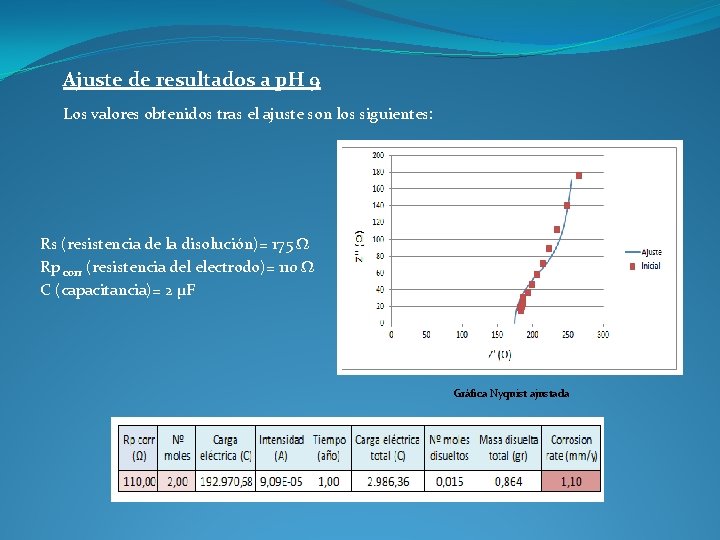
Ajuste de resultados a p. H 9 Los valores obtenidos tras el ajuste son los siguientes: Rs (resistencia de la disolución)= 175 Ω Rp corr (resistencia del electrodo)= 110 Ω C (capacitancia)= 2 µF Gráfica Nyquist ajustada

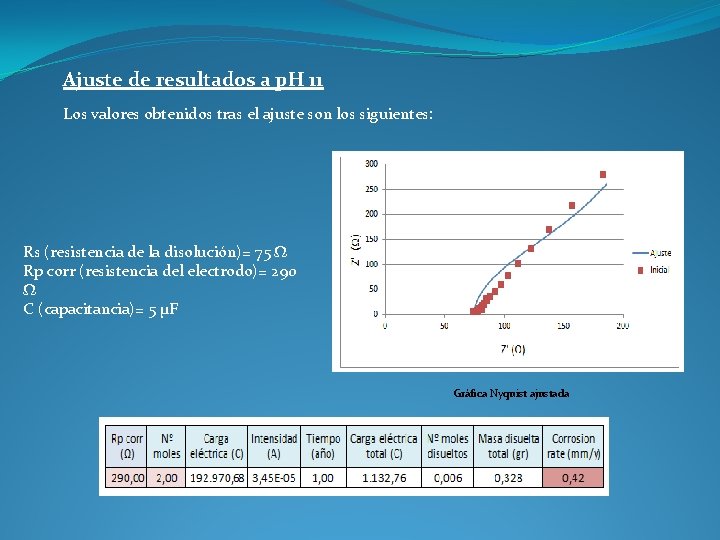
Ajuste de resultados a p. H 11 Los valores obtenidos tras el ajuste son los siguientes: Rs (resistencia de la disolución)= 75 Ω Rp corr (resistencia del electrodo)= 290 Ω C (capacitancia)= 5 µF Gráfica Nyquist ajustada

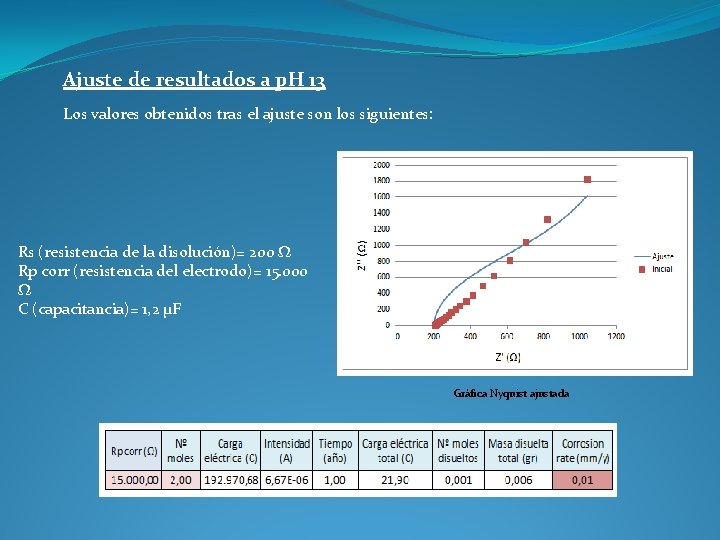
Ajuste de resultados a p. H 13 Los valores obtenidos tras el ajuste son los siguientes: Rs (resistencia de la disolución)= 200 Ω Rp corr (resistencia del electrodo)= 15. 000 Ω C (capacitancia)= 1, 2 µF Gráfica Nyquist ajustada

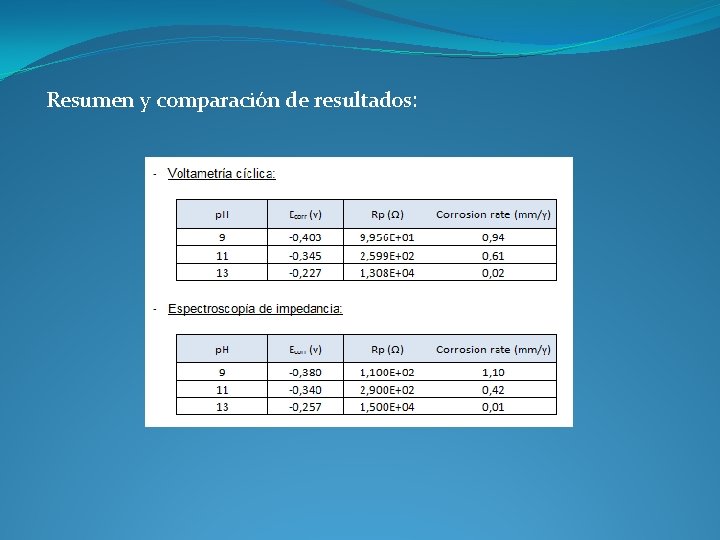
Resumen y comparación de resultados:

Ensayos sobre probetas La secuencia de ensayos es la siguiente: Ø Espectroscopía de impedancia: Obtenemos el OCP del sistema. Ø Voltametría cíclica: Realizamos una polarización reversible aplicando 10 mv a cada lado del OCP. La finalidad del ensayo es la obtención de la velocidad de corrosión de las armaduras, mediante un ensayo no destructivo. Los resultados se obtendrán mediante el método de curvas de Tafel,

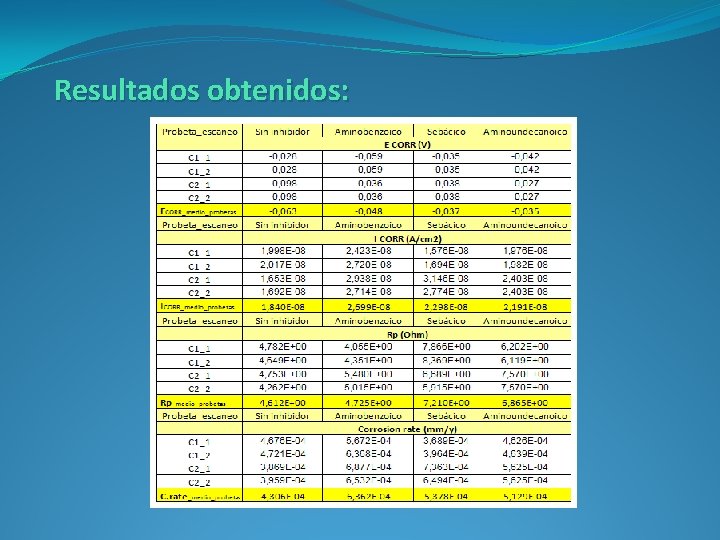
Resultados obtenidos:

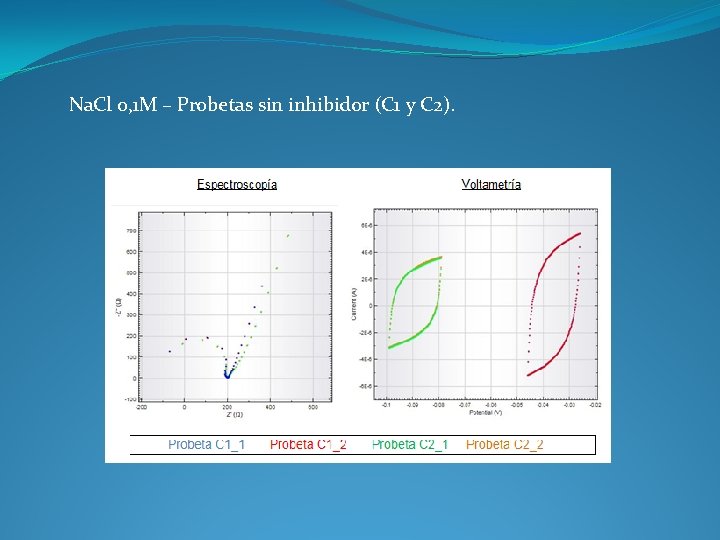
Na. Cl 0, 1 M – Probetas sin inhibidor (C 1 y C 2).

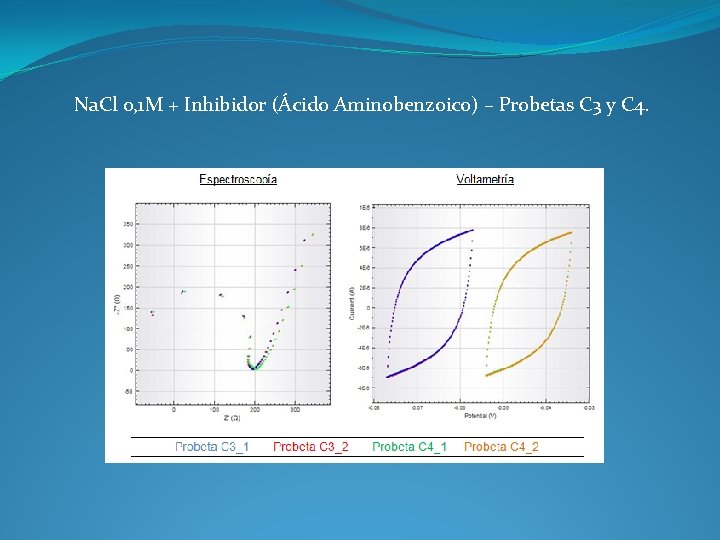
Na. Cl 0, 1 M + Inhibidor (Ácido Aminobenzoico) – Probetas C 3 y C 4.

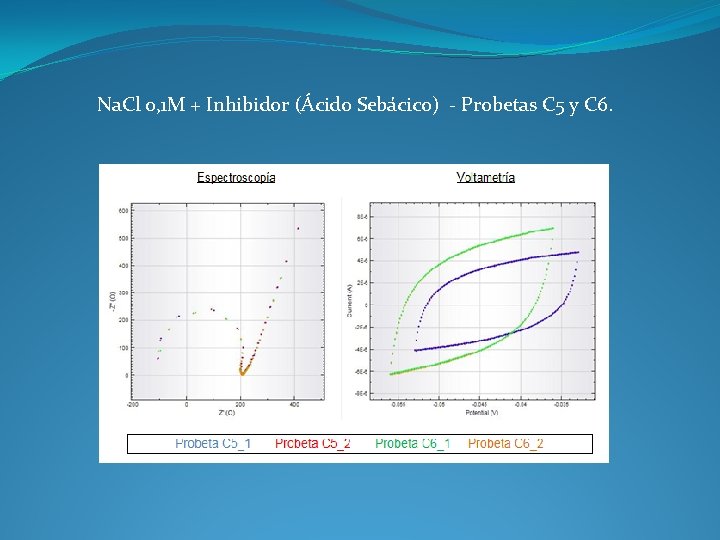
Na. Cl 0, 1 M + Inhibidor (Ácido Sebácico) - Probetas C 5 y C 6.

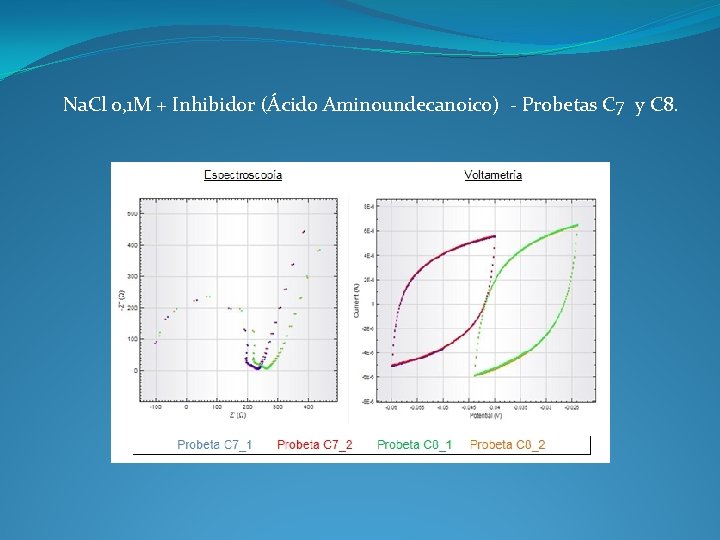
Na. Cl 0, 1 M + Inhibidor (Ácido Aminoundecanoico) - Probetas C 7 y C 8.

Conclusiones Las principales conclusiones son: Ø El inhibidor ácido aminoundecanoico reduce la velocidad de corrosión, en la franja de p. H entre 7 y 9, a valores más bajos que los producidos por los otros dos inhibidores probados. Ø Se comprueba la idoneidad de la utilización conjunta de las dos técnicas electroquímicas para la realización de ensayos no destructivos. Ø Se comprueba la efectividad de las dos técnicas empleadas, al conseguirse datos finales de gran similitud.

Líneas futuras de trabajo Ø Realización de un ensayo con probetas y disoluciones prolongado en el tiempo, permitiendo determinar la influencia de los inhibidores en la rotura de la fase inicial de pasivación. ØEn el ensayo con electrodos, comprobar el comportamiento de las disoluciones con inhibidor en condiciones donde existan variaciones importantes en el contenido de oxígeno. Ø Realización de ensayos de microscopía óptica, permeabilidad, adherencia y mecánicos, que ayuden a caracterizar todos las modificaciones, positivas o negativas, que produce el inhibidor en el hormigón armado.
 Armaduras compuestas
Armaduras compuestas Armadura estatica
Armadura estatica La velocidad
La velocidad Formula velocidad angular
Formula velocidad angular Formula del caudal
Formula del caudal Velocidad relativa fisica
Velocidad relativa fisica Rapidez velocidad y aceleración
Rapidez velocidad y aceleración Centros instantaneos
Centros instantaneos Velocidad y potencia
Velocidad y potencia Course navette velocidad
Course navette velocidad La velocidad es una magnitud vectorial
La velocidad es una magnitud vectorial Movimiento del centro de masa
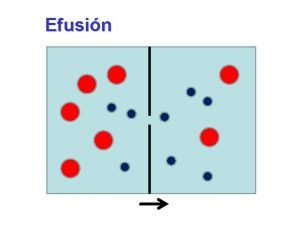
Movimiento del centro de masa Velocidad de efusion
Velocidad de efusion Funcion de rueda
Funcion de rueda Frente de onda
Frente de onda Cangrejo sobre cocodrilo albino
Cangrejo sobre cocodrilo albino Calcula la velocidad
Calcula la velocidad Dibujo mini atletismo
Dibujo mini atletismo 080016600
080016600 Constante de velocidad
Constante de velocidad Formula velocidad tangencial
Formula velocidad tangencial 36km/h a m/s
36km/h a m/s Magnitud del velocímetro
Magnitud del velocímetro Direccion de la velocidad
Direccion de la velocidad Velocidad ciclica y aciclica ejemplos
Velocidad ciclica y aciclica ejemplos Indice de compresibilidad farmacia
Indice de compresibilidad farmacia Movimiento en el plano con velocidad constante
Movimiento en el plano con velocidad constante Lluvia vapor y velocidad turner
Lluvia vapor y velocidad turner Reglamentación del baloncesto
Reglamentación del baloncesto Velocidad impetuosa o movimiento acelerado
Velocidad impetuosa o movimiento acelerado Que es velocidad constante
Que es velocidad constante Q es timbre
Q es timbre Flujo masico
Flujo masico Objetivos de fluidez lectora
Objetivos de fluidez lectora Horizontal
Horizontal Formula velocidad luz
Formula velocidad luz Satelites de pluton
Satelites de pluton Velocidad lectora por edades
Velocidad lectora por edades La velocidad es una magnitud
La velocidad es una magnitud Test de velocidad
Test de velocidad Una unidad eide de gran velocidad
Una unidad eide de gran velocidad Como sacar el periodo de una onda
Como sacar el periodo de una onda Centro instantaneo de velocidad
Centro instantaneo de velocidad Objetivo de la velocidad
Objetivo de la velocidad Actividad enzimatica
Actividad enzimatica Doble periodicidad de la función de onda
Doble periodicidad de la función de onda Movimiento vertical hacia arriba
Movimiento vertical hacia arriba Velocidad gestual
Velocidad gestual Simbolo de velocidad
Simbolo de velocidad Velocidad relativa
Velocidad relativa Velocidad
Velocidad Velocidad
Velocidad Anamnesis alimentaria
Anamnesis alimentaria Relatividad de movimiento
Relatividad de movimiento Formula velocidad tangencial
Formula velocidad tangencial Coordenada absoluta
Coordenada absoluta Instrumento para medir distancias
Instrumento para medir distancias Formulas cinematica
Formulas cinematica Deca hecto kilo mega giga tera peta exa
Deca hecto kilo mega giga tera peta exa Ecuación cuantitativa
Ecuación cuantitativa Palabras leidas por minuto
Palabras leidas por minuto Dribling estatico
Dribling estatico Velocidad maxima
Velocidad maxima Velocidad de sedimentacion globular
Velocidad de sedimentacion globular Juegos de velocidad de procesamiento
Juegos de velocidad de procesamiento Vertical
Vertical Movimiento proyectil
Movimiento proyectil Tabla de velocidad lectora primaria
Tabla de velocidad lectora primaria Vt=2pir/t
Vt=2pir/t Resumen de la velocidad
Resumen de la velocidad Velocidad lectora primaria
Velocidad lectora primaria Velocidad de las particulas
Velocidad de las particulas