Cromatografia Il termine cromatografia indica un insieme di



































- Slides: 61

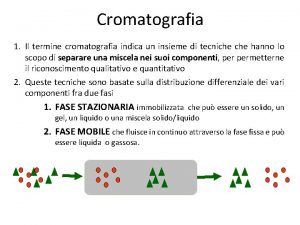
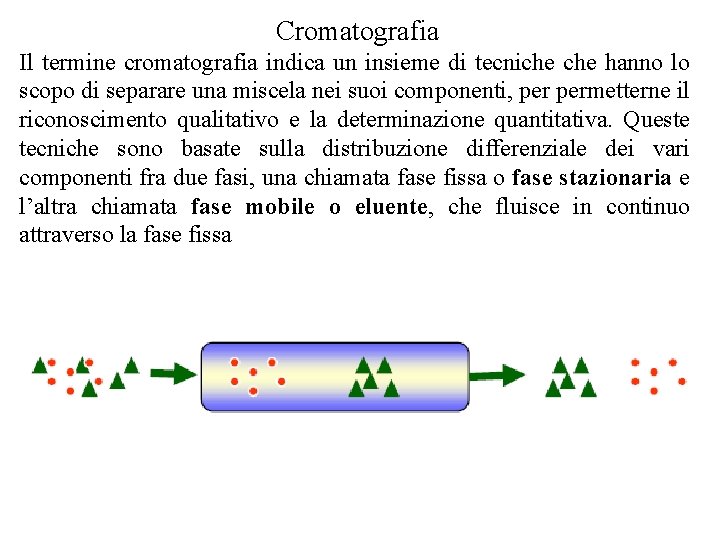
Cromatografia Il termine cromatografia indica un insieme di tecniche hanno lo scopo di separare una miscela nei suoi componenti, permetterne il riconoscimento qualitativo e la determinazione quantitativa. Queste tecniche sono basate sulla distribuzione differenziale dei vari componenti fra due fasi, una chiamata fase fissa o fase stazionaria e l’altra chiamata fase mobile o eluente, che fluisce in continuo attraverso la fase fissa

La cromatografia è nata all’inizio del XX secolo come tecnica per la separazione di pigmenti fogliari, inventata dal botanico russo Mikhail Semenovich Tswett per separare i pigmenti presenti nella clorofilla; un estratto di foglie verdi in etere di petrolio, fu depositato in testa ad una colonna di vetro riempita (impaccata) impaccata con carbonato di calcio (fase solida o stazionaria) ed eluito con solfuro di carbonio (fase mobile): i vari pigmenti in funzione della loro maggiore o minore affinità con la fase mobile e/o la fase stazionaria si separavano in bande colorate, in particolare clorofilla A e B, carotene e xantofilla Carotene Xantofilla Clorofilla b Tswett chiamò questa tecnica cromatografia dal greco scrittura del colore

Le diverse sostanze o molecole che compongono la miscela iniziale si separano in funzione della loro affinità chimico-fisica con la fase eluente e/o con la fase stazionaria; i composti più affini con la fase stazionaria tenderanno ad interagire (ripartirsi) preferenzialmente con quest’ultima; questa interazione ritarderà il tempo di eluizione. Viceversa i composti più simili alla fase eluente avranno una minore interazione con la fase stazionaria e quindi un tempo di eluizione più rapido


Le molecole della miscela devono avere interazioni reversibili con le due fasi; le interazioni non devono quindi portare ad una modificazione chimica delle molecole ( e. g. formazione o rottura di legami covalenti) Le affinità sono quindi basate su interazioni deboli Ølegami a idrogeno ØInterazione idrofobica Ø interazioni dipolo-dipolo indotto Ø forze di Van der Waals Ø attrazione coulombiana Ø interazioni steriche In queste interazioni svolge un ruolo solitamente decisivo la polarità delle due fasi. Spesso possono essere presenti più tipi di interazione nello stesso processo cromatografico. Un ruolo nella separazione è svolto anche dalla dimensioni delle molecole.

Ponendo all’uscita della colonna un rivelatore che misuri la concentrazione del soluto nell’eluato (cioè la fase mobile che esce dalla colonna) e riportando il segnale in funzione del tempo si può ottenere un cromatogramma La posizione dei picchi sull’asse dei tempi, o tempo di ritenzione, serve per identificare i componenti del campione. L’area sottesa dai picchi è proporzionale alla quantità di ogni singolo componente e può essere utilizzata a scopo quantitativo

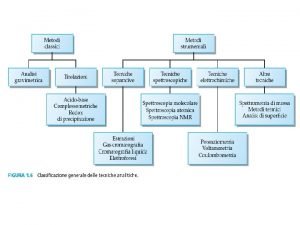
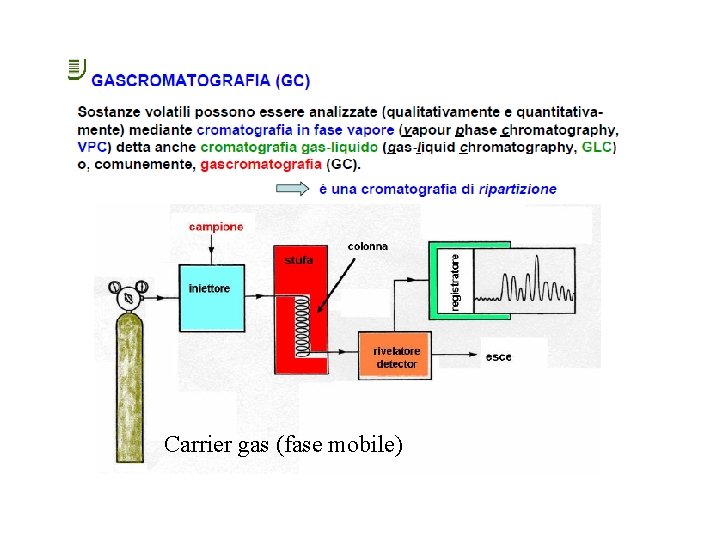
In base allo stato fisico della mobile possiamo classificare le tecniche cromatografiche come segue: Cromatografia Liquida (LC): la fase mobile è un liquido nel quale siano solubili i componenti della miscela da separare; la fase stazionaria deve essere insolubile nella fase mobile La cromatografia liquida è impiegata per la separazione di sostanze non volatili, neutre o ioniche, e di sostanze termolabili (e. g. proteine, aminoacidi, carboidrati, fenoli, ioni inorganici etc. ) Gascromatografia (GC): la fase mobile è un gas che funge da carrier per i componenti della miscela. La gascromatografia è impiegata per la separazione di sostanze volatili, che non subiscono variazioni chimiche ad alte temperature lipidi (acid grassi, alcol, steroli, terpenoidi), sostanze aromatiche (lignina), carboidrati, inquinanti organici (idrocarburi, PAH etc. )

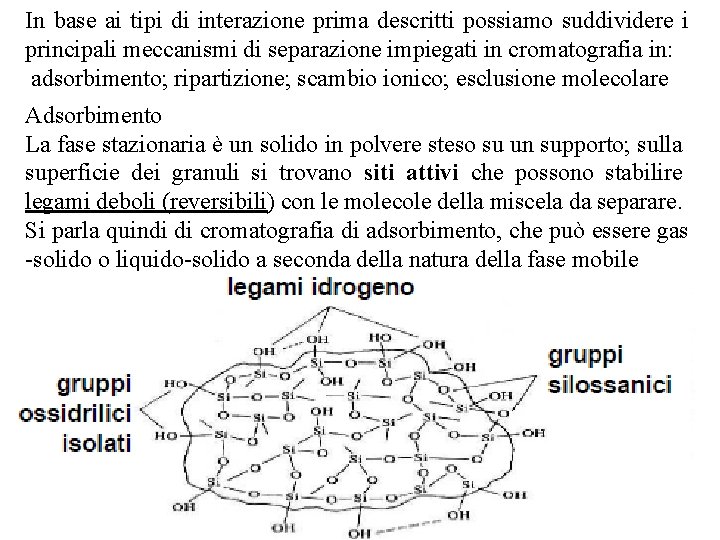
In base ai tipi di interazione prima descritti possiamo suddividere i principali meccanismi di separazione impiegati in cromatografia in: adsorbimento; ripartizione; scambio ionico; esclusione molecolare Adsorbimento La fase stazionaria è un solido in polvere steso su un supporto; sulla superficie dei granuli si trovano siti attivi che possono stabilire legami deboli (reversibili) con le molecole della miscela da separare. Si parla quindi di cromatografia di adsorbimento, che può essere gas -solido o liquido-solido a seconda della natura della fase mobile La cromatografia di adsorbimento è utilizzata per separare sostanze neutre polari o non polari, di natura organica o inorganica Le interazioni tra superficie adsorbente e soluto variano da non specifiche (forze di dispersione o di Van der Waals) a specifiche (interazioni elettrostatiche o interazioni tra accettori o donatori di elettroni -legami idrogeno).

Ripartizione La fase stazionaria è un liquido che impregna un solido granulare inerte o è ad esso chimicamente legato; in questo liquido le molecole da separare sono solubili; la fase stazionaria e la fase mobile devono invece essere immiscibili. Durante l’eluizione le molecole si distribuiscono (ripartiscono) dinamicamente tra le due fasi secondo la diversa solubilità; la cromatografia di ripartizione può essere gasliquido o liquido-liquido a seconda della natura della fase mobile La cromatografia di ripartizione è chiamata in fase normale se la fase stazionaria è più polare della fase mobile, mentre è chiamata fase inversa se la fase stazionaria è meno polare della fase mobile. Si tratta della tecnica più comunemente impiegata per la separazione di sostanze organiche

Scambio ionico La fase stazionaria è costituita da un polimero inerte contenente siti attivi ionizzati o ionizzabili, i cui controioni possono essere scambiati con altri ioni aventi carica dello stesso segno. Il meccanismo di separazione è basato sulla competizione per i siti di scambio tra gli ioni presenti nella fase mobile e quelli presenti nel campione. Si parla di cromatografia di scambio ionico (IEC) La cromatografia a scambio ionico è impiegata per la separazione di sostanze ioniche o ionizzabili Fasi stazionarie: polimeri funzionalizzate con gruppi carichi (solfonici, carbossilici, amminici). Fase mobile: contiene generalmente un controione di carica opposta al gruppo ionico sulla superficie, per la formazione di una coppia ionica + +

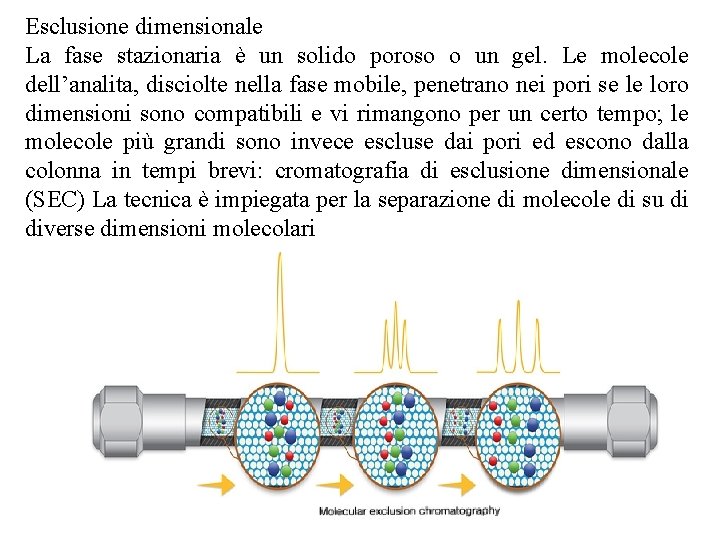
Esclusione dimensionale La fase stazionaria è un solido poroso o un gel. Le molecole dell’analita, disciolte nella fase mobile, penetrano nei pori se le loro dimensioni sono compatibili e vi rimangono per un certo tempo; le molecole più grandi sono invece escluse dai pori ed escono dalla colonna in tempi brevi: cromatografia di esclusione dimensionale (SEC) La tecnica è impiegata per la separazione di molecole di su di diverse dimensioni molecolari

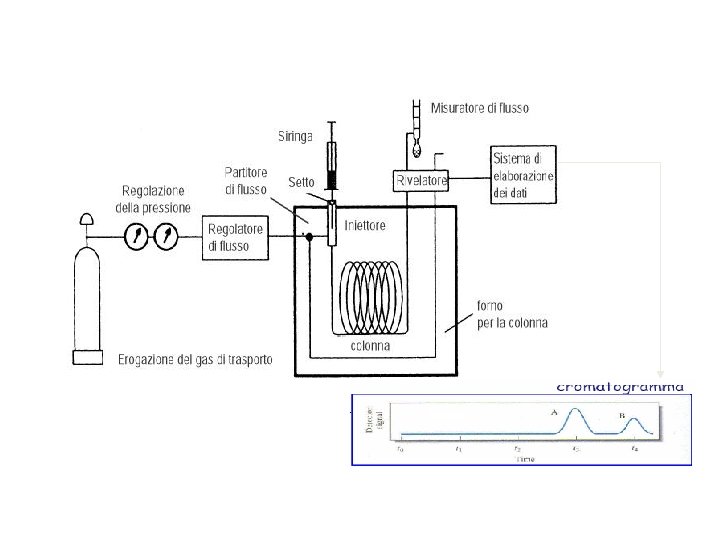
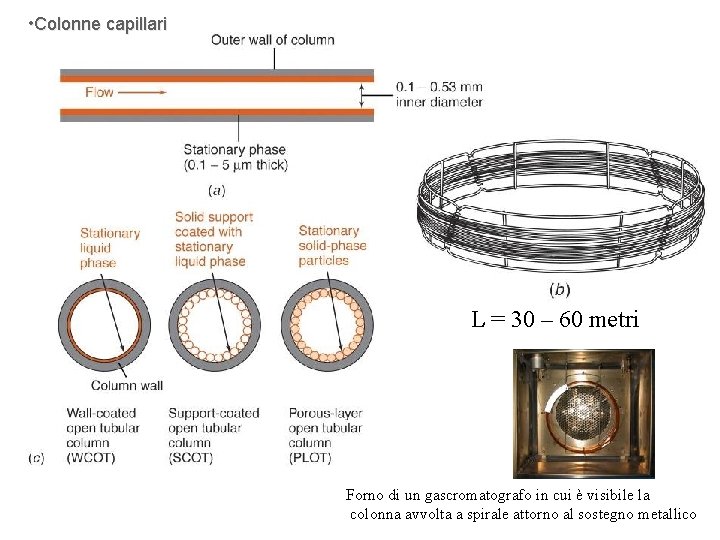
Nella gascromatografia il campione è vaporizzato e poi iniettato in colonna; un gas costituisce la fase mobile ma in questo caso non ha alcuna interazione con i soluti in quanto agisce soltanto da carrier, cioè trasporta i soluti lungo la colonna: gas inerte He 2, N 2, H 2 I composti analizzabili in un sistema GC devono avere T. eb. < 300°C e non devono essere termolabili , ovvero non devono degradarsi per effetto della temperatura Gas-liquido: supporto inerte solido- liquido non volatile (altobollente), legato covalentemente- meccanismo di ripartizione Colonne impaccate: contengono un supporto solido inerte, finemente suddiviso (comumente basato su terra di diatomee), ricoperto di fase stazionaria liquida Colonne capillari: WCOT (Wall Coated Open Tubular), strato sottile di fase liquida (1μm) depositato sulla superficie


Carrier gas (fase mobile)

La separazione delle molecole in gas cromatografia dipende dalla diversa temperatura di ebollizione e dalla interazione con la fase stazionaria Polarità: molecole più polari hanno temperature di ebollizione più alte Peso molecolare: per le stesse classi di composti, con composizione chimica simile, le molecole più grandi avranno una T. eb più alta e una interazione maggiore con la fase stazionaria (tempo di ritenzione maggiore) In Gas Cromatografia la separazione delle molecole si basa quindi sulla scelta della fase stazionaria più idonea (in funzione della natura chimica del campione polare o apolare e sull’impiego di temperature costanti o crescenti durante l’analisi

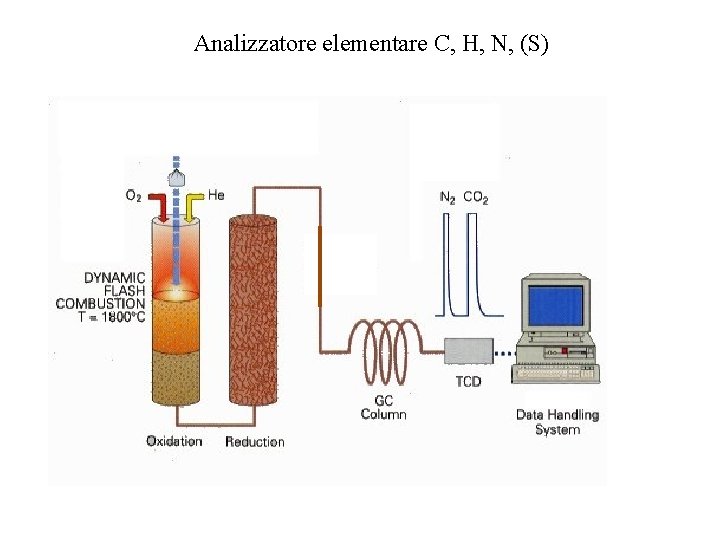
L’analisi elementare si basa sulla determinazione del contenuto di N, C (H, S) del campione. E’ una tecnica gas cromatografica per cui i diversi elementi devono essere portati in fase gassosa; l’analisi prevede quindi una combustione iniziale del campione (T = 1800°C) in presenza di O 2 e di reagenti che facilitano una iniziale ossidazione della sostanza organica a cui fa seguito una reazione di riduzione Il Carbonio viene convertito in CO 2, l’Azoto in N 2, l’Idrogeno in H 2 O ed lo Zolfo a SO 2 Il Carrier gas (He –fase mobile) trasporta i composti in forma gassosa verso la colonna cromatografica (colonna impaccata) dove i composti si separano in funzione della diversa polarità e secondariamente in base al peso molecolare nel seguente ordine N=N < O=C=O < H-O-H < SO 2


Analizzatore elementare C, H, N, (S)


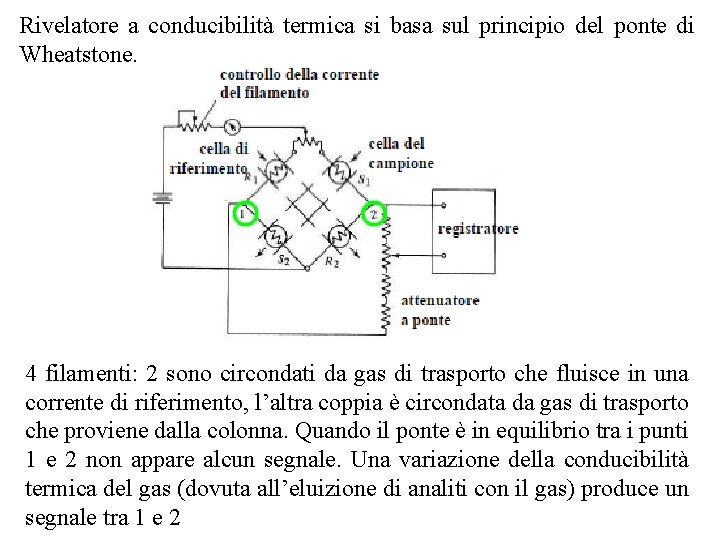
Rivelatore a conducibilità termica si basa sul principio del ponte di Wheatstone. 4 filamenti: 2 sono circondati da gas di trasporto che fluisce in una corrente di riferimento, l’altra coppia è circondata da gas di trasporto che proviene dalla colonna. Quando il ponte è in equilibrio tra i punti 1 e 2 non appare alcun segnale. Una variazione della conducibilità termica del gas (dovuta all’eluizione di analiti con il gas) produce un segnale tra 1 e 2

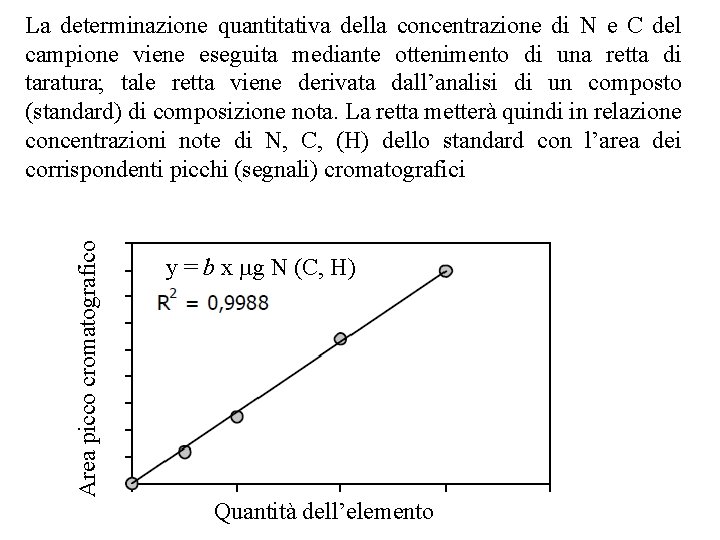
Area picco cromatografico La determinazione quantitativa della concentrazione di N e C del campione viene eseguita mediante ottenimento di una retta di taratura; tale retta viene derivata dall’analisi di un composto (standard) di composizione nota. La retta metterà quindi in relazione concentrazioni note di N, C, (H) dello standard con l’area dei corrispondenti picchi (segnali) cromatografici y = b x mg N (C, H) Quantità dell’elemento

La relazione tra area del segnale cromatografico e quantità dell’elemento sarà utilizzata per determinare la concentrazione incognita dell’elemento nel campione (suolo, tessuto vegetale, materiale organico etc) partendo dall’area dei segnali cromatografici tramite la relazione Area N (C, H)Cp : Area N (C, H)St = mg. N (C, H) Cp: mg. N (C, H)St mg. N (C, H) Cp = Area Cp/Area St x m g. St La quantità dell’elemento divisa per il peso del campione utilizzato per l’analisi darà la concentrazione, generalmente espressa in % (g/100 g)


Il carrier (elio, azoto, argon, idrogeno) deve avere un’elevata inerzia chimica nei confronti della fase stazionaria e del materiale di cui è costituita la colonna. Non deve essere segnalato dal rivelatore o deve fornire un rumore di fondo trascurabile

• Colonne capillari L = 30 – 60 metri Forno di un gascromatografo in cui è visibile la colonna avvolta a spirale attorno al sostegno metallico

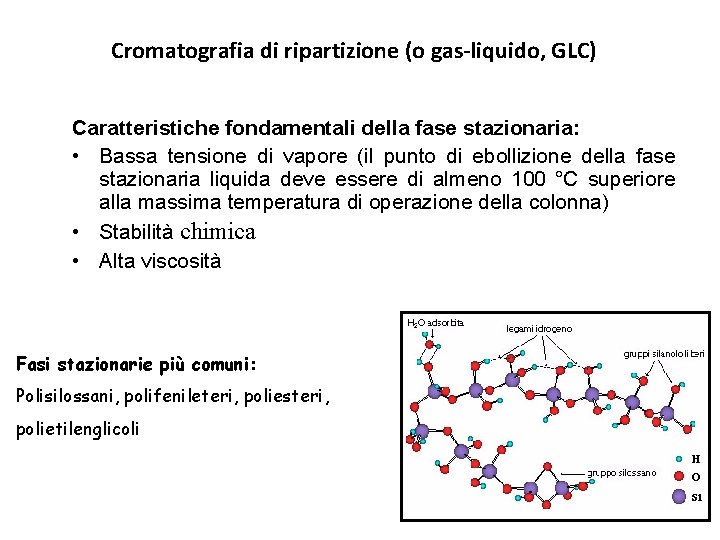
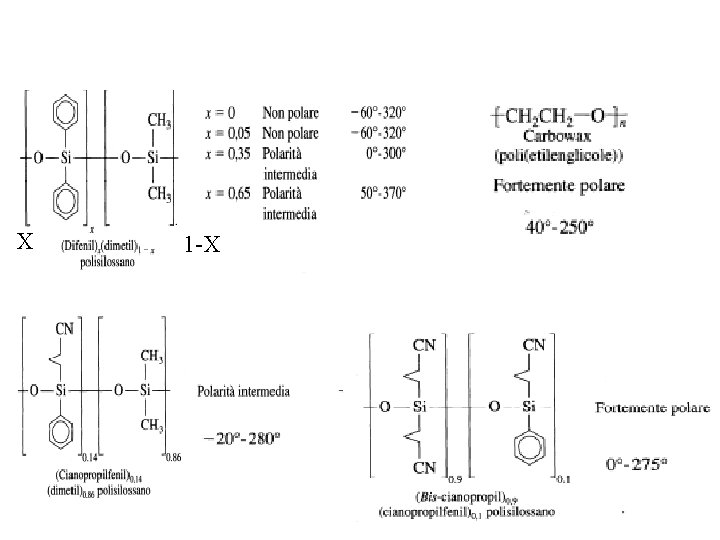
Cromatografia di ripartizione (o gas-liquido, GLC) Caratteristiche fondamentali della fase stazionaria: • Bassa tensione di vapore (il punto di ebollizione della fase stazionaria liquida deve essere di almeno 100 °C superiore alla massima temperatura di operazione della colonna) • Stabilità chimica • Alta viscosità Fasi stazionarie più comuni: Polisilossani, polifenileteri, poliesteri, polietilenglicoli


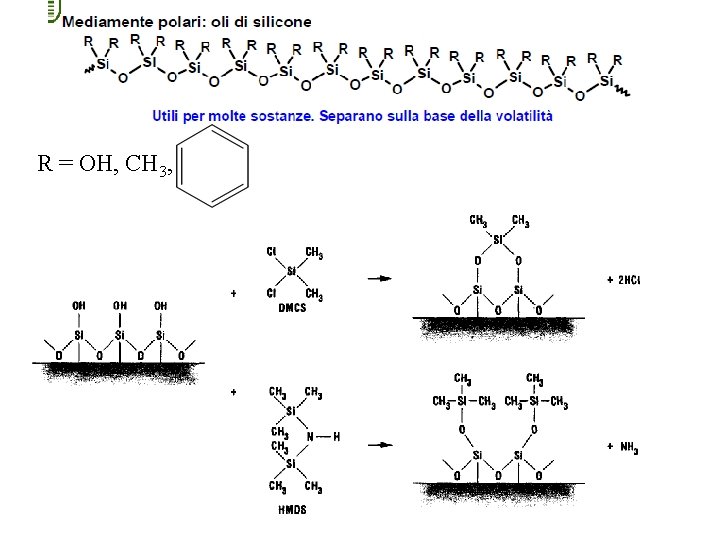
R = OH, CH 3,

X 1 -X


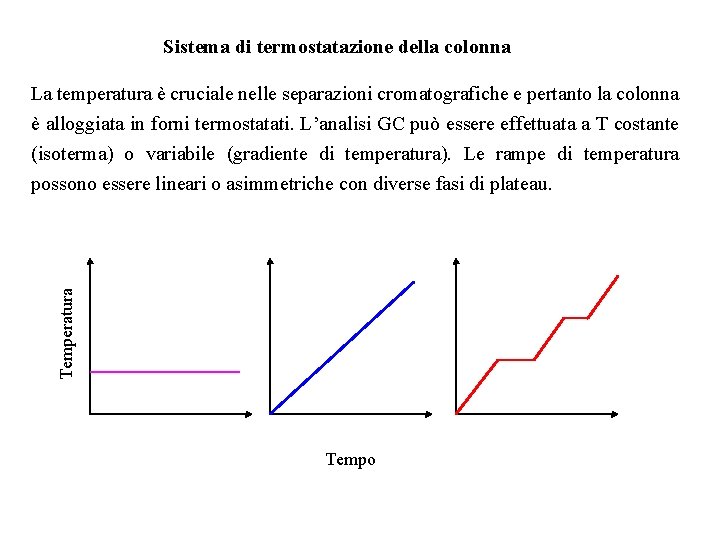
Sistema di termostatazione della colonna Temperatura La temperatura è cruciale nelle separazioni cromatografiche e pertanto la colonna è alloggiata in forni termostatati. L’analisi GC può essere effettuata a T costante (isoterma) o variabile (gradiente di temperatura). Le rampe di temperatura possono essere lineari o asimmetriche con diverse fasi di plateau. Tempo

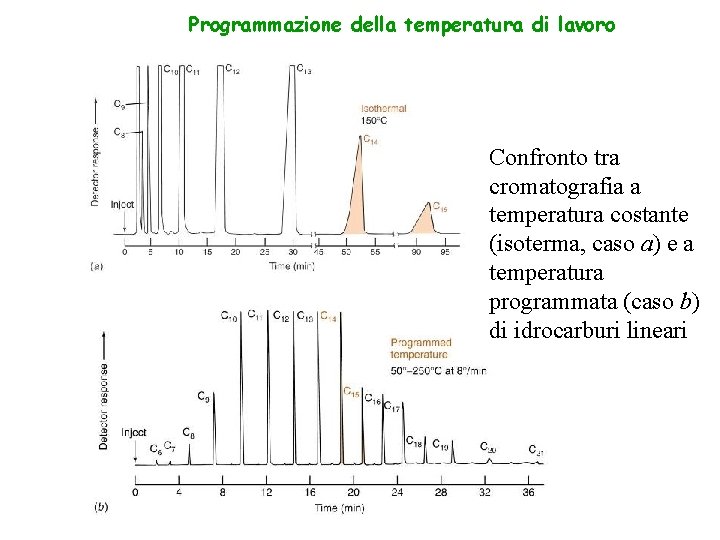
Programmazione della temperatura di lavoro Confronto tra cromatografia a temperatura costante (isoterma, caso a) e a temperatura programmata (caso b) di idrocarburi lineari


(alte temperature!)




Rivelatori per GC Uno dei punti di forza della tecnica GC è la grande varietà dei rivelatori disponibili. Alcuni sono aspecifici e quindi di uso generale (TCD, FID), altri sono invece molto specifici. Quelli universalmente accettati sono TCD ed FID, ma è sempre più diffuso l’impiego del rivelatore a spettrometria di massa (MS) Rivelatori più utilizzati: • • a conducibilità termica (TCD) a ionizzazione di fiamma (FID) a cattura di elettroni (ECD) a ionizzazione in fiamma termoionico (rivelatore azoto-fosforo, NPD)

• si misura la variazione di conducibilità termica in un flusso di H 2 ed He (Conducibilità termica di elio ed idrogeno è circa 6– 10 > composti organici e non) • si tratta di un rivelatore non specifico, quindi risponde ad ogni tipo di composto • la sensibilità è una delle peggiori Campione Riferimento

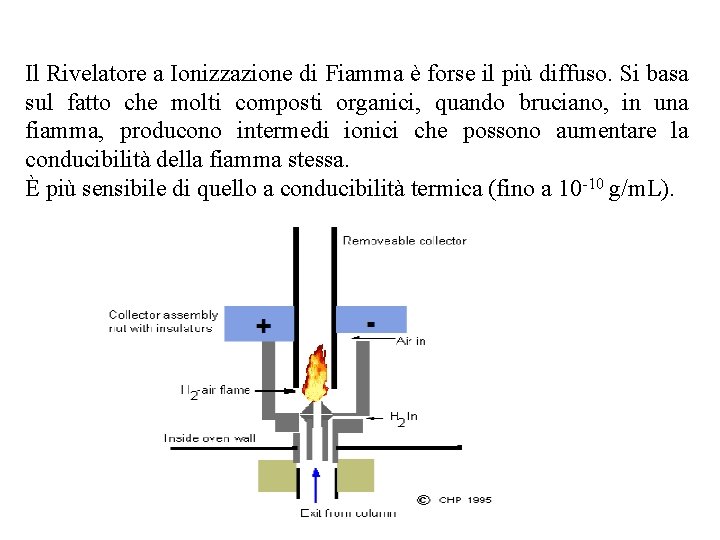
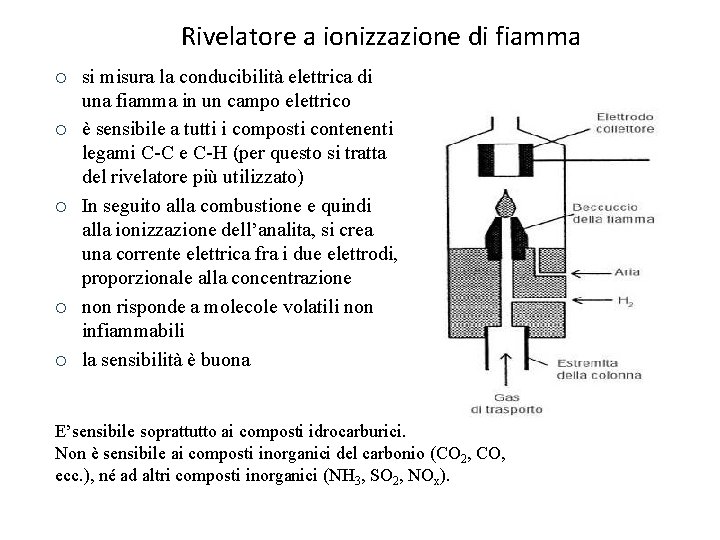
Il Rivelatore a Ionizzazione di Fiamma è forse il più diffuso. Si basa sul fatto che molti composti organici, quando bruciano, in una fiamma, producono intermedi ionici che possono aumentare la conducibilità della fiamma stessa. È più sensibile di quello a conducibilità termica (fino a 10 -10 g/m. L).

Rivelatore a ionizzazione di fiamma ¡ ¡ ¡ si misura la conducibilità elettrica di una fiamma in un campo elettrico è sensibile a tutti i composti contenenti legami C-C e C-H (per questo si tratta del rivelatore più utilizzato) In seguito alla combustione e quindi alla ionizzazione dell’analita, si crea una corrente elettrica fra i due elettrodi, proporzionale alla concentrazione non risponde a molecole volatili non infiammabili la sensibilità è buona E’sensibile soprattutto ai composti idrocarburici. Non è sensibile ai composti inorganici del carbonio (CO 2, CO, ecc. ), né ad altri composti inorganici (NH 3, SO 2, NOx).

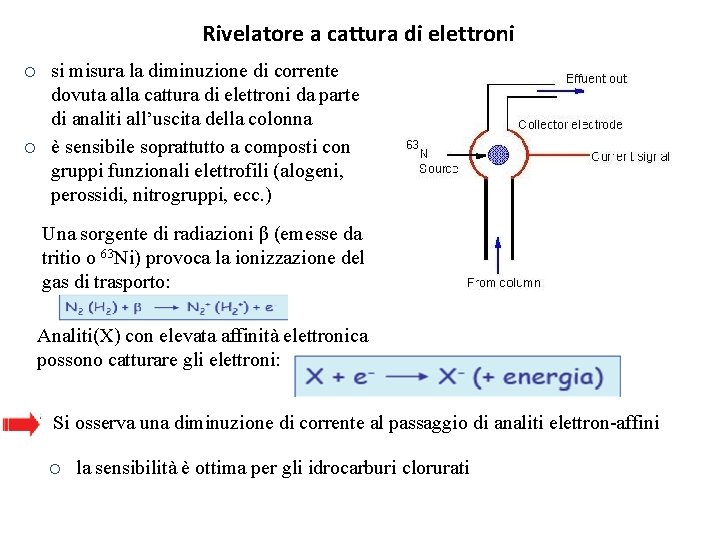
Rivelatore a cattura di elettroni ¡ ¡ si misura la diminuzione di corrente dovuta alla cattura di elettroni da parte di analiti all’uscita della colonna è sensibile soprattutto a composti con gruppi funzionali elettrofili (alogeni, perossidi, nitrogruppi, ecc. ) Una sorgente di radiazioni β (emesse da tritio o 63 Ni) provoca la ionizzazione del gas di trasporto: Analiti(X) con elevata affinità elettronica possono catturare gli elettroni: Si osserva una diminuzione di corrente al passaggio di analiti elettron-affini ¡ la sensibilità è ottima per gli idrocarburi clorurati

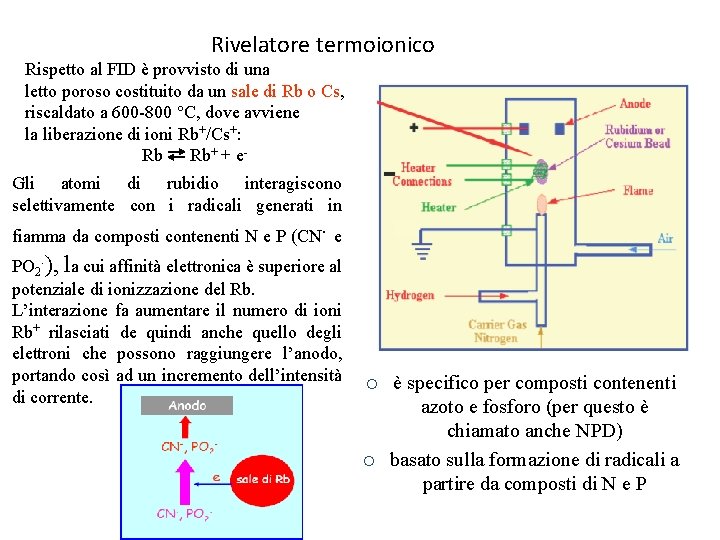
Rivelatore termoionico Rispetto al FID è provvisto di una letto poroso costituito da un sale di Rb o Cs, riscaldato a 600 -800 °C, dove avviene la liberazione di ioni Rb+/Cs+: Rb Rb+ + e. Gli atomi di rubidio interagiscono selettivamente con i radicali generati in fiamma da composti contenenti N e P (CN. e PO 2. ), la cui affinità elettronica è superiore al potenziale di ionizzazione del Rb. L’interazione fa aumentare il numero di ioni Rb+ rilasciati de quindi anche quello degli elettroni che possono raggiungere l’anodo, portando così ad un incremento dell’intensità di corrente. ¡ ¡ è specifico per composti contenenti azoto e fosforo (per questo è chiamato anche NPD) basato sulla formazione di radicali a partire da composti di N e P

Derivatizzazione in GC • La derivatizazzione è un processo che permette di modificare chimicamente un composto (> polare e altobollente) al fine di ottenere un derivato le cui proprietà chimico-fisiche sono compatibili con l’analisi GC • La derivatizzazione permette le seguenti modifiche: - aumento la volatilità (riduce la polarità di gruppi come OH, NH) - aumenta la stabilità (e. g. ione molecolare spettrometria di massa) - aumenta la sensibilità (inserimento di gruppi alogenati per ECD) • Le principali reazioni di derivatizzazione sono: • Silanizzazione • Alchilazione

La silanizzazione produce composti volatili e stabili termicamente. In tale reazione l’H attivato viene sostituito con un gruppo trimetil-sililico mediante una reazione di attacco nucleofilo (SN 2; la reazione è guidata dal gruppo uscente) L’agente silanizzante più semplice è il trimetilclorosilano (CH 3)3 -Si-Cl -OH -SH -COOH -NH 2 -NH CONH 2 TMS-Cl -OTMS -STMS -COOTMS -NHTMS, N(TMS)2 -NTMS CONHTMS • La reattività del gruppo funzionale verso la silanizzazione il seguente: Alcoli (primario> secondario>terziario) > fenolo > carbossile > ammina> • Dato che i reattivi reagiscono con H 2 O, è necessario usare solventi anidri (la piridina è il solvente più utilizzato)


Derivatizzazione mediante alchilazione Campione-OH + R-X Campione-OR + H-X La derivatizzazione mediante alchilazione riduce la polarità di molecole sostituendo idrogeni attivi con gruppi alchilici. La reazione si effettua con alogenuri alchilici o arilici, diazoalcani secondo le reazioni: R-NH 2 + 2 Cl-R’ R-NR’ + 2 HCl R-COOH + CH 2 N 2 RCOO-CH 3 + N 2 R-OH R-SH R-COOH R-NH 2 R-NH R-CONH 2 R-OR’ R-SR’ R-COOR’ R-NHR’ R-NR’ 2 R-COONR’ 2 Tra i principali agenti alchilanti: BF 3 in Me. OH, KOH in Me. OH pentafluorobenzilbromuri


La determinazione dei composti volatili è generalmente effettuata con la gascromatografia (GC). La GC è utilizzata per la separazione di sostanze volatili o volatilizzabili come idrocarburi, aromi, acidi organici. Tra le varie versioni, particolarmente utilizzata in campo agroalimentare è quella accoppiata alla spettrometria di massa (GC-MS) nella quale, è possibile avere informazioni strutturali sulle sostanze separate Interfaccia cromatografo – spettrometro di massa Spettrometro di massa al PC Iniettore Forno per la colonna Impostazione dei parametri strumentali

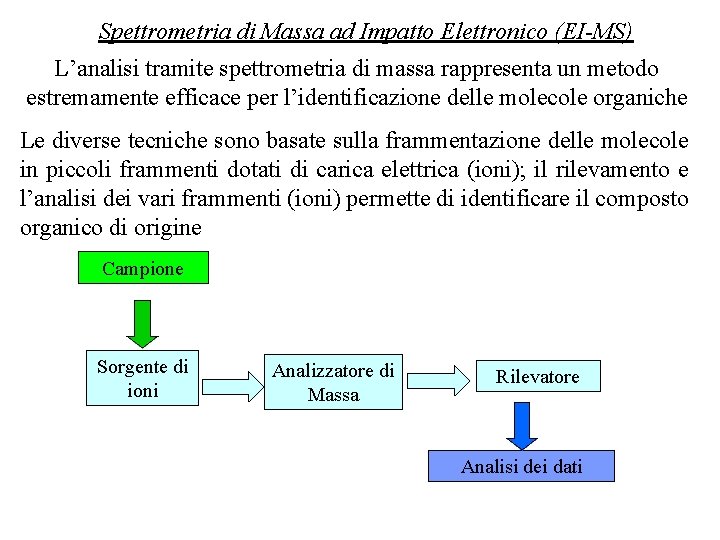
Spettrometria di Massa ad Impatto Elettronico (EI-MS) L’analisi tramite spettrometria di massa rappresenta un metodo estremamente efficace per l’identificazione delle molecole organiche Le diverse tecniche sono basate sulla frammentazione delle molecole in piccoli frammenti dotati di carica elettrica (ioni); il rilevamento e l’analisi dei vari frammenti (ioni) permette di identificare il composto organico di origine Campione Sorgente di ioni Analizzatore di Massa Rilevatore Analisi dei dati

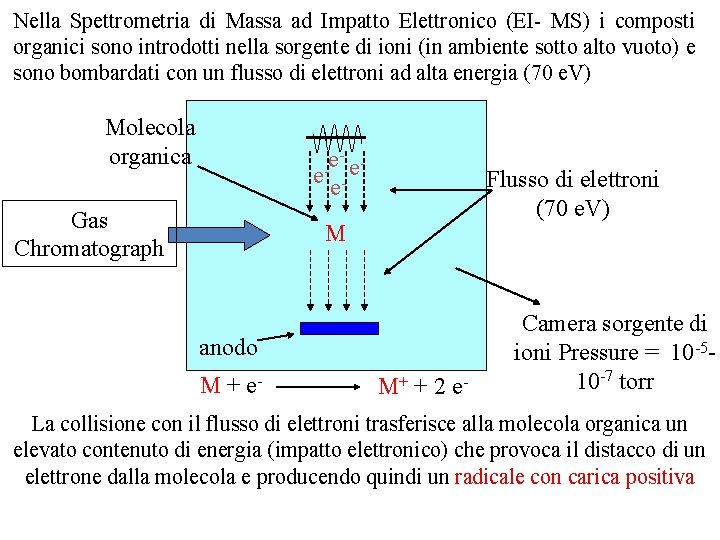
Nella Spettrometria di Massa ad Impatto Elettronico (EI- MS) i composti organici sono introdotti nella sorgente di ioni (in ambiente sotto alto vuoto) e sono bombardati con un flusso di elettroni ad alta energia (70 e. V) Molecola organica e e- Gas Chromatograph Flusso di elettroni (70 e. V) M anodo M + e- M+ + 2 e - Camera sorgente di ioni Pressure = 10 -510 -7 torr La collisione con il flusso di elettroni trasferisce alla molecola organica un elevato contenuto di energia (impatto elettronico) che provoca il distacco di un elettrone dalla molecola e producendo quindi un radicale con carica positiva

Il frammento con carica positiva ha un elevata energia ed è altamente instabile e inizia a cedere l’eccesso di energia mediante la scomposizione (frammentazione) in piccoli frammenti positivi con masse di dimensioni via più piccole (frammenti di massa positivi) con bassi pesi molecolari m+ m+ M+ frammentazione m+ m+ m+ m + + m m + + + m +m m m I diversi frammenti di massa (ioni) sono “raccolti” tramite delle “lenti elettroniche” e sono accelerati e spinti nella zona dell’ analizzatore di massa che provvede a separare i frammenti in base al loro peso molecolare: gli ioni più piccoli sono più veloci I frammenti che escono dall’analizzatore di massa sono raccolti ad intervalli regolari (1 secondo) ed inviati al sistema di rilevamento Mass spectra

Ion source Electronic lens and accelerating slit Mass analyzer Collector and amplifier

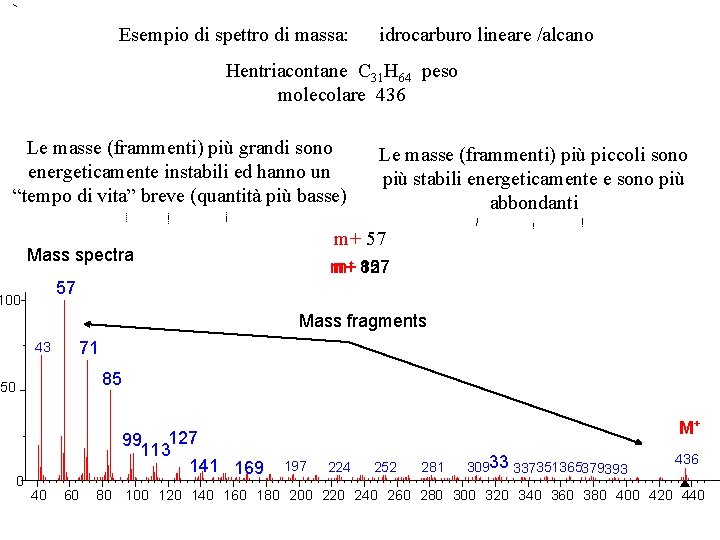
Esempio di spettro di massa: idrocarburo lineare /alcano Hentriacontane C 31 H 64 peso molecolare 436 Le masse (frammenti) più grandi sono energeticamente instabili ed hanno un “tempo di vita” breve (quantità più basse) Le masse (frammenti) più piccoli sono più stabili energeticamente e sono più abbondanti m+ 57 Mass spectra m+ m+ 127 85 57 100 Mass fragments 43 71 85 50 0 99 127 113 141 169 40 60 M+ 197 224 252 281 30933 337351365379393 436 80 100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420 440

Il principale vantaggio della EI-MS è che ogni classe di composti organici hanno lo stesso comportamento di frammentazione: molecole simili si frammentano nello stesso modo ed è quindi più facile identificarli Lo spettro di massa è quindi una impronta digitale (fingerprint) dello specifica classe di composti organici Lo spettro di massa ottenuto tramite la tecnica EI-MS semplifica l’identificazione dei composti organici incogniti I moderni spettrometri di massa sono sempre associati con dei computer e dei software che permettono una rapida interpretazione dello spettro di massa il software consente un rapido confronto tra lo spettro di massa del composto incognito col lo spettro di massa di composti standard contenuti nelle librerie e nei database

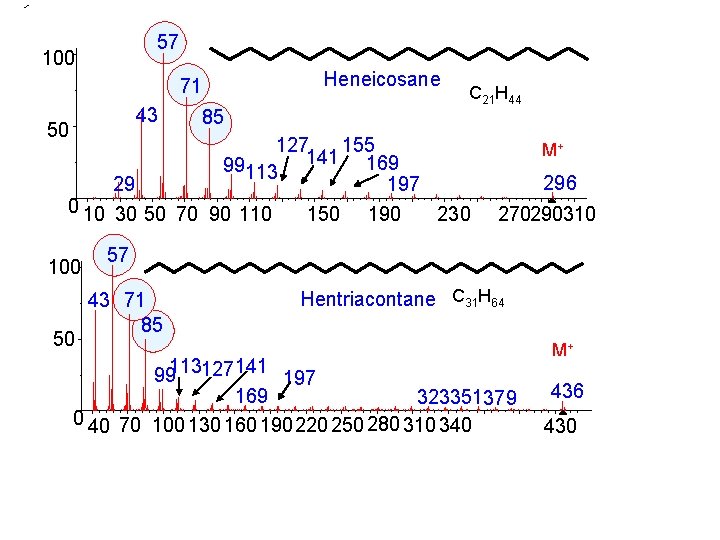
57 100 Heneicosane 71 43 50 29 85 127 155 141 169 99113 197 0 10 30 50 70 90 110 100 50 C 21 H 44 150 190 M+ 296 230 270290310 57 43 71 85 Hentriacontane C 31 H 64 99113127141 197 169 323351379 0 40 70 100 130 160 190 220 250 280 310 340 M+ 436 430

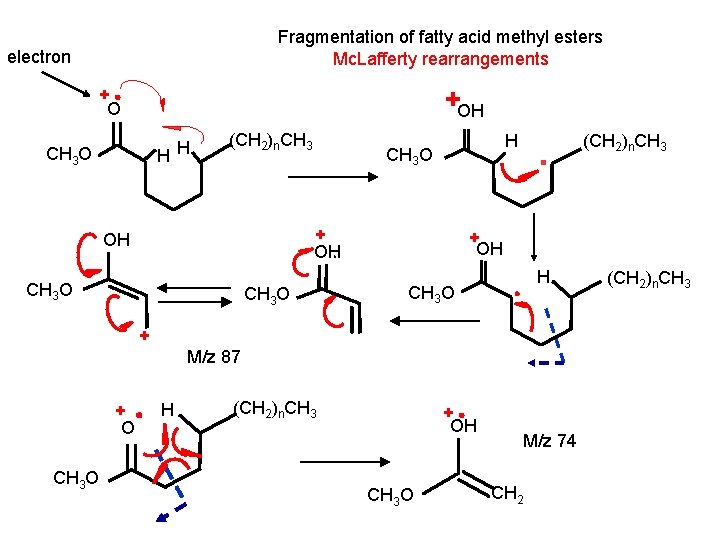
Fragmentation of fatty acid methyl esters Mc. Lafferty rearrangements electron +OH + O H H CH 3 O (CH 2)n. CH 3 H CH 3 O + OH OH CH 3 O (CH 2)n. CH 3 + OH H CH 3 O + M/z 87 + O CH 3 O H (CH 2)n. CH 3 + OH CH 3 O M/z 74 CH 2 (CH 2)n. CH 3

Acidi Grassi esteri metilici 74 100 C 15 f. a. acido pentadecanoico m. e. 87 M+ 50 55 143 111 129 157 69 0 74 100 50 83 97 111 326 171 157 185 129 0 74 87 199 213 283 269 295 C 30 f. a. acido triacontanoico m. e. 143 M+ 466 57 69 83 97 0 M+ 143 55 100 256 C 20 f. a. acido eicosanoico m. e. 87 69 50 213225 171 185 199 111 129 157 171 213 199 227 241 255 269 283 297 311 325 339 353 367 381 409 423 435

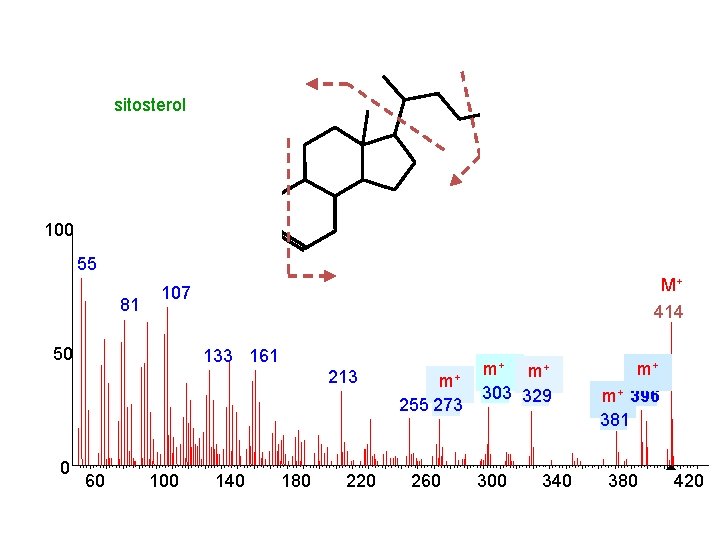
sitosterol 100 HO HO 55 81 M+ 414 107 50 133 161 213 m+ 255 273 0 60 100 140 180 220 260 m+ m+ 303 329 300 340 m+ m+ 396 381 380 420

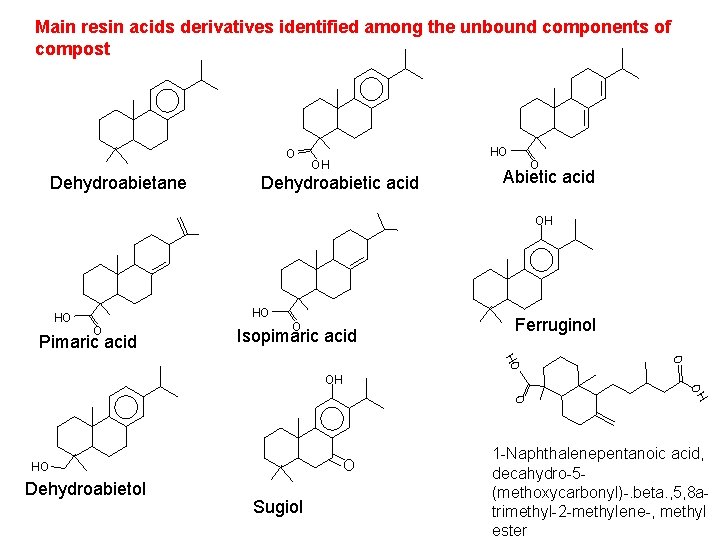
Main resin acids derivatives identified among the unbound components of compost O Dehydroabietane HO OH O Dehydroabietic acid Abietic acid OH HO HO O Pimaric acid O Isopimaric acid Ferruginol O HO OH O Dehydroabietol Sugiol H O O HO 1 -Naphthalenepentanoic acid, decahydro-5(methoxycarbonyl)-. beta. , 5, 8 atrimethyl-2 -methylene-, methyl ester

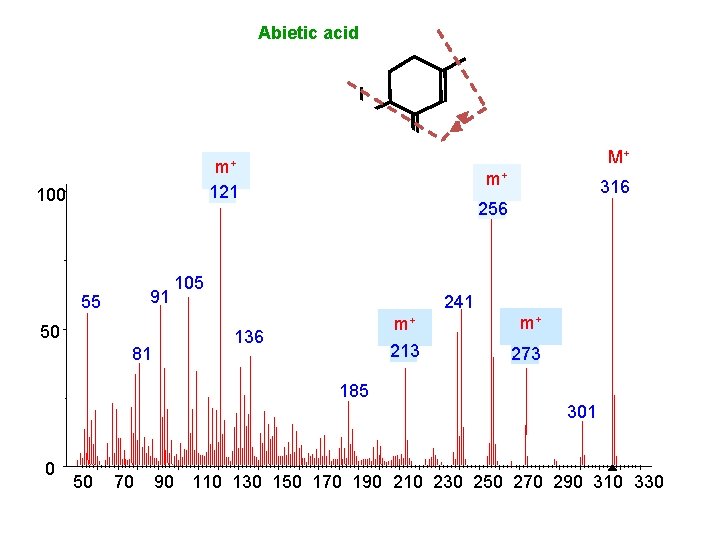
Abietic acid m+ 121 100 M+ m+ O 256 O 91 55 50 81 316 105 241 m+ 213 136 m+ 273 185 301 0 50 70 90 110 130 150 170 190 210 230 250 270 290 310 330
 Il termine 'hardware' indica:
Il termine 'hardware' indica: L'orchestra è un insieme di
L'orchestra è un insieme di Lo sono gli enti geometrici con una sola faccia
Lo sono gli enti geometrici con una sola faccia L'efficacia della deontologia dipende da:
L'efficacia della deontologia dipende da: Insieme di procedure
Insieme di procedure Tutti insieme per un mondo migliore
Tutti insieme per un mondo migliore Regole per stare bene in classe
Regole per stare bene in classe Divina commedia parafrasi inferno
Divina commedia parafrasi inferno Mitosi video
Mitosi video Impariamo insieme matematica
Impariamo insieme matematica Due piroscafi a e b sono partiti insieme
Due piroscafi a e b sono partiti insieme Insiemi disgiunti
Insiemi disgiunti Due piroscafi a e b sono partiti insieme
Due piroscafi a e b sono partiti insieme Definizione di insieme matematico
Definizione di insieme matematico Retta dei numeri
Retta dei numeri Insieme di cromosomi
Insieme di cromosomi I sintagmi cosa sono
I sintagmi cosa sono Uova e pesce insieme
Uova e pesce insieme La deontologia mette insieme
La deontologia mette insieme Insieme delle acque presenti sulla terra
Insieme delle acque presenti sulla terra è tanto bello essere amici giocare insieme sentirsi felici
è tanto bello essere amici giocare insieme sentirsi felici Insieme parzialmente ordinato
Insieme parzialmente ordinato Strofa a 5 versi
Strofa a 5 versi Un programma è un insieme di
Un programma è un insieme di Rappresentazione intensiva di un insieme
Rappresentazione intensiva di un insieme Indieme q
Indieme q Insieme numeri interi
Insieme numeri interi Insieme q
Insieme q Emsland gymnasium rheine termine
Emsland gymnasium rheine termine Cosa significa il termine bibbia
Cosa significa il termine bibbia Complemento oggetto scuola primaria
Complemento oggetto scuola primaria Forma normale equazione secondo grado
Forma normale equazione secondo grado Punktehürden abi bayern
Punktehürden abi bayern Il barocco ppt
Il barocco ppt Que toda familia comece e termine sabendo onde vai
Que toda familia comece e termine sabendo onde vai Il termine vangelo significa
Il termine vangelo significa Comparativo di minoranza in latino
Comparativo di minoranza in latino Artista maledetto decadentismo
Artista maledetto decadentismo Leggi ponderali della chimica
Leggi ponderali della chimica Complemento di termine
Complemento di termine Interrogative passive
Interrogative passive Calcola il medio proporzionale
Calcola il medio proporzionale Tossico a lungo termine
Tossico a lungo termine Significato
Significato La parola bibbia deriva dal greco
La parola bibbia deriva dal greco Avanguardie storiche
Avanguardie storiche Da dove deriva il termine romanticismo
Da dove deriva il termine romanticismo Francesco flora ermetismo
Francesco flora ermetismo No dejes que termine sin haber crecido un poco
No dejes que termine sin haber crecido un poco Pronomi personali definizione
Pronomi personali definizione Glc cromatografia
Glc cromatografia Interacción hidrofóbica
Interacción hidrofóbica Cromatografia
Cromatografia Cromatografia em coluna
Cromatografia em coluna Fases
Fases Cromatografia inversa
Cromatografia inversa Tiempo de retencion ajustado
Tiempo de retencion ajustado Cromatografia a scambio ionico
Cromatografia a scambio ionico Cromatoplaca
Cromatoplaca Interação quimica
Interação quimica Cromatografia en columna
Cromatografia en columna Mikhail tswett cromatografia
Mikhail tswett cromatografia