INTRODUO A MTODOS CROMATOGRFICOS Vvian Nazareth Oliveira Mestranda














- Slides: 24

INTRODUÇÃO A MÉTODOS CROMATOGRÁFICOS Vívian Nazareth Oliveira Mestranda Orientador: Prof. Dr. Marcone Augusto 1

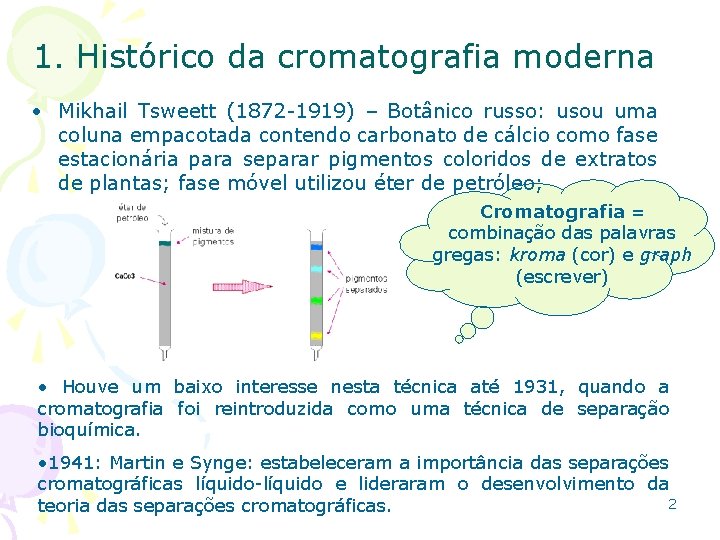
1. Histórico da cromatografia moderna • Mikhail Tsweett (1872 -1919) – Botânico russo: usou uma coluna empacotada contendo carbonato de cálcio como fase estacionária para separar pigmentos coloridos de extratos de plantas; fase móvel utilizou éter de petróleo; Cromatografia = combinação das palavras gregas: kroma (cor) e graph (escrever) • Houve um baixo interesse nesta técnica até 1931, quando a cromatografia foi reintroduzida como uma técnica de separação bioquímica. • 1941: Martin e Synge: estabeleceram a importância das separações cromatográficas líquido-líquido e lideraram o desenvolvimento da 2 teoria das separações cromatográficas.

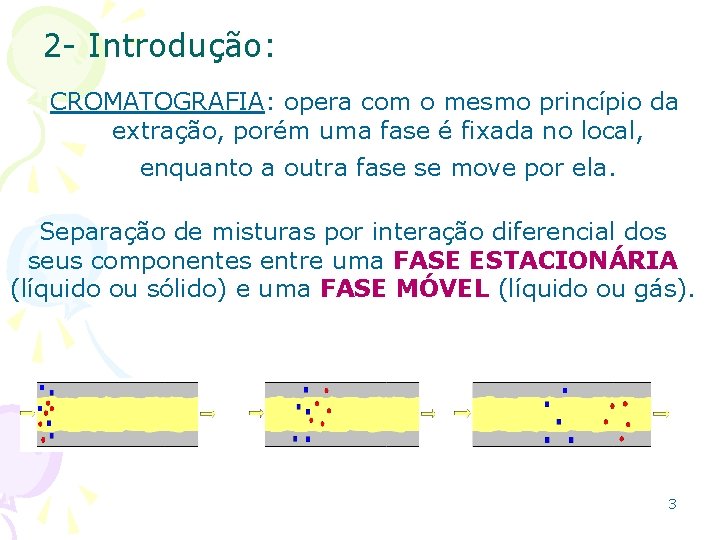
2 - Introdução: CROMATOGRAFIA: opera com o mesmo princípio da extração, porém uma fase é fixada no local, enquanto a outra fase se move por ela. Separação de misturas por interação diferencial dos seus componentes entre uma FASE ESTACIONÁRIA (líquido ou sólido) e uma FASE MÓVEL (líquido ou gás). 3

2 - Introdução: Fase MÓVEL: solvente que percorre a coluna • Líquido • Gás Cromatografia Líquida Cromatografia Gasosa Fase ESTACIONÁRIA: fixada dentro da coluna – é normalmente um líquido viscoso que cobre o interior de um tubo capilar ou a superfície de partículas sólidas empacotadas dentro da coluna, ou, as próprias partículas sólidas podem ser a FE. Planar Cromatografia Coluna 4

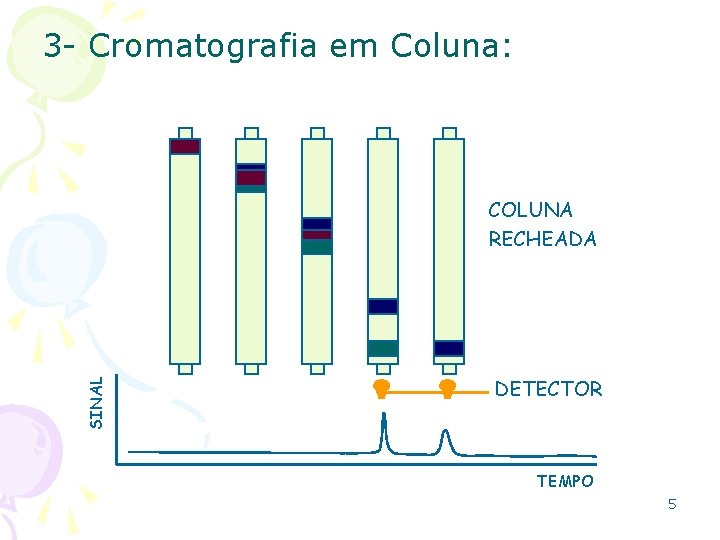
3 - Cromatografia em Coluna: SINAL COLUNA RECHEADA DETECTOR TEMPO 5

4 - Tipos de cromatografia: A cromatografia é dividida em categorias com base no mecanismo de interação da substância dissolvida com a FE: • Cromatografia de adsorção: Utiliza uma fase estacionária sólida e uma fase móvel liquida ou gasosa. O soluto é adsorvido na superfície da partícula sólida. O equilíbrio entre a FE e FM justifica a separação dos diferentes solutos. Soluto adsorvido na superfície da FE 6

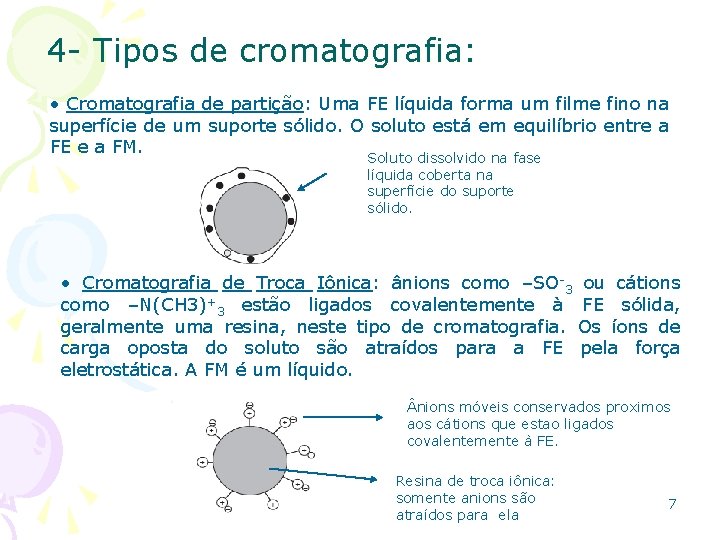
4 - Tipos de cromatografia: • Cromatografia de partição: Uma FE líquida forma um filme fino na superfície de um suporte sólido. O soluto está em equilíbrio entre a FE e a FM. Soluto dissolvido na fase líquida coberta na superfície do suporte sólido. • Cromatografia de Troca Iônica: ânions como –SO-3 ou cátions como –N(CH 3)+3 estão ligados covalentemente à FE sólida, geralmente uma resina, neste tipo de cromatografia. Os íons de carga oposta do soluto são atraídos para a FE pela força eletrostática. A FM é um líquido. nions móveis conservados proximos aos cátions que estao ligados covalentemente à FE. Resina de troca iônica: somente anions são atraídos para ela 7

4 - Tipos de cromatografia: • Cromatografia de exclusão molecular: Também chamada de cromatografia de filtração de gel ou de permeação em gel, esta técnica separa as moléculas pelo tamanho, com os maiores solutos passando por ela com maior velocidade. Ao contrário dos outros tipos de cromatografia, não há interações atrativas entre a FE e o soluto no caso real da exclusão molecular. Mais exatamente, a FM líquida ou gasosa passa pelo gel poroso. Os poros são pequenos o suficiente para excluírem as moléculas grandes do soluto, mas não as pequenas. O fluxo de moléculas grandes passa sem entrar pelos poros. As moléculas pequenas levam mais tempo para passar pela coluna, porque elas entram no gel e portanto devem passar por um volume maior antes de sair da coluna. As moléculas pequenas penetram nos poros das partículas As moléculas grandes são excluídas 8

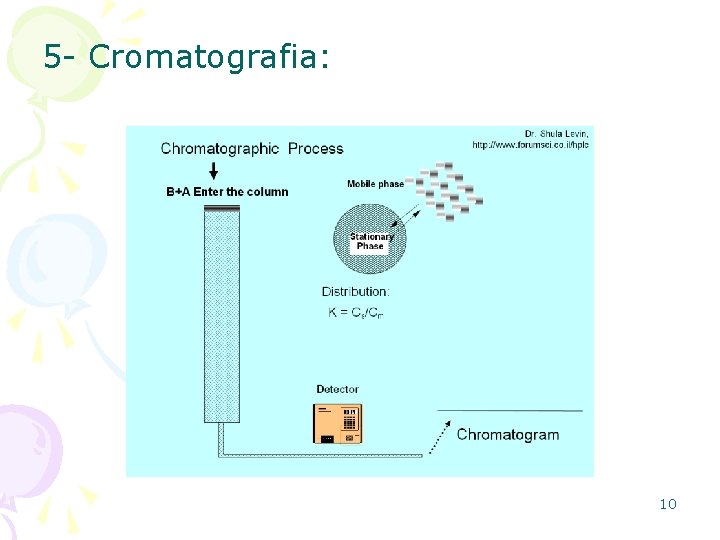
5 - Cromatografia: Uma típica coluna cromatográfica experimenta um perfil como mostrado na figura ao lado. A figura retrata uma cromatografia líquido-sólido. O modelo da coluna e o estado físico da FM e FE podem variar. A amostra é introduzida no topo da coluna, como uma reduzida banda. O perfil inicial da concentração é retangular. Como a amostra se move pela coluna os solutos começam a separar e, bandas individuais começam a se ampliar e desenvolver um perfil gaussianico. Se a força da interação de cada soluto com a FE é suficientemente diferente, então os solutos se separam em bandas individuais. O processo de separação cromatográfico é monitorado com um conveniente detector situado no final da coluna. 9

5 - Cromatografia: 10

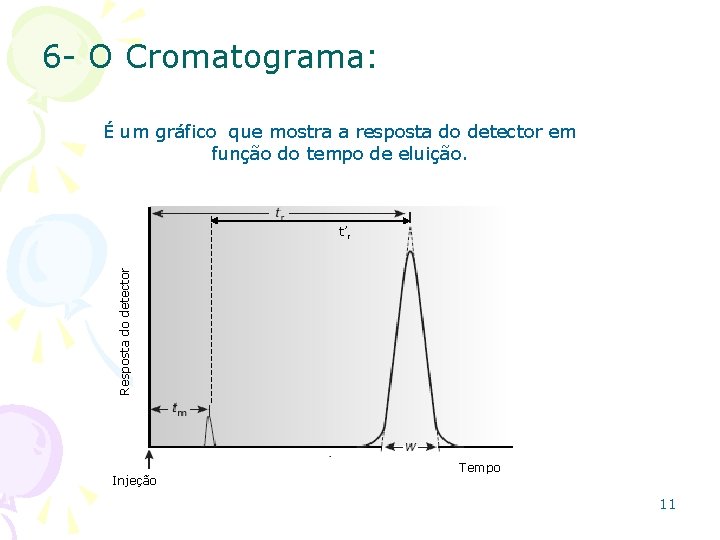
6 - O Cromatograma: É um gráfico que mostra a resposta do detector em função do tempo de eluição. Resposta do detector t’r Injeção Tempo 11

6 - O Cromatograma: • tr: Tempo de retenção – para cada componente é o tempo necessário após a injeção da mistura na coluna até aquele componente alcançar o detector; • Vr: Volume de retenção – volume necessário de fase móvel para eluir o soluto dissolvido na coluna; • tm: mínimo tempo possível para a FM não retida percorrer a coluna. Solutos que não interagem com a FE são eluídos neste tempo; • t’r: Tempo de retenção ajustado – é o tempo adicional necessário para o soluto percorrer o comprimento da coluna, além do tempo utilizado pelo solvente não-retido; 12

6 - O Cromatograma: • k’: Fator capacidade – para cada pico no cromatograma é definido como: k’ = tr – tm = t’r tm tm • α: Retenção relativa – para qualquer um dos componentes, 1 e 2, é a razão dos seus tempos de retenção ajustados. α = t’r 2 = tr 2 – tm = k’ 2 t’r 1 – tm k’ 1 Onde: t’r 2 > t’r 1, logo, α > 1 13

6 - O Cromatograma: Ex. : 1 - Em uma análise cromatográfica de ácido de baixo peso molecular, o ácido butírico elui com um tempo de retenção (tr) de 7, 63 min. O tempo de retenção da fase móvel (tm) é 0, 31 min. Calcule o fator de capacidade (k’) do ácido butírico. (23, 6) 2 - Na mesma análise cromatografica para acidos de baixo peso molecular do exemplo anterior, o tempo de retenção para o ácido isobutírico é 5, 98 min. Qual a retenção relativa (α) para o ácido butírico e isobutírico? (1, 29) 14

7 - Eficiência da coluna: Resposta do detector tangentes ao ponto de inflexão (pontos de inflexão) W 1/2 = 2, 354 wi = 2 O soluto movendo pela coluna cromatográfica tende a se dispersar numa forma gaussiana com um desvio-padrão . Quanto mais tempo um soluto passa na coluna, mais larga se torna a banda. wb = 4 15

8 - Eficiência de separação: Alguns fatores contribuem para uma boa separação por cromatografia, entre eles: - Diferença de tempo de eluição entre os picos: quanto mais afastados, melhor a separação; - Alargamento dos picos: quanto mais largo for o pico, pior será sua separação. 16

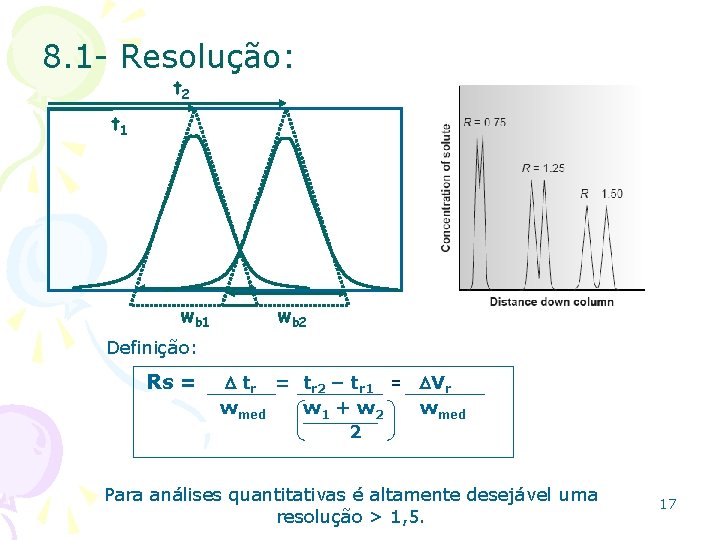
8. 1 - Resolução: t 2 t 1 wb 2 Definição: Rs = tr = tr 2 – tr 1 = Vr wmed w 1 + w 2 wmed 2 Para análises quantitativas é altamente desejável uma resolução > 1, 5. 17

8. 1 - Resolução: Ex. : 1 - Um pico com tempo de retenção de 407 s tem uma largura na base de 13 s. Um pico vizinho é eluído a 424 s com uma largura de 16 s. Encontre a resolução entre esses dois componentes. (1, 17) 18

8. 2 - Altura do prato: É uma constante de proporcionalidade entre a variancia ( 2) da banda e a distancia que ela percorreu: H= 2 x Quanto < a altura do prato, mais estreita a largura da banda. A habilidade de uma coluna de separar os componentes de uma mistura é aumentada pela diminuição da altura do prato. CG H 0, 1 a 1 mm HPLC H 10 m EC H <1 m 19

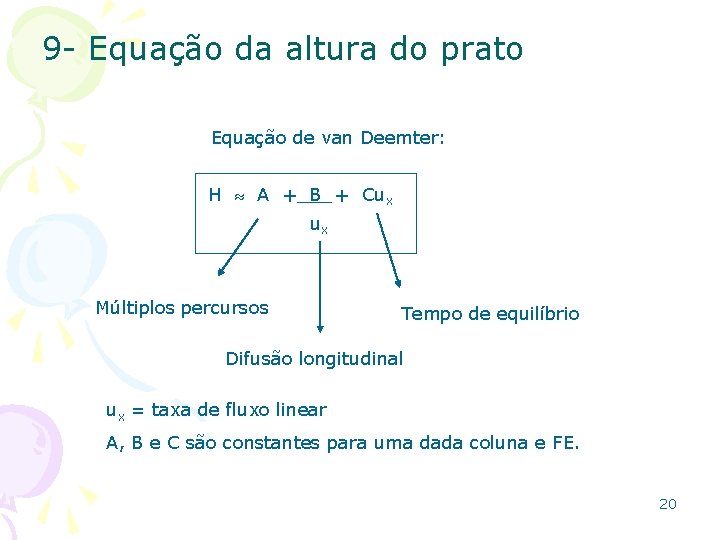
9 - Equação da altura do prato Equação de van Deemter: H A + B + Cux ux Múltiplos percursos Tempo de equilíbrio Difusão longitudinal ux = taxa de fluxo linear A, B e C são constantes para uma dada coluna e FE. 20

10 - Equação de van Deemter Termo A: Múltiplos percursos • múltiplos caminhos que a molécula encontra durante seu percurso na coluna; • comprimento dos percursos podem diferir consideravelmente; assim o tempo de residência da molécula na coluna também varia; 21

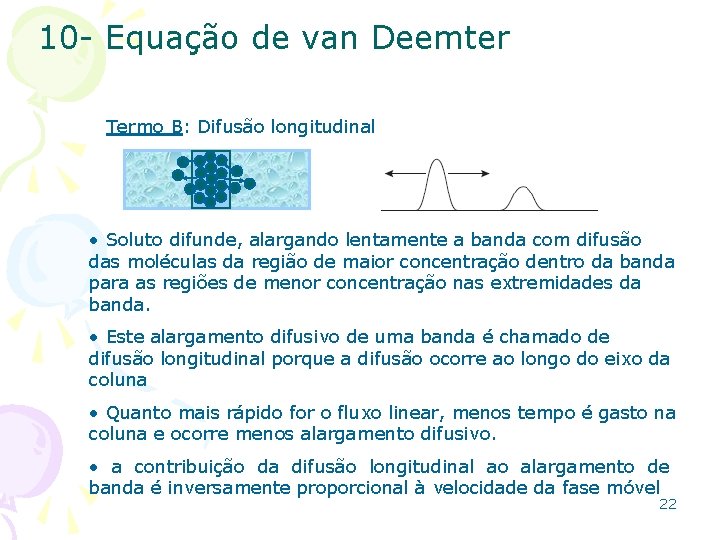
10 - Equação de van Deemter Termo B: Difusão longitudinal • Soluto difunde, alargando lentamente a banda com difusão das moléculas da região de maior concentração dentro da banda para as regiões de menor concentração nas extremidades da banda. • Este alargamento difusivo de uma banda é chamado de difusão longitudinal porque a difusão ocorre ao longo do eixo da coluna • Quanto mais rápido for o fluxo linear, menos tempo é gasto na coluna e ocorre menos alargamento difusivo. • a contribuição da difusão longitudinal ao alargamento de banda é inversamente proporcional à velocidade da fase móvel 22

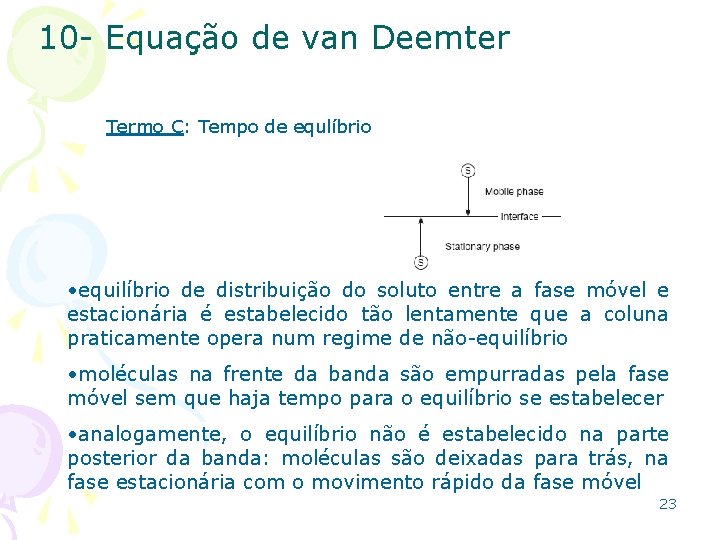
10 - Equação de van Deemter Termo C: Tempo de equlíbrio • equilíbrio de distribuição do soluto entre a fase móvel e estacionária é estabelecido tão lentamente que a coluna praticamente opera num regime de não-equilíbrio • moléculas na frente da banda são empurradas pela fase móvel sem que haja tempo para o equilíbrio se estabelecer • analogamente, o equilíbrio não é estabelecido na parte posterior da banda: moléculas são deixadas para trás, na fase estacionária com o movimento rápido da fase móvel 23

10 - Equação de van Deemter Termo C: Tempo de equlíbrio • alargamento devido a efeitos de transferência de massa ocorrem porque os vários caminhos que a fase móvel percorre dentro da coluna ou a camada de líquido imobilizada na fase estacionária, tem dimensões finitas; assim, é necessário um certo tempo para que o soluto possa difundir do interior dessas fases para a interface, onde a transferência ocorre; este tempo de atraso faz com que a situação de não-equilíbrio persista • nos processos de transferência de massa, quanto mais rápida for a velocidade da fase móvel, menos tempo existe para que o equilíbrio seja alcançado; portanto a contribuição dos processos de transferência de massa ao alargamento de banda é proporcional à velocidade da fase móvel 24
 Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Método del calendario
Método del calendario Mtodos
Mtodos Funda de plastico latex que evita el paso de espermatozoide
Funda de plastico latex que evita el paso de espermatozoide Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Colegio familia de nazareth
Colegio familia de nazareth Nazareth virtual tour
Nazareth virtual tour Evert vandenberghe
Evert vandenberghe Alexandra nazareth
Alexandra nazareth Klump v. nazareth area school district
Klump v. nazareth area school district Jesus rejected at nazareth mark
Jesus rejected at nazareth mark Luke 4 rejection at nazareth
Luke 4 rejection at nazareth Simon srugi
Simon srugi Guido rocha jesus
Guido rocha jesus Simon srugi
Simon srugi Anjolina
Anjolina Alberto de oliveira parnasianismo
Alberto de oliveira parnasianismo Anjolina grisi de oliveira
Anjolina grisi de oliveira Anjolina grisi de oliveira
Anjolina grisi de oliveira Roberto imbuzeiro oliveira
Roberto imbuzeiro oliveira














































