53 e congrs EASL Paris du 11 au































- Slides: 163

53 e congrès EASL Paris, du 11 au 15 avril 2018 Coordination Marc Bourlière - Hôpital Saint-Joseph, Marseille Stanislas Pol - Hôpital Cochin, Paris Rédaction Jean-Pierre Bronowicki – CHU Nancy Christophe Hézode - CHU Créteil Victor de Ledinghen, CHU Bordeaux Georges-Philippe Pageaux – CHU Montpellier Dominique Thabut - Hôpital Pitié-Salpêtrière, Paris une édition AEI

Hépatites virales Epidémiologie

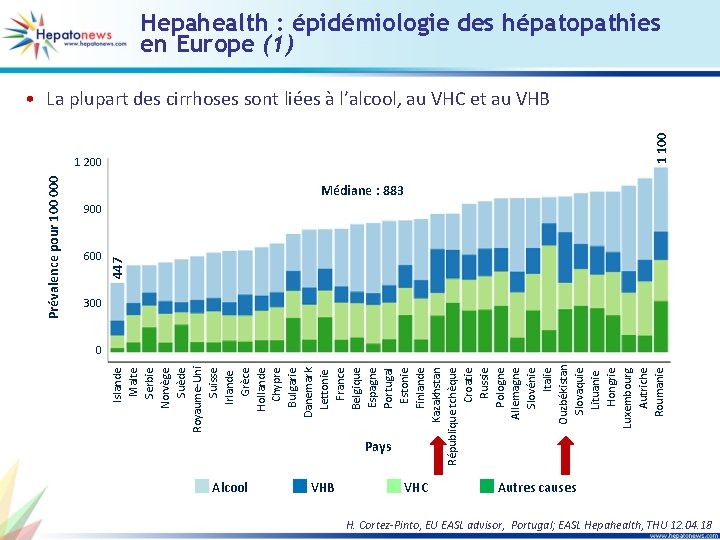
447 600 Islande Malte Serbie Norvège Suède Royaume-Uni Suisse Irlande Grèce Hollande Chypre Bulgarie Danemark Lettonie France Belgique Espagne Portugal Estonie Finlande Kazakhstan République tchèque Croatie Russie Pologne Allemagne Slovénie Italie Ouzbékistan Slovaquie Lituanie Hongrie Luxembourg Autriche Roumanie Prévalence pour 100 000 1 200 1 100 Hepahealth : épidémiologie des hépatopathies en Europe (1) • La plupart des cirrhoses sont liées à l’alcool, au VHC et au VHB Médiane : 883 900 300 0 Pays Alcool VHB VHC Autres causes H. Cortez-Pinto, EU EASL advisor, Portugal; EASL Hepahealth, THU 12. 04. 18

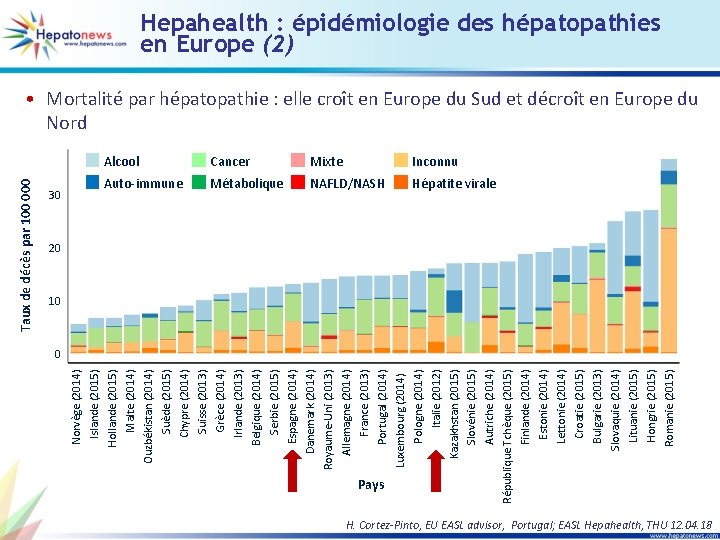
Pays Kazakhstan (2015) Slovénie (2015) Autriche (2014) République Tchèque (2015) Finlande (2014) Estonie (2014) Lettonie (2014) Croatie (2015) Bulgarie (2013) Slovaquie (2014) Lituanie (2015) Hongrie (2015) Romanie (2015) France (2013) Portugal (2014) Luxembourg (2014) Pologne (2014) Italie (2012) 30 Norvège (2014) Islande (2015) Hollande (2015) Malte (2014) Ouzbékistan (2014) Suède (2015) Chypre (2014) Suisse (2013) Grèce (2014) Irlande (2013) Belgique (2014) Serbie (2015) Espagne (2014) Danemark (2014) Royaume-Uni (2013) Allemagne (2014) Taux de décès par 100 000 Hepahealth : épidémiologie des hépatopathies en Europe (2) • Mortalité par hépatopathie : elle croît en Europe du Sud et décroît en Europe du Nord Alcool Cancer Mixte Inconnu Auto-immune Métabolique NAFLD/NASH Hépatite virale 20 10 0 H. Cortez-Pinto, EU EASL advisor, Portugal; EASL Hepahealth, THU 12. 04. 18

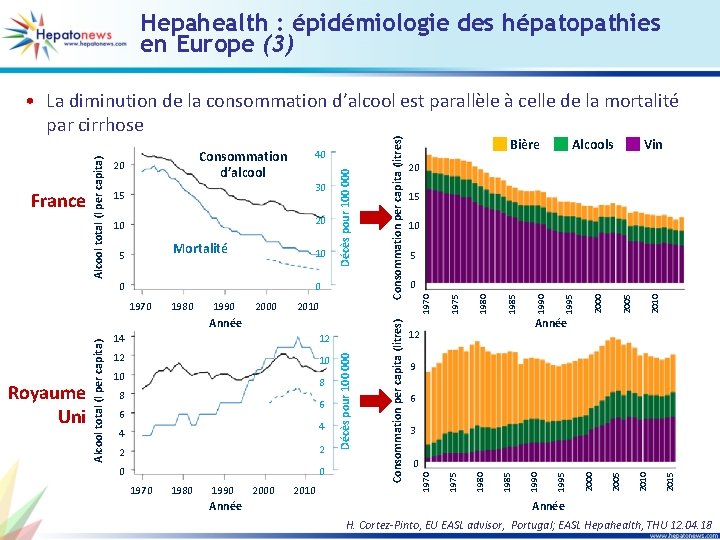
Hepahealth : épidémiologie des hépatopathies en Europe (3) 10 8 8 6 6 4 4 2 2 0 0 1970 1980 1990 Année 2000 2010 2005 2000 9 6 3 0 2015 10 2010 12 2005 12 Année 12 2000 14 Décès pour 100 000 Royaume Uni Alcool total (l per capita) Année 1995 2010 1995 2000 1990 1985 1970 0 1985 0 1980 0 5 1980 10 10 1975 Mortalité 5 Vin 15 1975 20 10 Alcools 20 1970 30 Bière 1970 15 Consommation per capita (litres) 20 40 Consommation per capita (litres) Consommation d’alcool Décès pour 100 000 France Alcool total (l per capita) • La diminution de la consommation d’alcool est parallèle à celle de la mortalité par cirrhose Année H. Cortez-Pinto, EU EASL advisor, Portugal; EASL Hepahealth, THU 12. 04. 18

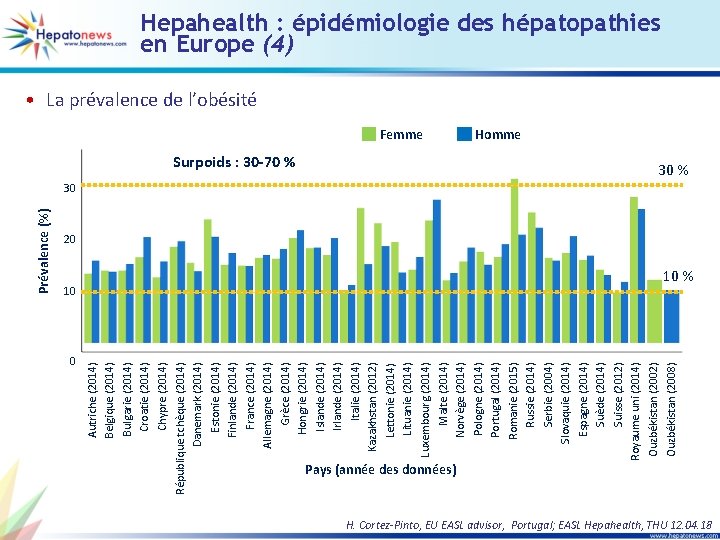
0 Autriche (2014) Belgique (2014) Bulgarie (2014) Croatie (2014) Chypre (2014) République tchèque (2014) Danemark (2014) Estonie (2014) Finlande (2014) France (2014) Allemagne (2014) Grèce (2014) Hongrie (2014) Islande (2014) Irlande (2014) Italie (2014) Kazakhstan (2012) Lettonie (2014) Lituanie (2014) Luxembourg (2014) Malte (2014) Norvège (2014) Pologne (2014) Portugal (2014) Romanie (2015) Russie (2014) Serbie (2004) Slovaquie (2014) Espagne (2014) Suède (2014) Suisse (2012) Royaume uni (2014) Ouzbékistan (2002) Ouzbékistan (2008) Prévalence (%) Hepahealth : épidémiologie des hépatopathies en Europe (4) • La prévalence de l’obésité Femme Surpoids : 30 -70 % 10 Homme 30 % 30 20 10 % Pays (année des données) H. Cortez-Pinto, EU EASL advisor, Portugal; EASL Hepahealth, THU 12. 04. 18

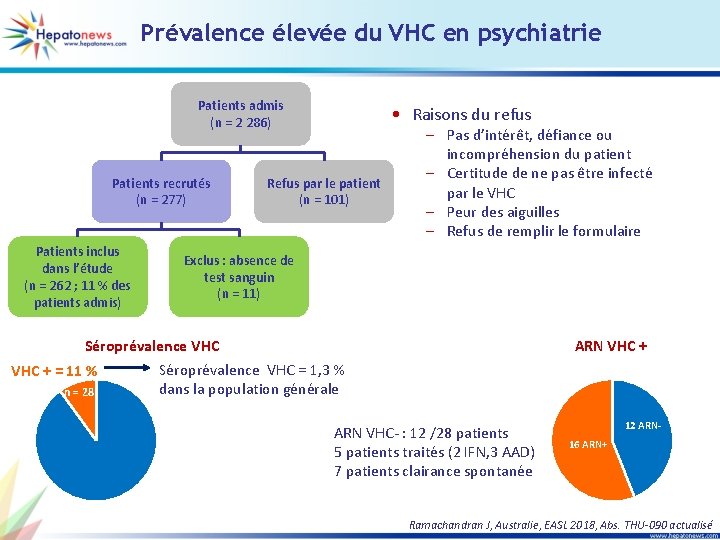
Prévalence élevée du VHC en psychiatrie Patients admis (n = 2 286) Patients recrutés (n = 277) Patients inclus dans l’étude (n = 262 ; 11 % des patients admis) • Raisons du refus Refus par le patient (n = 101) – Pas d’intérêt, défiance ou incompréhension du patient – Certitude de ne pas être infecté par le VHC – Peur des aiguilles – Refus de remplir le formulaire Exclus : absence de test sanguin (n = 11) Séroprévalence VHC + = 11 % n = 28 ARN VHC + Séroprévalence VHC = 1, 3 % dans la population générale ARN VHC- : 12 /28 patients 5 patients traités (2 IFN, 3 AAD) 7 patients clairance spontanée 12 ARN 16 ARN+ Ramachandran J, Australie, EASL 2018, Abs. THU-090 actualisé

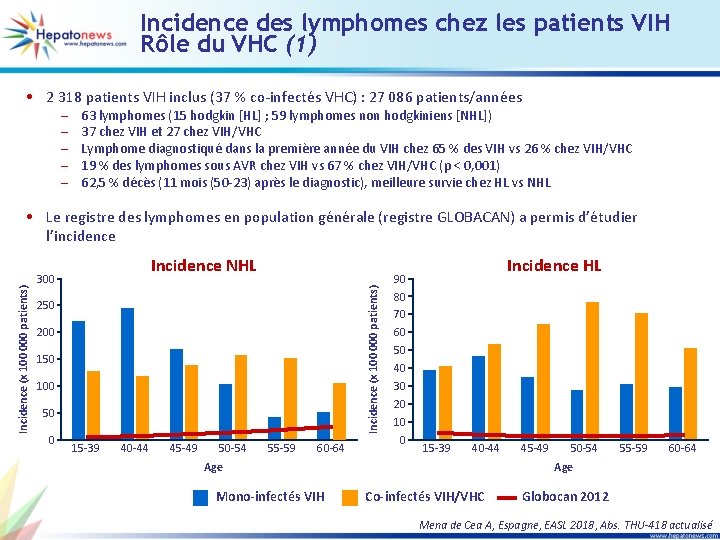
Incidence des lymphomes chez les patients VIH Rôle du VHC (1) • 2 318 patients VIH inclus (37 % co-infectés VHC) : 27 086 patients/années – – – 63 lymphomes (15 hodgkin [HL] ; 59 lymphomes non hodgkiniens [NHL]) 37 chez VIH et 27 chez VIH/VHC Lymphome diagnostiqué dans la première année du VIH chez 65 % des VIH vs 26 % chez VIH/VHC 19 % des lymphomes sous AVR chez VIH vs 67 % chez VIH/VHC (p < 0, 001) 62, 5 % décès (11 mois (50 -23) après le diagnostic), meilleure survie chez HL vs NHL Incidence NHL 300 Incidence (x 100 000 patients) • Le registre des lymphomes en population générale (registre GLOBACAN) a permis d’étudier l’incidence 250 200 150 100 50 0 15 -39 40 -44 45 -49 50 -54 55 -59 60 -64 90 80 70 60 50 40 30 20 10 0 Incidence HL 15 -39 40 -44 Age Mono-infectés VIH 45 -49 50 -54 55 -59 60 -64 Age Co-infectés VIH/VHC Globocan 2012 Mena de Cea A, Espagne, EASL 2018, Abs. THU-418 actualisé

Incidence des lymphomes chez les patients VIH Rôle du VHC (2) Conclusion • L’incidence des lymphomes chez les patients VIH ou VIH/VHC est 15 fois supérieure à celle de la population générale • Les lymphomes chez les patients VIH/VHC sont plus tardifs que chez les patients VIH et surviennent avec une infection VIH contrôlée • Cette incidence est particulièrement élevée pour les lymphomes hodgkiniens dans la population des patients VIH/VHC • Ces données confirment le rôle causal du VHC dans le développement des lymphomes chez les patients VIH Mena de Cea A, Espagne, EASL 2018, Abs. THU-418 actualisé

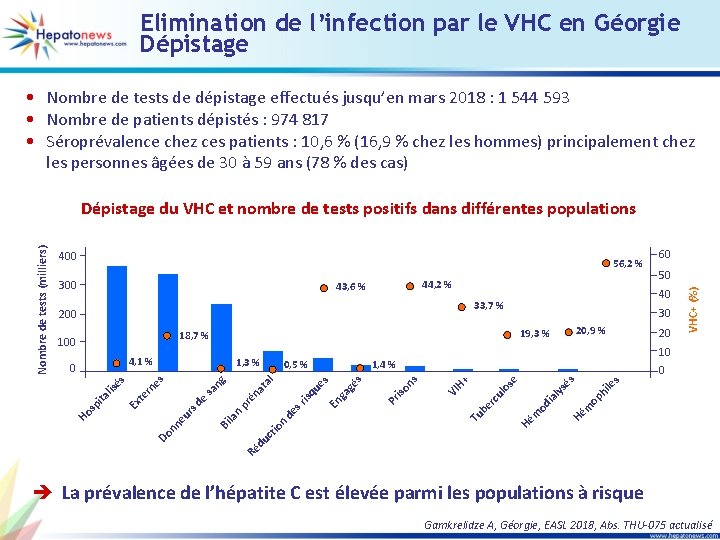
Elimination de l’infection par le VHC en Géorgie Dépistage • Nombre de tests de dépistage effectués jusqu’en mars 2018 : 1 544 593 • Nombre de patients dépistés : 974 817 • Séroprévalence chez ces patients : 10, 6 % (16, 9 % chez les hommes) principalement chez les personnes âgées de 30 à 59 ans (78 % des cas) 56, 2 % 300 44, 2 % 43, 6 % 30 s s ile op h m Hé Hé m od ia ly sé lo se rc u be iso ns Pr s gé VI H+ Tu n 0 Ré du ct io ga ue isq s r de n Bi la 20 10 1, 4 % s al pr én sa d e rs eu nn Do 0, 5 % at ng s ne er Ex t ta lis sp i Ho 1, 3 % En 4, 1 % 0 20, 9 % 19, 3 % 18, 7 % 100 50 40 33, 7 % 200 60 VHC+ (%) 400 és Nombre de tests (milliers) Dépistage du VHC et nombre de tests positifs dans différentes populations è La prévalence de l’hépatite C est élevée parmi les populations à risque Gamkrelidze A, Géorgie, EASL 2018, Abs. THU-075 actualisé

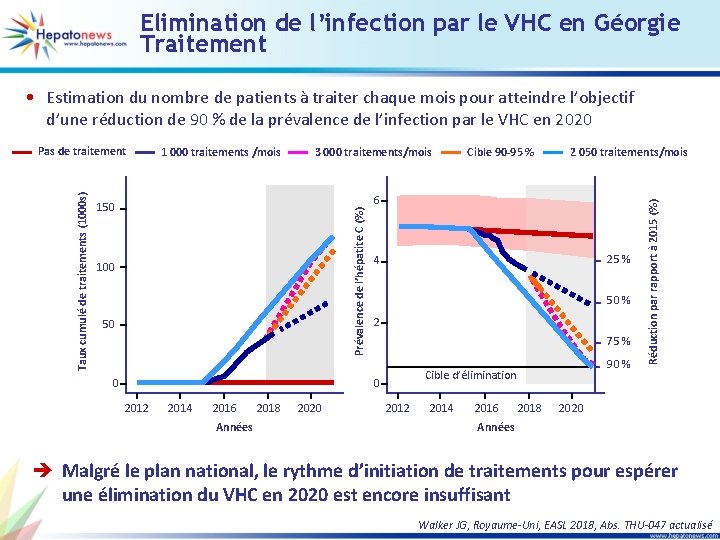
Elimination de l’infection par le VHC en Géorgie Traitement • Estimation du nombre de patients à traiter chaque mois pour atteindre l’objectif d’une réduction de 90 % de la prévalence de l’infection par le VHC en 2020 3 000 traitements/mois Cible 90 -95 % 2 050 traitements/mois 6 150 100 50 0 25 % 4 50 % 2 75 % 0 2012 2014 2016 Années 2018 2020 90 % Cible d’élimination 2012 2014 2016 2018 Réduction par rapport à 2015 (%) 1 000 traitements /mois Prévalence de l’hépatite C (%) Taux cumulé de traitements (1000 s) Pas de traitement 2020 Années è Malgré le plan national, le rythme d’initiation de traitements pour espérer une élimination du VHC en 2020 est encore insuffisant Walker JG, Royaume-Uni, EASL 2018, Abs. THU-047 actualisé

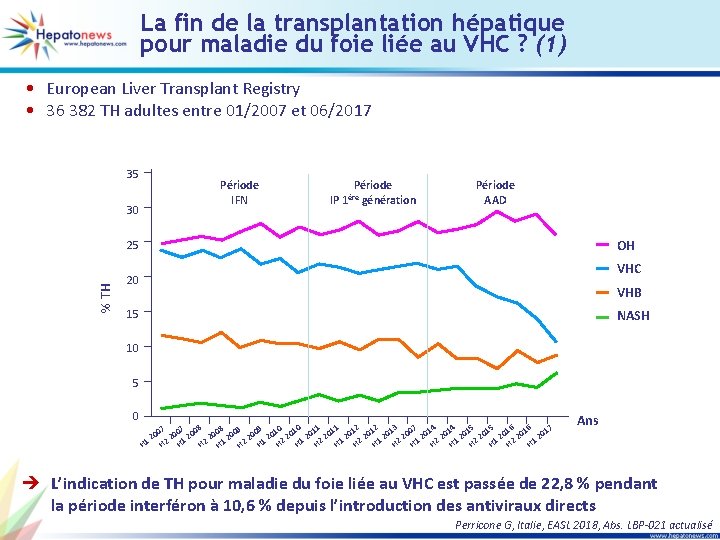
VHC - Résultats des traitements

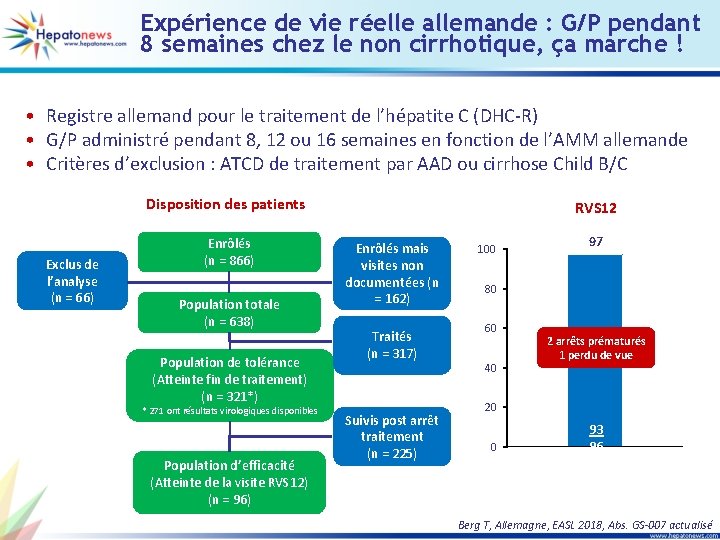
Expérience de vie réelle allemande : G/P pendant 8 semaines chez le non cirrhotique, ça marche ! • Registre allemand pour le traitement de l’hépatite C (DHC-R) • G/P administré pendant 8, 12 ou 16 semaines en fonction de l’AMM allemande • Critères d’exclusion : ATCD de traitement par AAD ou cirrhose Child B/C Disposition des patients Exclus de l’analyse (n = 66) Enrôlés (n = 866) Population totale (n = 638) Population de tolérance (Atteinte fin de traitement) (n = 321*) * 271 ont résultats virologiques disponibles Population d’efficacité (Atteinte de la visite RVS 12) (n = 96) RVS 12 Enrôlés mais visites non documentées (n = 162) Traités (n = 317) Suivis post arrêt traitement (n = 225) 100 97 80 60 40 2 arrêts prématurés 1 perdu de vue 20 0 93 96 Berg T, Allemagne, EASL 2018, Abs. GS-007 actualisé

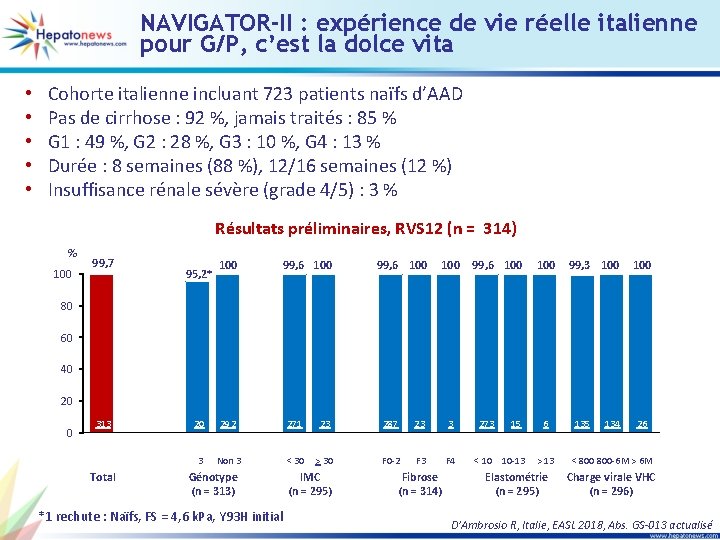
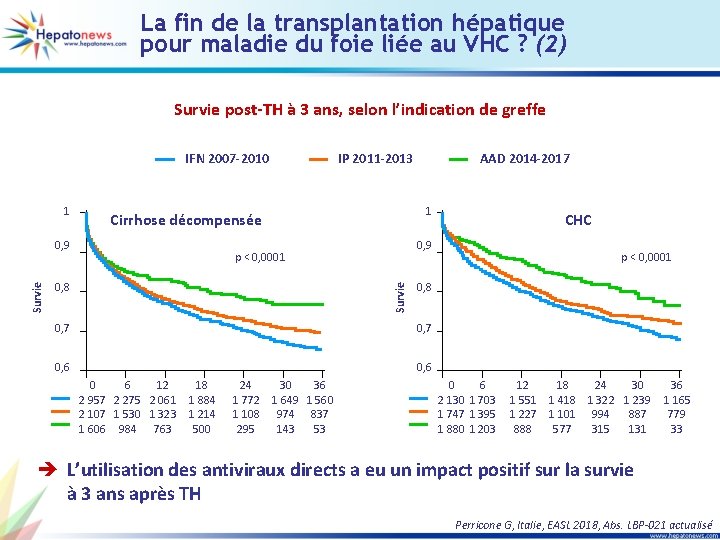
NAVIGATOR-II : expérience de vie réelle italienne pour G/P, c’est la dolce vita • • • Cohorte italienne incluant 723 patients naïfs d’AAD Pas de cirrhose : 92 %, jamais traités : 85 % G 1 : 49 %, G 2 : 28 %, G 3 : 10 %, G 4 : 13 % Durée : 8 semaines (88 %), 12/16 semaines (12 %) Insuffisance rénale sévère (grade 4/5) : 3 % Résultats préliminaires, RVS 12 (n = 314) % 100 99, 7 95, 2* 100 99, 6 100 99, 3 100 80 60 1 rechute* 40 20 0 313 314 Total 20 21 292 271 272 23 23 287 288 23 23 3 Non 3 < 30 > 30 F 0 -2 F 3 F 4 Génotype (n = 313) *1 rechute : Naïfs, FS = 4, 6 k. Pa, Y 93 H initial IMC (n = 295) Fibrose (n = 314) 273 274 15 15 < 10 10 -13 6 6 > 13 Elastométrie (n = 295) 135 136 134 26 26 < 800 -6 M > 6 M Charge virale VHC (n = 296) D’Ambrosio R, Italie, EASL 2018, Abs. GS-013 actualisé

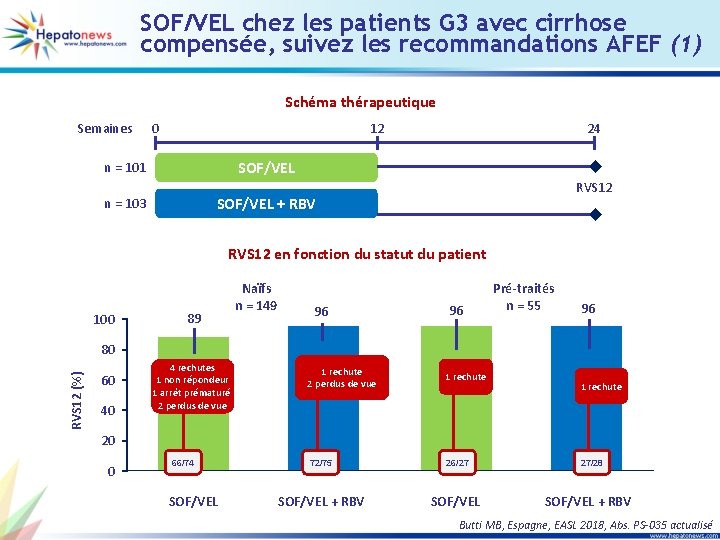
SOF/VEL chez les patients G 3 avec cirrhose compensée, suivez les recommandations AFEF (1) Schéma thérapeutique Semaines 0 12 24 SOF/VEL n = 101 RVS 12 SOF/VEL + RBV n = 103 RVS 12 en fonction du statut du patient 100 89 Naïfs n = 149 96 96 Pré-traités n = 55 96 RVS 12 (%) 80 60 40 4 rechutes 1 non répondeur 1 arrêt prématuré 2 perdus de vue 1 rechute 72/75 26/27 SOF/VEL + RBV SOF/VEL 1 rechute 20 0 66/74 SOF/VEL 27/28 SOF/VEL + RBV Butti MB, Espagne, EASL 2018, Abs. PS-035 actualisé

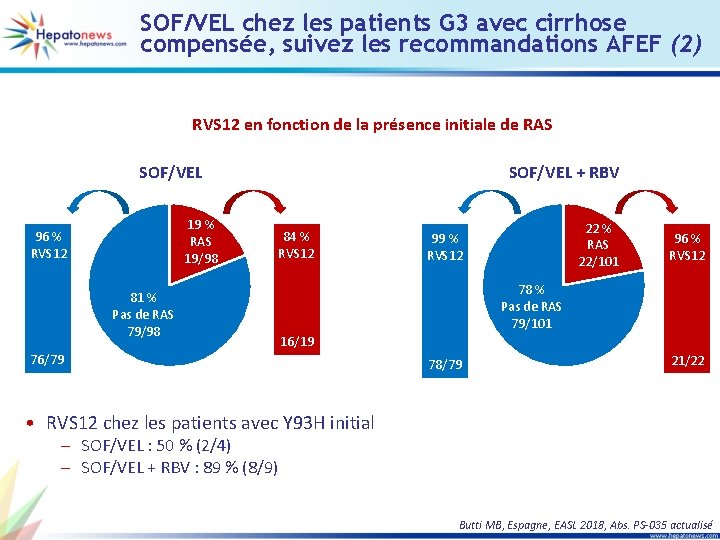
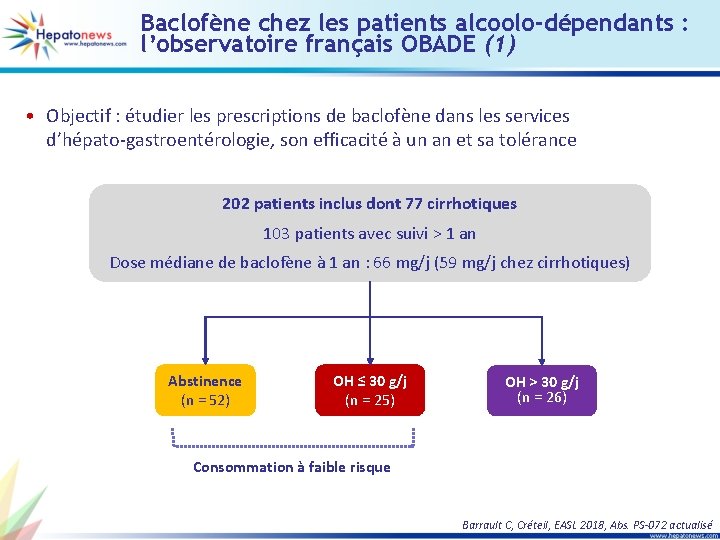
SOF/VEL chez les patients G 3 avec cirrhose compensée, suivez les recommandations AFEF (2) RVS 12 en fonction de la présence initiale de RAS SOF/VEL + RBV SOF/VEL 19 % RAS 19/98 96 % RVS 12 84 % RVS 12 81 % Pas de RAS 79/98 22 % RAS 22/101 99 % RVS 12 96 % RVS 12 78 % Pas de RAS 79/101 16/19 76/79 78/79 21/22 • RVS 12 chez les patients avec Y 93 H initial – SOF/VEL : 50 % (2/4) – SOF/VEL + RBV : 89 % (8/9) Butti MB, Espagne, EASL 2018, Abs. PS-035 actualisé

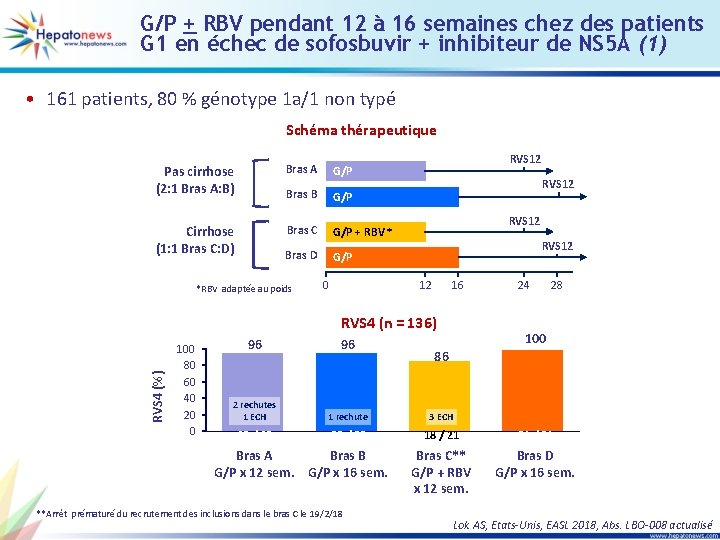
G/P + RBV pendant 12 à 16 semaines chez des patients G 1 en échec de sofosbuvir + inhibiteur de NS 5 A (1) • 161 patients, 80 % génotype 1 a/1 non typé Schéma thérapeutique Pas cirrhose (2: 1 Bras A: B) Bras A G/P Bras B G/P Cirrhose (1: 1 Bras C: D) Bras C G/P + RBV * Bras D G/P *RBV adaptée au poids 0 RVS 12 12 16 RVS 4 (%) RVS 4 (n = 136) 100 80 60 40 20 0 24 28 100 96 96 2 rechutes 1 ECH 1 rechute 3 ECH 65 / 68 28 / 29 18 / 21 21 / 21 Bras C** G/P + RBV x 12 sem. Bras D G/P x 16 sem. Bras A Bras B G/P x 12 sem. G/P x 16 sem. **Arrêt prématuré du recrutement des inclusions dans le bras C le 19/2/18 86 Lok AS, Etats-Unis, EASL 2018, Abs. LBO-008 actualisé

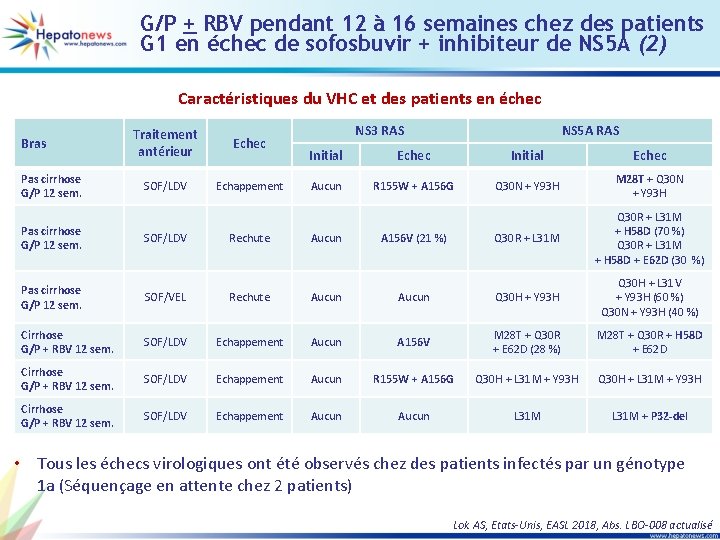
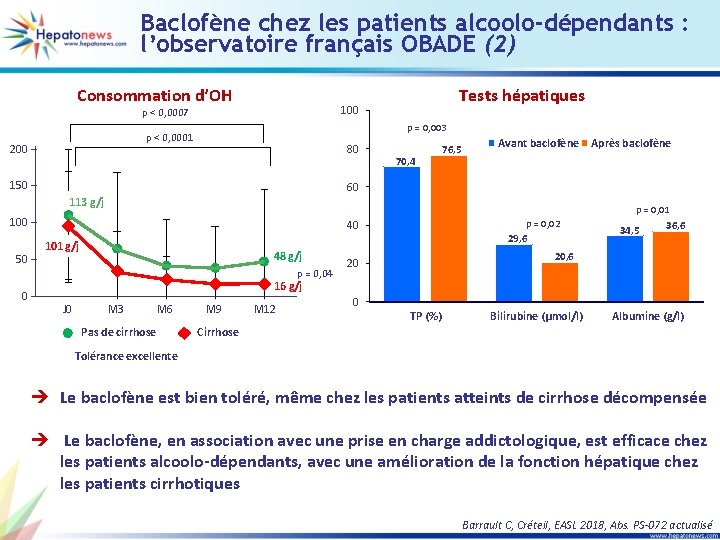
G/P + RBV pendant 12 à 16 semaines chez des patients G 1 en échec de sofosbuvir + inhibiteur de NS 5 A (2) Caractéristiques du VHC et des patients en échec Bras Pas cirrhose G/P 12 sem. NS 3 RAS Traitement Echec antérieur Caractéristiques des patients en échec Initial Echec SOF/LDV Echappement Rechute Aucun R 155 W + A 156 G A 156 V (21 %) NS 5 A RAS Initial Echec Q 30 N + Y 93 H M 28 T + Q 30 N + Y 93 H Q 30 R + L 31 M + H 58 D (70 %) Q 30 R + L 31 M + H 58 D + E 62 D (30 %) Pas cirrhose G/P 12 sem. SOF/VEL Rechute Aucun Q 30 H + Y 93 H Q 30 H + L 31 V + Y 93 H (60 %) Q 30 N + Y 93 H (40 %) Cirrhose G/P + RBV 12 sem. SOF/LDV Echappement Aucun A 156 V M 28 T + Q 30 R + E 62 D (28 %) M 28 T + Q 30 R + H 58 D + E 62 D Cirrhose G/P + RBV 12 sem. SOF/LDV Echappement Aucun R 155 W + A 156 G Q 30 H + L 31 M + Y 93 H Cirrhose G/P + RBV 12 sem. SOF/LDV Echappement Aucun L 31 M + P 32 -del • Tous les échecs virologiques ont été observés chez des patients infectés par un génotype 1 a (Séquençage en attente chez 2 patients) Lok AS, Etats-Unis, EASL 2018, Abs. LBO-008 actualisé

Sofosbuvir + G/P chez les patients en échec d’un traitement par AAD (1) • MAGELLAN-3, traitement par sofosbuvir + G/P + ribavirine pendant 12 ou 16 semaines chez les patients en échec de G/P Caractéristiques virologiques des patients Génotype non 3 12 semaines Génotype 3 + genotype non 3 + cirrhose 16 semaines Total (n = 2) (n = 21) (n = 23) 0 0 0 2 (100) 16 (76, 2) 18 (78, 3) NS 3 + NS 5 A 0 5 (23, 8) 5 (21, 7) Aucun 0 0 0 RAS à l’inclusion NS 3 seul NS 5 A seul Wyles D, Etats-Unis, EASL 2018, Abs. PS-040 actualisé

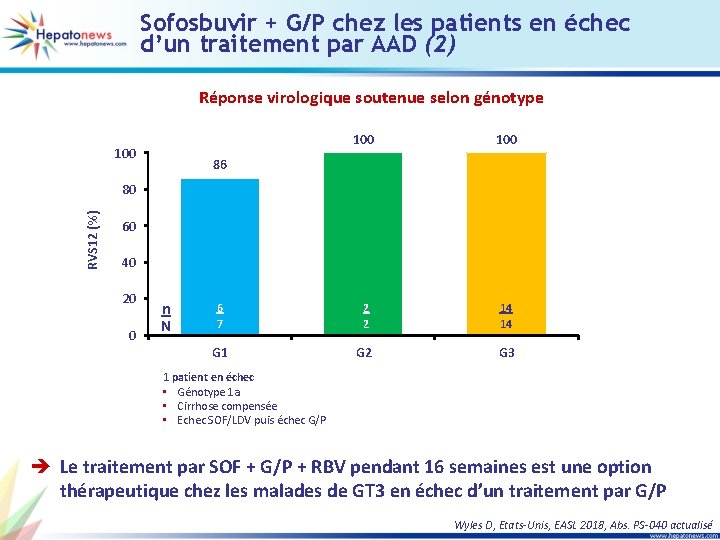
Sofosbuvir + G/P chez les patients en échec d’un traitement par AAD (2) Réponse virologique soutenue selon génotype 100 100 6 7 2 2 14 14 G 1 G 2 G 3 86 RVS 12 (%) 80 60 40 20 0 n N 1 patient en échec • Génotype 1 a • Cirrhose compensée • Echec SOF/LDV puis échec G/P è Le traitement par SOF + G/P + RBV pendant 16 semaines est une option thérapeutique chez les malades de GT 3 en échec d’un traitement par G/P Wyles D, Etats-Unis, EASL 2018, Abs. PS-040 actualisé

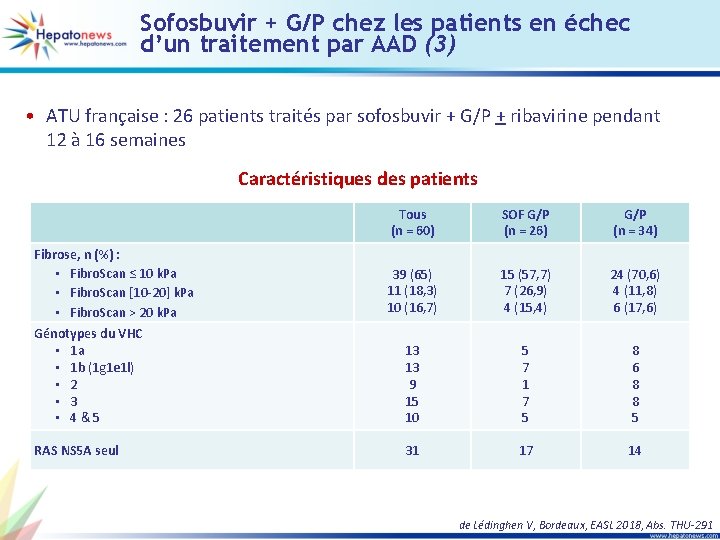
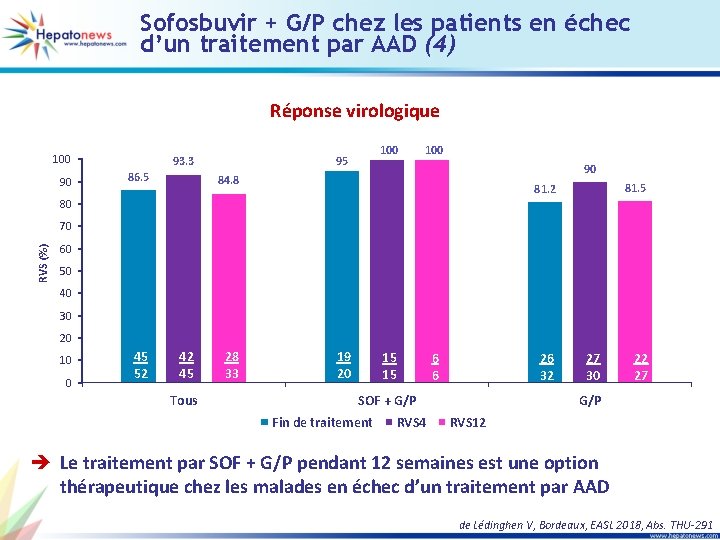
Sofosbuvir + G/P chez les patients en échec d’un traitement par AAD (3) • ATU française : 26 patients traités par sofosbuvir + G/P + ribavirine pendant 12 à 16 semaines Caractéristiques des patients Tous (n = 60) SOF G/P (n = 26) G/P (n = 34) 39 (65) 11 (18, 3) 10 (16, 7) 15 (57, 7) 7 (26, 9) 4 (15, 4) 24 (70, 6) 4 (11, 8) 6 (17, 6) Génotypes du VHC • 1 a • 1 b (1 g 1 e 1 l) • 2 • 3 • 4&5 13 13 9 15 10 5 7 1 7 5 8 6 8 8 5 RAS NS 5 A seul 31 17 14 Fibrose, n (%) : • Fibro. Scan ≤ 10 k. Pa • Fibro. Scan [10 -20] k. Pa • Fibro. Scan > 20 k. Pa de Lédinghen V, Bordeaux, EASL 2018, Abs. THU-291

Sofosbuvir + G/P chez les patients en échec d’un traitement par AAD (4) Réponse virologique 100 90 86. 5 100 95 93. 3 100 90 84. 8 81. 5 81. 2 80 RVS (%) 70 60 50 40 30 20 10 0 45 52 42 45 Tous 28 33 19 20 15 15 6 6 26 32 SOF + G/P Fin de traitement RVS 4 27 30 22 27 G/P RVS 12 è Le traitement par SOF + G/P pendant 12 semaines est une option thérapeutique chez les malades en échec d’un traitement par AAD de Lédinghen V, Bordeaux, EASL 2018, Abs. THU-291

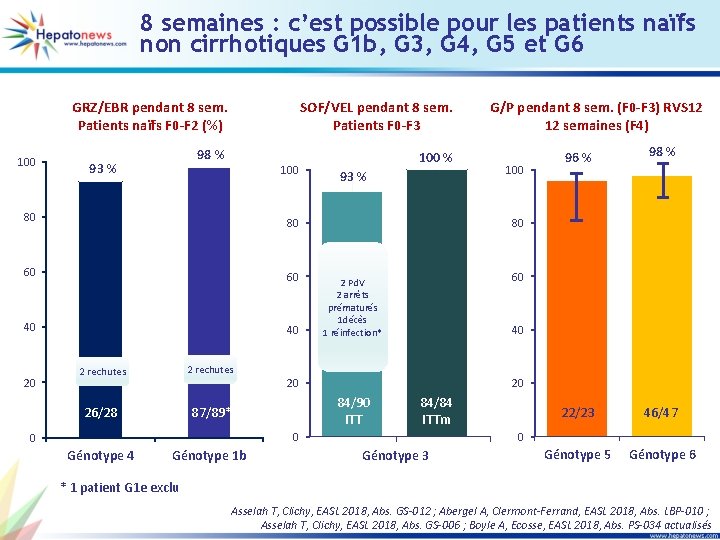
8 semaines : c’est possible pour les patients naïfs non cirrhotiques G 1 b, G 3, G 4, G 5 et G 6 100 GRZ/EBR pendant 8 sem. Patients naïfs F 0 -F 2 (%) SOF/VEL pendant 8 sem. Patients F 0 -F 3 98 % 100 % 93 % 100 80 80 60 60 40 40 20 2 rechutes 26/28 87/89* 93 % Génotype 4 Génotype 1 b 100 96 % 98 % 22/23 46/47 Génotype 5 Génotype 6 80 60 2 Pd. V 2 arrêts prématurés 1 décès 1 réinfection* 40 20 20 84/90 ITT 84/84 ITTm 0 0 0 G/P pendant 8 sem. (F 0 -F 3) RVS 12 12 semaines (F 4) Génotype 3 * 1 patient G 1 e exclu Asselah T, Clichy, EASL 2018, Abs. GS-012 ; Abergel A, Clermont-Ferrand, EASL 2018, Abs. LBP-010 ; Asselah T, Clichy, EASL 2018, Abs. GS-006 ; Boyle A, Ecosse, EASL 2018, Abs. PS-034 actualisés

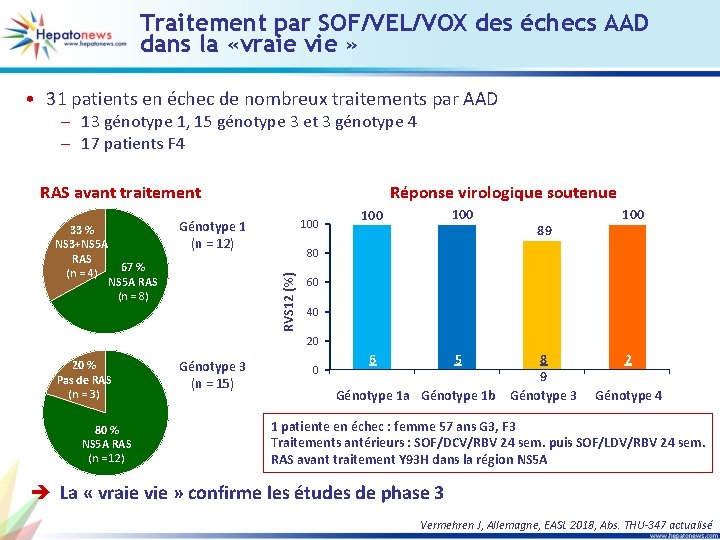
Traitement par SOF/VEL/VOX des échecs AAD dans la «vraie vie » • 31 patients en échec de nombreux traitements par AAD – 13 génotype 1, 15 génotype 3 et 3 génotype 4 – 17 patients F 4 RAS avant traitement 100 Génotype 1 (n = 12) 67 % NS 5 A RAS (n = 8) 100 89 100 80 RVS 12 (%) 33 % NS 3+NS 5 A RAS (n = 4) Réponse virologique soutenue 60 40 20 20 % Pas de RAS (n = 3) 80 % NS 5 A RAS (n = 12) Génotype 3 (n = 15) 0 6 5 Génotype 1 a Génotype 1 b 8 9 Génotype 3 2 2 Génotype 4 1 patiente en échec : femme 57 ans G 3, F 3 Traitements antérieurs : SOF/DCV/RBV 24 sem. puis SOF/LDV/RBV 24 sem. RAS avant traitement Y 93 H dans la région NS 5 A è La « vraie vie » confirme les études de phase 3 Vermehren J, Allemagne, EASL 2018, Abs. THU-347 actualisé

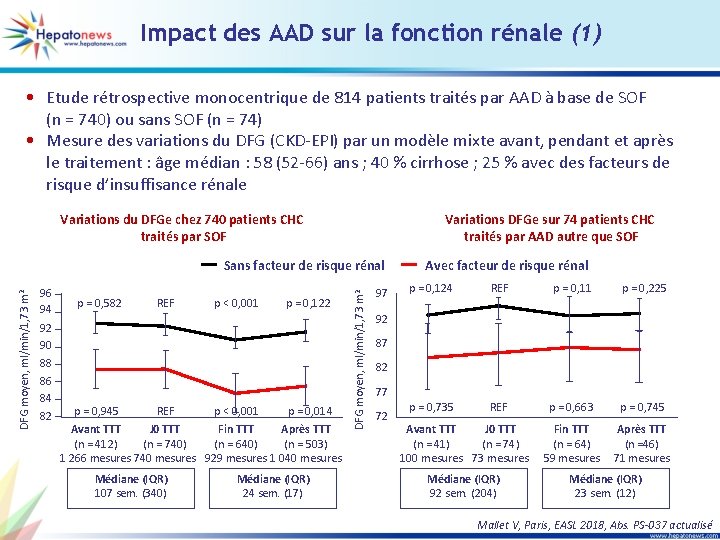
Impact des AAD sur la fonction rénale (1) • Etude rétrospective monocentrique de 814 patients traités par AAD à base de SOF (n = 740) ou sans SOF (n = 74) • Mesure des variations du DFG (CKD-EPI) par un modèle mixte avant, pendant et après le traitement : âge médian : 58 (52 -66) ans ; 40 % cirrhose ; 25 % avec des facteurs de risque d’insuffisance rénale Variations du DFGe chez 740 patients CHC traités par SOF Variations DFGe sur 74 patients CHC traités par AAD autre que SOF 96 94 92 90 88 86 84 82 p = 0, 582 p = 0, 945 REF p < 0, 001 p = 0, 122 p = 0, 014 Avant TTT J 0 TTT Fin TTT Après TTT (n = 412) (n = 740) (n = 640) (n = 503) 1 266 mesures 740 mesures 929 mesures 1 040 mesures Médiane (IQR) 107 sem. (340) Médiane (IQR) 24 sem. (17) DFG moyen, ml/min/1, 73 m 2 Sans facteur de risque rénal 97 Avec facteur de risque rénal p = 0, 124 REF p = 0, 11 p = 0, 225 p = 0, 735 REF p = 0, 663 p = 0, 745 Fin TTT (n = 64) 59 mesures Après TTT (n =46) 71 mesures 92 87 82 77 72 Avant TTT J 0 TTT (n = 41) (n = 74) 100 mesures 73 mesures Médiane (IQR) 92 sem. (204) Médiane (IQR) 23 sem. (12) Mallet V, Paris, EASL 2018, Abs. PS-037 actualisé

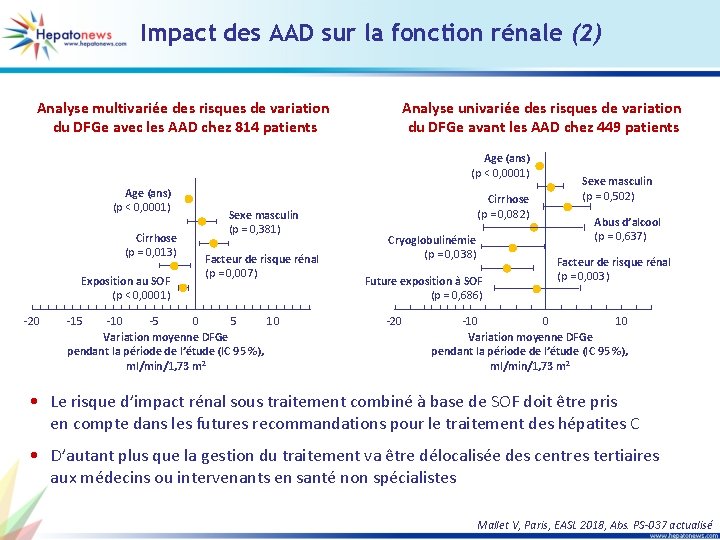
Impact des AAD sur la fonction rénale (2) Analyse multivariée des risques de variation du DFGe avec les AAD chez 814 patients Analyse univariée des risques de variation du DFGe avant les AAD chez 449 patients Age (ans) (p < 0, 0001) Cirrhose (p = 0, 013) Exposition au SOF (p < 0, 0001) -20 -15 Sexe masculin (p = 0, 381) Facteur de risque rénal (p = 0, 007) -10 -5 0 5 10 Variation moyenne DFGe pendant la période de l’étude (IC 95 %), ml/min/1, 73 m 2 Cirrhose (p = 0, 082) Cryoglobulinémie (p = 0, 038) Future exposition à SOF (p = 0, 686) -20 Sexe masculin (p = 0, 502) Abus d’alcool (p = 0, 637) Facteur de risque rénal (p = 0, 003) -10 0 10 Variation moyenne DFGe pendant la période de l’étude (IC 95 %), ml/min/1, 73 m 2 • Le risque d’impact rénal sous traitement combiné à base de SOF doit être pris en compte dans les futures recommandations pour le traitement des hépatites C • D’autant plus que la gestion du traitement va être délocalisée des centres tertiaires aux médecins ou intervenants en santé non spécialistes Mallet V, Paris, EASL 2018, Abs. PS-037 actualisé

VHC – Populations particulières

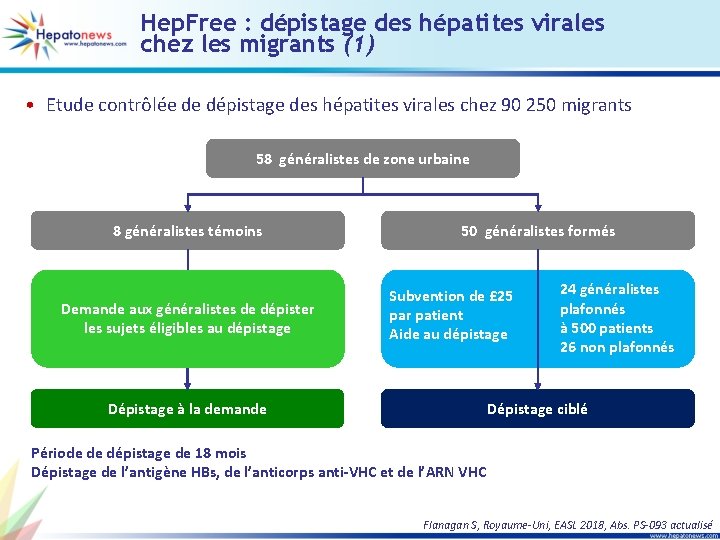
Hep. Free : dépistage des hépatites virales chez les migrants (1) • Etude contrôlée de dépistage des hépatites virales chez 90 250 migrants 58 généralistes de zone urbaine 8 généralistes témoins Demande aux généralistes de dépister les sujets éligibles au dépistage 50 généralistes formés Subvention de £ 25 par patient Aide au dépistage Dépistage à la demande 24 généralistes plafonnés à 500 patients 26 non plafonnés Dépistage ciblé Période de dépistage de 18 mois Dépistage de l’antigène HBs, de l’anticorps anti-VHC et de l’ARN VHC Flanagan S, Royaume-Uni, EASL 2018, Abs. PS-093 actualisé

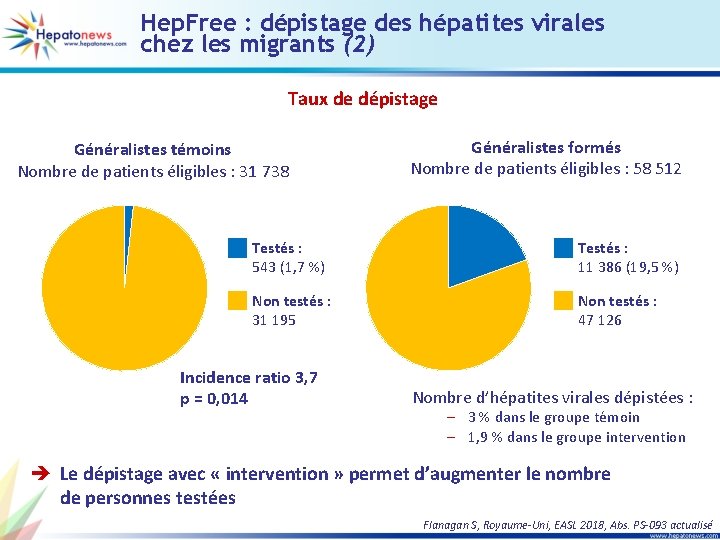
Hep. Free : dépistage des hépatites virales chez les migrants (2) Taux de dépistage Généralistes témoins Nombre de patients éligibles : 31 738 Généralistes formés Nombre de patients éligibles : 58 512 Testés : 543 (1, 7 %) Testés : 11 386 (19, 5 %) Non testés : 31 195 Non testés : 47 126 Incidence ratio 3, 7 p = 0, 014 Nombre d’hépatites virales dépistées : – 3 % dans le groupe témoin – 1, 9 % dans le groupe intervention è Le dépistage avec « intervention » permet d’augmenter le nombre de personnes testées Flanagan S, Royaume-Uni, EASL 2018, Abs. PS-093 actualisé

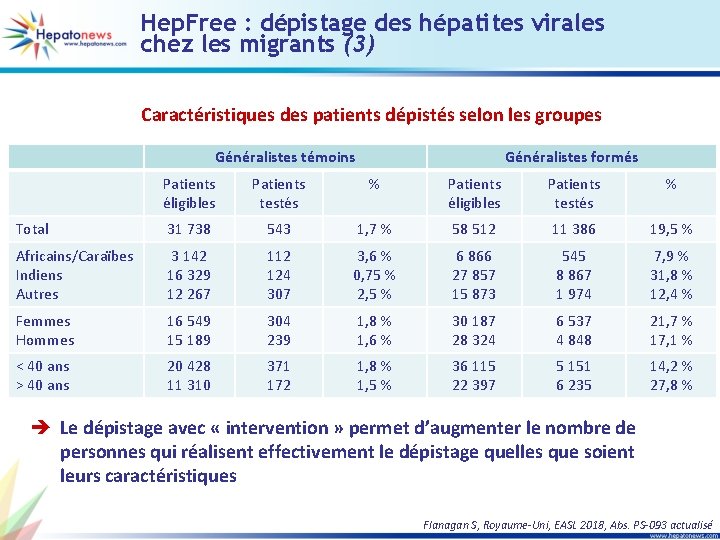
Hep. Free : dépistage des hépatites virales chez les migrants (3) Caractéristiques des patients dépistés selon les groupes Généralistes témoins Généralistes formés Patients éligibles Patients testés % Total 31 738 543 1, 7 % 58 512 11 386 19, 5 % Africains/Caraïbes Indiens Autres 3 142 16 329 12 267 112 124 307 3, 6 % 0, 75 % 2, 5 % 6 866 27 857 15 873 545 8 867 1 974 7, 9 % 31, 8 % 12, 4 % Femmes Hommes 16 549 15 189 304 239 1, 8 % 1, 6 % 30 187 28 324 6 537 4 848 21, 7 % 17, 1 % < 40 ans > 40 ans 20 428 11 310 371 172 1, 8 % 1, 5 % 36 115 22 397 5 151 6 235 14, 2 % 27, 8 % è Le dépistage avec « intervention » permet d’augmenter le nombre de personnes qui réalisent effectivement le dépistage quelles que soient leurs caractéristiques Flanagan S, Royaume-Uni, EASL 2018, Abs. PS-093 actualisé

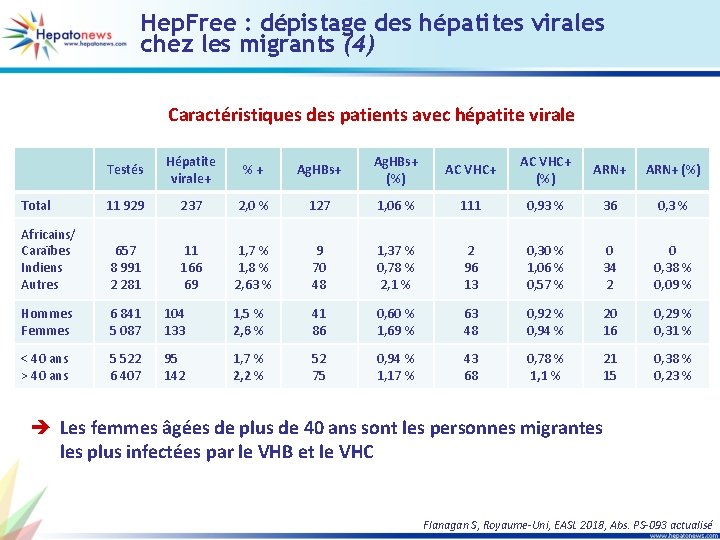
Hep. Free : dépistage des hépatites virales chez les migrants (4) Caractéristiques des patients avec hépatite virale Testés Hépatite virale+ % + Ag. HBs+ (%) AC VHC+ (%) ARN+ (%) Total 11 929 237 2, 0 % 127 1, 06 % 111 0, 93 % 36 0, 3 % Africains/ Caraïbes Indiens Autres 657 8 991 2 281 11 166 69 1, 7 % 1, 8 % 2, 63 % 9 70 48 1, 37 % 0, 78 % 2, 1 % 2 96 13 0, 30 % 1, 06 % 0, 57 % 0 34 2 0 0, 38 % 0, 09 % Hommes Femmes 6 841 5 087 104 133 1, 5 % 2, 6 % 41 86 0, 60 % 1, 69 % 63 48 0, 92 % 0, 94 % 20 16 0, 29 % 0, 31 % < 40 ans > 40 ans 5 522 6 407 95 142 1, 7 % 2, 2 % 52 75 0, 94 % 1, 17 % 43 68 0, 78 % 1, 1 % 21 15 0, 38 % 0, 23 % è Les femmes âgées de plus de 40 ans sont les personnes migrantes les plus infectées par le VHB et le VHC Flanagan S, Royaume-Uni, EASL 2018, Abs. PS-093 actualisé

Amélioration du dépistage par alerte informatique automatique • Evaluer l’impact d’une alerte informatique de rappel de dépistage de l’infection par le VHC • Mesure du nombre de tests faits avant et après mis en place de l’alerte Nombre de « baby boomers » testés 10 000 8 928 8 000 6 000 4 000 2 000 625 Nombre de sérologies + 180 160 140 120 100 80 60 40 20 0 155 31 0 Pré-alerte Post-alerte è Un rappel informatique automatique permet d’augmenter très significativement le nombre de personnes dépistées (x 14) Teply R, Etats-Unis, EASL 2018, Abs. THU-437 actualisé

Prescription du traitement de l’hépatite C par les généralistes en Australie • Evaluer la place des généralistes dans la prise en charge thérapeutique de l’hépatite C • Nombre de patients traités entre mars 2016 et juin 2017 : 44 382 • Prescription par des spécialistes dans 54 % des cas • Prescription par les généralistes plus fréquente – Dans les zones rurales – Dans les zones à forte population indigène • Régions où le traitement a été le moins prescrit : – – Zones rurales Zones économiquement pauvres Zones à forte proportion d’immigrés Zones avec peu de spécialistes • 16 mois : 7, 9 % personnes infectées par le VHC ont été traités è L’ouverture de la prescription aux généralistes permet l’accès au traitement des populations plutôt défavorisées, loin des zones urbaines è Mais il reste beaucoup à faire, car 58 % des régions ont traité < 12 % des cas (objectif OMS pour l’élimination en 2030) Scott N, Australie, EASL 2018, Abs. THU-052 actualisé

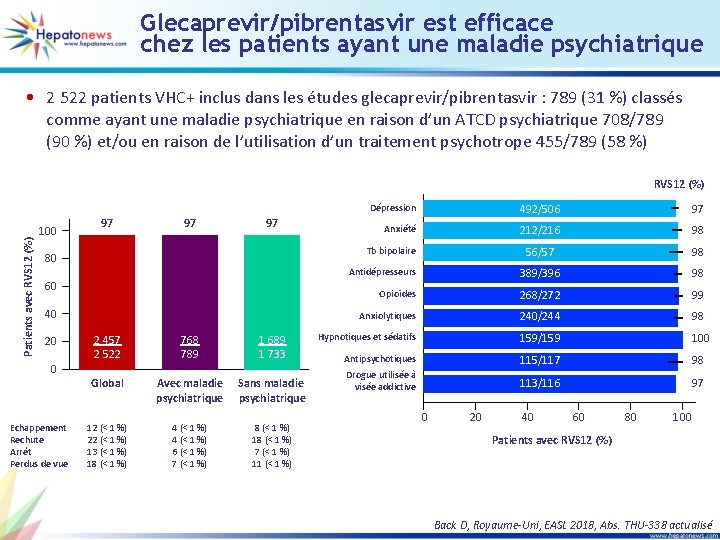
Glecaprevir/pibrentasvir est efficace chez les patients ayant une maladie psychiatrique • 2 522 patients VHC+ inclus dans les études glecaprevir/pibrentasvir : 789 (31 %) classés comme ayant une maladie psychiatrique en raison d’un ATCD psychiatrique 708/789 (90 %) et/ou en raison de l’utilisation d’un traitement psychotrope 455/789 (58 %) Patients avec RVS 12 (%) 100 97 97 97 60 40 0 Echappement Rechute Arrêt Perdus de vue 492/506 97 Anxiété 212/216 98 56/57 98 Antidépresseurs 389/396 98 Opioïdes 268/272 99 Anxiolytiques 240/244 98 Hypnotiques et sédatifs 159/159 100 Antipsychotiques 115/117 98 Drogue utilisée à visée addictive 113/116 97 Tb bipolaire 80 20 Dépression 2 457 2 522 768 789 1 689 1 733 Global Avec maladie psychiatrique Sans maladie psychiatrique 12 (< 1 %) 22 (< 1 %) 13 (< 1 %) 18 (< 1 %) 4 (< 1 %) 6 (< 1 %) 7 (< 1 %) 8 (< 1 %) 18 (< 1 %) 7 (< 1 %) 11 (< 1 %) 0 20 40 60 80 100 Patients avec RVS 12 (%) Back D, Royaume-Uni, EASL 2018, Abs. THU-338 actualisé

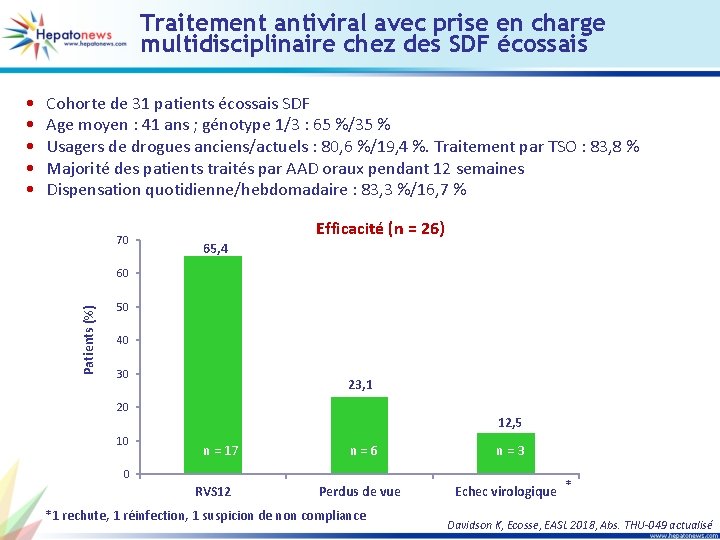
Traitement antiviral avec prise en charge multidisciplinaire chez des SDF écossais Cohorte de 31 patients écossais SDF Age moyen : 41 ans ; génotype 1/3 : 65 %/35 % Usagers de drogues anciens/actuels : 80, 6 %/19, 4 %. Traitement par TSO : 83, 8 % Majorité des patients traités par AAD oraux pendant 12 semaines Dispensation quotidienne/hebdomadaire : 83, 3 %/16, 7 % 70 Efficacité (n = 26) 65, 4 60 Patients (%) • • • 50 40 30 23, 1 20 10 12, 5 n = 17 n=6 n=3 Perdus de vue Echec virologique * 0 RVS 12 *1 rechute, 1 réinfection, 1 suspicion de non compliance Davidson K, Ecosse, EASL 2018, Abs. THU-049 actualisé

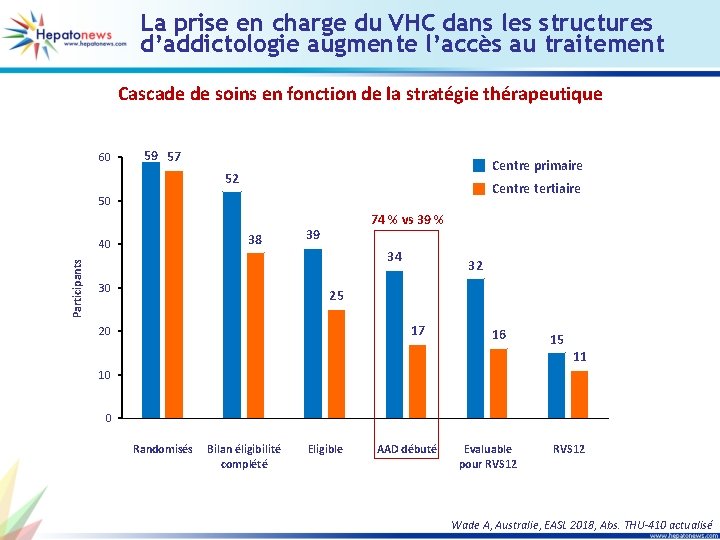
La prise en charge du VHC dans les structures d’addictologie augmente l’accès au traitement Cascade de soins en fonction de la stratégie thérapeutique 60 59 57 Centre primaire 52 Centre tertiaire 50 38 Participants 40 74 % vs 39 % 39 34 30 32 25 17 20 16 15 11 10 0 Randomisés Bilan éligibilité complété Eligible AAD débuté Evaluable pour RVS 12 Wade A, Australie, EASL 2018, Abs. THU-410 actualisé

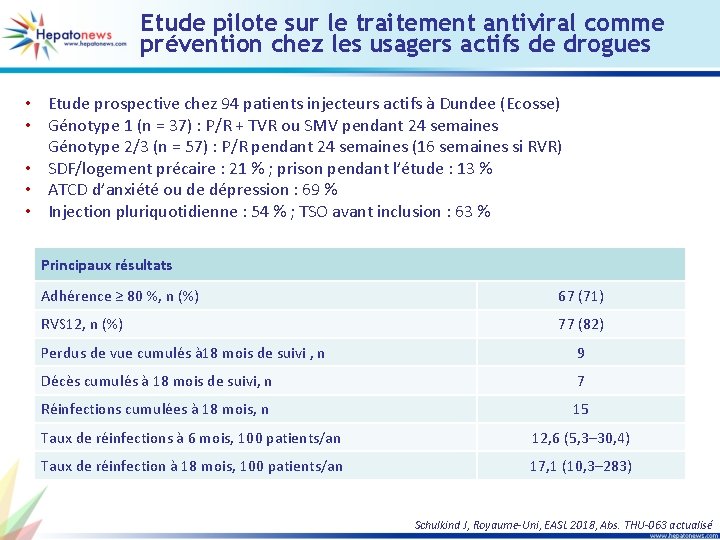
Etude pilote sur le traitement antiviral comme prévention chez les usagers actifs de drogues • Etude prospective chez 94 patients injecteurs actifs à Dundee (Ecosse) • Génotype 1 (n = 37) : P/R + TVR ou SMV pendant 24 semaines Génotype 2/3 (n = 57) : P/R pendant 24 semaines (16 semaines si RVR) • SDF/logement précaire : 21 % ; prison pendant l’étude : 13 % • ATCD d’anxiété ou de dépression : 69 % • Injection pluriquotidienne : 54 % ; TSO avant inclusion : 63 % Principaux résultats Adhérence ≥ 80 %, n (%) 67 (71) RVS 12, n (%) 77 (82) Perdus de vue cumulés à 18 mois de suivi , n 9 Décès cumulés à 18 mois de suivi, n 7 Réinfections cumulées à 18 mois, n 15 Taux de réinfections à 6 mois, 100 patients/an 12, 6 (5, 3‒ 30, 4) Taux de réinfection à 18 mois, 100 patients/an 17, 1 (10, 3‒ 283) Schulkind J, Royaume-Uni, EASL 2018, Abs. THU-063 actualisé

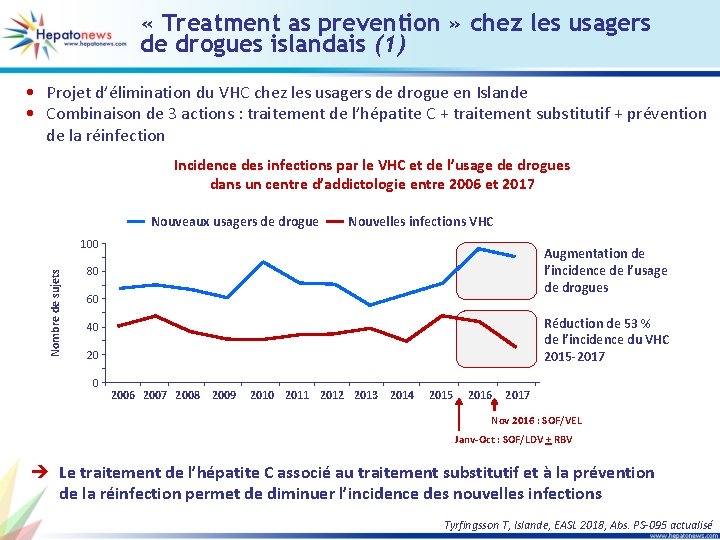
« Treatment as prevention » chez les usagers de drogues islandais (1) • Projet d’élimination du VHC chez les usagers de drogue en Islande • Combinaison de 3 actions : traitement de l’hépatite C + traitement substitutif + prévention de la réinfection Incidence des infections par le VHC et de l’usage de drogues dans un centre d’addictologie entre 2006 et 2017 Nouveaux usagers de drogue Nouvelles infections VHC Nombre de sujets 100 Augmentation de l’incidence de l’usage de drogues 80 60 Réduction de 53 % de l’incidence du VHC 2015 -2017 40 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 2016 2017 Nov 2016 : SOF/VEL Janv-Oct : SOF/LDV + RBV è Le traitement de l’hépatite C associé au traitement substitutif et à la prévention de la réinfection permet de diminuer l’incidence des nouvelles infections Tyrfingsson T, Islande, EASL 2018, Abs. PS-095 actualisé

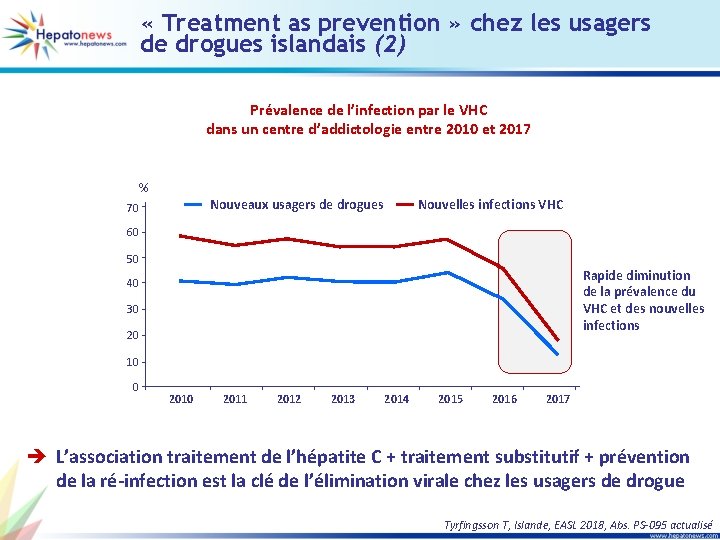
« Treatment as prevention » chez les usagers de drogues islandais (2) Prévalence de l’infection par le VHC dans un centre d’addictologie entre 2010 et 2017 % Nouveaux usagers de drogues 70 Nouvelles infections VHC 60 50 Rapide diminution de la prévalence du VHC et des nouvelles infections 40 30 20 10 0 2011 2012 2013 2014 2015 2016 2017 è L’association traitement de l’hépatite C + traitement substitutif + prévention de la ré-infection est la clé de l’élimination virale chez les usagers de drogue Tyrfingsson T, Islande, EASL 2018, Abs. PS-095 actualisé

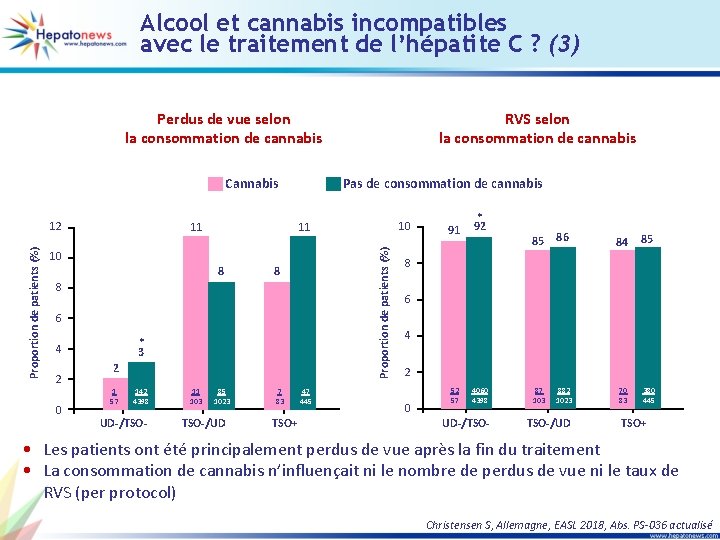
Alcool et cannabis incompatibles avec le traitement de l’hépatite C ? (1) • But : évaluer le rôle de la consommation d’alcool et/ou de cannabis sur le taux de RVS et de perdus de vue • Etude de 7 747 patients VHC traités par AAD – 739 patients traités par traitement substitutif opioïde (TSO) – 1 500 patients usagers de drogues actuels ou par le passé sans TSO (UD) – 5 508 patients sans usage de drogue ni TSO (UD-TSO-) Caractéristiques des patients UD-TSO- UD TSO Effectif 5 508 1 500 739 Alcool (> 40 g hommes ; > 30 g femmes) 13, 9 % 22, 2 % 25 % Cannabis 1, 2 % 9, 6 % 19, 2 % Christensen S, Allemagne, EASL 2018, Abs. PS-036 actualisé

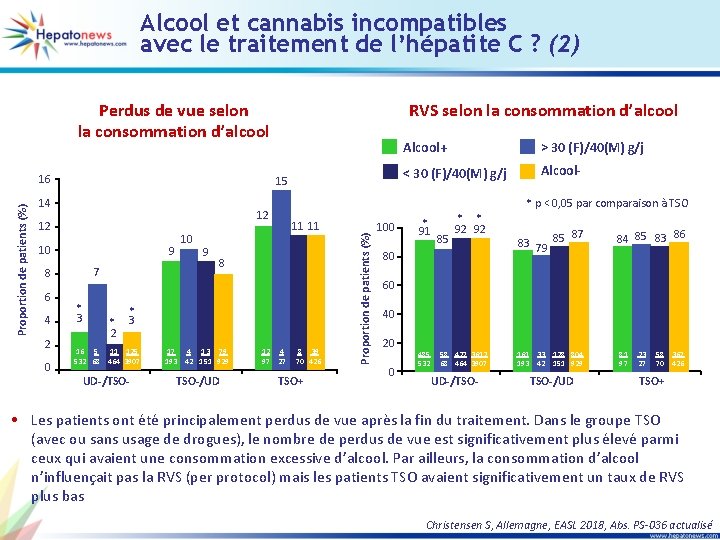
Alcool et cannabis incompatibles avec le traitement de l’hépatite C ? (2) Perdus de vue selon la consommation d’alcool 15 14 12 10 9 7 8 6 4 2 0 * 3 10 9 11 11 8 * * 3 2 16 5 11 125 532 68 464 3907 17 4 13 79 193 42 151 929 UD-/TSO-/UD 12 97 Alcool+ > 30 (F)/40(M) g/j < 30 (F)/40(M) g/j Alcool* p < 0, 05 par comparaison à TSO 12 4 27 8 39 70 426 TSO+ Proportion de patients (%) 16 RVS selon la consommation d’alcool 100 * 91 85 * * 92 92 80 87 83 79 85 84 85 83 86 60 40 20 0 485 532 58 427 3612 68 464 3907 UD-/TSO- 161 193 33 128 804 42 151 929 TSO-/UD 81 97 23 27 58 70 367 426 TSO+ • Les patients ont été principalement perdus de vue après la fin du traitement. Dans le groupe TSO (avec ou sans usage de drogues), le nombre de perdus de vue est significativement plus élevé parmi ceux qui avaient une consommation excessive d’alcool. Par ailleurs, la consommation d’alcool n’influençait pas la RVS (per protocol) mais les patients TSO avaient significativement un taux de RVS plus bas Christensen S, Allemagne, EASL 2018, Abs. PS-036 actualisé

Alcool et cannabis incompatibles avec le traitement de l’hépatite C ? (3) Perdus de vue selon la consommation de cannabis Cannabis Pas de consommation de cannabis 10 8 8 8 6 * 3 4 2 0 2 1 57 142 4398 UD-/TSO- 11 103 10 11 11 Proportion de patients (%) 12 RVS selon la consommation de cannabis 85 1023 TSO-/UD 7 83 TSO+ 47 445 91 * 92 85 86 87 103 882 1023 84 85 70 83 380 445 8 6 4 2 0 52 57 4060 4398 UD-/TSO-/UD TSO+ • Les patients ont été principalement perdus de vue après la fin du traitement • La consommation de cannabis n’influençait ni le nombre de perdus de vue ni le taux de RVS (per protocol) Christensen S, Allemagne, EASL 2018, Abs. PS-036 actualisé

VHC – Bénéfices et questions en suspens

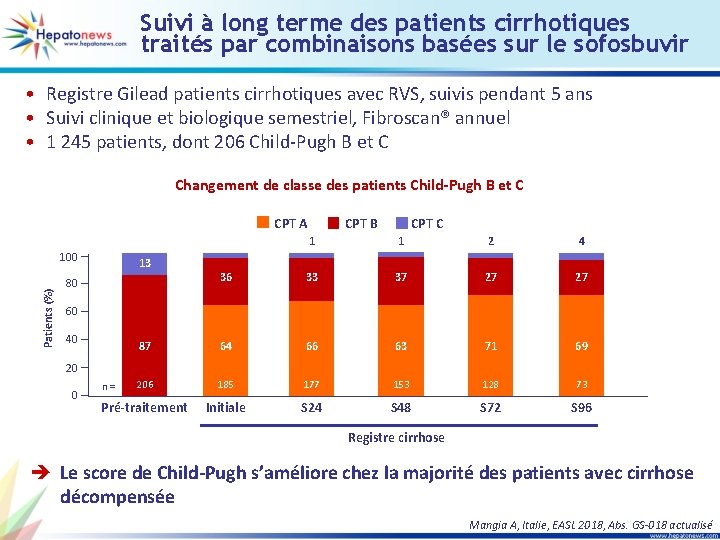
Suivi à long terme des patients cirrhotiques traités par combinaisons basées sur le sofosbuvir • Registre Gilead patients cirrhotiques avec RVS, suivis pendant 5 ans • Suivi clinique et biologique semestriel, Fibroscan® annuel • 1 245 patients, dont 206 Child-Pugh B et C Changement de classe des patients Child-Pugh B et C CPT A CPT C 1 1 2 4 36 33 37 27 27 87 64 66 63 71 69 206 185 177 153 128 73 Pré-traitement Initiale S 24 S 48 S 72 S 96 100 Patients (%) CPT B 13 80 60 40 20 0 n = Registre cirrhose è Le score de Child-Pugh s’améliore chez la majorité des patients avec cirrhose décompensée Mangia A, Italie, EASL 2018, Abs. GS-018 actualisé

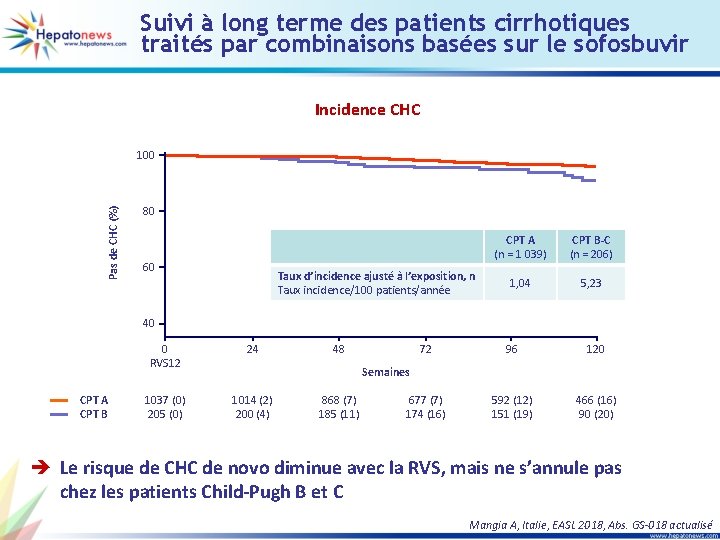
Suivi à long terme des patients cirrhotiques traités par combinaisons basées sur le sofosbuvir Incidence CHC Pas de CHC (%) 100 80 60 Taux d’incidence ajusté à l’exposition, n Taux incidence/100 patients/année CPT A (n = 1 039) CPT B-C (n = 206) 1, 04 5, 23 40 CPT A CPT B 0 RVS 12 24 1037 (0) 205 (0) 1014 (2) 200 (4) 48 72 96 120 677 (7) 174 (16) 592 (12) 151 (19) 466 (16) 90 (20) Semaines 868 (7) 185 (11) è Le risque de CHC de novo diminue avec la RVS, mais ne s’annule pas chez les patients Child-Pugh B et C Mangia A, Italie, EASL 2018, Abs. GS-018 actualisé

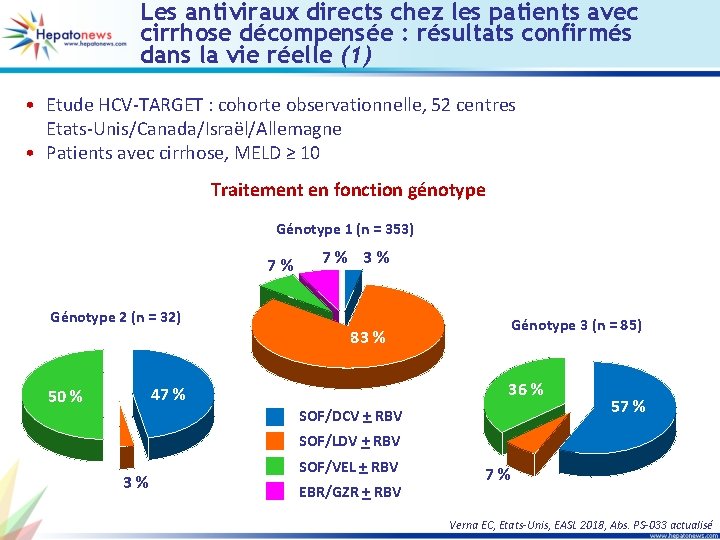
Les antiviraux directs chez les patients avec cirrhose décompensée : résultats confirmés dans la vie réelle (1) • Etude HCV-TARGET : cohorte observationnelle, 52 centres Etats-Unis/Canada/Israël/Allemagne • Patients avec cirrhose, MELD ≥ 10 Traitement en fonction génotype Génotype 1 (n = 353) 7 % Génotype 2 (n = 32) 7 % 36 % 47 % 50 % Génotype 3 (n = 85) 83 % SOF/DCV + RBV 57 % SOF/LDV + RBV 3 % SOF/VEL + RBV EBR/GZR + RBV 7 % Verna EC, Etats-Unis, EASL 2018, Abs. PS-033 actualisé

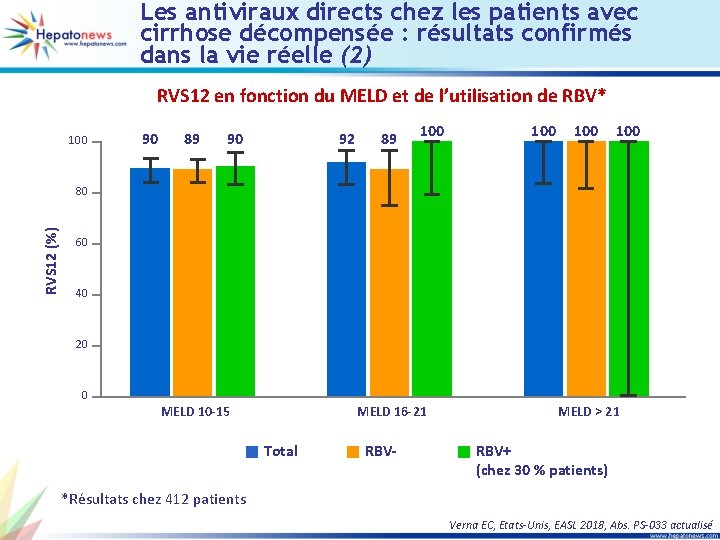
Les antiviraux directs chez les patients avec cirrhose décompensée : résultats confirmés dans la vie réelle (2) RVS 12 en fonction du MELD et de l’utilisation de RBV* 100 90 89 90 92 89 100 100 RVS 12 (%) 80 60 40 20 0 MELD 10 -15 MELD 16 -21 Total RBV- MELD > 21 RBV+ (chez 30 % patients) *Résultats chez 412 patients Verna EC, Etats-Unis, EASL 2018, Abs. PS-033 actualisé

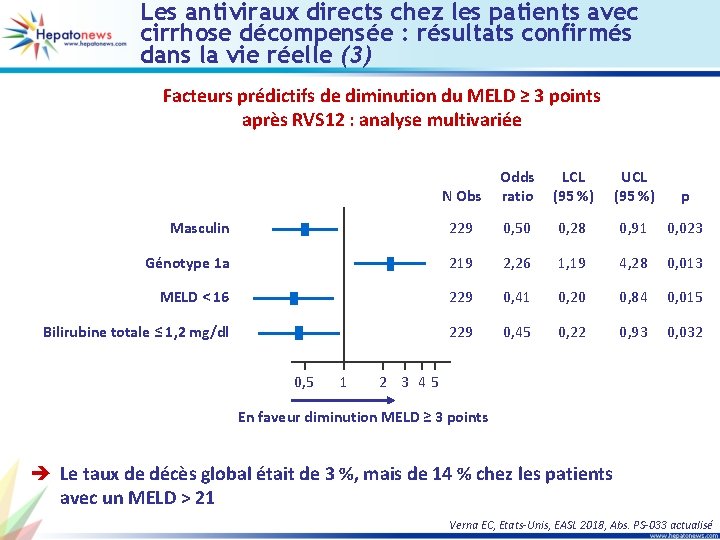
Les antiviraux directs chez les patients avec cirrhose décompensée : résultats confirmés dans la vie réelle (3) Facteurs prédictifs de diminution du MELD ≥ 3 points après RVS 12 : analyse multivariée N Obs Odds ratio LCL (95 %) UCL (95 %) p Masculin 229 0, 50 0, 28 0, 91 0, 023 Génotype 1 a 219 2, 26 1, 19 4, 28 0, 013 MELD < 16 229 0, 41 0, 20 0, 84 0, 015 Bilirubine totale ≤ 1, 2 mg/dl 229 0, 45 0, 22 0, 93 0, 032 0, 5 1 2 3 45 En faveur diminution MELD ≥ 3 points è Le taux de décès global était de 3 %, mais de 14 % chez les patients avec un MELD > 21 Verna EC, Etats-Unis, EASL 2018, Abs. PS-033 actualisé

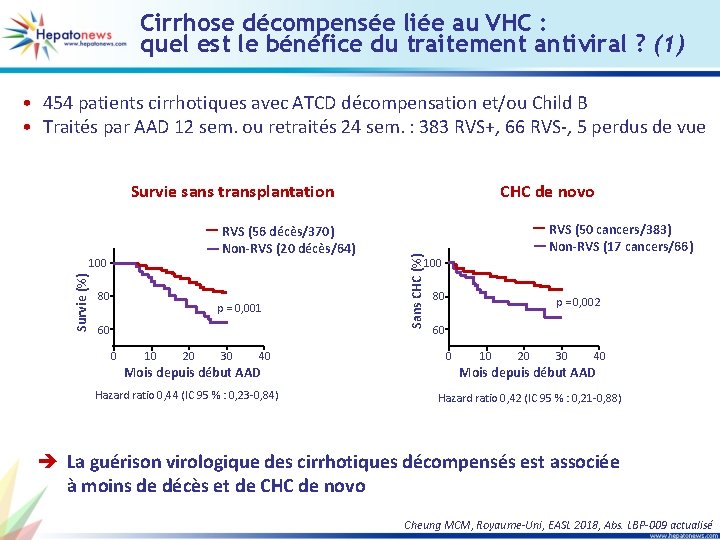
Cirrhose décompensée liée au VHC : quel est le bénéfice du traitement antiviral ? (1) • 454 patients cirrhotiques avec ATCD décompensation et/ou Child B • Traités par AAD 12 sem. ou retraités 24 sem. : 383 RVS+, 66 RVS-, 5 perdus de vue RVS (56 décès/370) Non-RVS (20 décès/64) Survie (%) 100 80 p = 0, 001 60 0 10 20 30 40 Mois depuis début AAD Hazard ratio 0, 44 (IC 95 % : 0, 23 -0, 84) CHC de novo Sans CHC (%) Survie sans transplantation RVS (50 cancers/383) Non-RVS (17 cancers/66) 100 80 p = 0, 002 60 0 10 20 30 40 Mois depuis début AAD Hazard ratio 0, 42 (IC 95 % : 0, 21 -0, 88) è La guérison virologique des cirrhotiques décompensés est associée à moins de décès et de CHC de novo Cheung MCM, Royaume-Uni, EASL 2018, Abs. LBP-009 actualisé

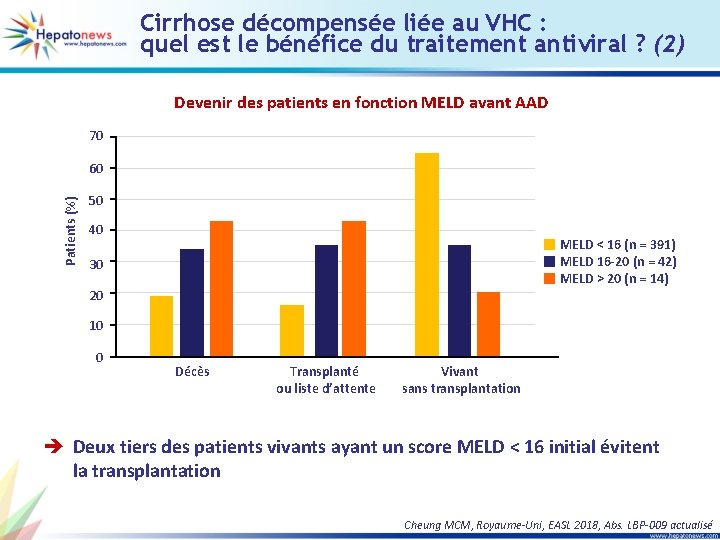
Cirrhose décompensée liée au VHC : quel est le bénéfice du traitement antiviral ? (2) Devenir des patients en fonction MELD avant AAD 70 Patients (%) 60 50 40 MELD < 16 (n = 391) MELD 16 -20 (n = 42) MELD > 20 (n = 14) 30 20 10 0 Décès Transplanté ou liste d’attente Vivant sans transplantation è Deux tiers des patients vivants ayant un score MELD < 16 initial évitent la transplantation Cheung MCM, Royaume-Uni, EASL 2018, Abs. LBP-009 actualisé

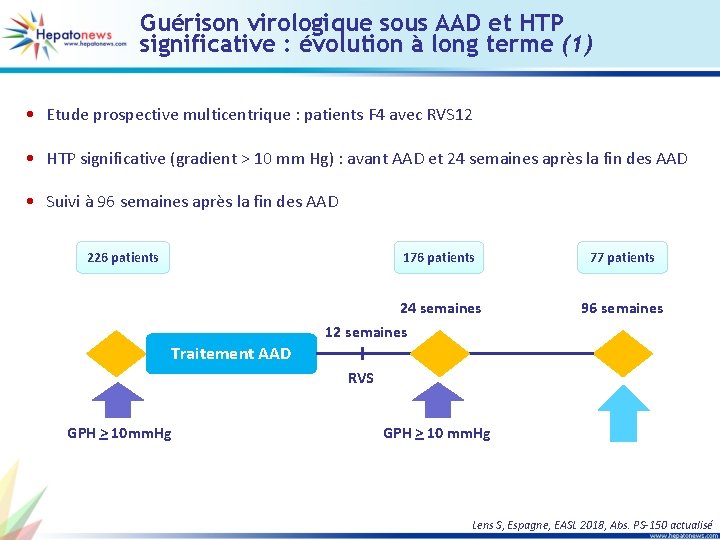
Guérison virologique sous AAD et HTP significative : évolution à long terme (1) • Etude prospective multicentrique : patients F 4 avec RVS 12 • HTP significative (gradient > 10 mm Hg) : avant AAD et 24 semaines après la fin des AAD • Suivi à 96 semaines après la fin des AAD 226 patients 176 patients 77 patients 24 semaines 96 semaines 12 semaines Traitement AAD RVS GPH > 10 mm. Hg GPH > 10 mm. Hg Lens S, Espagne, EASL 2018, Abs. PS-150 actualisé

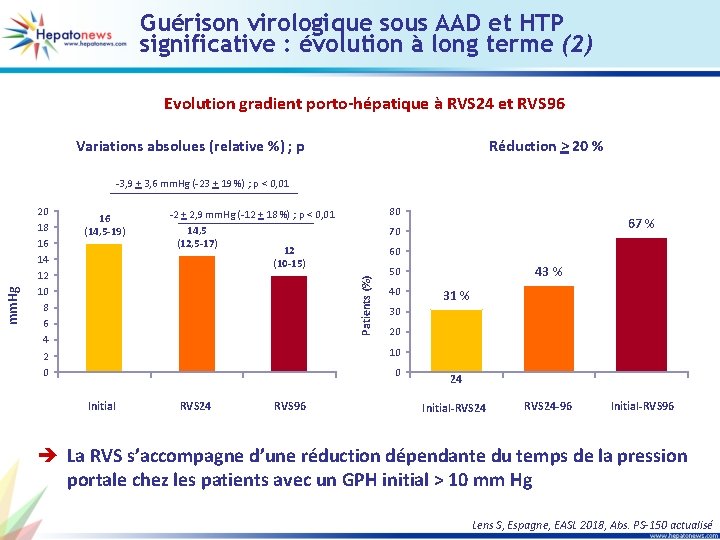
Guérison virologique sous AAD et HTP significative : évolution à long terme (2) Evolution gradient porto-hépatique à RVS 24 et RVS 96 Variations absolues (relative %) ; p Réduction > 20 % 20 18 16 14 12 10 8 6 4 2 0 16 (14, 5 -19) 80 -2 + 2, 9 mm. Hg (-12 + 18 %) ; p < 0, 01 14, 5 (12, 5 -17) 12 (10 -15) 67 % 70 60 Patients (%) mm. Hg -3, 9 + 3, 6 mm. Hg (-23 + 19 %) ; p < 0, 01 43 % 50 40 31 % 30 20 10 0 Initial RVS 24 RVS 96 24 33 49 Initial-RVS 24 -96 Initial-RVS 96 è La RVS s’accompagne d’une réduction dépendante du temps de la pression portale chez les patients avec un GPH initial > 10 mm Hg Lens S, Espagne, EASL 2018, Abs. PS-150 actualisé

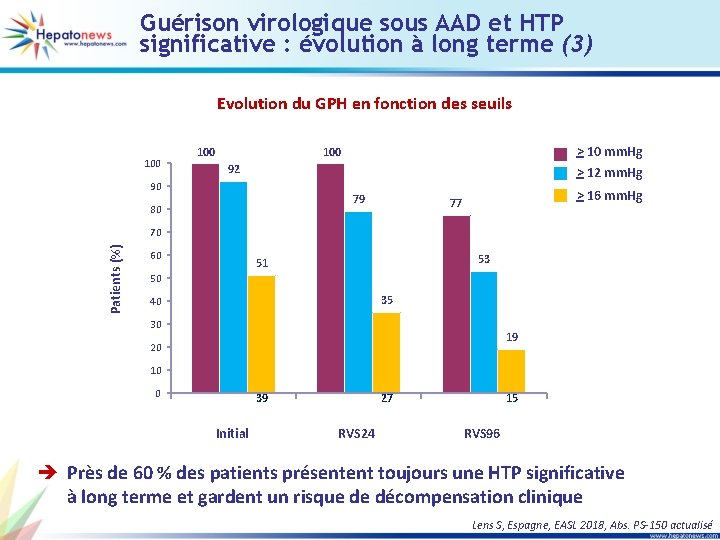
Guérison virologique sous AAD et HTP significative : évolution à long terme (3) Evolution du GPH en fonction des seuils 100 > 10 mm. Hg > 12 mm. Hg 100 92 90 79 80 > 16 mm. Hg 77 Patients (%) 70 60 53 51 50 35 40 30 19 20 10 0 77 71 Initial 39 77 61 RVS 24 27 59 41 15 RVS 96 è Près de 60 % des patients présentent toujours une HTP significative à long terme et gardent un risque de décompensation clinique Lens S, Espagne, EASL 2018, Abs. PS-150 actualisé

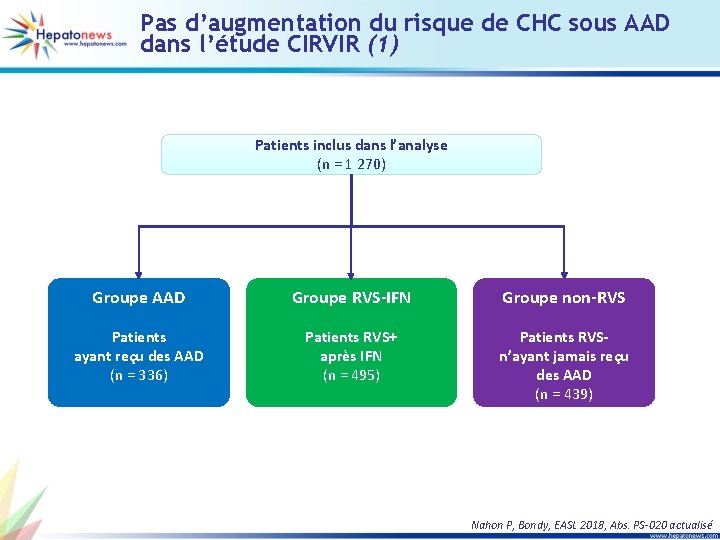
Pas d’augmentation du risque de CHC sous AAD dans l’étude CIRVIR (1) Patients inclus dans l’analyse (n = 1 270) Groupe AAD Groupe RVS-IFN Groupe non-RVS Patients ayant reçu des AAD (n = 336) Patients RVS+ après IFN (n = 495) Patients RVSn’ayant jamais reçu des AAD (n = 439) Nahon P, Bondy, EASL 2018, Abs. PS-020 actualisé

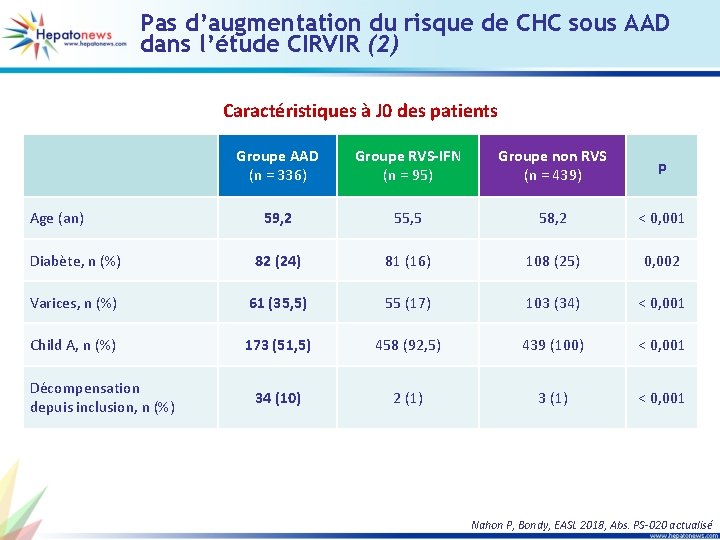
Pas d’augmentation du risque de CHC sous AAD dans l’étude CIRVIR (2) Caractéristiques à J 0 des patients Groupe AAD (n = 336) Groupe RVS-IFN (n = 95) Groupe non RVS (n = 439) p 59, 2 55, 5 58, 2 < 0, 001 Diabète, n (%) 82 (24) 81 (16) 108 (25) 0, 002 Varices, n (%) 61 (35, 5) 55 (17) 103 (34) < 0, 001 Child A, n (%) 173 (51, 5) 458 (92, 5) 439 (100) < 0, 001 34 (10) 2 (1) 3 (1) < 0, 001 Age (an) Décompensation depuis inclusion, n (%) Nahon P, Bondy, EASL 2018, Abs. PS-020 actualisé

Pas d’augmentation du risque de CHC sous AAD dans l’étude CIRVIR (3) Caractéristiques des CHC au moment du diagnostic Groupe AAD (n = 332) Groupe RVS-IFN (n = 497) Groupe non RVS (n = 440) p CHC, n (%) 15 (4, 5) 30 (6) 155 (35) < 0, 001 Dans les critères de Milan, n (%) 10 (71) 23 (88, 5) 111(80) 0, 38 Traitement curatif, n (%) 7 (58) 21 (78) 94 (67) 0, 26 Temps depuis la dernière imagerie avant CHC (mois) 6, 1 (3 -8, 6) 6, 3 (5, 8 -11, 4) 6, 7 (5, 6 -9, 4) 0, 58 78, 6 (42, 9 -92, 3) 91, 7 (75 -100) 100 (80 -100) < 0, 001 Nb d’imageries réalisées/nb théorique depuis inclusion (%) • 8/15 patients avec un CHC dans le groupe AAD avaient une imagerie > 6 mois et/ou une imagerie anormale Nahon P, Bondy, EASL 2018, Abs. PS-020 actualisé

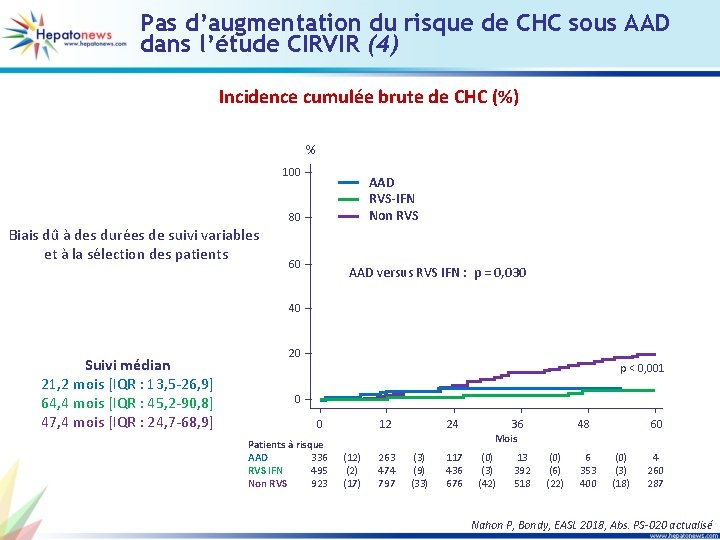
Pas d’augmentation du risque de CHC sous AAD dans l’étude CIRVIR (4) Incidence cumulée brute de CHC (%) % 100 AAD RVS-IFN Non RVS 80 Biais dû à des durées de suivi variables et à la sélection des patients 60 AAD versus RVS IFN : p = 0, 030 40 Suivi médian 21, 2 mois [IQR : 13, 5 -26, 9] 64, 4 mois [IQR : 45, 2 -90, 8] 47, 4 mois [IQR : 24, 7 -68, 9] 20 p < 0, 001 0 0 Patients à risque AAD 336 RVS IFN 495 Non RVS 923 12 24 36 48 60 Mois (12) (17) 263 474 797 (3) (9) (33) 117 436 676 (0) (3) (42) 13 392 518 (0) (6) (22) 6 353 400 (0) (3) (18) 4 260 287 Nahon P, Bondy, EASL 2018, Abs. PS-020 actualisé

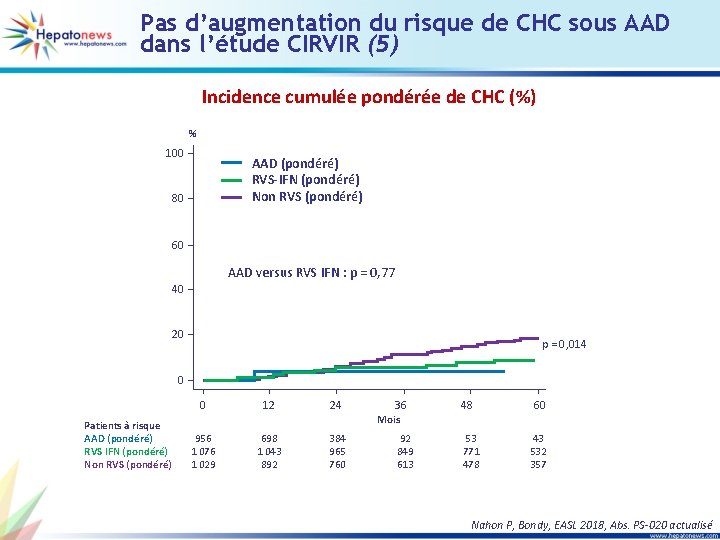
Pas d’augmentation du risque de CHC sous AAD dans l’étude CIRVIR (5) Incidence cumulée pondérée de CHC (%) % 100 AAD (pondéré) RVS-IFN (pondéré) Non RVS (pondéré) 80 60 AAD versus RVS IFN : p = 0, 77 40 20 p = 0, 014 0 0 Patients à risque AAD (pondéré) RVS IFN (pondéré) Non RVS (pondéré) 12 24 36 48 60 Mois 956 1 076 1 029 698 1 043 892 384 965 760 92 849 613 53 771 478 43 532 357 Nahon P, Bondy, EASL 2018, Abs. PS-020 actualisé

Pas d’augmentation de l’agressivité tumorale après traitement par AAD (1) • 420 CHC sur cirrhose VHC+ réséqués entre 2014 et 2016 : 78 traités par AAD avant résection (groupe étudié) et 342 non traités (groupe contrôle) Facteurs prédictifs de tumeurs agressives* en analyse multivariée OR (IC 95 %) p AAD avant résection 0, 78 (0, 46 -1, 33) 0, 352 MELD ≥ 10 0, 56 (0, 33 -0, 96) 0, 034 Tumeur la plus large > 30 mm 1, 66 (1, 08 -2, 57) 0, 02 AFP > 20 ng/ml 1, 82 (1, 90 -2, 80) 0, 006 * Différenciation histologique G 3, micro-envahissement vasculaire, tumeur satellite è Le traitement par AAD n’augmente pas l’agressivité histologique des CHC Vitale A, Italie, EASL 2018, Abs. PS-023 actualisé

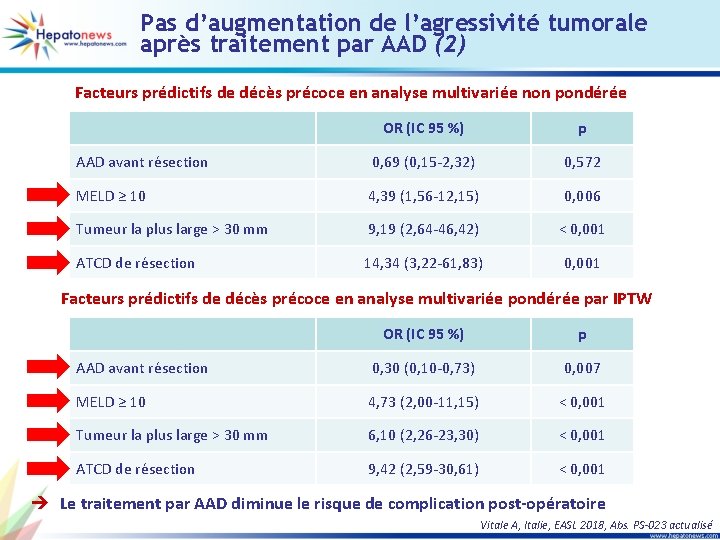
Pas d’augmentation de l’agressivité tumorale après traitement par AAD (2) Facteurs prédictifs de décès précoce en analyse multivariée non pondérée OR (IC 95 %) p AAD avant résection 0, 69 (0, 15 -2, 32) 0, 572 MELD ≥ 10 4, 39 (1, 56 -12, 15) 0, 006 Tumeur la plus large > 30 mm 9, 19 (2, 64 -46, 42) < 0, 001 ATCD de résection 14, 34 (3, 22 -61, 83) 0, 001 Facteurs prédictifs de décès précoce en analyse multivariée pondérée par IPTW OR (IC 95 %) p AAD avant résection 0, 30 (0, 10 -0, 73) 0, 007 MELD ≥ 10 4, 73 (2, 00 -11, 15) < 0, 001 Tumeur la plus large > 30 mm 6, 10 (2, 26 -23, 30) < 0, 001 ATCD de résection 9, 42 (2, 59 -30, 61) < 0, 001 è Le traitement par AAD diminue le risque de complication post-opératoire Vitale A, Italie, EASL 2018, Abs. PS-023 actualisé

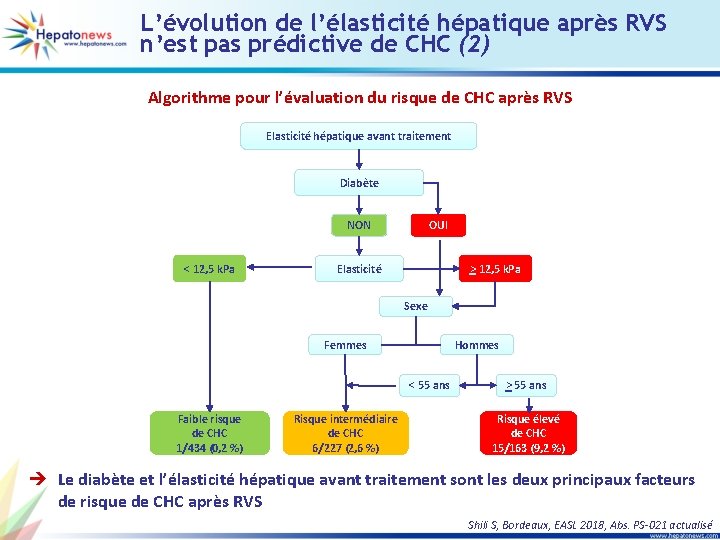
L’évolution de l’élasticité hépatique après RVS n’est pas prédictive de CHC (1) • Etude prospective de 828 patients VHC traités par AAD, avec RVS • Suivi médian après RVS : 6 mois • Evolution élasticité hépatique : -3, 6 [-6, 2 ; -1, 1] k. Pa (p < 0, 0001) Facteurs de risque de CHC (analyse multivariée) Paramètres Sexe masculin (versus féminin) HR [IC 95 %] 3, 04 [1, 10 -8, 41] p 0, 032 Age (/année) Age ≥ 55 ans versus < 55 ans 1, 06 [1, 02 -1, 10] 4, 35 [1, 58 -19, 26] 0, 005 0, 040 Syndrome métabolique (oui versus non) Diabète (oui versus non) 1, 06 [0, 64 -1, 75] 2, 70 [1, 12 -6, 51] 0, 816 0, 026 Elasticité à l’inclusion (/k. Pa) Elasticité qualitative à l’inclusion : - Elasticité [8 -12, 5] versus élasticité < 8 k. Pa - Elasticité > 12, 5 versus élasticité < 8 k. Pa 1, 05 [1, 02 -1, 07] < 0, 0001 1, 59 [0, 14 -17, 59] 10, 44 [1, 38 -78, 63] 0, 005 0, 99 [0, 94 -1, 04] 0, 705 Delta élasticité (/k. Pa) è La diminution de l’élasticité hépatique n’a pas d’impact sur le risque de CHC Shili S, Bordeaux, EASL 2018, Abs. PS-021 actualisé

L’évolution de l’élasticité hépatique après RVS n’est pas prédictive de CHC (2) Algorithme pour l’évaluation du risque de CHC après RVS Elasticité hépatique avant traitement Diabète NON < 12, 5 k. Pa OUI Elasticité > 12, 5 k. Pa Sexe Femmes Hommes < 55 ans Faible risque de CHC 1/434 (0, 2 %) Risque intermédiaire de CHC 6/227 (2, 6 %) > 55 ans Risque élevé de CHC 15/163 (9, 2 %) è Le diabète et l’élasticité hépatique avant traitement sont les deux principaux facteurs de risque de CHC après RVS Shili S, Bordeaux, EASL 2018, Abs. PS-021 actualisé

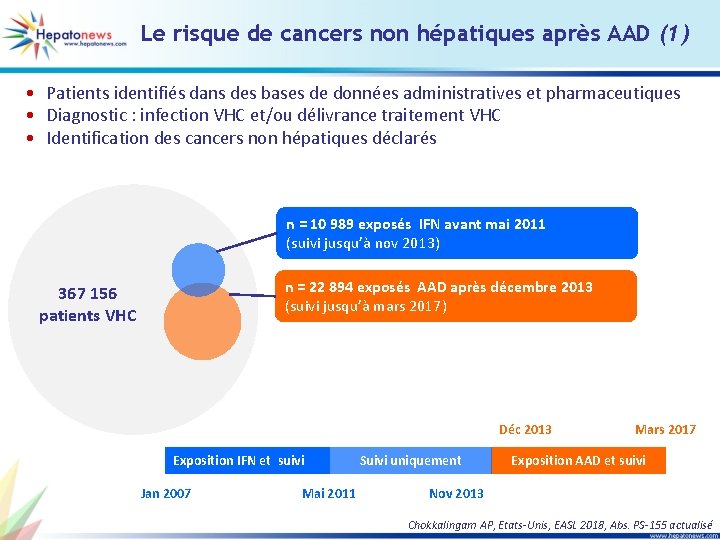
Le risque de cancers non hépatiques après AAD (1) • Patients identifiés dans des bases de données administratives et pharmaceutiques • Diagnostic : infection VHC et/ou délivrance traitement VHC • Identification des cancers non hépatiques déclarés n = 10 989 exposés IFN avant mai 2011 (suivi jusqu’à nov 2013) n = 22 894 exposés AAD après décembre 2013 (suivi jusqu’à mars 2017) 367 156 patients VHC Déc 2013 Exposition IFN et suivi Jan 2007 Mai 2011 Suivi uniquement Mars 2017 Exposition AAD et suivi Nov 2013 Chokkalingam AP, Etats-Unis, EASL 2018, Abs. PS-155 actualisé

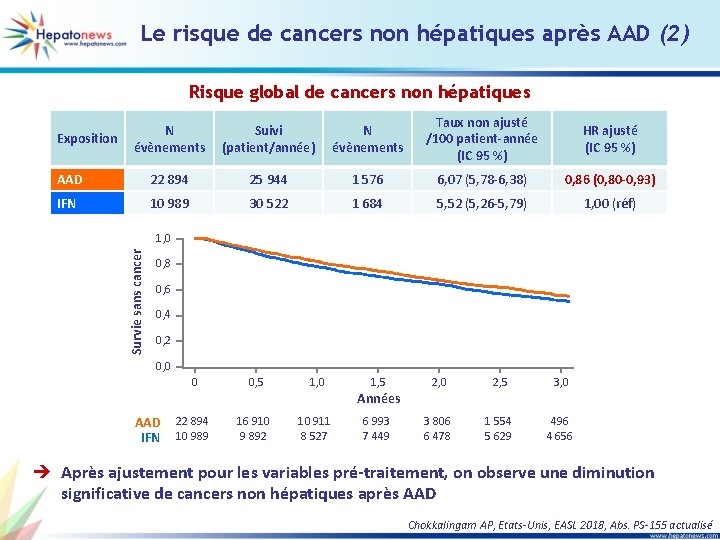
Le risque de cancers non hépatiques après AAD (2) Risque global de cancers non hépatiques N évènements Suivi (patient/année) N évènements Taux non ajusté /100 patient-année (IC 95 %) HR ajusté (IC 95 %) AAD 22 894 25 944 1 576 6, 07 (5, 78 -6, 38) 0, 86 (0, 80 -0, 93) IFN 10 989 30 522 1 684 5, 52 (5, 26 -5, 79) 1, 00 (réf) Exposition Survie sans cancer 1, 0 0, 8 0, 6 0, 4 0, 2 0, 0 0 0, 5 1, 0 1, 5 2, 0 2, 5 3, 0 3 806 6 478 1 554 5 629 496 4 656 Années AAD IFN 22 894 10 989 16 910 9 892 10 911 8 527 6 993 7 449 è Après ajustement pour les variables pré-traitement, on observe une diminution significative de cancers non hépatiques après AAD Chokkalingam AP, Etats-Unis, EASL 2018, Abs. PS-155 actualisé

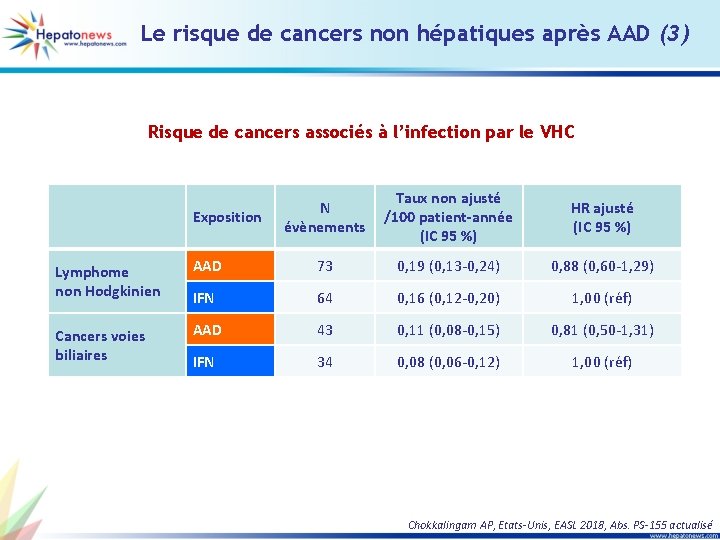
Le risque de cancers non hépatiques après AAD (3) Risque de cancers associés à l’infection par le VHC Exposition N évènements Taux non ajusté /100 patient-année (IC 95 %) HR ajusté (IC 95 %) Lymphome non Hodgkinien AAD 73 0, 19 (0, 13 -0, 24) 0, 88 (0, 60 -1, 29) IFN 64 0, 16 (0, 12 -0, 20) 1, 00 (réf) Cancers voies biliaires AAD 43 0, 11 (0, 08 -0, 15) 0, 81 (0, 50 -1, 31) IFN 34 0, 08 (0, 06 -0, 12) 1, 00 (réf) Chokkalingam AP, Etats-Unis, EASL 2018, Abs. PS-155 actualisé

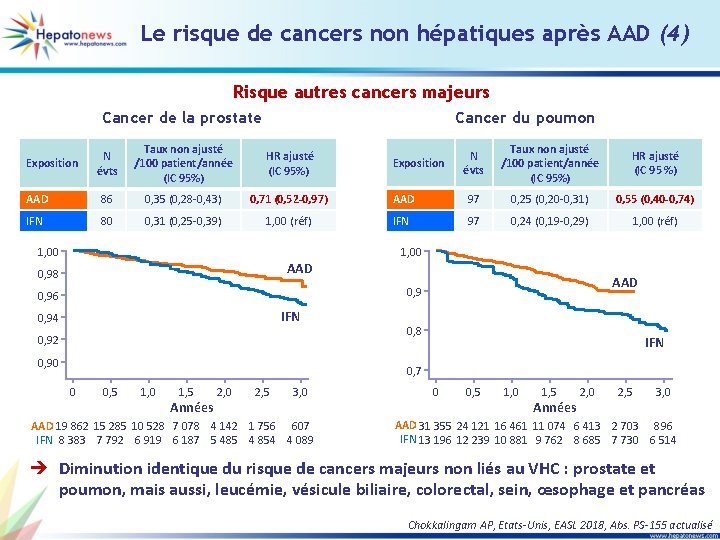
Le risque de cancers non hépatiques après AAD (4) Risque autres cancers majeurs Cancer de la prostate Cancer du poumon N évts Taux non ajusté /100 patient/année (IC 95%) HR ajusté (IC 95%) AAD 86 0, 35 (0, 28 -0, 43) 0, 71 (0, 52 -0, 97) IFN 80 0, 31 (0, 25 -0, 39) 1, 00 (réf) Exposition 1, 00 N évts Taux non ajusté /100 patient/année (IC 95%) HR ajusté (IC 95 %) AAD 97 0, 25 (0, 20 -0, 31) 0, 55 (0, 40 -0, 74) IFN 97 0, 24 (0, 19 -0, 29) 1, 00 (réf) Exposition 1, 00 AAD 0, 98 AAD 0, 96 IFN 0, 94 0, 92 0, 90 0, 8 IFN 0, 7 0 0, 5 1, 0 1, 5 Années 2, 0 2, 5 3, 0 AAD 19 862 15 285 10 528 7 078 4 142 1 756 607 IFN 8 383 7 792 6 919 6 187 5 485 4 854 4 089 0 0, 5 1, 0 1, 5 Années 2, 0 2, 5 3, 0 AAD 31 355 24 121 16 461 11 074 6 413 2 703 896 IFN 13 196 12 239 10 881 9 762 8 685 7 730 6 514 è Diminution identique du risque de cancers majeurs non liés au VHC : prostate et poumon, mais aussi, leucémie, vésicule biliaire, colorectal, sein, œsophage et pancréas Chokkalingam AP, Etats-Unis, EASL 2018, Abs. PS-155 actualisé

VHB et VHD

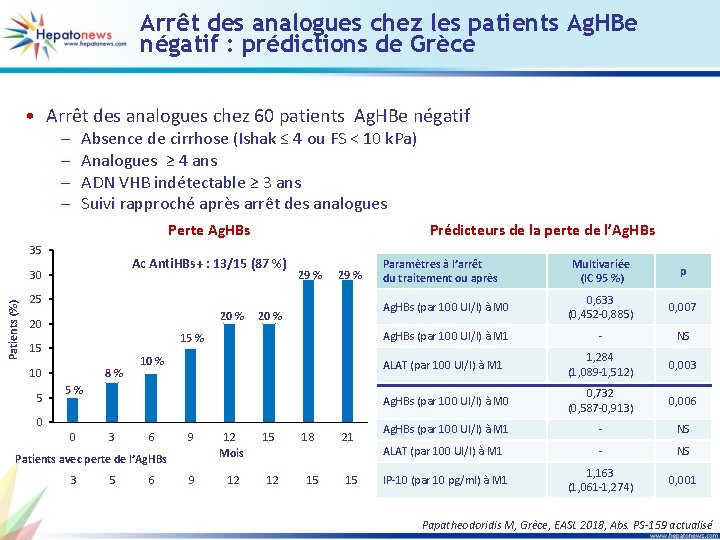
Arrêt des analogues chez les patients Ag. HBe négatif : prédictions de Grèce • Arrêt des analogues chez 60 patients Ag. HBe négatif – – Absence de cirrhose (Ishak ≤ 4 ou FS < 10 k. Pa) Analogues ≥ 4 ans ADN VHB indétectable ≥ 3 ans Suivi rapproché après arrêt des analogues Perte Ag. HBs 35 Ac Anti. HBs+ : 13/15 (87 %) 30 Patients (%) Prédicteurs de la perte de l’Ag. HBs 29 % 25 20 % 20 15 % 15 10 5 20 % 8 % 10 % 5 % 0 0 3 6 9 12 Mois 9 12 Patients avec perte de l’Ag. HBs 3 5 6 15 12 18 15 21 15 Paramètres à l’arrêt du traitement ou après Multivariée (IC 95 %) p Ag. HBs (par 100 UI/l) à M 0 0, 633 (0, 452 -0, 885) 0, 007 Ag. HBs (par 100 UI/l) à M 1 - NS ALAT (par 100 UI/l) à M 1 1, 284 (1, 089 -1, 512) 0, 003 Ag. HBs (par 100 UI/l) à M 0 0, 732 (0, 587 -0, 913) 0, 006 Ag. HBs (par 100 UI/l) à M 1 - NS ALAT (par 100 UI/l) à M 1 - NS IP-10 (par 10 pg/ml) à M 1 1, 163 (1, 061 -1, 274) 0, 001 Papatheodoridis M, Grèce, EASL 2018, Abs. PS-159 actualisé

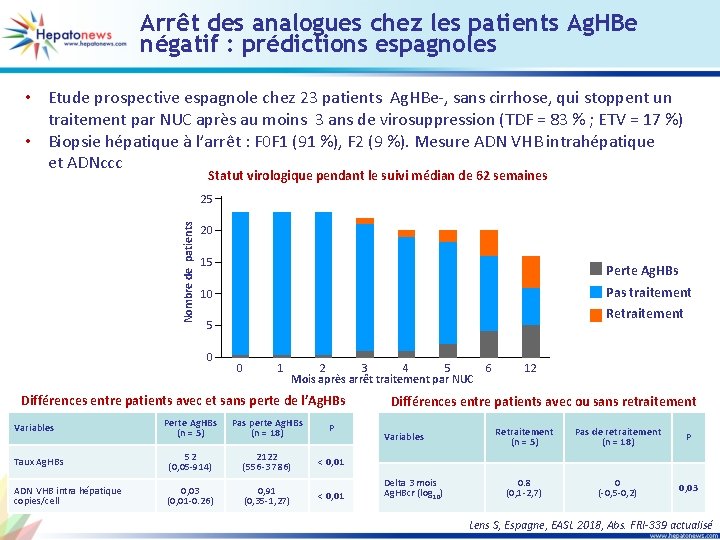
Arrêt des analogues chez les patients Ag. HBe négatif : prédictions espagnoles • Etude prospective espagnole chez 23 patients Ag. HBe-, sans cirrhose, qui stoppent un traitement par NUC après au moins 3 ans de virosuppression (TDF = 83 % ; ETV = 17 %) • Biopsie hépatique à l’arrêt : F 0 F 1 (91 %), F 2 (9 %). Mesure ADN VHB intrahépatique et ADNccc Statut virologique pendant le suivi médian de 62 semaines Nombre de patients 25 20 15 Perte Ag. HBs Pas traitement 10 Retraitement 5 0 0 1 2 3 4 5 Mois après arrêt traitement par NUC Différences entre patients avec et sans perte de l’Ag. HBs Perte Ag. HBs (n = 5) Pas perte Ag. HBs (n = 18) P Taux Ag. HBs 52 (0, 05 -914) 2122 (556 -3 786) < 0, 01 ADN VHB intra hépatique copies/cell 0, 03 (0, 01 -0. 26) 0, 91 (0, 35 -1, 27) < 0, 01 Variables 6 12 Différences entre patients avec ou sans retraitement Variables Delta 3 mois Ag. HBcr (log 10) Retraitement (n = 5) Pas de retraitement (n = 18) P 0. 8 (0, 1 -2, 7) 0 (-0, 5 -0, 2) 0, 03 Lens S, Espagne, EASL 2018, Abs. FRI-339 actualisé

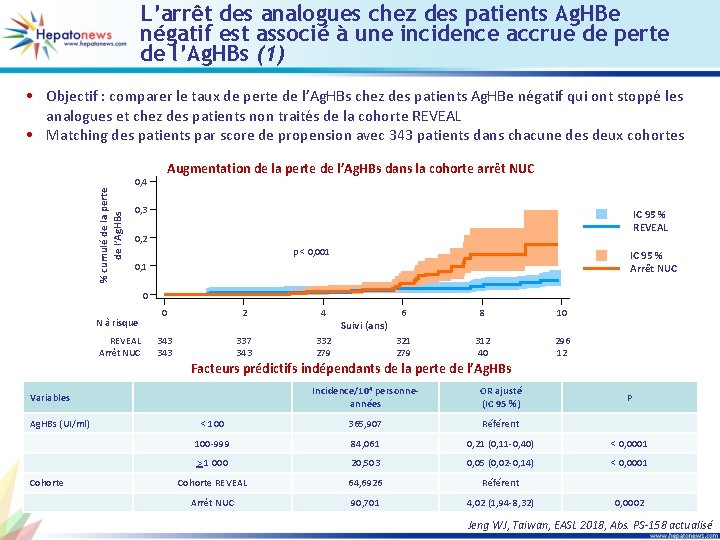
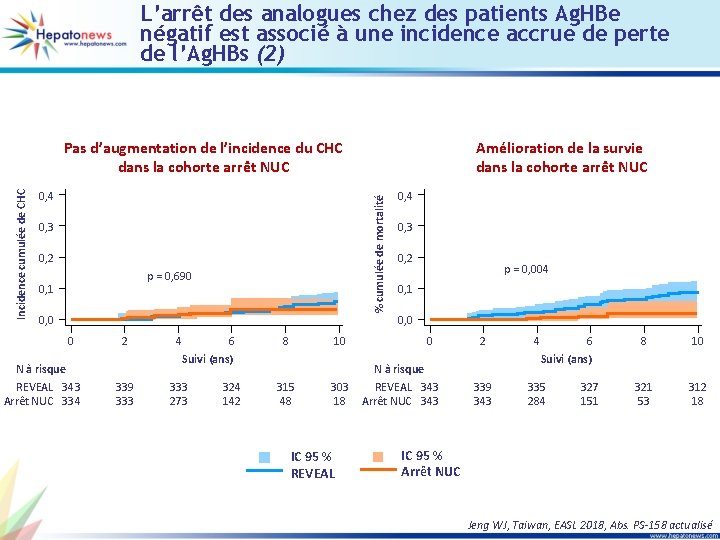
L’arrêt des analogues chez des patients Ag. HBe négatif est associé à une incidence accrue de perte de l’Ag. HBs (1) • Objectif : comparer le taux de perte de l’Ag. HBs chez des patients Ag. HBe négatif qui ont stoppé les analogues et chez des patients non traités de la cohorte REVEAL • Matching des patients par score de propension avec 343 patients dans chacune des deux cohortes Augmentation de la perte de l’Ag. HBs dans la cohorte arrêt NUC % cumulé de la perte de l’Ag. HBs 0, 4 0, 3 IC 95 % REVEAL 0, 2 p < 0, 001 IC 95 % Arrêt NUC 0, 1 0 N à risque REVEAL Arrêt NUC 0 2 4 343 337 343 332 279 Suivi (ans) 6 8 10 321 279 312 40 296 12 Facteurs prédictifs indépendants de la perte de l’Ag. HBs Incidence/104 personneannées OR ajusté (IC 95 %) < 100 365, 907 Référent 100 -999 84, 061 0, 21 (0, 11 -0, 40) < 0, 0001 > 1 000 20, 503 0, 05 (0, 02 -0, 14) < 0, 0001 Cohorte REVEAL 64, 6926 Référent Arrêt NUC 90, 701 4, 02 (1, 94 -8, 32) Variables Ag. HBs (UI/ml) Cohorte P 0, 0002 Jeng WJ, Taiwan, EASL 2018, Abs. PS-158 actualisé

L’arrêt des analogues chez des patients Ag. HBe négatif est associé à une incidence accrue de perte de l’Ag. HBs (2) 0, 4 0, 3 0, 2 p = 0, 690 0, 1 0, 0 0 N à risque REVEAL 343 Arrêt NUC 334 2 4 6 8 10 Suivi (ans) 339 333 273 Amélioration de la survie dans la cohorte arrêt NUC % cumulée de mortalité Incidence cumulée de CHC Pas d’augmentation de l’incidence du CHC dans la cohorte arrêt NUC 324 142 315 48 303 18 IC 95 % REVEAL 0, 4 0, 3 0, 2 p = 0, 004 0, 1 0, 0 0 N à risque REVEAL 343 Arrêt NUC 343 2 4 6 8 10 321 53 312 18 Suivi (ans) 339 343 335 284 327 151 IC 95 % Arrêt NUC Jeng WJ, Taiwan, EASL 2018, Abs. PS-158 actualisé

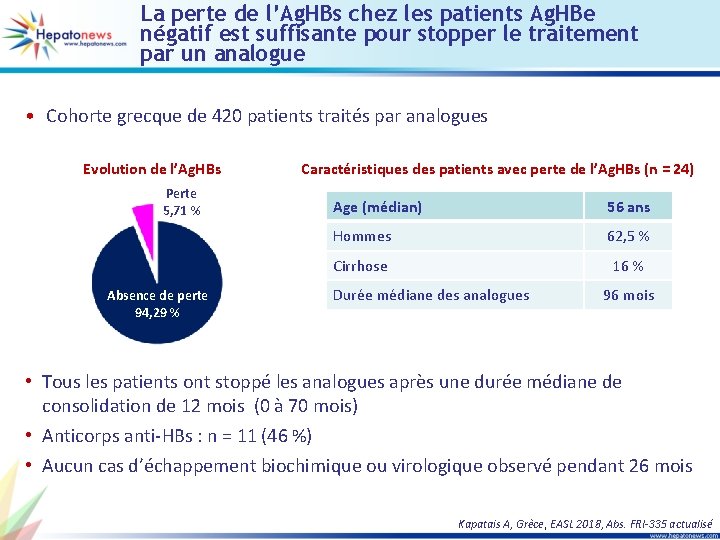
La perte de l’Ag. HBs chez les patients Ag. HBe négatif est suffisante pour stopper le traitement par un analogue • Cohorte grecque de 420 patients traités par analogues Evolution de l’Ag. HBs Perte 5, 71 % Absence de perte 94, 29 % Caractéristiques des patients avec perte de l’Ag. HBs (n = 24) Age (médian) 56 ans Hommes 62, 5 % Cirrhose 16 % Durée médiane des analogues 96 mois • Tous les patients ont stoppé les analogues après une durée médiane de consolidation de 12 mois (0 à 70 mois) • Anticorps anti-HBs : n = 11 (46 %) • Aucun cas d’échappement biochimique ou virologique observé pendant 26 mois Kapatais A, Grèce, EASL 2018, Abs. FRI-335 actualisé

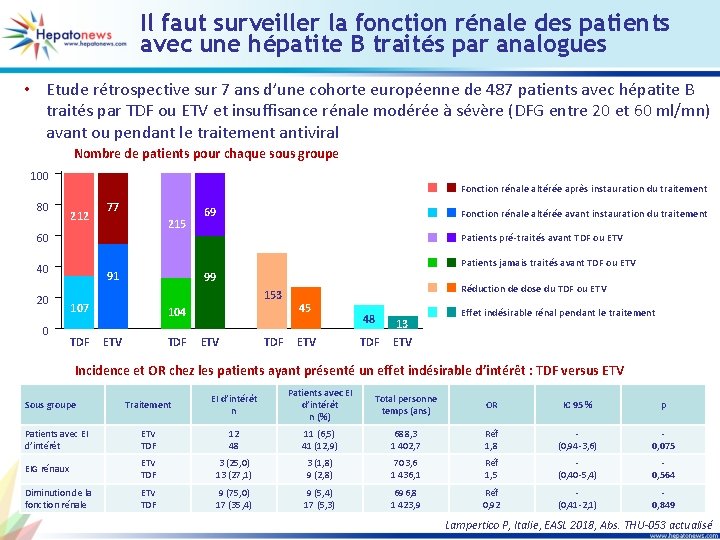
Il faut surveiller la fonction rénale des patients avec une hépatite B traités par analogues • Etude rétrospective sur 7 ans d’une cohorte européenne de 487 patients avec hépatite B traités par TDF ou ETV et insuffisance rénale modérée à sévère (DFG entre 20 et 60 ml/mn) avant ou pendant le traitement antiviral Nombre de patients pour chaque sous groupe 100 80 Fonction rénale altérée après instauration du traitement 212 77 215 60 0 Fonction rénale altérée avant instauration du traitement Patients pré-traités avant TDF ou ETV 40 20 69 Patients jamais traités avant TDF ou ETV 91 99 153 107 TDF 104 ETV TDF Réduction de dose du TDF ou ETV 45 ETV 48 TDF 13 ETV Effet indésirable rénal pendant le traitement Incidence et OR chez les patients ayant présenté un effet indésirable d’intérêt : TDF versus ETV Traitement EI d’intérêt n Patients avec EI d’intérêt n (%) Total personne temps (ans) OR IC 95 % p Patients avec EI d’intérêt ETV TDF 12 48 11 (6, 5) 41 (12, 9) 688, 3 1 402, 7 Réf 1, 8 (0, 94 -3, 6) 0, 075 EIG rénaux ETV TDF 3 (25, 0) 13 (27, 1) 3 (1, 8) 9 (2, 8) 703, 6 1 436, 1 Réf 1, 5 (0, 40 -5, 4) 0, 564 Diminution de la fonction rénale ETV TDF 9 (75, 0) 17 (35, 4) 9 (5, 4) 17 (5, 3) 696, 8 1 423, 9 Réf 0, 92 (0, 41 -2, 1) 0, 849 Sous groupe Lampertico P, Italie, EASL 2018, Abs. THU-053 actualisé

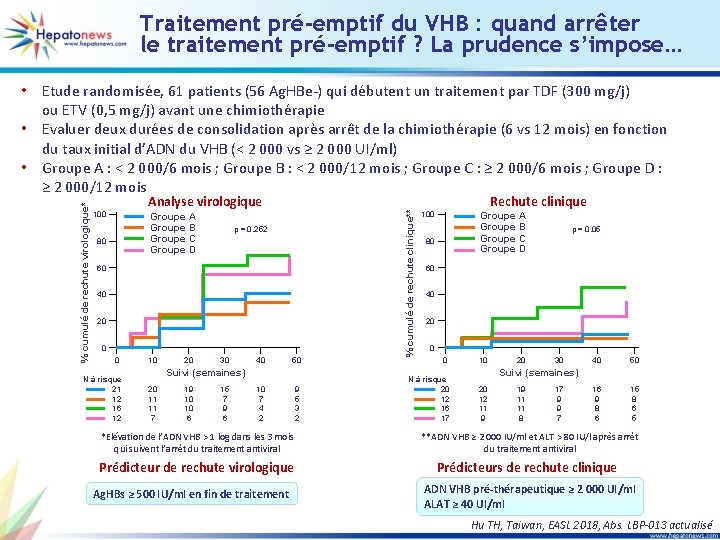
Traitement pré-emptif du VHB : quand arrêter le traitement pré-emptif ? La prudence s’impose… Analyse virologique 100 Groupe A Groupe B Groupe C Groupe D 80 p = 0, 252 60 40 20 0 0 N à risque 21 12 16 12 10 20 30 40 50 10 7 4 2 9 5 3 2 Suivi (semaines) 20 11 11 7 19 10 10 6 15 7 9 6 % cumulé de rechute clinique** % cumulé de rechute virologique* • Etude randomisée, 61 patients (56 Ag. HBe-) qui débutent un traitement par TDF (300 mg/j) ou ETV (0, 5 mg/j) avant une chimiothérapie • Evaluer deux durées de consolidation après arrêt de la chimiothérapie (6 vs 12 mois) en fonction du taux initial d’ADN du VHB (< 2 000 vs ≥ 2 000 UI/ml) • Groupe A : < 2 000/6 mois ; Groupe B : < 2 000/12 mois ; Groupe C : ≥ 2 000/6 mois ; Groupe D : ≥ 2 000/12 mois Rechute clinique 100 Groupe A Groupe B Groupe C Groupe D 80 p = 0, 05 60 40 20 0 0 10 N à risque 20 12 16 17 20 12 11 9 20 30 40 50 16 9 8 6 15 8 6 5 Suivi (semaines) 19 11 11 8 17 9 9 7 *Elévation de l’ADN VHB > 1 log dans les 3 mois qui suivent l’arrêt du traitement antiviral **ADN VHB ≥ 2 000 IU/ml et ALT > 80 IU/l après arrêt du traitement antiviral Prédicteur de rechute virologique Prédicteurs de rechute clinique Ag. HBs ≥ 500 IU/ml en fin de traitement ADN VHB pré-thérapeutique ≥ 2 000 UI/ml ALAT ≥ 40 UI/ml Hu TH, Taiwan, EASL 2018, Abs. LBP-013 actualisé

Infection occulte par le VHB et CHC sur hépatopathie « non virale » • But : incidence des infections occultes par le VHB (IOB) chez 90 CHC liés à l’alcool, la NASH, l’HAI, la CBP, les cholangites infectieuses ou cryptogéniques sans marqueur d’infection active virale B ou C (21 % sur foie cirrhotique) • ADN VHB en foie tumoral et non tumoral détecté par une PCR nichée de 4 régions génomiques (Pol, P, C, S ou X) : IOB = au moins 2 régions positives • 50/90 (56 %) IOB (13, 18 et 19 patients avec 2, 3 et 4 régions PCR+) 45/50 patients (90 %) n’avaient pas de cirrhose è L’IOB est présente chez plus de la moitié des CHC d’origine « non virale » et pourrait être un facteur synergique de survenue du CHC, en plus de l’hépatopathie sous-jacente Wong D, Chine, EASL 2018, Abs. FRI-254 actualisé

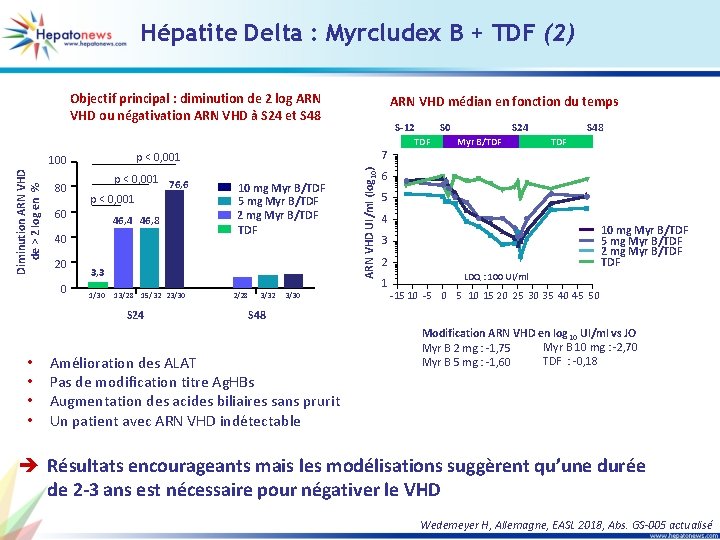
Hépatite Delta : Myrcludex B + TDF (1) • Myrcludex B : inhibiteur d’entrée du VHB • Etude phase 2 b : 120 patients, 50 % : F 4 Bras A (n = 28) Pré-traitement TDF Myr B 2 mg + TDF Suivi (TDF) Bras B (n = 32) Pré-traitement TDF Myr B 5 mg + TDF Suivi (TDF Bras C (n = 30) Pré-traitement TDF Myr B 10 mg + TDF Suivi (TDF) Bras D (n = 30) Pré-traitement TDF S -12 TDF S 0 S 24 S 48 Wedemeyer H, Allemagne, EASL 2018, Abs. GS-005 actualisé

Hépatite Delta : Myrcludex B + TDF (2) p < 0, 001 76, 6 p < 0, 001 60 46, 4 46, 8 40 20 0 7 10 mg Myr B/TDF 5 mg Myr B/TDF 2 mg Myr B/TDF 3, 3 1/30 13/28 15/32 23/30 S 24 • • S-12 p < 0, 001 100 80 ARN VHD médian en fonction du temps 2/28 3/32 3/30 ARN VHD UI/ml (log 10) Diminution ARN VHD de > 2 log en % Objectif principal : diminution de 2 log ARN VHD ou négativation ARN VHD à S 24 et S 48 S 0 TDF S 24 Myr B/TDF S 48 TDF 6 5 4 10 mg Myr B/TDF 5 mg Myr B/TDF 2 mg Myr B/TDF 3 2 1 LDQ : 100 UI/ml -15 10 -5 0 5 10 15 20 25 30 35 40 45 50 S 48 Amélioration des ALAT Pas de modification titre Ag. HBs Augmentation des acides biliaires sans prurit Un patient avec ARN VHD indétectable Modification ARN VHD en log 10 UI/ml vs JO Myr B 10 mg : -2, 70 Myr B 2 mg : -1, 75 TDF : -0, 18 Myr B 5 mg : -1, 60 è Résultats encourageants mais les modélisations suggèrent qu’une durée de 2 -3 ans est nécessaire pour négativer le VHD Wedemeyer H, Allemagne, EASL 2018, Abs. GS-005 actualisé

Complications de la cirrhose

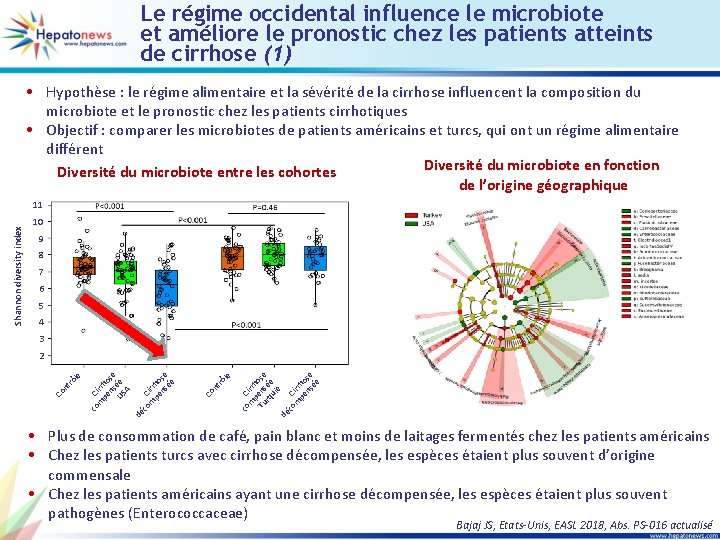
Le régime occidental influence le microbiote et améliore le pronostic chez les patients atteints de cirrhose (1) • Hypothèse : le régime alimentaire et la sévérité de la cirrhose influencent la composition du microbiote et le pronostic chez les patients cirrhotiques • Objectif : comparer les microbiotes de patients américains et turcs, qui ont un régime alimentaire différent Diversité du microbiote en fonction Diversité du microbiote entre les cohortes de l’origine géographique 10 9 8 7 6 5 4 3 C m irrh pe o ns se ée co dé C m irrh pe o Tu ns se rq ée ui e co le rô nt Co C m irrh pe o ns se ée co dé co C m irrh pe o ns se US ée A nt rô le 2 Co Shannon diversity index 11 • Plus de consommation de café, pain blanc et moins de laitages fermentés chez les patients américains • Chez les patients turcs avec cirrhose décompensée, les espèces étaient plus souvent d’origine commensale • Chez les patients américains ayant une cirrhose décompensée, les espèces étaient plus souvent pathogènes (Enterococcaceae) Bajaj JS, Etats-Unis, EASL 2018, Abs. PS-016 actualisé

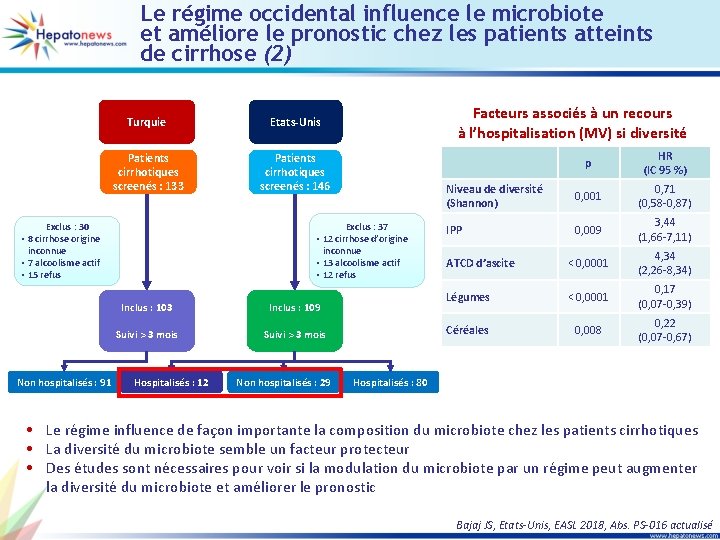
Le régime occidental influence le microbiote et améliore le pronostic chez les patients atteints de cirrhose (2) Turquie Etats-Unis Patients cirrhotiques screenés : 133 Patients cirrhotiques screenés : 146 Exclus : 37 • 12 cirrhose d’origine inconnue • 13 alcoolisme actif • 12 refus Exclus : 30 • 8 cirrhose origine inconnue • 7 alcoolisme actif • 15 refus Non hospitalisés : 91 Facteurs associés à un recours à l’hospitalisation (MV) si diversité Inclus : 103 Inclus : 109 Suivi > 3 mois Hospitalisés : 12 Non hospitalisés : 29 p HR (IC 95 %) Niveau de diversité (Shannon) 0, 001 0, 71 (0, 58 -0, 87) IPP 0, 009 3, 44 (1, 66 -7, 11) ATCD d’ascite < 0, 0001 4, 34 (2, 26 -8, 34) Légumes < 0, 0001 0, 17 (0, 07 -0, 39) Céréales 0, 008 0, 22 (0, 07 -0, 67) Hospitalisés : 80 • Le régime influence de façon importante la composition du microbiote chez les patients cirrhotiques • La diversité du microbiote semble un facteur protecteur • Des études sont nécessaires pour voir si la modulation du microbiote par un régime peut augmenter la diversité du microbiote et améliorer le pronostic Bajaj JS, Etats-Unis, EASL 2018, Abs. PS-016 actualisé

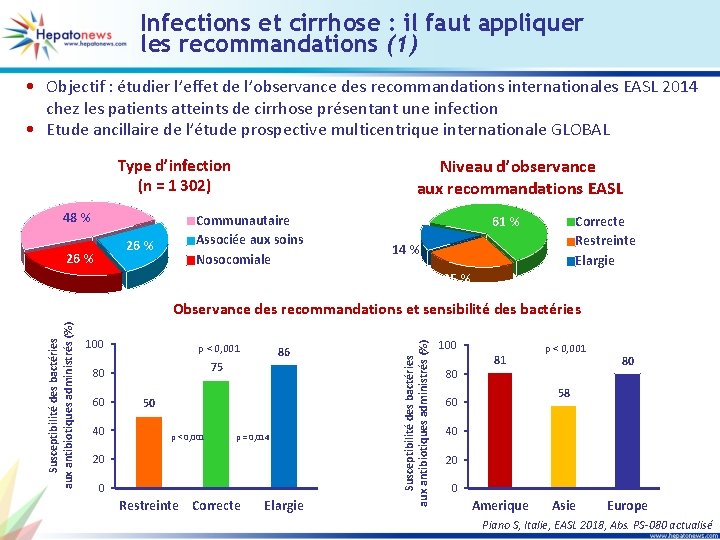
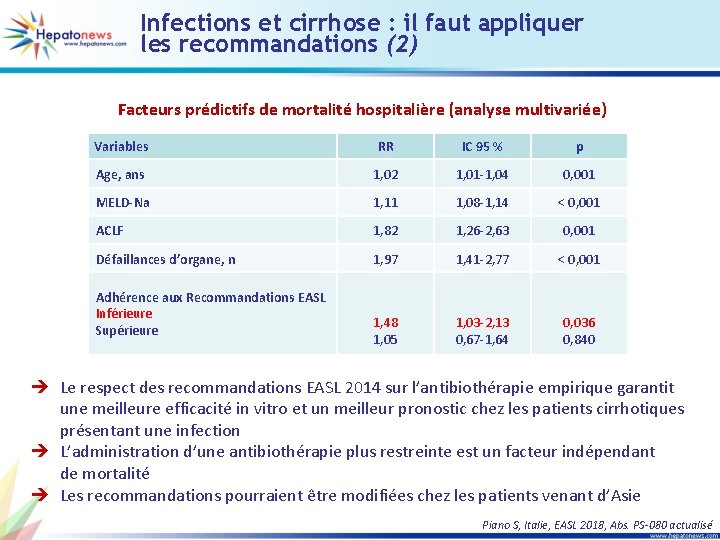
Infections et cirrhose : il faut appliquer les recommandations (1) • Objectif : étudier l’effet de l’observance des recommandations internationales EASL 2014 chez les patients atteints de cirrhose présentant une infection • Etude ancillaire de l’étude prospective multicentrique internationale GLOBAL Niveau d’observance aux recommandations EASL Type d’infection (n = 1 302) 48 % 26 % Communautaire Associée aux soins Nosocomiale Correcte Restreinte Elargie 61 % 14 % 25 % 100 p < 0, 001 75 80 60 40 86 50 p < 0, 001 p = 0, 014 20 0 Restreinte Correcte Elargie Susceptibilité des bactéries aux antibiotiques administrés (%) Observance des recommandations et sensibilité des bactéries 100 80 81 p < 0, 001 80 58 60 40 20 0 Amerique Asie Europe Piano S, Italie, EASL 2018, Abs. PS-080 actualisé

Infections et cirrhose : il faut appliquer les recommandations (2) Facteurs prédictifs de mortalité hospitalière (analyse multivariée) Variables RR IC 95 % p Age, ans 1, 02 1, 01 -1, 04 0, 001 MELD-Na 1, 11 1, 08 -1, 14 < 0, 001 ACLF 1, 82 1, 26 -2, 63 0, 001 Défaillances d’organe, n 1, 97 1, 41 -2, 77 < 0, 001 1, 48 1, 05 1, 03 -2, 13 0, 67 -1, 64 0, 036 0, 840 Adhérence aux Recommandations EASL Inférieure Supérieure è Le respect des recommandations EASL 2014 sur l’antibiothérapie empirique garantit une meilleure efficacité in vitro et un meilleur pronostic chez les patients cirrhotiques présentant une infection è L’administration d’une antibiothérapie plus restreinte est un facteur indépendant de mortalité è Les recommandations pourraient être modifiées chez les patients venant d’Asie Piano S, Italie, EASL 2018, Abs. PS-080 actualisé

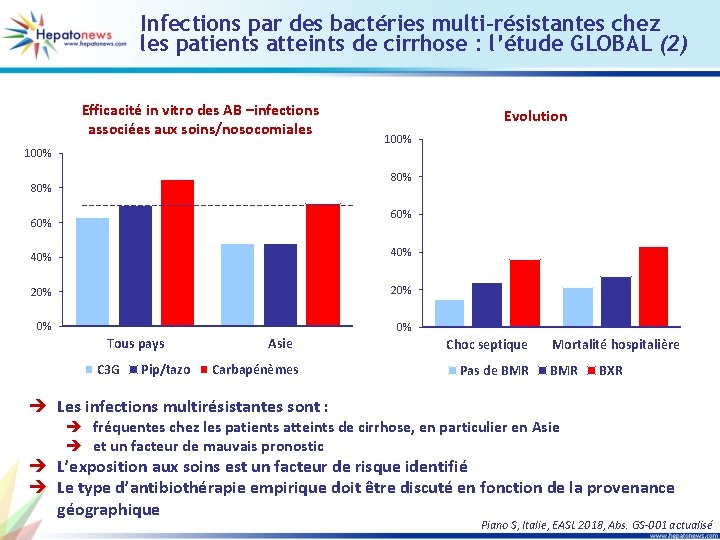
Infections par des bactéries multi-résistantes chez les patients atteints de cirrhose : l’étude GLOBAL (1) • Objectif : étudier l’épidémiologie, les facteurs prédictifs et le pronostic des infections à BMR chez les patients atteints de cirrhose • Etude prospective multicentrique internationale Facteurs de risque de BMR Type d’infection (n = 1 302) Communautaire 48% 26% Associée aux soins Nosocomiale • ISLA, infections urinaires et pulmonaires • 35 % BMR, 8 % BXR Variables RR IC 95 % p Origine géographique Amérique du Sud Inde Asie (sauf Inde) 2, 23 7, 94 2, 79 0, 99 -5, 00 3, 30 -19, 11 1, 20 -6, 46 0, 053 < 0, 001 0, 017 Type d’infection Urinaire Pulmonaire Cellulite 2, 48 3, 20 2, 92 1, 59 -3, 87 1, 83 -5, 59 1, 41 -6, 07 < 0, 001 0, 004 AB dans les 3 derniers mois 1, 92 1, 32 -2, 80 0, 001 Exposition aux soins Associée aux soins Nosocomiale 1, 62 2, 65 1, 04 -2, 52 1, 75 -4, 01 0, 032 < 0, 001 Piano S, Italie, EASL 2018, Abs. GS-001 actualisé

Infections par des bactéries multi-résistantes chez les patients atteints de cirrhose : l’étude GLOBAL (2) Efficacité in vitro des AB –infections associées aux soins/nosocomiales 100% Evolution 100% 80% 60% 40% 20% 0% 0% Tous pays C 3 G Pip/tazo Asie Carbapénèmes Choc septique Pas de BMR Mortalité hospitalière BMR BXR è Les infections multirésistantes sont : è fréquentes chez les patients atteints de cirrhose, en particulier en Asie è et un facteur de mauvais pronostic è L’exposition aux soins est un facteur de risque identifié è Le type d’antibiothérapie empirique doit être discuté en fonction de la provenance géographique Piano S, Italie, EASL 2018, Abs. GS-001 actualisé

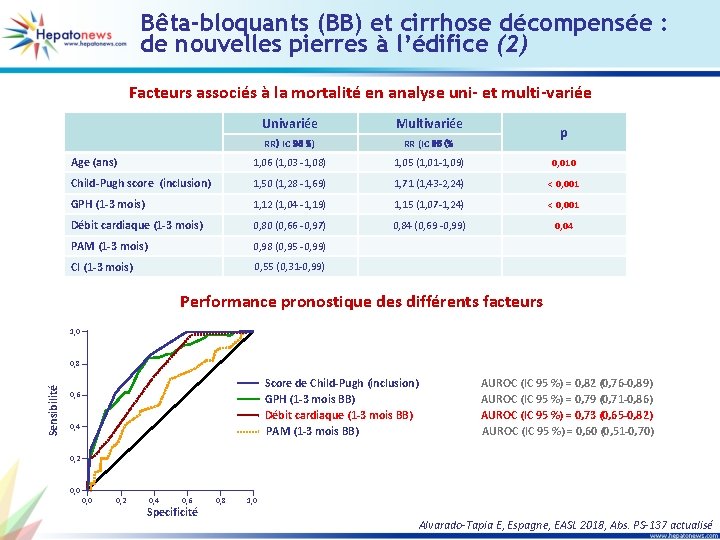
Bêta-bloquants (BB) et cirrhose décompensée : de nouvelles pierres à l’édifice (1) • Objectif : étudier les effets des BB sur la réponse hémodynamique et leur influence sur la survie chez les patients ayant une cirrhose décompensée • Critères d’inclusion : patients ayant une cirrhose décompensée avec ascite et varices de grande taille sans ATCD d’hémorragie Suivi médian 36 mois (16 -62) Etude hémodynamique chez 404 patients en attente de prophylaxie primaire : 190 (47 %) patients avec une cirrhose décompensée + ascite et varices de grande taille Etude hémodynamique (inclusion) Traitement par β-bloquants Etude hémodynamique (1 -3 mois de suivi) Etude de la réponse hémodynamique et influence sur la survie Décompensation pendant le suivi : n = 150 (79 %) Ascite 141 (74 %) Ascite réfractaire 80 (42 %) IRA 75 (40 %) SHR 31 (16 %) ISLA 38 (20 %) Encéphalopathie 37 (19 %) RVO 27 (14 %) TH 18 (9 %) CHC 31 (15 %) Décès 73 (38 %) Alvarado-Tapia E, Espagne, EASL 2018, Abs. PS-137 actualisé

Bêta-bloquants (BB) et cirrhose décompensée : de nouvelles pierres à l’édifice (2) Facteurs associés à la mortalité en analyse uni- et multi-variée Univariée Multivariée RR) IC 95 %) RR (IC 95 (% Age (ans) 1, 06 (1, 03 -1, 08) 1, 05 (1, 01 -1, 09) 0, 010 Child-Pugh score (inclusion) 1, 50 (1, 28 -1, 69) 1, 71 (1, 43 -2, 24) < 0, 001 GPH (1 -3 mois) 1, 12 (1, 04 -1, 19) 1, 15 (1, 07 -1, 24) < 0, 001 Débit cardiaque (1 -3 mois) 0, 80 (0, 66 -0, 97) 0, 84 (0, 69 -0, 99) 0, 04 PAM (1 -3 mois) 0, 98 (0, 95 -0, 99) CI (1 -3 mois) 0, 55 (0, 31 -0, 99) p Performance pronostique des différents facteurs 1, 0 Sensibilité 0, 8 Score de Child-Pugh (inclusion) GPH (1 -3 mois BB) Débit cardiaque (1 -3 mois BB) PAM (1 -3 mois BB) 0, 6 0, 4 AUROC (IC 95 %) = 0, 82 (0, 76 -0, 89) AUROC (IC 95 %) = 0, 79 (0, 71 -0, 86) AUROC (IC 95 %) = 0, 73 (0, 65 -0, 82) AUROC (IC 95 %) = 0, 60 (0, 51 -0, 70) 0, 2 0, 0 0, 2 0, 4 0, 6 Specificité 0, 8 1, 0 Alvarado-Tapia E, Espagne, EASL 2018, Abs. PS-137 actualisé

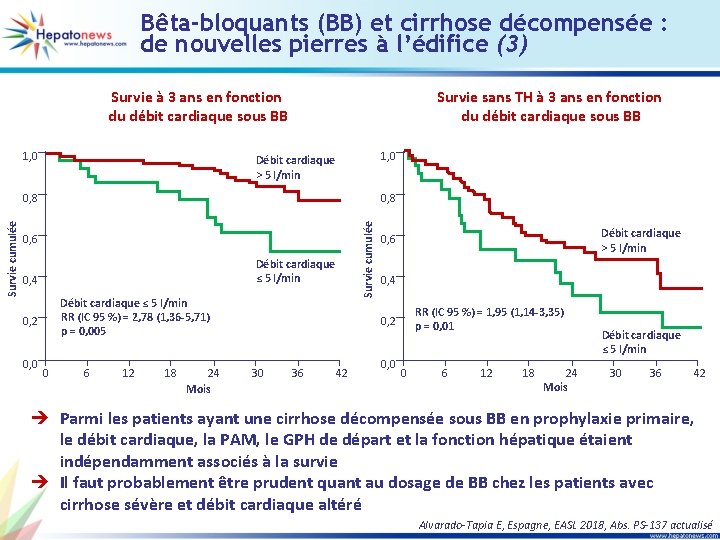
Bêta-bloquants (BB) et cirrhose décompensée : de nouvelles pierres à l’édifice (3) Survie à 3 ans en fonction du débit cardiaque sous BB 1, 0 Survie sans TH à 3 ans en fonction du débit cardiaque sous BB 1, 0 Débit cardiaque > 5 l/min 0, 8 0, 6 Débit cardiaque ≤ 5 l/min 0, 4 Débit cardiaque ≤ 5 l/min RR (IC 95 %) = 2, 78 (1, 36 -5, 71) p = 0, 005 0, 2 0, 0 0 6 12 18 24 Mois Survie cumulée 0, 8 Débit cardiaque > 5 l/min 0, 6 0, 4 RR (IC 95 %) = 1, 95 (1, 14 -3, 35) p = 0, 01 0, 2 30 36 42 0, 0 0 6 12 18 24 Mois Débit cardiaque ≤ 5 l/min 30 36 42 è Parmi les patients ayant une cirrhose décompensée sous BB en prophylaxie primaire, le débit cardiaque, la PAM, le GPH de départ et la fonction hépatique étaient indépendamment associés à la survie è Il faut probablement être prudent quant au dosage de BB chez les patients avec cirrhose sévère et débit cardiaque altéré Alvarado-Tapia E, Espagne, EASL 2018, Abs. PS-137 actualisé

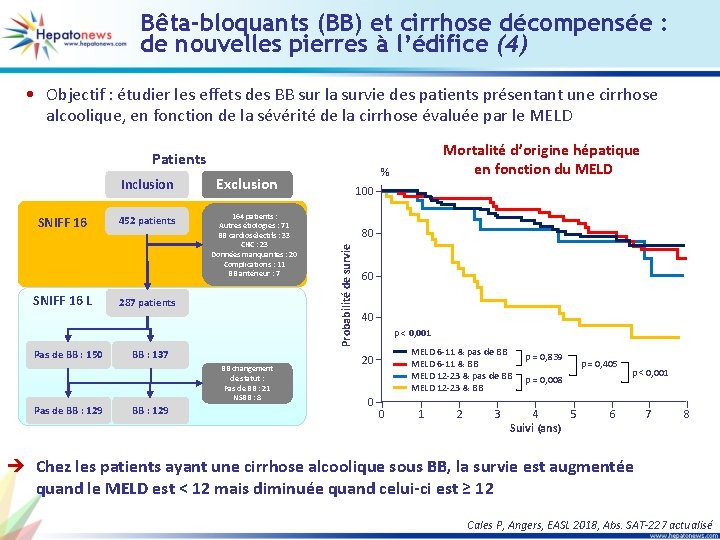
Bêta-bloquants (BB) et cirrhose décompensée : de nouvelles pierres à l’édifice (4) • Objectif : étudier les effets des BB sur la survie des patients présentant une cirrhose alcoolique, en fonction de la sévérité de la cirrhose évaluée par le MELD Patients SNIFF 16 L Pas de BB : 150 452 patients 164 patients : Autres étiologies : 71 BB cardiosélectifs : 33 CHC : 23 Données manquantes : 20 Complications : 11 BB antérieur : 7 287 patients BB : 137 BB changement de statut : Pas de BB : 21 NSBB : 8 Pas de BB : 129 % Exclusion 100 80 Probabilité de survie Inclusion Mortalité d’origine hépatique en fonction du MELD 60 40 p < 0, 001 MELD 6 -11 & pas de BB MELD 6 -11 & BB MELD 12 -23 & pas de BB MELD 12 -23 & BB 20 0 0 1 2 3 p = 0, 839 p = 0, 405 p = 0, 008 4 5 Suivi (ans) p < 0, 001 6 7 8 è Chez les patients ayant une cirrhose alcoolique sous BB, la survie est augmentée quand le MELD est < 12 mais diminuée quand celui-ci est ≥ 12 Cales P, Angers, EASL 2018, Abs. SAT-227 actualisé

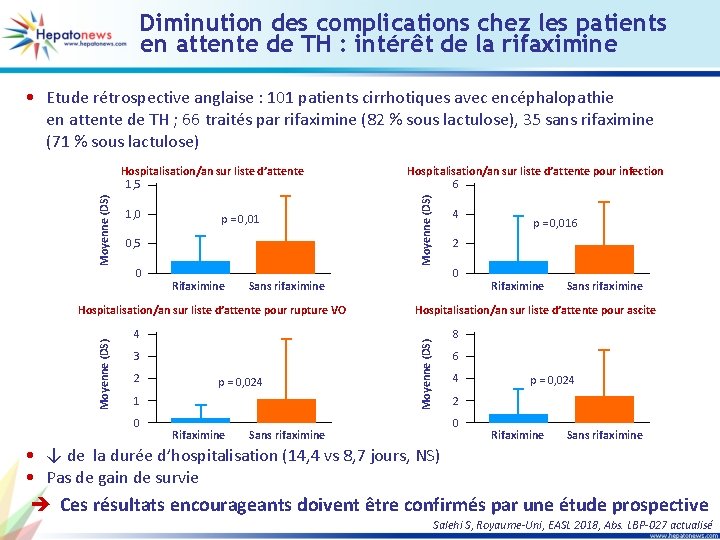
Diminution des complications chez les patients en attente de TH : intérêt de la rifaximine • Etude rétrospective anglaise : 101 patients cirrhotiques avec encéphalopathie en attente de TH ; 66 traités par rifaximine (82 % sous lactulose), 35 sans rifaximine (71 % sous lactulose) p = 0, 01 0, 5 0 Rifaximine Sans rifaximine Moyenne (DS) Hospitalisation/an sur liste d’attente pour rupture VO 4 3 2 p = 0, 024 1 0 Rifaximine Moyenne (DS) 1, 0 Hospitalisation/an sur liste d’attente pour infection 6 4 p = 0, 016 2 0 Rifaximine Sans rifaximine Hospitalisation/an sur liste d’attente pour ascite Moyenne (DS) Hospitalisation/an sur liste d’attente 1, 5 8 6 4 2 0 Sans rifaximine p = 0, 024 Rifaximine Sans rifaximine • ↓ de la durée d’hospitalisation (14, 4 vs 8, 7 jours, NS) • Pas de gain de survie è Ces résultats encourageants doivent être confirmés par une étude prospective Salehi S, Royaume-Uni, EASL 2018, Abs. LBP-027 actualisé

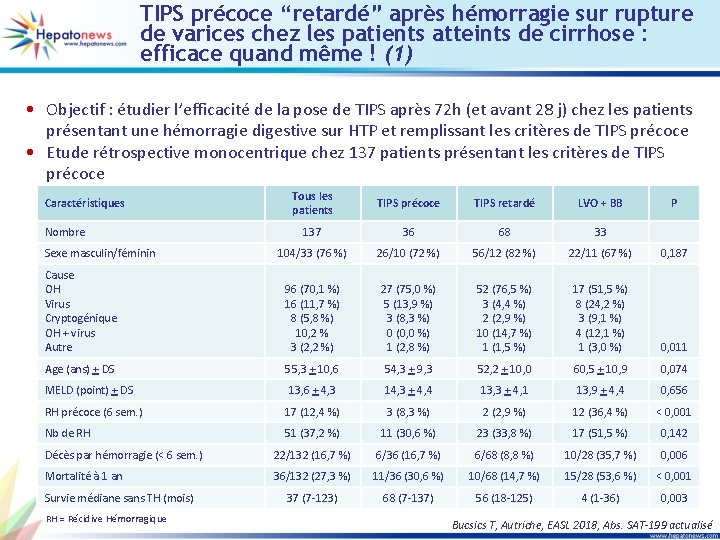
TIPS précoce “retardé” après hémorragie sur rupture de varices chez les patients atteints de cirrhose : efficace quand même ! (1) • Objectif : étudier l’efficacité de la pose de TIPS après 72 h (et avant 28 j) chez les patients présentant une hémorragie digestive sur HTP et remplissant les critères de TIPS précoce • Etude rétrospective monocentrique chez 137 patients présentant les critères de TIPS précoce Tous les patients TIPS précoce TIPS retardé LVO + BB 137 36 68 33 104/33 (76 %) 26/10 (72 %) 56/12 (82 %) 22/11 (67 %) 0, 187 Cause OH Virus Cryptogénique OH + virus Autre 96 (70, 1 %) 16 (11, 7 %) 8 (5, 8 %) 10, 2 % 3 (2, 2 %) 27 (75, 0 %) 5 (13, 9 %) 3 (8, 3 %) 0 (0, 0 %) 1 (2, 8 %) 52 (76, 5 %) 3 (4, 4 %) 2 (2, 9 %) 10 (14, 7 %) 1 (1, 5 %) 17 (51, 5 %) 8 (24, 2 %) 3 (9, 1 %) 4 (12, 1 %) 1 (3, 0 %) 0, 011 Age (ans) + DS 55, 3 + 10, 6 54, 3 + 9, 3 52, 2 + 10, 0 60, 5 + 10, 9 0, 074 MELD (point) + DS 13, 6 + 4, 3 14, 3 + 4, 4 13, 3 + 4, 1 13, 9 + 4, 4 0, 656 RH précoce (6 sem. ) 17 (12, 4 %) 3 (8, 3 %) 2 (2, 9 %) 12 (36, 4 %) < 0, 001 Nb de RH 51 (37, 2 %) 11 (30, 6 %) 23 (33, 8 %) 17 (51, 5 %) 0, 142 Décès par hémorragie (< 6 sem. ) 22/132 (16, 7 %) 6/36 (16, 7 %) 6/68 (8, 8 %) 10/28 (35, 7 %) 0, 006 Mortalité à 1 an 36/132 (27, 3 %) 11/36 (30, 6 %) 10/68 (14, 7 %) 15/28 (53, 6 %) < 0, 001 37 (7 -123) 68 (7 -137) 56 (18 -125) 4 (1 -36) 0, 003 Caractéristiques Nombre Sexe masculin/féminin Survie médiane sans TH (mois) RH = Récidive Hémorragique P Bucsics T, Autriche, EASL 2018, Abs. SAT-199 actualisé

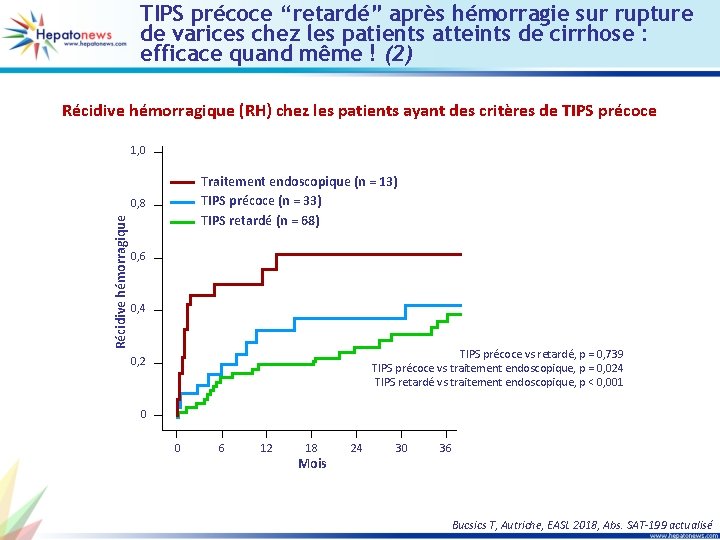
TIPS précoce “retardé” après hémorragie sur rupture de varices chez les patients atteints de cirrhose : efficace quand même ! (2) Récidive hémorragique (RH) chez les patients ayant des critères de TIPS précoce 1, 0 Traitement endoscopique (n = 13) TIPS précoce (n = 33) TIPS retardé (n = 68) Récidive hémorragique 0, 8 0, 6 0, 4 TIPS précoce vs retardé, p = 0, 739 TIPS précoce vs traitement endoscopique, p = 0, 024 TIPS retardé vs traitement endoscopique, p < 0, 001 0, 2 0 0 6 12 18 Mois 24 30 36 Bucsics T, Autriche, EASL 2018, Abs. SAT-199 actualisé

TIPS précoce “retardé” après hémorragie sur rupture de varices chez les patients atteints de cirrhose : efficace quand même ! (3) Survie chez les patients ayant des critères de TIPS précoce 1, 0 0, 8 Analyse multivariée (Cox) des facteurs de risque de mortalité Survie 0, 6 0, 4 Traitement endoscopique (n = 23) TIPS précoce (n = 36) TIPS retardé (n = 68) 0, 2 0 0 6 12 18 24 30 RR IC 95 % p TIPS précoce vs ttt endoscopique + BB 0, 524 0, 282 -0, 974 0, 041 TIPS retardé vs ttt endoscopique + BB 0, 548 0, 329 -0, 911 0, 021 Age (par an) 1, 030 1, 007 -1, 054 0, 011 MELD (par point) 1, 051 0, 999 -1, 106 0, 054 TIPS précoce vs retardé, p = 0, 853 TIPS précoce vs traitement endoscopique, p = 0, 017 TIPS retardé vs traitement endoscopique, p = 0, 001 36 Survie sans TH (mois) è Dans cette étude rétrospective, les patients remplissant les critères de TIPS précoce qui ont bénéficié d’un TIPS après 72 h avaient une mortalité inférieure à ceux traités par BB + LVO è Ces résultats doivent être confirmés par une étude prospective Bucsics T, Autriche, EASL 2018, Abs. SAT-199 actualisé

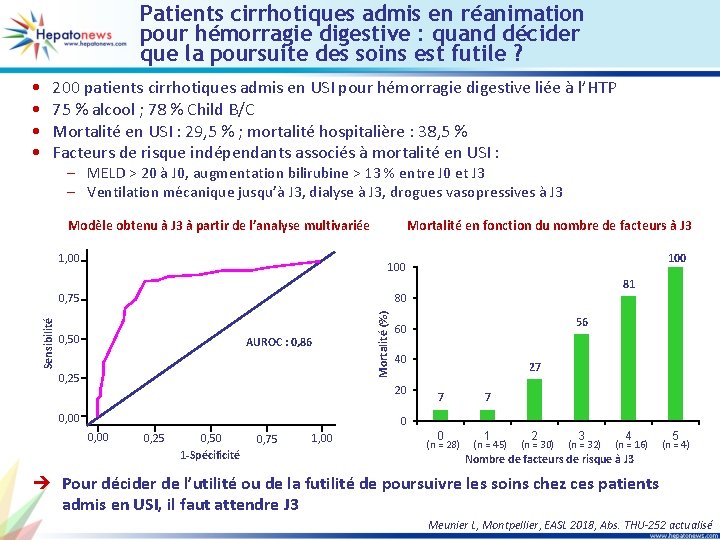
Patients cirrhotiques admis en réanimation pour hémorragie digestive : quand décider que la poursuite des soins est futile ? • • 200 patients cirrhotiques admis en USI pour hémorragie digestive liée à l’HTP 75 % alcool ; 78 % Child B/C Mortalité en USI : 29, 5 % ; mortalité hospitalière : 38, 5 % Facteurs de risque indépendants associés à mortalité en USI : – MELD > 20 à J 0, augmentation bilirubine > 13 % entre J 0 et J 3 – Ventilation mécanique jusqu’à J 3, dialyse à J 3, drogues vasopressives à J 3 Modèle obtenu à J 3 à partir de l’analyse multivariée 1, 00 Mortalité en fonction du nombre de facteurs à J 3 81 80 0, 50 AUROC : 0, 86 0, 25 Mortalité (%) 0, 75 Sensibilité 100 40 20 0, 00 56 60 27 7 7 0 0, 00 0, 25 0, 50 1 -Spécificité 0, 75 1, 00 0 (n = 28) 1 (n = 45) 2 (n = 30) 3 (n = 32) 4 (n = 16) 5 (n = 4) Nombre de facteurs de risque à J 3 è Pour décider de l’utilité ou de la futilité de poursuivre les soins chez ces patients admis en USI, il faut attendre J 3 Meunier L, Montpellier, EASL 2018, Abs. THU-252 actualisé

CHC

HR-Test et HR-AFP Test : les Fibrotests du CHC ? (1) • Mise au point d’un marqueur sanguin de risque de CHC (HR- et HR-AFP test) avec les mêmes paramètres que ceux utilisés pour le calcul du Fibrotest chez des patients suivis pour maladie chronique du foie • Construction du score à partir de 9 892 patients Groupe d’élaboration du test Groupe de validation p CHC Nombre patients AUROC (IC 95 %) p vs 0, 5 Non infériorité Tous stades HR-test 113 4 944 0, 862 (0, 827 -0, 890) < 0, 0001 108 4 948 0, 806 (0, 767 -0, 839) < 0, 0001 0, 035 Tous stades HR-AFP 106 2 015 0, 851 (0, 826 -0, 889) < 0, 0001 95 2 038 0, 788 (0, 743 -0, 827) < 0, 0001 0, 11 è Les deux tests ont une bonne performance prédictive de survenue d’un CHC Poynard T, Paris, EASL 2018, Abs. FRI-128 actualisé

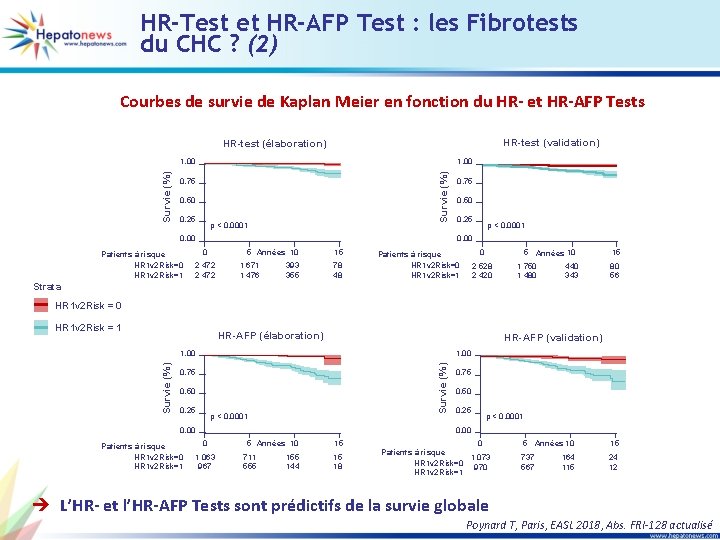
HR-Test et HR-AFP Test : les Fibrotests du CHC ? (2) Courbes de survie de Kaplan Meier en fonction du HR- et HR-AFP Tests HR-test (validation) HR-test (élaboration) 1, 00 Survie (%) 1, 00 0, 75 0, 50 0, 25 p < 0, 0001 0, 00 Patients à risque HR 1 v 2 Risk=0 HR 1 v 2 Risk=1 0, 75 0, 50 0, 25 p < 0, 0001 0, 00 0 5 Années 10 2 472 1 671 1 476 393 355 15 78 48 0 Patients à risque HR 1 v 2 Risk=0 HR 1 v 2 Risk=1 5 Années 10 2 528 2 420 1 750 1 480 440 343 15 80 56 Strata HR 1 v 2 Risk = 0 HR 1 v 2 Risk = 1 HR-AFP (élaboration) HR-AFP (validation) 1, 00 Survie (%) 1, 00 0, 75 0, 50 0, 25 p < 0, 0001 0, 00 Patients à risque HR 1 v 2 Risk=0 HR 1 v 2 Risk=1 0, 75 0, 50 0, 25 p < 0, 0001 0, 00 0 1 063 967 5 Années 10 711 555 144 15 15 18 0 Patients à risque 1 073 HR 1 v 2 Risk=0 970 HR 1 v 2 Risk=1 5 Années 10 15 737 567 24 12 164 115 è L’HR- et l’HR-AFP Tests sont prédictifs de la survie globale Poynard T, Paris, EASL 2018, Abs. FRI-128 actualisé

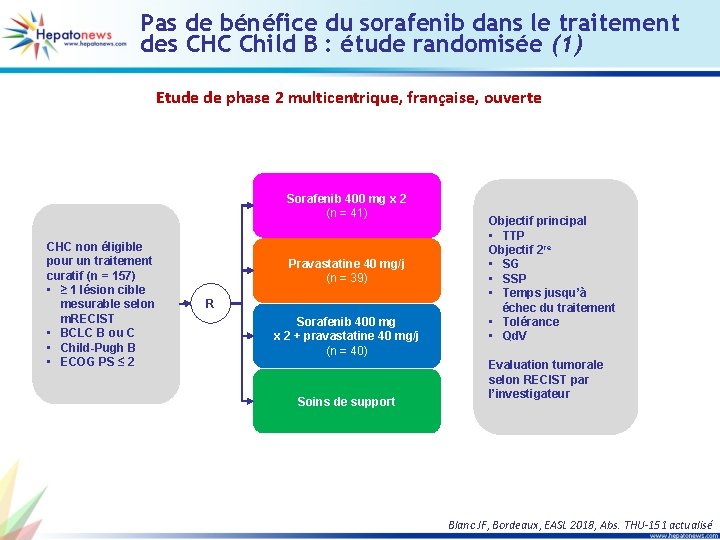
Pas de bénéfice du sorafenib dans le traitement des CHC Child B : étude randomisée (1) Etude de phase 2 multicentrique, française, ouverte Sorafenib 400 mg x 2 (n = 41) CHC non éligible pour un traitement curatif (n = 157) • ≥ 1 lésion cible mesurable selon m. RECIST • BCLC B ou C • Child-Pugh B • ECOG PS ≤ 2 Pravastatine 40 mg/j (n = 39) R Sorafenib 400 mg x 2 + pravastatine 40 mg/j (n = 40) Soins de support Objectif principal • TTP Objectif 2 re • SG • SSP • Temps jusqu’à échec du traitement • Tolérance • Qd. V Evaluation tumorale selon RECIST par l’investigateur Blanc JF, Bordeaux, EASL 2018, Abs. THU-151 actualisé

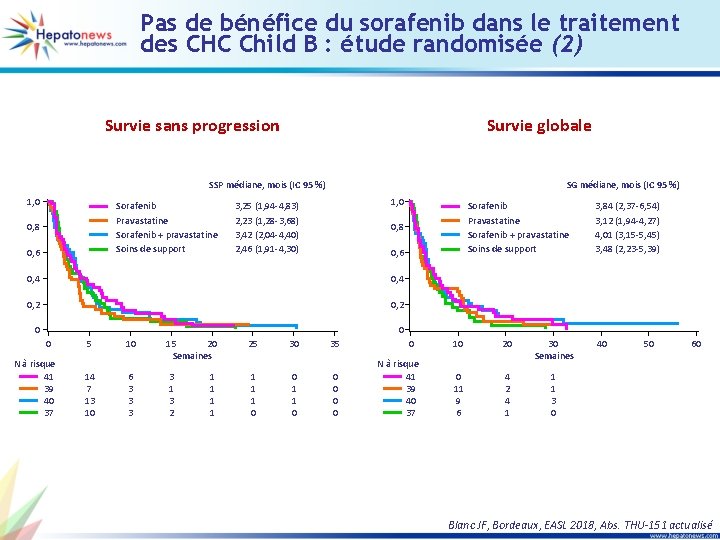
Pas de bénéfice du sorafenib dans le traitement des CHC Child B : étude randomisée (2) Survie sans progression Survie globale SSP médiane, mois (IC 95 %) 1, 0 Sorafenib Pravastatine Sorafenib + pravastatine Soins de support 0, 8 0, 6 SG médiane, mois (IC 95 %) 1, 0 3, 25 (1, 94 -4, 83) 2, 23 (1, 28 -3, 68) 3, 42 (2, 04 -4, 40) 2, 46 (1, 91 -4, 30) Sorafenib Pravastatine Sorafenib + pravastatine Soins de support 0, 8 0, 6 0, 4 0, 2 0 3, 84 (2, 37 -6, 54) 3, 12 (1, 94 -4, 27) 4, 01 (3, 15 -5, 45) 3, 48 (2, 23 -5, 39) 0 0 N à risque 41 39 40 37 5 14 7 13 10 10 6 3 3 3 15 20 Semaines 25 3 1 3 2 1 1 1 0 1 1 30 0 1 1 0 35 0 0 0 N à risque 41 39 40 37 10 20 30 Semaines 0 11 9 6 4 2 4 1 1 1 3 0 40 50 60 Blanc JF, Bordeaux, EASL 2018, Abs. THU-151 actualisé

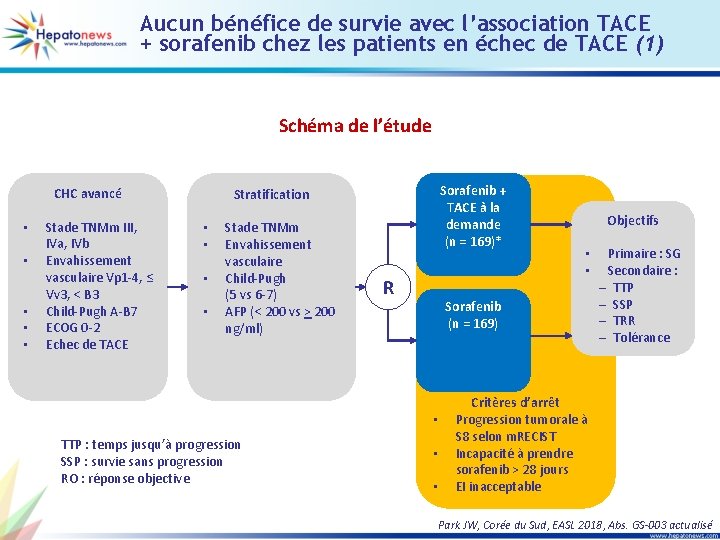
Aucun bénéfice de survie avec l’association TACE + sorafenib chez les patients en échec de TACE (1) Schéma de l’étude CHC avancé • • • Stade TNMm III, IVa, IVb Envahissement vasculaire Vp 1 -4, ≤ Vv 3, < B 3 Child-Pugh A-B 7 ECOG 0 -2 Echec de TACE Sorafenib + TACE à la demande (n = 169)* Stratification • • Stade TNMm Envahissement vasculaire Child-Pugh (5 vs 6 -7) AFP (< 200 vs > 200 ng/ml) R • • Sorafenib (n = 169) • TTP : temps jusqu’à progression SSP : survie sans progression RO : réponse objective Objectifs • • Primaire : SG Secondaire : – TTP – SSP – TRR – Tolérance Critères d’arrêt Progression tumorale à S 8 selon m. RECIST Incapacité à prendre sorafenib > 28 jours EI inacceptable Park JW, Corée du Sud, EASL 2018, Abs. GS-003 actualisé

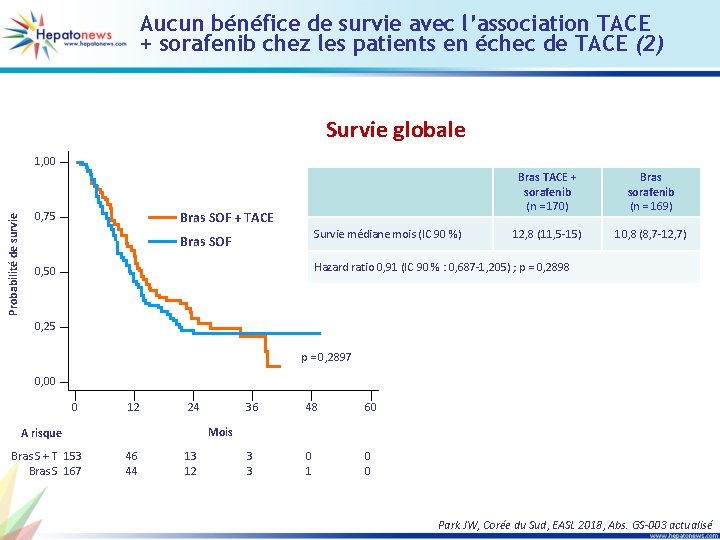
Aucun bénéfice de survie avec l’association TACE + sorafenib chez les patients en échec de TACE (2) Survie globale Probabilité de survie 1, 00 Bras SOF + TACE 0, 75 Survie médiane mois (IC 90 %) Bras SOF Bras TACE + sorafenib (n = 170) Bras sorafenib (n = 169) 12, 8 (11, 5 -15) 10, 8 (8, 7 -12, 7) Hazard ratio 0, 91 (IC 90 % : 0, 687 -1, 205) ; p = 0, 2898 0, 50 0, 25 p = 0, 2897 0, 00 0 12 24 48 60 3 3 0 1 0 0 Mois A risque Bras S + T 153 Bras S 167 36 46 44 13 12 Park JW, Corée du Sud, EASL 2018, Abs. GS-003 actualisé

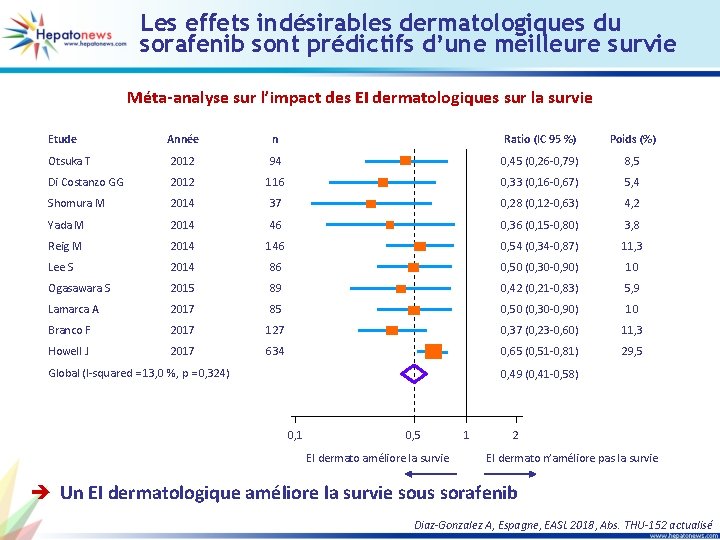
Les effets indésirables dermatologiques du sorafenib sont prédictifs d’une meilleure survie Méta-analyse sur l’impact des EI dermatologiques sur la survie Etude Année n Ratio (IC 95 %) Poids (%) Otsuka T 2012 94 0, 45 (0, 26 -0, 79) 8, 5 Di Costanzo GG 2012 116 0, 33 (0, 16 -0, 67) 5, 4 Shomura M 2014 37 0, 28 (0, 12 -0, 63) 4, 2 Yada M 2014 46 0, 36 (0, 15 -0, 80) 3, 8 Reig M 2014 146 0, 54 (0, 34 -0, 87) 11, 3 Lee S 2014 86 0, 50 (0, 30 -0, 90) 10 Ogasawara S 2015 89 0, 42 (0, 21 -0, 83) 5, 9 Lamarca A 2017 85 0, 50 (0, 30 -0, 90) 10 Branco F 2017 127 0, 37 (0, 23 -0, 60) 11, 3 Howell J 2017 634 0, 65 (0, 51 -0, 81) 29, 5 Global (I-squared = 13, 0 %, p = 0, 324) 0, 49 (0, 41 -0, 58) 0, 1 0, 5 EI dermato améliore la survie 1 2 EI dermato n’améliore pas la survie è Un EI dermatologique améliore la survie sous sorafenib Diaz-Gonzalez A, Espagne, EASL 2018, Abs. THU-152 actualisé

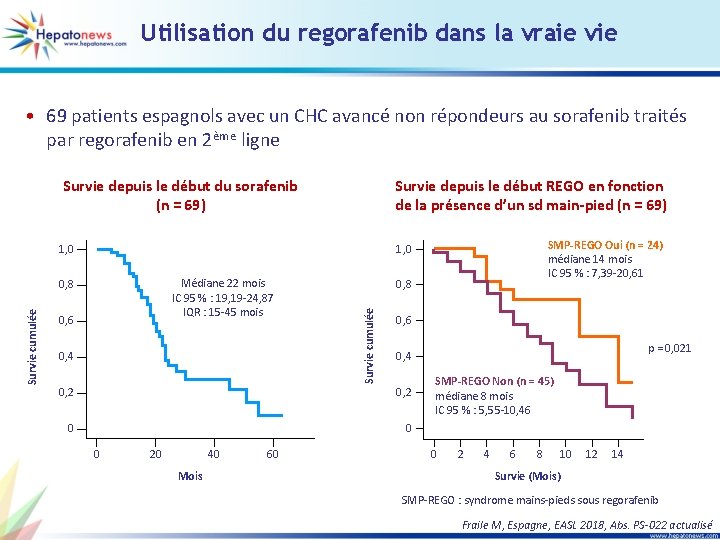
Utilisation du regorafenib dans la vraie vie • 69 patients espagnols avec un CHC avancé non répondeurs au sorafenib traités par regorafenib en 2ème ligne Survie depuis le début du sorafenib (n = 69) Survie depuis le début REGO en fonction de la présence d’un sd main-pied (n = 69) 0, 6 0, 4 0, 8 Survie cumulée Médiane 22 mois IC 95 % : 19, 19 -24, 87 IQR : 15 -45 mois 0, 8 Survie cumulée SMP-REGO Oui (n = 24) médiane 14 mois IC 95 % : 7, 39 -20, 61 1, 0 0, 6 0, 2 0 0 0 20 40 Mois 60 p = 0, 021 0, 4 SMP-REGO Non (n = 45) médiane 8 mois IC 95 % : 5, 55 -10, 46 0 2 4 6 8 10 12 14 Survie (Mois) SMP-REGO : syndrome mains-pieds sous regorafenib Fraile M, Espagne, EASL 2018, Abs. PS-022 actualisé

L’association sorafenib + TACE pourrait être intéressante dans les CHC métastasés (1) • Etude coréenne, randomisée, comparant sorafenib + TACE dans les CHC avec métastases extra-hépatiques • Dans le groupe sorafenib + TACE, les patients recevaient 2 ou 4 TACE avant de débuter le sorafenib • Il est prévu d’inclure 130 patients : les résultats préliminaires sur 65 patients sont présentés ici CHC avancé avec métastase (n = 65) Sorafenib monothérapie (n = 33) TACE-sorafenib (n = 32) Sorafenib Après 2 -4 TACE Sorafenib Yim HJ, Corée du Sud, EASL 2018, Abs. THU-186 actualisé

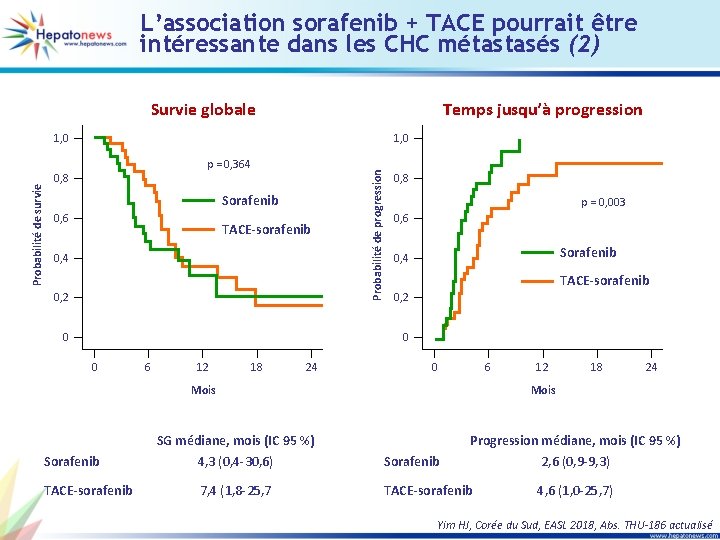
L’association sorafenib + TACE pourrait être intéressante dans les CHC métastasés (2) Survie globale Temps jusqu’à progression 1, 0 p = 0, 364 0, 8 Sorafenib 0, 6 TACE-sorafenib 0, 4 0, 2 0 Probabilité de progression Probabilité de survie 1, 0 0, 8 p = 0, 003 0, 6 Sorafenib 0, 4 TACE-sorafenib 0, 2 0 0 6 12 18 24 0 6 Mois Sorafenib TACE-sorafenib SG médiane, mois (IC 95 %) 4, 3 (0, 4 -30, 6) 7, 4 (1, 8 -25, 7 12 18 24 Mois Sorafenib Progression médiane, mois (IC 95 %) 2, 6 (0, 9 -9, 3) TACE-sorafenib 4, 6 (1, 0 -25, 7) Yim HJ, Corée du Sud, EASL 2018, Abs. THU-186 actualisé

CHC : pas de place pour la radioembolisation ? (1) • Etude randomisée comparant sorafenib à sorafenib + radioembolisation (RE) par SIR-sphere® • Dans le bras sorafenib + RE, le sorafenib est commencé à demi-dose 3 jours après la dernière séance de radioembolisation • Critères d’inclusion : CHC BCLC B non éligible pour une TACE et BCLC C, CHILD A 5 -B 7, naïf ou avec ATCD de TACE > 3 mois, + métastase sauf pulmonaire n = 424 n = 216 assignés à RE/sorafenib Population ITT (ITT) n = 208 assignés à sorafenib 68 patients exclus : * n = 24 RE/sorafenib ayant reçu que RE n = 15 RE/sorafenib ayant reçu que sorafenib n = 18 RE/sorafenib ayant reçu aucun TTT n = 11 sorafenib ayant reçu aucun TTT n = 45 patients exclus car déviations majeures n = 159 ayant reçu RE/sorafenib Population tolérance n = 197 ayant reçu sorafenib n = 114 ayant reçu RE/sorafenib sans déviation majeure Population Per protocol (PP) n = 174 ayant reçu sorafenib sans déviation majeure (exclusion n = 15 randomisés dans RE/sorafenib ayant reçu que sorafenib) n = 23 patients exclus car déviations majeures (exclusion n = 15 randomisés dans RE/sorafenib ayant reçu que sorafenib) Ricke J, Allemagne, EASL 2018, Abs. LBO-005 actualisé

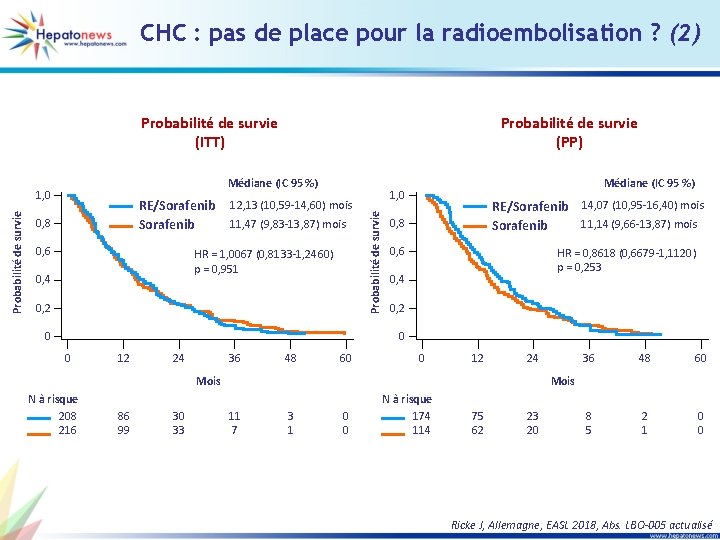
CHC : pas de place pour la radioembolisation ? (2) Probabilité de survie (ITT) Médiane (IC 95 %) RE/Sorafenib 0, 8 0, 6 12, 13 (10, 59 -14, 60) mois 11, 47 (9, 83 -13, 87) mois HR = 1, 0067 (0, 8133 -1, 2460) p = 0, 951 0, 4 0, 2 0 Médiane (IC 95 %) 1, 0 Probabilité de survie (PP) RE/Sorafenib 14, 07 (10, 95 -16, 40) mois 11, 14 (9, 66 -13, 87) mois Sorafenib 0, 8 0, 6 HR = 0, 8618 (0, 6679 -1, 1120) p = 0, 253 0, 4 0, 2 0 0 12 24 36 48 60 0 12 24 Mois N à risque 208 216 86 99 30 33 36 48 60 8 5 2 1 0 0 Mois 11 7 3 1 0 0 N à risque 174 114 75 62 23 20 Ricke J, Allemagne, EASL 2018, Abs. LBO-005 actualisé

Transplantation hépatique

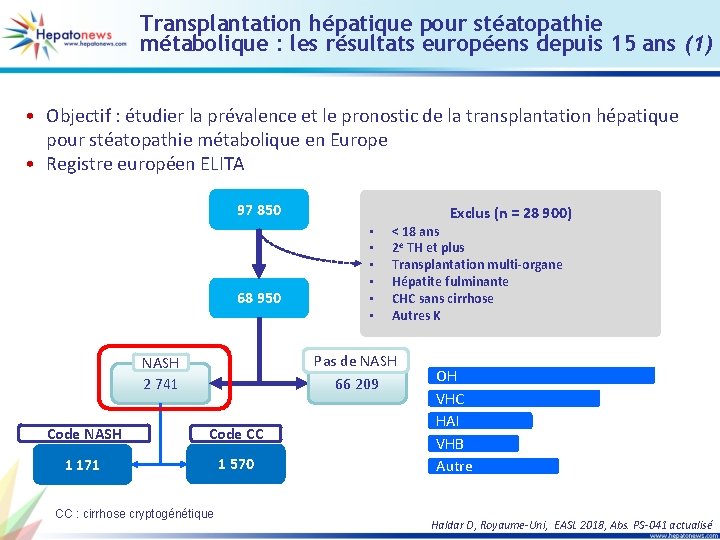
Transplantation hépatique pour stéatopathie métabolique : les résultats européens depuis 15 ans (1) • Objectif : étudier la prévalence et le pronostic de la transplantation hépatique pour stéatopathie métabolique en Europe • Registre européen ELITA 97 850 68 950 • • • < 18 ans 2 e TH et plus Transplantation multi-organe Hépatite fulminante CHC sans cirrhose Autres K Pas de NASH 66 209 NASH 2 741 Code NASH Code CC 1 171 1 570 CC : cirrhose cryptogénétique Exclus (n = 28 900) OH VHC HAI VHB Autre Haldar D, Royaume-Uni, EASL 2018, Abs. PS-041 actualisé

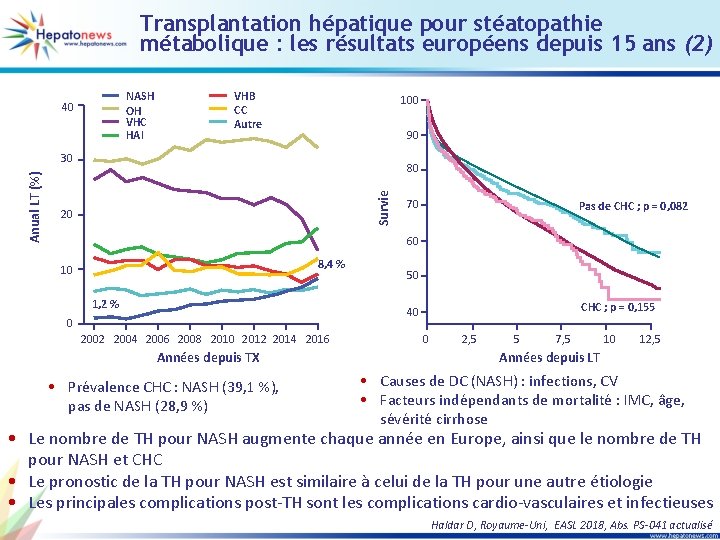
Transplantation hépatique pour stéatopathie métabolique : les résultats européens depuis 15 ans (2) NASH OH VHC HAI 40 VHB CC Autre 100 90 80 Survie Anual LT (%) 30 20 70 Pas de CHC ; p = 0, 082 60 8, 4 % 10 1, 2 % 50 CHC ; p = 0, 155 40 0 2002 2004 2006 2008 2010 2012 2014 2016 Années depuis TX • Prévalence CHC : NASH (39, 1 %), pas de NASH (28, 9 %) 0 2, 5 5 7, 5 10 12, 5 Années depuis LT • Causes de DC (NASH) : infections, CV • Facteurs indépendants de mortalité : IMC, âge, sévérité cirrhose • Le nombre de TH pour NASH augmente chaque année en Europe, ainsi que le nombre de TH pour NASH et CHC • Le pronostic de la TH pour NASH est similaire à celui de la TH pour une autre étiologie • Les principales complications post-TH sont les complications cardio-vasculaires et infectieuses Haldar D, Royaume-Uni, EASL 2018, Abs. PS-041 actualisé

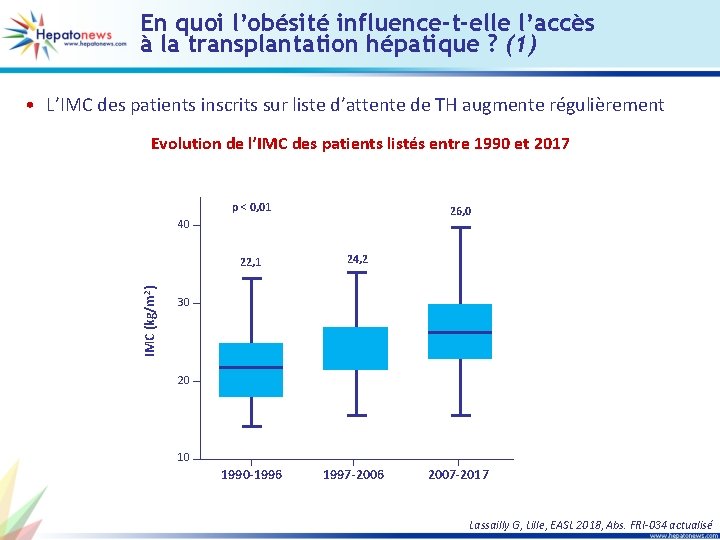
En quoi l’obésité influence-t-elle l’accès à la transplantation hépatique ? (1) • L’IMC des patients inscrits sur liste d’attente de TH augmente régulièrement Evolution de l’IMC des patients listés entre 1990 et 2017 p < 0, 01 26, 0 40 IMC (kg/m 2) 22, 1 24, 2 30 20 10 1990 -1996 1997 -2006 2007 -2017 Lassailly G, Lille, EASL 2018, Abs. FRI-034 actualisé

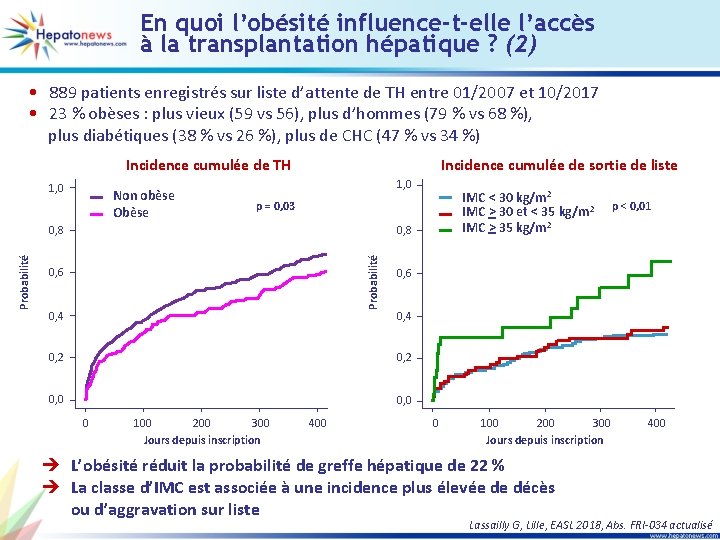
En quoi l’obésité influence-t-elle l’accès à la transplantation hépatique ? (2) • 889 patients enregistrés sur liste d’attente de TH entre 01/2007 et 10/2017 • 23 % obèses : plus vieux (59 vs 56), plus d’hommes (79 % vs 68 %), plus diabétiques (38 % vs 26 %), plus de CHC (47 % vs 34 %) Incidence cumulée de TH 1, 0 Non obèse Obèse Incidence cumulée de sortie de liste 1, 0 0, 8 Probabilité IMC < 30 kg/m 2 IMC > 30 et < 35 kg/m 2 IMC > 35 kg/m 2 p = 0, 03 0, 6 0, 4 0, 2 0, 0 0 100 200 300 Jours depuis inscription 400 p < 0, 01 0 100 200 300 Jours depuis inscription è L’obésité réduit la probabilité de greffe hépatique de 22 % è La classe d’IMC est associée à une incidence plus élevée de décès ou d’aggravation sur liste 400 Lassailly G, Lille, EASL 2018, Abs. FRI-034 actualisé

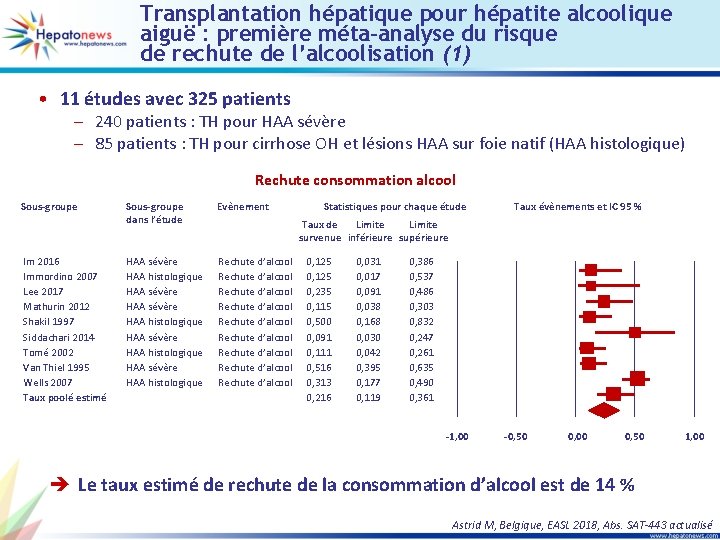
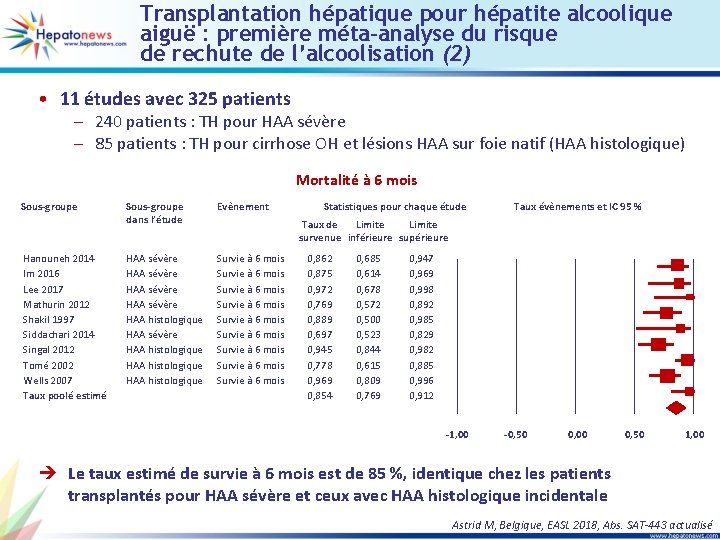
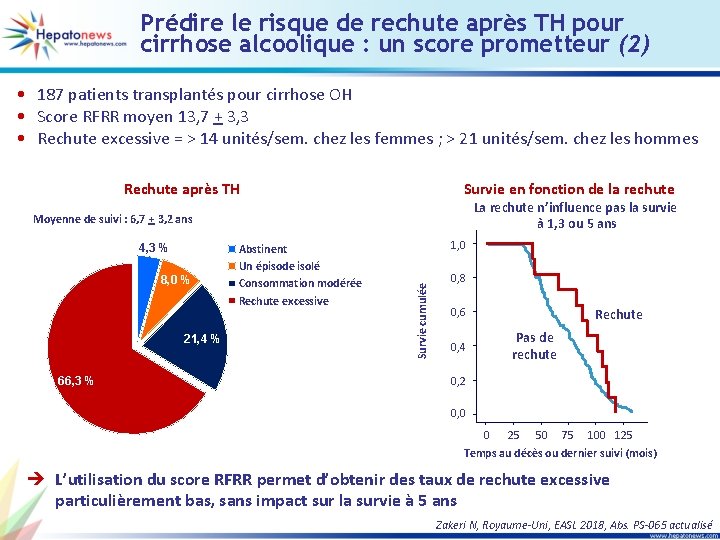
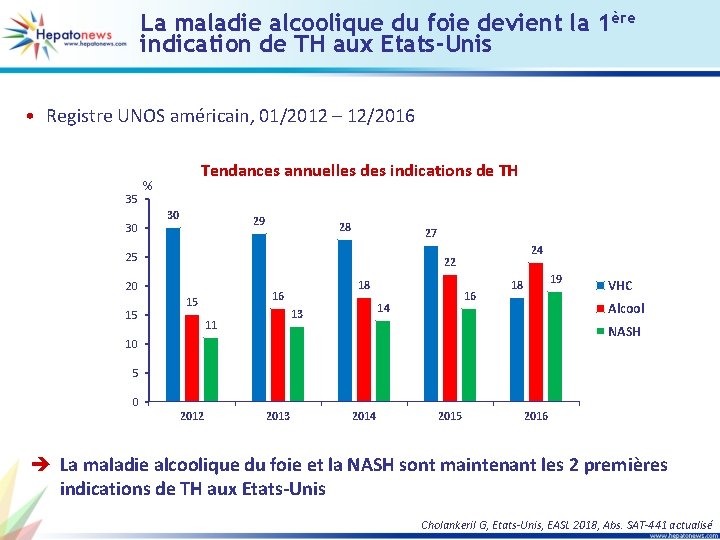
Transplantation hépatique pour hépatite alcoolique aiguë : première méta-analyse du risque de rechute de l’alcoolisation (1) • 11 études avec 325 patients – 240 patients : TH pour HAA sévère – 85 patients : TH pour cirrhose OH et lésions HAA sur foie natif (HAA histologique) Rechute consommation alcool Sous-groupe Im 2016 Immordino 2007 Lee 2017 Mathurin 2012 Shakil 1997 Siddachari 2014 Tomé 2002 Van Thiel 1995 Wells 2007 Taux poolé estimé Sous-groupe dans l’étude Evènement HAA sévère HAA histologique HAA sévère HAA histologique Rechute d’alcool Rechute d’alcool Rechute d’alcool Statistiques pour chaque étude Taux évènements et IC 95 % Taux de Limite survenue inférieure supérieure 0, 125 0, 235 0, 115 0, 500 0, 091 0, 111 0, 516 0, 313 0, 216 0, 031 0, 017 0, 091 0, 038 0, 168 0, 030 0, 042 0, 395 0, 177 0, 119 0, 386 0, 537 0, 486 0, 303 0, 832 0, 247 0, 261 0, 635 0, 490 0, 361 -1, 00 -0, 50 0, 00 0, 50 1, 00 è Le taux estimé de rechute de la consommation d’alcool est de 14 % Astrid M, Belgique, EASL 2018, Abs. SAT-443 actualisé

Transplantation hépatique pour hépatite alcoolique aiguë : première méta-analyse du risque de rechute de l’alcoolisation (2) • 11 études avec 325 patients – 240 patients : TH pour HAA sévère – 85 patients : TH pour cirrhose OH et lésions HAA sur foie natif (HAA histologique) Mortalité à 6 mois Sous-groupe Hanouneh 2014 Im 2016 Lee 2017 Mathurin 2012 Shakil 1997 Siddachari 2014 Singal 2012 Tomé 2002 Wells 2007 Taux poolé estimé Sous-groupe dans l’étude Evènement HAA sévère HAA histologique HAA sévère HAA histologique Survie à 6 mois Survie à 6 mois Survie à 6 mois Statistiques pour chaque étude Taux évènements et IC 95 % Taux de Limite survenue inférieure supérieure 0, 862 0, 875 0, 972 0, 769 0, 889 0, 697 0, 945 0, 778 0, 969 0, 854 0, 685 0, 614 0, 678 0, 572 0, 500 0, 523 0, 844 0, 615 0, 809 0, 769 0, 947 0, 969 0, 998 0, 892 0, 985 0, 829 0, 982 0, 885 0, 996 0, 912 -1, 00 -0, 50 0, 00 0, 50 1, 00 è Le taux estimé de survie à 6 mois est de 85 %, identique chez les patients transplantés pour HAA sévère et ceux avec HAA histologique incidentale Astrid M, Belgique, EASL 2018, Abs. SAT-443 actualisé

Prédire le risque de rechute après TH pour cirrhose alcoolique : un score prometteur (1) • Score RFRR (Relative Risk Factors for Relapse) : 0 -27 1 - Histoire d’abstinence (0 -5) 5 - arrêt OH à l’hospitalisation 4 - arrêt OH après conséquences physiques 3 - arrêt OH au diagnostic 2 - arrêt OH à la demande de médecin 1 - arrêt OH avant la recommandation du médecin 0 - aucune des situations au-dessus 2 - Dépendance (0 -3) 3 -Acceptation du diagnostic (0 -3) 4 - Volonté d’engagement dans le traitement de la maladie alcoolique (0 -4) 5 - Insertion sociale (0 -3) 6 - Usage de drogues (0 -5) 7 - Activités de remplacement (0 -4) è Valeur élevée : augmentation du risque de rechute è A intégrer dans le bilan pré-TH Zakeri N, Royaume-Uni, EASL 2018, Abs. PS-065 actualisé

Prédire le risque de rechute après TH pour cirrhose alcoolique : un score prometteur (2) • 187 patients transplantés pour cirrhose OH • Score RFRR moyen 13, 7 + 3, 3 • Rechute excessive = > 14 unités/sem. chez les femmes ; > 21 unités/sem. chez les hommes Survie en fonction de la rechute Rechute après TH La rechute n’influence pas la survie à 1, 3 ou 5 ans Moyenne de suivi : 6, 7 + 3, 2 ans 8, 0 % 21, 4 % 66, 3 % Abstinent Un épisode isolé Consommation modérée Rechute excessive 1, 0 Survie cumulée 4, 3 % 0, 8 0, 6 Rechute Pas de rechute 0, 4 0, 2 0, 0 0 25 50 75 100 125 Temps au décès ou dernier suivi (mois) è L’utilisation du score RFRR permet d’obtenir des taux de rechute excessive particulièrement bas, sans impact sur la survie à 5 ans Zakeri N, Royaume-Uni, EASL 2018, Abs. PS-065 actualisé

La maladie alcoolique du foie devient la 1ère indication de TH aux Etats-Unis • Registre UNOS américain, 01/2012 – 12/2016 35 30 Tendances annuelles des indications de TH % 30 29 28 27 25 20 15 24 22 18 16 15 14 13 11 16 19 18 VHC Alcool NASH 10 5 0 2012 2013 2014 2015 2016 è La maladie alcoolique du foie et la NASH sont maintenant les 2 premières indications de TH aux Etats-Unis Cholankeril G, Etats-Unis, EASL 2018, Abs. SAT-441 actualisé

La fin de la transplantation hépatique pour maladie du foie liée au VHC ? (1) • European Liver Transplant Registry • 36 382 TH adultes entre 01/2007 et 06/2017 35 30 Période IFN Période IP 1ère génération Période AAD OH % TH 25 VHC 20 VHB 15 NASH 10 5 0 2 2 4 4 5 6 8 3 7 5 6 7 0 1 1 8 7 7 0 9 9 00 200 200 201 201 201 201 2 H 1 H 2 H 1 H 2 H 1 H 2 H 1 Ans è L’indication de TH pour maladie du foie liée au VHC est passée de 22, 8 % pendant la période interféron à 10, 6 % depuis l’introduction des antiviraux directs Perricone G, Italie, EASL 2018, Abs. LBP-021 actualisé

La fin de la transplantation hépatique pour maladie du foie liée au VHC ? (2) Survie post-TH à 3 ans, selon l’indication de greffe IFN 2007 -2010 1 AAD 2014 -2017 1 Cirrhose décompensée 0, 9 0, 8 0, 7 0, 6 18 1 884 1 214 500 24 1 772 1 108 295 30 36 1 649 1 560 974 837 143 53 p < 0, 0001 0, 8 0, 7 0 6 12 2 957 2 275 2 061 2 107 1 530 1 323 1 606 984 763 CHC 0, 9 p < 0, 0001 Survie IP 2011 -2013 0 6 2 130 1 703 1 747 1 395 1 880 1 203 12 1 551 1 227 888 18 24 30 1 418 1 322 1 239 1 101 994 887 577 315 131 36 1 165 779 33 è L’utilisation des antiviraux directs a eu un impact positif sur la survie à 3 ans après TH Perricone G, Italie, EASL 2018, Abs. LBP-021 actualisé

Alcool et autres hépatopathies

Baclofène chez les patients alcoolo-dépendants : l’observatoire français OBADE (1) • Objectif : étudier les prescriptions de baclofène dans les services d’hépato-gastroentérologie, son efficacité à un an et sa tolérance 202 patients inclus dont 77 cirrhotiques 103 patients avec suivi > 1 an Dose médiane de baclofène à 1 an : 66 mg/j (59 mg/j chez cirrhotiques) Abstinence (n = 52) OH ≤ 30 g/j (n = 25) OH > 30 g/j (n = 26) Consommation à faible risque Barrault C, Créteil, EASL 2018, Abs. PS-072 actualisé

Baclofène chez les patients alcoolo-dépendants : l’observatoire français OBADE (2) Consommation d’OH p < 0, 0007 p = 0, 003 p < 0, 0001 200 Tests hépatiques 100 80 150 70, 4 76, 5 Avant baclofène 60 113 g/j p = 0, 01 100 50 0 Après baclofène p = 0, 02 29, 6 40 101 g/j 48 g/j p = 0, 04 34, 5 36, 6 20 16 g/j J 0 M 3 M 6 Pas de cirrhose M 9 M 12 0 TP (%) Bilirubine (μmol/l) Albumine (g/l) Cirrhose Tolérance excellente è Le baclofène est bien toléré, même chez les patients atteints de cirrhose décompensée è Le baclofène, en association avec une prise en charge addictologique, est efficace chez les patients alcoolo-dépendants, avec une amélioration de la fonction hépatique chez les patients cirrhotiques Barrault C, Créteil, EASL 2018, Abs. PS-072 actualisé

Elasticité hépatique et pronostic de la cirrhose alcoolique • But : évaluer l’élasticité hépatique (par Fibroscan) comme facteur prédictif de survenue de complications hépatiques au cours de la cirrhose alcoolique • 276 patients Child A ou B suivis en moyenne 29 mois Probabilité cumulée de survenue de complications 1, 0 p < 0, 001 Elasticité > 25 k. Pa (n = 177) Elasticité < 25 k. Pa (n = 99) 0, 8 0, 6 35, 4 % 0, 4 27, 8 % 0, 2 13, 7 % 0, 0 5, 2 % 0, 0 12 10, 6 % 24 12, 2 % 36 48 Mois è L’élasticité hépatique est prédictive de survenue des complications de la cirrhose alcoolique Gomez-Outomuro A, Espagne, EASL 2018, Abs. SAT-074 actualisé

Abstinence et risque de CHC chez les cirrhotiques alcooliques (1) • But : évaluer l’impact de l’abstinence sur le risque de CHC chez 602 cirrhotiques alcooliques* Child A/B dans un programme prospectif de surveillance échographique semestrielle avec un suivi médian de 77 mois • Age médian : 55 ans, 83 % homme, 38 % consommation OH, IMC médian : 28, 79 % VO, 76 % Child A et 69 % ATCD décompensation Comparaison des caractéristiques initiales entre abstinents et non abstinents Caractéristiques Abstinents (n = 298) Non abstinents (n = 298) p Age médian, ans 56 (52 ; 61) 54 (49 ; 60) < 0, 001 Sexe masculin, % 81, 2 84, 8 0, 23 Consommation alcool persistante, % 17, 7 57, 2 < 0, 001 Fumeur actif, % 36, 5 44, 2 0, 05 Diabète, % 23, 4 30, 9 0, 041 IMC médian 27, 7 (24, 8 ; 31, 1) 28, 9 (25, 3 ; 32, 4) 0, 029 81, 1 77, 3 0, 26 Plaquettes x 103/mm 3 115, 5 (81, 0 ; 156, 5) 114, 0 (81, 2 ; 154, 7) 0, 78 GGT (UI/l) 72, 5 (47, 0 ; 129, 0) 145 (66, 5 ; 273, 0) < 0, 001 Child A, % 77, 2 74, 0 0, 36 Décompensation antérieure, % 74, 8 64, 1 0, 04 67, 5 (36, 0 ; 18, 5) 60, 0 (36, 0 ; 111, 0) 0, 29 VO, % Suivi médian, mois * Définis par > 80 g/j chez les hommes et > 60 g/j chez les femmes depuis > 10 ans Castano-Garcia A, Espagne, EASL 2018, Abs. PS-064 actualisé

Abstinence et risque de CHC chez les cirrhotiques alcooliques (2) Risque cumulé de CHC selon l’abstinence % 1, 0 0, 8 Incidence annuelle de CHC : 2, 4 %/an (45 % après 77 mois de suivi) • Non-abstinents : 2, 39 % • Abstinents : 2, 42 % 0, 6 Non abstinents : • (n = 304) • (n. CHC = 45) • Suivi médian : 60 mois Abstinents : • (n = 298) • (n. CHC = 48) • Suivi médian : 67 mois 0, 4 0, 2 Variable HR (IC 95 %) p Sexe masculin 2, 56 (1, 26 -5, 05) 0, 009 Age > 55 ans 2, 15 (1, 39 -3, 35) 0, 001 Plaquettes < 145 x 10 3/mm 3 1, 94 (1, 11 -3, 40) 0, 019 Abstinence 1, 04 (0, 66 -1, 61) 0, 86 p = 0, 88 0, 0 Patients à risque Facteurs de risque de CHC en analyse multivariée 0 24 48 72 96 120 144 168 192216 240 264 Mois 298 304 156 148 68 56 25 25 7 4 èL’abstinence ne réduit pas le risque de CHC principalement associé au sexe masculin, à l’âge et à la sévérité de la maladie hépatique Castano-Garcia A, Espagne, EASL 2018, Abs. PS-064 actualisé

Hépatites aiguës sévères d’origine indéterminée : l’étude française HASIPRO (1) • Objectif : étudier le pronostic des hépatites aiguës sévères (HAS) d’origine indéterminée et les facteurs associés au recours à la TH • Etude observationnelle prospective HASIPRO, incluant des patients atteints d’HAS avec un INR > 1, 5 sans ATCD de maladie chronique du foie • • 70 patients avec HAS indéterminée 32 (46 %) guérison spontanée 30 (43 %) TH 28 (93 %) vivants Délai médian de TH : 3 [1 -10] j 86 % survie globale 93 % survie à 3 mois post-TH Facteurs indépendamment associés à la survie sans TH : absence d’EH, TP et remontée du TP à J 1 8 (11 %) DC 2 (7 %) décédés Coilly A, Villejuif, EASL 2018, Abs. PS-121 actualisé

Hépatites aiguës sévères d’origine indéterminée : l’étude française HASIPRO (2) 0, 9 93 % 80 % 0, 8 Survie (%) 70 patients avec HAS indéterminée 55 (76 %) Causes identifiées 0, 6 0, 4 TH Oui Non 0, 2 16 (23 %) HAI 0, 0 0 20 40 Temps 60 7 (10 %) DILI 5 (7 %) Virus (VHE, dengue) 27 (49 %) Autres 80 è L’HAS de cause indéterminée est une maladie sévère avec une survie sans TH de 46 % à 3 mois è Les facteurs indépendamment associés à une survie sans TH sont l’absence d’EH à l’admission, le TP et l’absence de diminution du TP à J 1 è De nouveaux critères sont en cours d’élaboration pour déterminer quels patients doivent être transplantés Coilly A, Villejuif, EASL 2018, Abs. PS-121 actualisé

Quelle place pour les inhibiteurs de calcineurine dans l’hépatite auto-immune résistante ? (1) • 33 patients HAI avec échec/intolérance aux traitements conventionnels Caractéristiques initiales Traitements antérieurs Cy. A (n = 17) TAC (n = 21)* 14 (82 %) 18 (86 %) Age au diagnostic HAI, médian [IQR] 35, 0 [16 -43] 18, 5 [14 -40) Age au début ICN 42, 2 [25 -50] 24, 7 [17 -45] HAI type 1, n (%) 16 (94 %) 18 (86 %) 9 (53 %)/6 (35 %) 11 (52 %)/4 (19 %) ASAT, IU/ml 81 [69 -235] 181 [76 -584] ALAT, IU/ml 151 [94 -352] 204 [110 -561] 19 [9 -38] 33 [12, 5 -53, 5] 22 [17, 6 -28, 4] 29, 8 [25, 9 -38] Femme, n (%) Cirrhose/HTP : oui n (%) Bilirubine, mmol/l Ig. G, mg/l Cy. A (n = 17) TAC (n = 21)* Prednisone, n (%) 17 (100 %) 21 (100 %) Azathioprine, n (%) 15 (88 %) 19 (90 %) 6 MP, n (%) 2 (12 %) 2 (10 %) MMF, n (%) 8 (47 %) 10 (48 %) Combinaison, n (%) 16 (94 %) 21 (100 %) * 5 patients ont reçu TAC après échec/intolérance Cy. A Strasser SI, Australie, EASL 2018, Abs. THU-235 actualisé

Quelle place pour les inhibiteurs de calcineurine dans l’hépatite auto-immune résistante ? (2) Réponse au traitement Cy. A (n = 17) Echec 6 % Réponse incomplète 27 % TAC (n = 21) Echec 10 % Rémission* 33 % Rémission 67 % • Taux de rémission – Inefficacité traitement standard + MMF 6/11 patients (54, 5 %) – Intolérance ttt antérieur 3/6 patients (50 %) Effets secondaires Réponse incomplète 57 % • Taux de rémission – Inefficacité traitement standard + MMF 5/16 patients (31 %) – Intolérance ttt antérieur 2/5 patients (40 %) Cy. A (n = 17) TAC (n = 21)* Atteinte rénale, y compris hyper K 3 3 Hypertrophie gingivale 4 - Neurologiques, y compris tremblements 1 9 HTA 1 - Dermatologiques 2 2 • 3 patients ont eu une TH • 5 patients sont décédés è Au total, une rémission était obtenue chez 48 % des patients. Les ICN étaient globalement bien tolérés, mais 15 % des patients sont décédés Strasser SI, Australie, EASL 2018, Abs. THU-235 actualisé

Ac anti-HIP 1 R : un nouveau marqueur diagnostique dans les hépatites auto-immunes (1) 100 *** *** 90 80 60 52, 7 40 20 0 ***p < 0, 001 HAI Non-HAI Contrôle non traitée sain Valeurs des Ac anti-HIP 1 -R selon les étiologies (Cohorte d’Hanovre) Anti-HIP 1 R (unités arbitraires) Valeurs et seuil limite des Ac anti-HIP 1 -R 100 0, 068 ns *** 90 80 60 40 20 0 ***p < 0, 001 HAI/CBP HAI/CSP HAI Non-HAI Contrôle non traitée sain è Les Ac anti-HIP 1 R sont plus sensibles, plus spécifiques, plus performants que les Ac classiques et ils diminuent avec le traitement de l’HAI Taubert R, Allemagne, EASL 2018, Abs. PS-006 actualisé

Ac anti-HIP 1 R : un nouveau marqueur diagnostique dans les hépatites auto-immunes (2) Performances diagnostiques des Ac anti-HIP 1 -R entre HAI et autres maladies hépatiques *** 1, 0 ns *** # SLA LKM ≥ 1: 40 SMA ≥ 1: 80 *** 0, 8 Sensibilité Spécificité ANA ≥ 1: 80 HIP 1 R LKM ≥ 1: 40 SMA ≥ 1: 80 # *** SLA ANA ≥ 1: 80 HIP 1 R *** LKM ≥ 1: 40 SMA ≥ 1: 80 SLA HIP 1 R 0, 4 ANA ≥ 1: 80 *** # SMA ≥ 1: 80 *** 0, 6 0 ANA ≥ 1: 80 HIP 1 R LKM ≥ 1: 40 SLA ANA ≥ 1: 80 SLA *** 1, 0 0, 2 # *** HIP 1 R 0 SMA ≥ 1: 80 0, 2 HIP 1 R 0, 4 ANA ≥ 1: 80 *** LKM ≥ 1: 40 0, 6 SMA ≥ 1: 80 0, 8 Performance diagnostique è Les Ac anti-HIP 1 R sont plus sensibles, plus spécifiques, plus performants que les Ac classiques et ils diminuent avec le traitement de l’HAI Taubert R, Allemagne, EASL 2018, Abs. PS-006 actualisé

CBP : traitement par acide ursodésoxycholique + budésonide (1) • Etude randomisée en double aveugle versus placebo • Patients avec réponse biochimique incomplète (PAL > 1, 5 N) après 6 mois de traitement par AUDC + activité inflammatoire à la PBH (n = 62) Screening Temps Randomisation Schéma de l’étude Placebo + 12 -16 mg/kg/j AUDC Suivi (tolérance) BUD 3 mg 2 fois par j* + 12 -16 mg/kg/j AUDC 4 semaines 0 S Inclusion 2 S 4 M 3 M 6 M 9 M 12 M 18 M 24 M 30 M 36 * Ajustement de dose à BUD 3 mg par jour si ASAT normales Hirschfield G, Royaume-Uni, EASL 2018, Abs. GS-011 actualisé

CBP : traitement par acide ursodésoxycholique + budésonide (2) • Randomisation : 26 patients dans le bras budésonide et 17 patients dans le bras placebo • Durée moyenne de traitement : 25, 3 mois Amélioration histologique p = 0, 225 Amélioration histologique patients (%) 50 40 Proportion des patients avec réponse biochimique (PAL < 1, 67 x N+ 15 % PAL + Bil normale) Mois Budésonide (n = 40) Placebo (n = 22) p 12 40 % (n = 16) 18 % (n = 4) 0, 029 24 45 % (n = 18) 18 % (n = 4) 0, 021 36 43 % (n = 17) 23 % (n = 5) 0, 038 30 20 10 0 Placebo Budésonide è Le budésonide ne semble pas pour l’instant être un traitement de 2 ème intention de la CBP Hirschfield G, Royaume-Uni, EASL 2018, Abs. GS-011 actualisé

Le score GLOBE permet d’identifier les patients avec CBP à risque de développer un CHC 100 Incidence cumulée CHC (%) • 4 820 patients avec CBP, traités par AUDC • 124 ont développé un CHC 15 10 5 0 0 5 10 15 Suivi (année) 20 Score GLOBE non répondeurs Score GLOBE répondeurs 100 15 10 p < 0, 00001 5 0 0 5 10 15 Suivi (année) 20 Analyses uni- et multi-variée des facteurs associés au développement d’un CHC Univariée Multivariée HR (IC 95 %) p Score GLOBE 7, 72 (2, 75 -21, 71) < 0, 0001 1, 96 (1, 46 -2, 62) < 0, 0001 Stade histologique 2, 83 (1, 09 -7, 35) < 0, 0001 Stade biochimique 2, 57 (1, 32 -4, 98) < 0, 0001 Sexe masculin 2, 55 (1, 63 -3, 99) < 0, 0001 Thrombocytopénie 7, 14 (4, 35 -12, 5) < 0, 0001 è Le score GLOBE après 1 an de traitement par AUDC pour CBP permet de prédire le risque de CHC chez les patients avec réponse incomplète Lammers WJ, Pays-Bas, EASL 2018, Abs. THU-226 actualisé

Estimation de la diminution du risque de décès ou de TH sous AUDC + bezafibrate (1) • Etude randomisée en double aveugle versus placebo • Patients traités par AUDC pour CBP avec réponse biochimique incomplète (Paris-2) : PAL > 1, 5 N ou ASAT > 1, 5 N ou bilirubine totale > 17 µmol/l • Critère principal d’efficacité : réponse biochimique complète à M 24 : taux normal bilirubine totale + PAL + transaminases + albumine + TP Arrêt prématuré (n = 4) Arrêt prématuré (n = 2) Placebo (n = 50) Réponse biochimique incomplète à l’AUDC (critères de Paris-2) Randomisation (n = 100) M 0 Placebo (n = 46) M 3 Bezafibrate 400 mg/j (n = 50) AUDC 13 -15 mg/kg/j M 6 M 9 M 12 Placebo (n = 44) M 15 M 18 M 21 Bezafibrate 400 mg/j (n = 50) M 24 Bezafibrate 400 mg/j (n = 48) Arrêt prématuré (n = 2) Corpechot C, Paris, EASL 2017, Abs. PS-001 actualisé

Estimation de la diminution du risque de décès ou de TH sous AUDC + bezafibrate (2) Décès ou transplantation hépatique* M 24 M 12 5 ans placebo +17, 0 % -42, 3 % 5 ans bezafibrate 10 ans placebo 10 ans bezafibrate 15 ans placebo 15 ans bezafibrate -100 % +16, 7 % -40, 5 % +15, 3 % +15, 6 % -41, 4 % -38, 3 % +13, 8 % -40, 1 % -50 % -36, 9 % 0% +50 % Diminution relative du risque par rapport à J 0 +100 % -50 % 0% +50 % +100 % Diminution relative du risque par rapport à J 0 *Modélisés à partir du score GLOBE Corpechot C, Paris, EASL 2017, Abs. PS-001 actualisé

Sténose sur CSP : intérêt d’une surveillance endoscopique programmée ? • Etude prospective (1987 -2016) : 286 CSP – 133 (46 %) : CPRE annuelle avec traitement endoscopique des sténoses par dilatation si besoin (groupe A) – 153 : CPRE en cas d’aggravation de la cholestase ou angiocholite (groupe B ) Survie sans transplantation Cohorte avec sténose dominante Cohorte globale 1, 0 p = 0, 008 0, 8 Groupe A Survie médiane : 17, 9 ans 0, 6 0, 4 Groupe B Survie médiane : 15, 2 ans 0, 2 0 0 10 20 1, 0 0, 6 0, 8 Groupe A Survie médiane : 0, 6 17, 8 ans 0, 4 Groupe B Survie médiane : 11, 1 ans 0, 2 0 30 1, 0 p < 0, 001 0, 8 Cohorte sans sténose dominante 0 10 p = 0, 9 Groupe A Survie médiane : 21 ans Groupe B Survie médiane : 18 ans 0, 2 0 20 30 0 10 20 30 Années • Facteurs associés à la survie sans transplantation en analyse multivariée : – Présence de MICI (p = 0, 03) – Présence d’une sténose dominante (p = 0, 06) – Score de Mayo (p = 0, 02) – Adhésion au programme de surveillance endoscopique è Au cours de la CSP, un programme de surveillance endoscopique a un bénéfice sur la survie uniquement en cas de sténose dominante Rupp C, Allemagne, EASL 2018, Abs. LBP-003 actualisé

Risque accru de cancer colorectal et de mortalité chez les patients de moins de 40 ans atteints de colite ulcéreuse qui développent une CSP (1) • Registre national de statistiques hospitalières au Royaume-Uni (2006 -2015) • 128 694 cas incidents de colite ulcéreuse (CU) dont 2 124 cas de cholangite sclérosante primitive diagnostiquée lors du suivi (CU + CSP) Incidence des évènements cliniques CU versus CU + CSP CU CU + CSP Cancer colorectal Colectomie Mortalité toutes causes TH ou mortalité TH 0 10 20 30 40 50 Taux d’incidence pour 1 000 patients/année (IC 95 %) Trivedi PJ, Royaume-Uni, EASL 2018, Abs. THU-208 actualisé

Risque accru de cancer colorectal et de mortalité chez les patients de moins de 40 ans atteints de colite ulcéreuse qui développent une CSP (2) Age stratifié au diagnostic de CU Taux d’incidence standardisée des évènements cliniques GLOBAL > 60 > 50 > 40 < 40 Cancer colorectal GLOBAL > 60 > 50 > 40 < 40 Colectomie GLOBAL > 60 > 50 > 40 < 40 TH ou mortalité GLOBAL > 60 > 50 > 40 < 40 Mortalité toutes causes 0 2 4 6 8 30 Taux d’incidence standardisée CU vs CU + CSP (IC 95 %) è Chez les patients de moins de 40 ans avec colite ulcéreuse, le développement d’une CSP multiplie par 6 le risque de mortalité et par 7 celui du cancer colorectal Trivedi PJ, Royaume-Uni, EASL 2018, Abs. THU-208 actualisé

Révision des critères et estimation de la prévalence du LPAC syndrome : une étude multicentrique française (1) • Rationnel : le syndrome LPAC est une cholélithiase d’origine génétique. La prévalence du syndrome LPAC est inconnue, et le gène ABCB 4 dont la présence a servi à établir les critères chez les patients n’est en fait retrouvé que dans la moitié des cas • Objectif : réviser les critères LPAC en ne tenant pas compte de la présence du gène ABCB 4, et estimer sa fréquence chez les patients atteints de cholélithiase • Etude rétrospective française cas-contrôle multicentrique effectuée chez les patients avec LPAC (critères classiques) dans 3 CHG et un CHU Critères classiques LPAC Au moins 2 des 3 critères suivants Symptômes biliaires avant 40 ans Récidive des symptômes après cholécystectomie Lithiase intra-hépatique à l’échographie Catherine D, Paris, EASL 2018, Abs. SAT-031 actualisé

Révision des critères et estimation de la prévalence du LPAC syndrome : une étude multicentrique française (2) • Patients : les cas de LPAC étaient divisés en une cohorte de dérivation et une cohorte de validation • Contrôles : patients ayant eu une cholécystectomie pour maladie lithiasique • Etablissement d’un score diagnostique de LPAC, validé dans la cohorte de validation Caractéristiques LPAC (n = 204) Contrôles (n = 137) p 77 % 62 % 0, 003 Age aux 1 ers symptômes, ans 27 47 < 0, 0001 IMC (kg/m²) 23 26 < 0, 0001 Oestrogènes et progestérone 46 % 23 % 0, 005 Cholestase gravidique (femmes) 23 % 4% 0, 001 ATCD de lithiase chez un parent au 1 er degré 48 % 32 % 0, 008 Eléments évoquant une lithiase de la VBP 74 % 10 % < 0, 0001 Cholangite 25 % 7% < 0, 0001 Sphinctérotomie 34 % 12 % < 0, 0001 Cholécystite aiguë 6% 39 % < 0, 0001 Cholécystectomie 84 % 100 % < 0, 0001 Récidive des symptômes après cholécystectomie 91 % 11 % < 0, 0001 Sexe féminin Catherine D, Paris, EASL 2018, Abs. SAT-031 actualisé

Révision des critères et estimation de la prévalence du LPAC syndrome : une étude multicentrique française (3) Nouveaux critères LPAC Au moins 2 des 3 critères suivants Mutation (n = 121) Absence de mutation (n = 146) p Signes de lithiase de la VBP 80 % 68 % 0, 029 Choléstase gravidique 34 % 17 % 0, 040 Symptômes biliaires avant 40 ans +4 Récidive des symptômes après cholécystectomie +5 Lithiase intra-hépatique à l’échographie +7 Elévation chronique des GGT 33 % 14 % < 0, 0001 Signes de lithiase de la VBP +4 Elevation chronique des ALAT 16 % 8% 0, 014 Cholécystite aiguë -4 ATCD personnels ou familiaux de cancer primitif du foie 8% 1% < 0, 005 Syndrome LPAC : score ≥ 9 Echographie dans les 2 ans après la cholécystectomie n = 68 (33 %) Un pt (1, 5 %) avec signes de LPAC Testé et LPAC + Fréquence du LPAC 0. 5 -1, 9 % en hôpital général 7, 5 % en CHU è Le syndrome LPAC concerne 1 % des patients avec cholélithiase symptômatique en France è En cas de symptômes avant 40 ans la probabilité de LPAC est importante è Les patients présentant une mutation ABCB 4 sont plus exposés au risque de lithiase de la VBP, de cholestase chronique, de cholestase gravidique et ont plus fréquemment un ATCD de cancer primitif du foie personnel ou familial Catherine D, Paris, EASL 2018, Abs. SAT-031 actualisé

Traitement de la maladie de Wilson par trientine • Etude multicentrique rétrospective de 77 patients traités pendant 73 mois Efficacité de la trientine sur les manifestations hépatiques et neurologiques Inchangé Amélioration Normalisation Asymptomatique 45 40 35 30 25 20 15 10 5 0 6 mois 12 mois 24 mois 36 mois 48 mois Dernier suivi Suivi neurologique Manifestations neurologiques (%) Manifestations hépatiques (%) Suivi hépatique Aggravation 60 50 40 30 20 10 0 6 mois 12 mois 24 mois 36 mois 48 mois Dernier suivi è La trientine est un bon traitement de deuxième ligne de la maladie de Wilson Weiss KH, Allemagne, EASL 2018, Abs. LBP-004 actualisé

Hémochromatose : la cirrhose peut régresser après saignée mais le risque de CHC reste élevé • 106 patients homozygotes C 282 Y avec fibrose F 3 -F 4 sur la biopsie initiale et ayant eu une 2ème biopsie après saignées - temps médian entre les 2 biopsies : 9, 5 (3, 5 -15, 5) ans 100% Stade de Fibrose sur la dernière biopsie en fonction de la fibrose au diagnostic 1 4 7 3 6 80% 60% 40% 14 51 9 20% 9 0% CHC en fonction du stade de fibrose sur la dernière biopsie Fibrose CHC Pas de CHC F 0 (n = 7) 0 (0, 0 %) 7 (100 %) F 1 (n = 18) 0 (0, 0 %) 18 (100 %) F 2 (n = 16) 2 (12, 5 %) 14 (87, 5 %) F 3 (n = 12) 4 (33, 3 %) 8 (66, 7 %) F 4 (n = 53) 30 (56, 6 %) 23 (43, 4 %) 36 (34 %) 70 (66 %) Total (n = 106) 2 F 3 F 4 F 3 F 2 F 1 F 0 F 4 • L’incidence cumulée de CHC est de 4, 8 % chez les patients ≤ F 2 vs 52, 3 % chez les patients F 3 -F 4 • Incidence de CHC/1 000 personnes-an: 2, 3 (IC 95 % : 0, 2 -8, 6) chez les patients ≤ F 2 vs 32, 8 (IC 95 % : 22, 7 -45, 9) chez les patients sans régression de fibrose, p < 0, 001 è Le dépistage du CHC reste une priorité dans cette population Bardou-Jacquet E, Rennes, EASL 2018, Abs. FRI-133 actualisé

Stéatopathies métaboliques

Valeur pronostique du Fibrotest au cours de la NAFLD (1) • Suivi de 1 079 patients NAFLD comparés à 3 449 patients VHC, 2 051 patients VHB et 503 patients alcooliques • Suivi médian : 7, 5 (4, 8 -9, 9) ans Courbes de survie globale 100 VHB VHC 60 40 Alcool NAFLD 20 0 0 1 2 3 4 5 6 7 8 Années 9 10 11 12 13 14 15 80 60 40 20 0 0 2 80 60 40 20 0 4 6 8 10 12 14 Années Cirrhose (14 %) 100 Survie 80 Survie Tous les patients 100 Non cirrhotiques (86 %) 0 2 4 6 8 10 12 14 Années è La mortalité des patients NAFLD est plus élevée que celle des autres patients Munteanu M, Paris, EASL 2018, Abs. PS-183 actualisé

Valeur pronostique du Fibrotest au cours de la NAFLD (2) AUROC du Fibrotest pour la prédiction de la survie à 10 ans Mortalité hépatique % 100 80 80 60 60 Sensibilité 100 Mortalité globale 40 20 0 0 20 40 60 1 -Spécificité 80 100 Alcool VHB VHC NAFLD 40 20 0 % 0 20 40 60 80 100 1 -Spécificité è Le Fibrotest prédictif de la mortalité de cause hépatique à 10 ans quelle que soit la cause de la maladie chronique du foie Munteanu M, Paris, EASL 2018, Abs. PS-183 actualisé

DLFS (Diabetes Liver Fibrosis Score), un nouveau test de diagnostic non-invasif de la fibrose sévère chez le diabétique ? (1) • Etude de 592 patients avec diabète de type 2 • Fibrose sévère : 201 patients Facteurs associés à la fibrose sévère (analyse multivariée) Paramètres OR IC 95 % Hypertension 0, 47 0, 32 -0, 70 Prise de statines 0, 48 0, 33 -0, 69 Insuffisance rénale chronique 2, 3 1, 3 -4 è Pour l’élaboration du DLFS, prise en compte de ces 3 facteurs + âge + plaquettes + ASAT Singh A, Etats-Unis, EASL 2018, Abs. PS-182 actualisé

DLFS (Diabetes Liver Fibrosis Score), un nouveau test de diagnostic non-invasif de la fibrose sévère chez le diabétique ? (2) Performance diagnostique du DLFS par rapport aux autres tests sanguins Valeurs seuils du DLFS 1, 0 Sensibilité 98 % VPP 86 % 0, 8 68, 9 Sensibilité 0, 6 14, 5 Sensibilité 95 % VPN 92 % 0, 4 DLFS : 0, 79 (0, 75 -0, 83) ASAT/ALAT : 0, 60 (0, 56 -0, 65) APRI : 0, 75 (0, 71 -0, 79) FIB-4 : 0, 77 (0, 73 -0, 81) NFS : 0, 69 (0, 65 -0, 74) 0, 2 0, 4 0, 6 0, 8 1, 0 Spécificité è Le DLFS pourrait être un nouveau test diagnostique de la fibrose sévère au cours de la NAFLD è Il nécessite cependant d’être validé par d’autres équipes Singh A, Etats-Unis, EASL 2018, Abs. PS-182 actualisé

Critères de validité de l’ARFI • Etude bicentrique (Angers et Bordeaux) de 1 084 patients avec maladie chronique du foie + PBH + mesure de l’élasticité hépatique par ARFI Critères de validité de l’ARFI IQR/M Valeur d’ARFI (m/s) < 1, 37 < 0, 15 -0, 34 > 0, 35 1, 37 -1, 86 > 1, 87 Excellente validité Validité satisfaisante Invalide è Comme pour le Fibroscan, l’interprétation de l’ARFI doit prendre en compte le ratio IQR/M Boursier J, Angers, EASL 2018, Abs. SAT-067 actualisé

Prévalence de la NASH chez les patients diabétiques (1) • Méta-analyse de 8 études (675 patients avec NASH) Prévalence de la NASH chez les patients diabétiques Evènements Total Prop (en %) (IC 95 %) Est Méditerrannéen Seetlani 2016 (Pakistan) Modèle RE par sous groupe (Q = 0, 00 ; df = 0 ; p = 1, 00 ; I 2 = 0, 0 %) 146 262 56, 49 (50, 42 -62, 37) Amériques Parente 2015 (Brésil) Portillo-Sanchez 2015 (Etats-Unis) Leite 2011 (Brésil) Modèle RE par sous groupe (Q = 23, 97 ; df = 2 ; p = 0, 00 ; I 2 = 90, 5 %) 22 21 72 59 37 92 37, 29 (25, 97 -50, 19) 56, 76 (40, 65 -71, 55) 78, 26 (68, 69 -85, 52) 58, 63 (33, 41 -80, 01) Asie du Sud-Est Prashanth 2009 (Inde) Gupte 2004 (Inde) Modèle RE par sous groupe (Q = 6, 05 ; df = 1 ; p = 0, 01 ; I 2 = 83, 5 %) 52 28 83 32 62, 65 (51, 81 -72, 35) 87, 50 (71, 06 -95, 23) 75, 94 (44, 00 -92, 69) Pacifique Ouest Kwok 2016 (Hong Kong) Casey 2012 (Australie) Modèle RE par sous groupe (Q = 5, 41 ; df = 1 ; p = 0, 02 ; I 2 = 81, 5 %) 53 15 94 16 56, 38 (46, 23 -66, 02) 93, 75 (66, 46 -99, 13) 78, 14 (25, 10 -97, 44) Auteur(s) et année Modèle RE (Q = 39, 27 ; df = 7 ; p = 0, 00 ; I 2 = 89, 4 %) 65, 26 (51, 73 -76, 71) 0 20 40 60 80 100 Proportion è Prévalence de la NASH chez les patients diabétiques de type 2 : 65, 26 % (IC 95 % : 51, 73 -76, 71) Golabi P, Etats-Unis, EASL 2018, Abs. SAT-525 actualisé

Prévalence de la NASH chez les patients diabétiques (2) • Méta-analyse de 15 études pour l’étude de la prévalence de la fibrose sévère (27 521 patients diabétiques) Auteur(s) et année Prévalence de la fibrose sévère chez les patients diabétiques Evènements Total Prop (en %) (IC 95 %) 94 59 16 50, 00 (40, 03 -59, 97) 3, 39 (0, 85 -12, 57) 43, 75 (22, 46 -67, 62) 8, 88 (2, 92 -23, 97) Europe Kwok 2016 (Biopsie) Parente 2015 (Biopsie) Casey 2012 (Biopsie) Modèle RE par sous groupe (Q = 188 73 ; df = 2 ; p = 0, 00 ; I 2 = 98, 5 %) 47 2 7 Amériques Leite 2011 (Biopsie) Prashanth 2009 (Biopsie) Gupte 2004 (Biopsie) Fortani 2016 (NFS) Arab 2016 (NFS) Modèle RE par sous groupe (Q = 37, 52 ; df = 4 ; p = 0, 00 ; I 2 = 87, 2 %) 8 5 3 1 021 17 92 83 32 23 194 133 8, 70 (4, 41 -16, 44) 6, 02 (2, 53 -13, 67) 9, 38 (3, 06 -25, 35) 4, 40 (4, 15 -4, 67) 12, 78 (8, 10 -19, 60) 10, 98 (5, 52 -20, 65) Asie du Sud-Est Yi 2016 (NFS) Fukuda 2015 (NFS) Petit 2011 (NFS) Modèle RE par sous groupe (Q = 0, 56 ; df = 2 ; p = 0, 76 ; I 2 = 0, 0 %) 1 410 31 14 1 751 209 234 80, 53 (76, 60 -82, 31) 14, 83 (10, 63 -20, 32) 5, 96 (3, 57 -9, 85) 6, 43 (3, 98 -10, 25) Pacifique Ouest Leite 2016 (Radiologie) Doycheva 2016 (Radiologie) Sporea 2016 (Radiologie) Sobhonslidsuk 2015 (Radiologie) Modèle RE par sous groupe (Q = 276, 71 ; df = 3 ; p = 0, 00 ; I 2 = 96, 2 %) 80 7 71 8 27, 49 (22, 67 -32, 90) 7, 14 (3, 44 -14, 23) 23, 83 (19, 33 -28, 99) 5, 84 (2, 95 -11, 24) 46, 65 (19, 03 -76, 49) 291 98 298 137 Modèle RE (Q = 4 573, 50 ; df = 14 ; p = 0, 00 ; I 2 = 99, 0 %) 15, 05 (8, 17 -26, 08) 0 10 30 50 70 90 Proportion è Prévalence de la fibrose sévère chez les patients diabétiques de type 2 : 15, 05 % (IC 95 % : 8, 17 -26, 08) Golabi P, Etats-Unis, EASL 2018, Abs. SAT-525 actualisé

Diabète de type 2 : le dépistage de la NASH ne doit pas se limiter aux patients avec ALAT élevées Schéma de l’étude ALAT > N 157/230 (68 %) durant le suivi n = 230 patients diabétiques A l’Inclusion : glycémie, tests hépatiques, Fibro. Test, TE-M, TE-XL et 2 D-SWE • ACTIVITE significative (A 2 -A 3) – 45 % sur PBF • FIBROSE significative (F 2 -F 4) – 35 % par PBF – 30 % par Fibro. Test® – 62 % par Elastrographie (TE-M or TE-XL/2 D-SWE) ALAT N 73/230 (32 %) durant le suivi Suivi moyen 7 ans Risque de maladie significative si ALAT N Survie globale chez les patients avec ou sans augmentation des ALAT 100 Survie 80 ALAT > N 60 ALAT N 40 ALAT > N ALAT N p Survie cumulée à 10 ans 70 % (58 -82) 56 % (43 -69) 0, 02 La différence disparaît après ajustement sur l’âge et le sexe féminin RR = 0, 69 (IC 95 % : 0, 40 -1, 16 ; p = 0, 16) 20 0 Survie (IC 95 %) 0 2 4 Années 6 8 10 Poynard T, Paris, EASL 2018, Abs. FRI-435 actualisé

NGM 282 : un traitement futur de la NASH ? (1) Schéma de l’étude Screening J-28 NGM 282 3 mg J 1 IRM-PDFF Liver. Multi. Scan. TM Suivi NGM 282 3 mg Rosuvastatine (si nécessaire) S 2 S 4 S 6 S 8 IRM-PDFF Liver. Multi. Scan. TM Biopsie hépatique S 12 S 18 IRM-PDFF Liver. Multi. Scan. TM Biopsie hépatique • 22 patients inclus avec une NASH confirmée à la PBF : NAS ≥ 4 , Fibrose stade 1 -3, graisse intra-hépatique ≥ 8 % (IRM-PDFF) • Objectif principal : ↓ graisse intra-hépatique ≥ 5 % à S 12 • 19 patients ayant été traités 12 semaines avec une 2ème biopsie • Traitement par rosuvastatine 20 mg à S 2 si ↑ LDL-C de 10 mg/dl Harrison S, Etats-Unis, EASL 2018, Abs. GS-014 actualisé

NGM 282 : un traitement futur de la NASH ? (2) Amélioration du score NAS à l’histologie de S 12 % 100 NAS Stéatose 42 % (n = 8) % patients (n = 19) 80 60 Inflammation 84 % (n = 16) 74 % (n = 14) Ballonnement 53 % (n = 10) Amélioration Stable Détérioration 40 53 % 42 % 20 11 % 0 Changement moyen à S 12 (DS) 26 % 5% -2, 3 (1, 8) -1, 1 (0, 9) 5% 5% -0, 5 (0, 8) -0, 7 (0, 9) Harrison S, Etats-Unis, EASL 2018, Abs. GS-014 actualisé

NGM 282 : un traitement futur de la NASH ? (3) Stade de fibrose à J 0 Evolution de la fibrose à S 12 100 Stade de fibrose moyen = 2, 5 F 4 80 F 1 5 % 47 % 42 % (n = 8) 60 40 53 % F 3 26 % F 2 20 0 Amélioration Stable Détérioration (1 point) 47 % 11 % • Changement moyen du stade de fibrose par rapport à J 0 = -0, 5 • 3 patients ont eu une amélioration de 2 stades de leur fibrose : F 3 → F 1 • Diminution moyenne de NAS chez les patients avec ↓ de la fibrose = -3, 5 Harrison S, Etats-Unis, EASL 2018, Abs. GS-014 actualisé

NGM 282 : un traitement futur de la NASH ? (4) • Répondeur histologique précoce défini comme : – Réduction NAS ≥ 2 avec au moins 1 point d’inflammation ou ballonnement – Réduction de fibrose ≥ 1 sans aggravation de la NASH – Résolution de la NASH (inflammation = 0 -1 et ballonnement = 0) 100 80 60 40 20 68 % (n = 13) 58 % (n = 11) 42 % (n = 8) 11 % (n = 2) Répondeur histologique précoce Δ NAS ≥ 2 (avec inflammation et ballonnement) Δ Fibrose ≥ 1 Résolution de la NASH 0 Harrison S, Etats-Unis, EASL 2018, Abs. GS-014 actualisé

Des résultats préliminaires intéressants dans la NASH avec un agoniste de la THR-β (1) MRI-PDFF PBH PK Screening J 1 IRM-PDFF PBF IRM-PDFF S 2 S 4 S 8 Changement relatif dans IRM-PDFF après 12 semaines (%) S 12 S 24 S 36 Changement absolu IRM-PDFF après 12 semaines Placebo MGL-3196 Haut Bas (n = 38) (n = 78) MGL-3196 p = 0, 02 p < 0, 0001 (n = 44) (n = 34) p < 0, 0001 0 0 -9, 6 -2 -10 -22, 5 -20 -42, 0 -40 p < 0, 0001 -50 *p < 0, 02 -36, 3 p < 0, 0001 Haut Bas MGL-3196 0 p < 0, 0001 75, 0 60, 3 *p < 0, 04 -5, 0 -4 -8, 8 p < 0, 0001 0 41, 2 *p < 0, 02 -7, 5 -8 0 18, 4 -10 -12 S 12 0 -2, 4 -6 -30 Extension > 30 % réduction graisse (%) après 12 semaines Placebo MGL-3196 Haut Bas (n = 38) (n = 78) MGL-3196 p = 0, 02** p < 0, 0001 (n = 44) (n = 34) p < 0, 0001 IRM-PDFF P < 0, 0001 0 Harrison S, Etats-Unis, EASL 2018, Abs. GS-009 actualisé

Des résultats préliminaires intéressants dans la NASH avec un agoniste de la THR-β (2) ALAT Placebo (n = 29) ** NS MGL-3196 (n = 47) p = 0, 002 ASAT 0 0 Haut MGL-3196 (n = 44) p = 0, 0002 -1, 6 -4 -13, 5 -6 -8 -20 MGL-3196 (n = 78) p = 0, 001 -2 -7, 7 -10 Placebo (n = 38) ** NS Haut MGL-3196 (n = 29) p < 0, 0001 -21 -7, 4 -9, 2 -10 -12 -30 -14 Harrison S, Etats-Unis, EASL 2018, Abs. GS-009 actualisé

Cenicriviroc dans le traitement de la NASH : des résultats décevants à 2 ans (1) • Étude de phase 2 b randomisée en double aveugle • 289 patients avec NASH (NAS ≥ 4 et fibrose 1 -3) traités par cenicriviroc (CVC, antagoniste CCR 2 et CCR 5) ou placebo • Stratification sur NAS (4 ou ≥ 5) et sur le stade de fibrose (≤ 2 ou > 2) Initial (mois 0) Randomisation 2: 1: 1 (n = 289) Année 1 (mois 1 -12) Bras A CVC 150 mg Bras B Placebo Bras C Placebo Biopsie Objectif principal Année 2 (mois 13 -24) CVC 150 mg Biopsie Finale Placebo Ratziu V, Paris, EASL 2018, Abs. GS-002 actualisé

Cenicriviroc dans le traitement de la NASH : des résultats décevants à 2 ans (2) Taux d’amélioration de la fibrose ≥ 1 à 2 ans Année 1 Année 2 CVC Placebo Proportion des participants, m. ITT (%) Bras A 30 Bras B p = 0, 63 Bras C 26 % 25 22 % p = 0, 94 20 17 % 15 10 5 0 n = 54 n = 99 n = 54 Placebo CVC Placebo Amélioration de la fibrose ≥ 1 n = 54 CVC Amélioration de la fibrose ≥ 1 sans aggravation de la NASH Ratziu V, Paris, EASL 2018, Abs. GS-002 actualisé

Pas d’effet anti-fibrosant de l’aspirine chez les patients diabétiques avec une NASH • 592 patients américains avec diabète de type 2 et maladie stéatosique du foie prouvée histologiquement • Fibrose F 0 -F 2 : 66 % ; fibrose F 3 -F 4 : 34 % Facteurs de risque de fibrose sévère (analyse multivariée) Non ajusté Ajusté† OR (IC 95 %) p HTA 0, 55 (0, 38 -0, 78) < 0, 001 0, 47 (0, 32 -0, 7) <0, 001 Dyslipidémie 0, 51 (0, 36 -0, 72) < 0, 001 0, 48 (0, 33 -0, 69) <0, 001 2, 9 (1, 7 -4, 9) < 0, 001 2, 3 (1, 3 -4, 0) 0, 003 Antidiabétiques oraux 0, 66 (0, 47 -0, 92) 0, 016 0, 66 (0, 46 -0, 95) 0, 024 Detemir*/levemir* 0, 80 (0, 38 -1, 7) 0, 57 0, 84 (0, 38 -1, 8) 0, 66 Lantus* 1, 4 (0, 9 -2, 2) 0, 13 1, 4 (0, 86 -2, 2) 0, 19 Anti-HTA 0, 91 (0, 64 -1, 3) 0, 58 0, 74 (0, 51 -1, 08) 0, 12 Anti-lipidique 0, 75 (0, 53 -1, 08) 0, 12 0, 63 (0, 43 -0, 92) 0, 017 1, 04 (0, 7 -1, 5) 0, 83 0, 77 (0, 51 -1, 2) 0, 22 Maladie rénale chronique Aspirine † Ajustement sur l’âge au moment de la biopsie, le sexe, la race et l’IMC *Insuline è L’aspirine n’influence pas le risque de fibrose sévère contrairement aux antidiabétiques oraux ou aux hypolipémiants Singh A, Etats-Unis, EASL 2018, Abs. FRI-486 actualisé

Validation des critères de Baveno VI pour le diagnostic de VO au cours de la NAFLD (1) • Etude multicentrique de 790 patients NAFLD avec cirrhose Groupe d’évaluation (n = 314) Baveno VI étendu 80 Groupe de validation (n = 338) Nouveaux critères pour les cirrhoses NAFLD : plaquettes > 110 G/l et élasticité < 30 k. Pa (sonde M) 70 68. 5 70 60 58 60 54. 1 50 50 40 61. 8 40 33. 8 30 30 20 10 33. 4 0. 9 3. 8 4. 2 9. 5 12. 7 13. 5 0 20 14. 2 16. 9 17. 7 4. 4 4. 8 10 0 Endoscopies évitées Varices non diagnostiquées nécessitant un traitement Petites varices non diagnostiquées è Cette étude valide les critères de Baveno VI chez les patients NAFLD et propose de nouveaux critères pour les cirrhoses NAFLD Petta S, Italie, EASL 2018, Abs. PS-177 actualisé

Validation des critères de Baveno VI pour le diagnostic de VO au cours de la NAFLD (2) • Proposition d’un nouveau critère pour les cirrhoses NAFLD Plaquettes > 110 g/l et élasticité hépatique < 25 k. Pa (sonde XL) 70 65 Groupe d’élaboration (n = 314) 60 50 40 30 20 13. 2 4. 9 10 0 Endoscopies évitées Varices non diagnostiquées nécessitant un traitement Petites varices non diagnostiquées 50 45 40 35 30 25 20 15 10 5 0 46. 4 Groupe de validation (n = 138) 15. 6 1. 6 Endoscopies évitées Varices non diagnostiquées nécessitant un traitement Petites varices non diagnostiquées è Les nouveaux critères pour les cirrhoses NAFLD avec la sonde XL ont la même performance que les critères Baveno VI Petta S, Italie, EASL 2018, Abs. PS-177 actualisé