11 1 Comparacin molecular de los gases lquidos





















- Slides: 31

11. 1 Comparación molecular de los gases, líquidos y sólidos

11. 1 Comparación molecular de los gases, líquidos y sólidos • El estado de una sustancia depende en gran medida del equilibrio entre las energías cinéticas de las partículas (átomos, moléculas o iones) y las energías de atracción entre estas. • Las energías cinéticas, las cuales dependen de la temperatura, tienden a mantener a las partículas separadas y en movimiento. • Las atracciones entre las partículas tienden a mantenerlas juntas.

11. 1 Comparación molecular de los gases, líquidos y sólidos FIGURA 11. 2 Cl 2 gaseoso, Br 2 líquido, I 2 sólido están formados por moléculas con enlaces covalentes. Debido a las diferencias en la intensidad de las fuerzas intermoleculares, existen en tres diferentes estados a temperatura ambiente y presión estándar.

11. 2 Fuerzas intermoleculares Las intensidades de las fuerzas intermoleculares en diferentes sustancias varían pero son mucho más débiles que las fuerzas intramoleculares: enlaces iónicos, metálicos o covalentes. FIGURA 11. 3 Fuerzas intermolecular e intramolecular.

11. 2 Fuerzas intermoleculares Cuanto más intensas sean las fuerzas de atracción, mayor será la temperatura a la que el líquido hierve. También, los puntos de fusión de los sólidos aumentan conforme crecen las intensidades de las fuerzas intermoleculares.


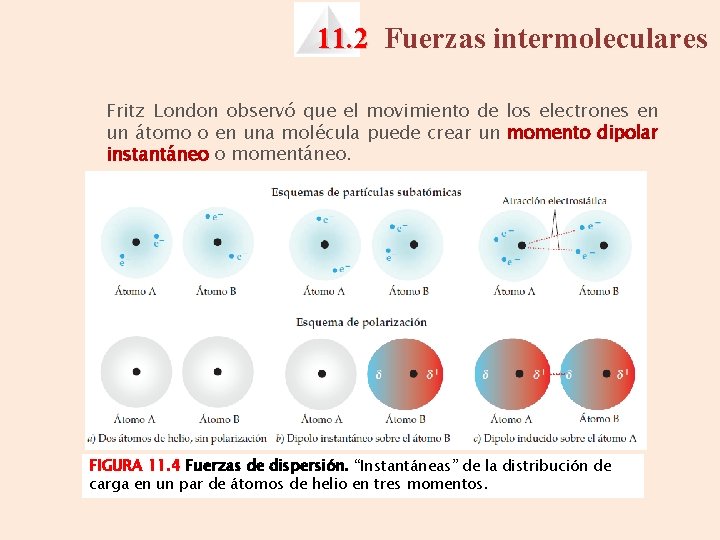
11. 2 Fuerzas intermoleculares Fritz London observó que el movimiento de los electrones en un átomo o en una molécula puede crear un momento dipolar instantáneo o momentáneo. FIGURA 11. 4 Fuerzas de dispersión. “Instantáneas” de la distribución de carga en un par de átomos de helio en tres momentos.

11. 2 Fuerzas intermoleculares 4 El dipolo instantáneo de un átomo induce un dipolo temporal en un átomo adyacente, ocasionando que los átomos se atraigan. 4 Esta interacción se conoce como fuerza de dispersión (o fuerza de dispersión de London). 4 La intensidad de la fuerza depende de la facilidad con que la distribución de carga de una molécula pueda distorsionarse para inducir un dipolo momentáneo. 4 La facilidad con que la distribución de carga se distorsiona se conoce como polarizabilidad de la molécula. Aumento de polarizabilidad

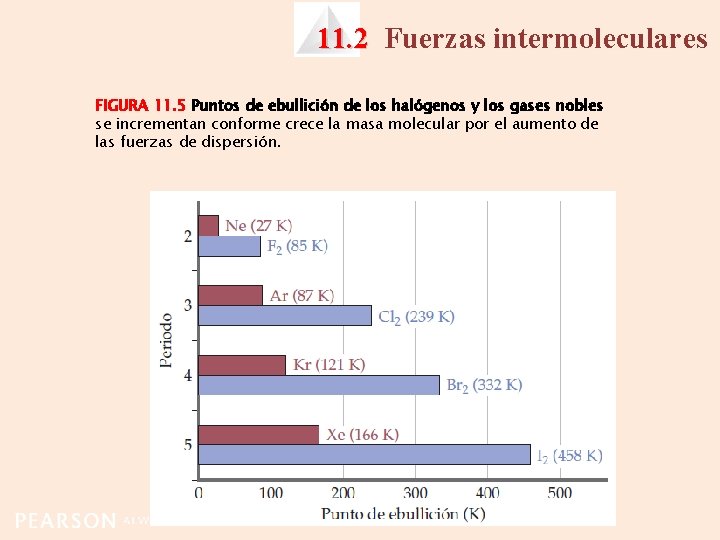
11. 2 Fuerzas intermoleculares FIGURA 11. 5 Puntos de ebullición de los halógenos y los gases nobles se incrementan conforme crece la masa molecular por el aumento de las fuerzas de dispersión.

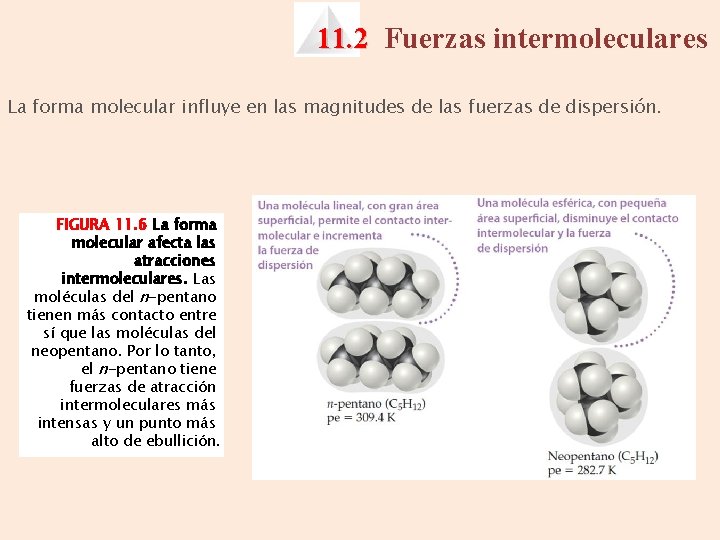
11. 2 Fuerzas intermoleculares La forma molecular influye en las magnitudes de las fuerzas de dispersión. FIGURA 11. 6 La forma molecular afecta las atracciones intermoleculares. Las moléculas del n-pentano tienen más contacto entre sí que las moléculas del neopentano. Por lo tanto, el n-pentano tiene fuerzas de atracción intermoleculares más intensas y un punto más alto de ebullición.

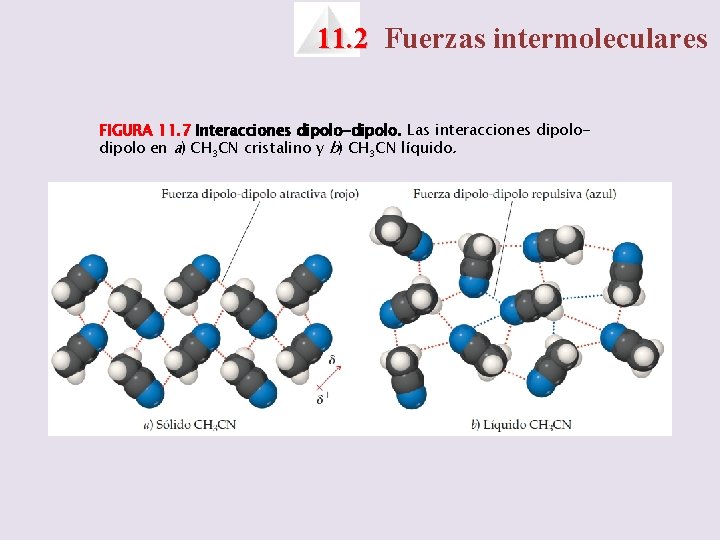
11. 2 Fuerzas intermoleculares FIGURA 11. 7 Interacciones dipolo-dipolo. Las interacciones dipolo en a) CH 3 CN cristalino y b) CH 3 CN líquido.

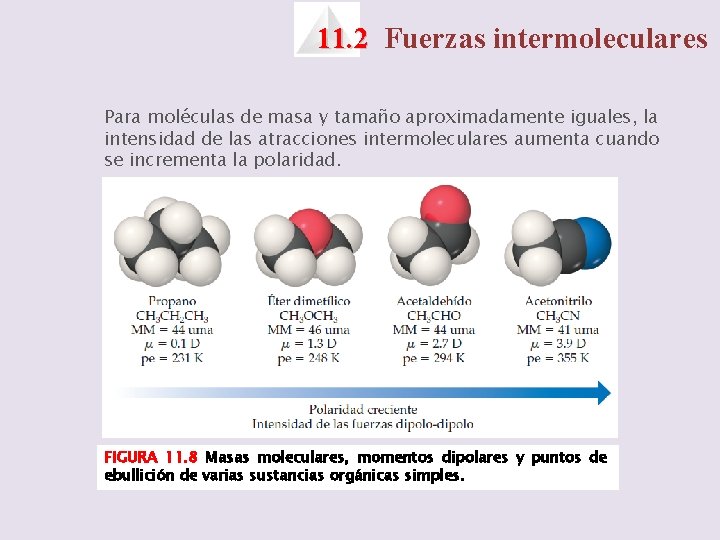
11. 2 Fuerzas intermoleculares Para moléculas de masa y tamaño aproximadamente iguales, la intensidad de las atracciones intermoleculares aumenta cuando se incrementa la polaridad. FIGURA 11. 8 Masas moleculares, momentos dipolares y puntos de ebullición de varias sustancias orgánicas simples.

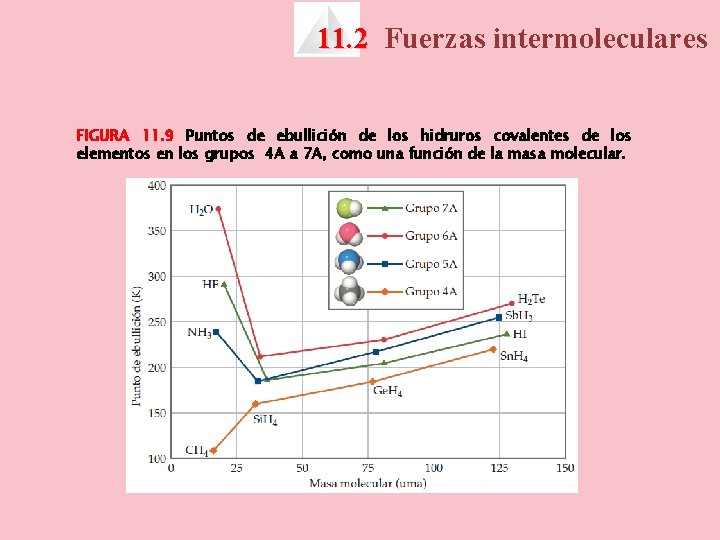
11. 2 Fuerzas intermoleculares FIGURA 11. 9 Puntos de ebullición de los hidruros covalentes de los elementos en los grupos 4 A a 7 A, como una función de la masa molecular.

11. 2 Fuerzas intermoleculares El enlace de hidrógeno es un tipo especial de atracción intermolecular entre el átomo de hidrógeno en un enlace polar (particularmente H—F, H —O y H—N) y un par de electrones de no enlace de un ion o átomo pequeño electronegativo cercano, usualmente de F, O o N (en otra molécula). FIGURA 11. 10 Enlace de hidrógeno.

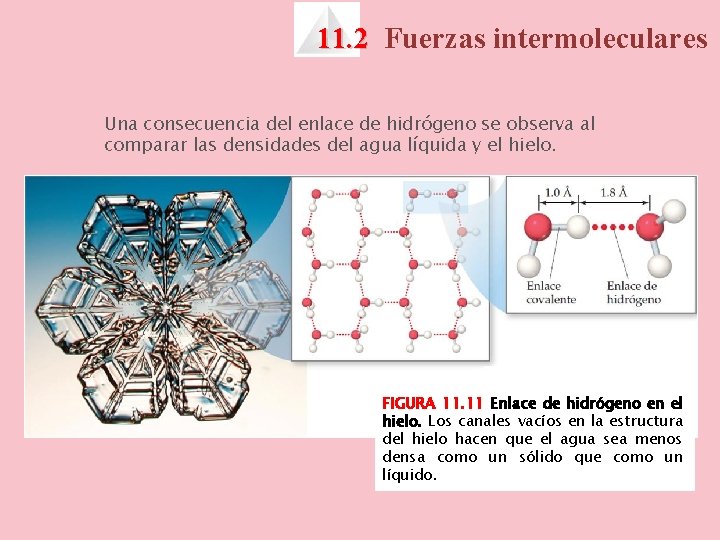
11. 2 Fuerzas intermoleculares Una consecuencia del enlace de hidrógeno se observa al comparar las densidades del agua líquida y el hielo. FIGURA 11. 11 Enlace de hidrógeno en el hielo. Los canales vacíos en la estructura del hielo hacen que el agua sea menos densa como un sólido que como un líquido.

11. 2 Fuerzas intermoleculares Los enlaces de hidrógeno en los líquidos son más aleatorios que en los sólidos, pero son lo suficientemente fuertes para mantener a las moléculas bastante unidas. FIGURA 11. 12 Expansión del agua al congelarse.

11. 2 Fuerzas intermoleculares Una fuerza ion-dipolo existe entre un ion y una molécula polar. FIGURA 11. 13 Fuerzas ion-dipolo.

La magnitud de las fuerzas intermoleculares afecta propiedades macro de las moléculas como tensión superficial, viscosidad, cambios de fase y presión de vapor

11. 3 Algunas propiedades de los líquidos 4 Viscosidad: Resistencia de un líquido a fluir. Cuanto más viscoso sea un líquido, más lentamente fluye. 4 Se mide determinando el tiempo que tarda cierta cantidad de un líquido en fluir a través de un tubo delgado vertical. FIGURA 11. 17 Comparación de viscosidades. La Sociedad de Ingenieros de Automóviles (Society of Automotive Engineers, SAE) estableció una escala numérica para indicar la viscosidad del aceite de motor.

11. 3 Algunas propiedades de los líquidos • La superficie del agua se comporta como si tuviera una piel elástica, debido a las fuerzas intermoleculares. • La tensión superficial es la energía requerida para aumentar el área superficial de un líquido.

11. 3 Algunas propiedades de los líquidos FIGURA 11. 19 Formas de meniscos para el agua y el mercurio en tubos de vidrio.

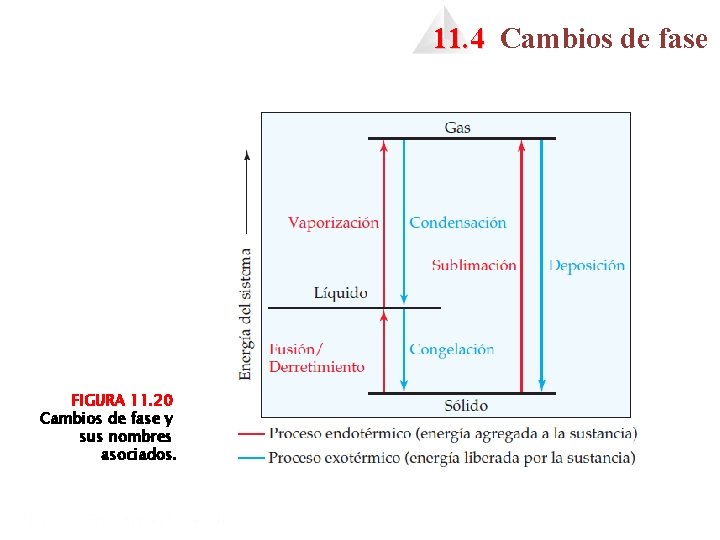
11. 4 Cambios de fase FIGURA 11. 20 Cambios de fase y sus nombres asociados.

11. 4 Cambios de fase 4 El derretimiento se conoce como fusión. El aumento en la libertad de movimiento de las partículas exige un precio, que se mide por el calor de fusión o entalpía de fusión, ΔHfus. 4 Cuando el líquido hierve, las partículas se mueven el estado gaseoso, donde están muy separadas. energía requerida para ocasionar esta transición conoce como calor de vaporización o entalpía vaporización, ΔHvap. en La se de 4 Las partículas de un sólido pueden transformarse directamente al estado gaseoso. El cambio de entalpía requerido para esta transición se conoce como calor de sublimación, y se denota por ΔHsub.

11. 4 Cambios de fase FIGURA 11. 21 Calores de fusión, vaporización y sublimación. Note que se puede aplicar la Ley de Hess: La energía de sublimación = energía de fusión + energía de vaporización

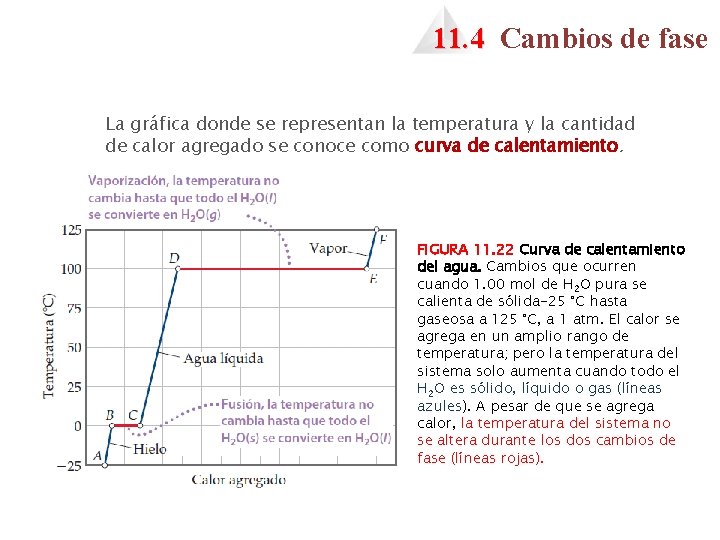
11. 4 Cambios de fase La gráfica donde se representan la temperatura y la cantidad de calor agregado se conoce como curva de calentamiento. FIGURA 11. 22 Curva de calentamiento del agua. Cambios que ocurren cuando 1. 00 mol de H 2 O pura se calienta de sólida-25 °C hasta gaseosa a 125 °C, a 1 atm. El calor se agrega en un amplio rango de temperatura; pero la temperatura del sistema solo aumenta cuando todo el H 2 O es sólido, líquido o gas (líneas azules). A pesar de que se agrega calor, la temperatura del sistema no se altera durante los dos cambios de fase (líneas rojas).

11. 4 Cambios de fase 4 La temperatura más elevada a la que se puede formar una fase líquida definida se conoce como temperatura crítica. 4 La presión crítica es la presión necesaria para llevar a cabo una licuefacción a la temperatura crítica.

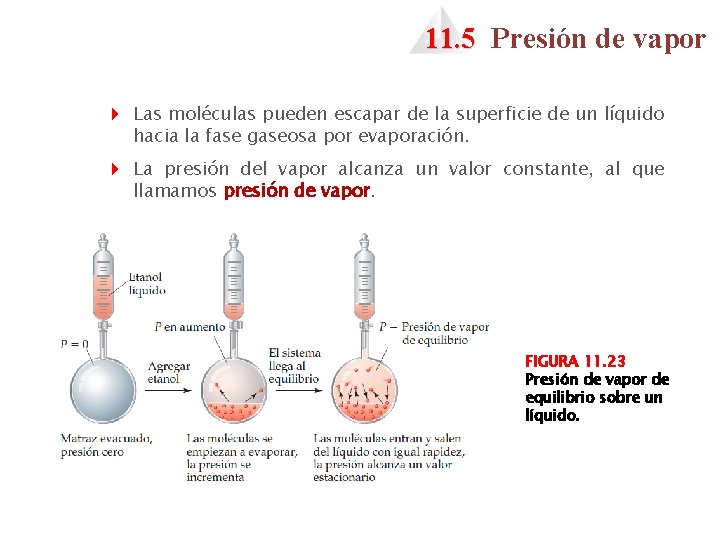
11. 5 Presión de vapor 4 Las moléculas pueden escapar de la superficie de un líquido hacia la fase gaseosa por evaporación. 4 La presión del vapor alcanza un valor constante, al que llamamos presión de vapor. FIGURA 11. 23 Presión de vapor de equilibrio sobre un líquido.

11. 5 Presión de vapor Las sustancias con una presión de vapor elevada se evaporan más rápidamente que las sustancias con una baja presión de vapor. Los líquidos que se evaporan rápidamente son volátiles. FIGURA 11. 24 Efecto de la temperatura sobre la distribución de las energías cinéticas de un líquido.

11. 5 Presión de vapor FIGURA 11. 25 Presión de vapor de cuatro líquidos como una función de la temperatura.

11. 5 Presión de vapor 4 Un líquido hierve cuando su presión de vapor es igual a la presión externa que actúa sobre su superficie. 4 En este punto se forman burbujas de vapor dentro del líquido. La temperatura a la que hierve un líquido dado aumenta cuando se incrementa la presión externa. 4 El punto de ebullición de un líquido a 1 atm (o 760 torr) de presión se conoce como punto de ebullición normal.

 Presion fuerza area
Presion fuerza area Lquidos
Lquidos Cinetica molecular
Cinetica molecular Comparacin
Comparacin Comparacin
Comparacin Comparacin
Comparacin Kinetic molecular theory of gases
Kinetic molecular theory of gases Molecular theory of gases and liquids
Molecular theory of gases and liquids Variables que condicionan el comportamiento de un gas
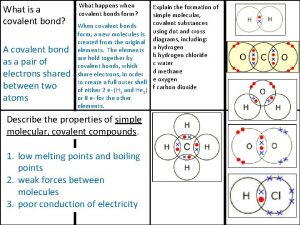
Variables que condicionan el comportamiento de un gas Covalent bond
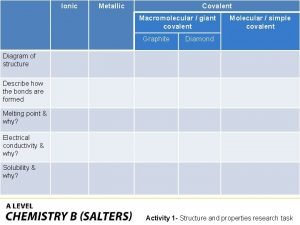
Covalent bond Ionic covalent metallic
Ionic covalent metallic Zinc oxide + nitric acid → zinc nitrate + water
Zinc oxide + nitric acid → zinc nitrate + water Fsica
Fsica Mapa de la termodinamica
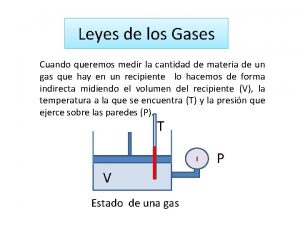
Mapa de la termodinamica El comportamiento de un gas
El comportamiento de un gas Globo aerostatico ley de los gases
Globo aerostatico ley de los gases Constante r de los gases
Constante r de los gases Ley de charles
Ley de charles Ley combinada de los gases ideales
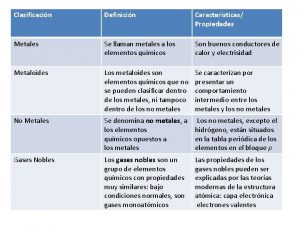
Ley combinada de los gases ideales Características de los gases nobles
Características de los gases nobles Usos de los gases nobles
Usos de los gases nobles Características gas
Características gas Mmhg a atm
Mmhg a atm Cuales son los gases nobles
Cuales son los gases nobles Propiedades del hidrogeno
Propiedades del hidrogeno Propiedades de neon
Propiedades de neon Porque los gases nobles no son reactivos
Porque los gases nobles no son reactivos Constante r de los gases
Constante r de los gases Cintico
Cintico Los gases nobles se caracterizan por
Los gases nobles se caracterizan por Cambio de energia interna
Cambio de energia interna Constante de los gases
Constante de los gases