Zklady termodynamiky n Energetika chemickch reakc poloha rovnovhy
































































- Slides: 66

Základy termodynamiky n Energetika chemických reakcí, poloha rovnováhy. n. Lze posoudit zda reakce může spontánně probíhat. n. Jak můžeme reakce optimalizovat vzhledem k výtěžnosti produktů.

Termodynamika se zabývá n n 1. 2. 3. Popisem dějů, ve stavu rovnováhy Nezabývá se: příčinou chemických dějů, mechanismem a rychlostí chemických reakcí.

Teplo a teplota Když teplo, které soustavě dodáme se nevyužije na práci, fázovou nebo chemickou přeměnu, je tepelná energie přímo úměrná zvýšení ΔT (teploty soustavy), kde C je konstantou úměrnosti (tepelné kapacity, měrná tepla, apod. , při pečlivějším rozboru se zjistilo, že tyto konstanty „přece jen“ trochu závisí na teplotě). Číselně se tyto konstanty rovnají teplu, které je nutné soustavě dodat, aby se zahřála o 1°C (1 K). Molární teplo

Termodynamické soustavy n n n n Soustava je část prostoru se svou látkovou náplní. Oblast mimo soustavu je okolí Okolí od soustavy je odděleno skutečnými nebo myšlenými stěnami. Soustava uzavřená: není možná výměna hmoty (látková výměna), je možná výměna energie s okolím. Soustava otevřená: může vyměňovat s okolím látku i energii. Soustava izolovaná (neumožňuje výměnu hmoty ani energie s okolím) Soustava homogenní ( vlastnosti soustavy jsou ve všech částech stejné nebo se spojitě mění) Soustava heterogenní (přítomnost dvou nebo více homogenních oblastí, mezi nimi jsou fázová rozhraní s velmi zajímavými vlastnostmi, elektrody)

Stavové veličiny a jejich proměnné n n Stav soustavy je popsán stavovými veličinami (energie (teplo), práce (objemová, povrchová) Stavové proměnné jsou p, T, V, koncentrace a látková množství ni (n 1, n 2, n 3 …. atd. ) Extenzivní veličiny. Mají aditivní vlastnosti a dají se určit jako součet příspěvků jednotlivých částí soustavy např. celková energie, hmota, objem, velikost apod. Intenzivní (nezávisí od množství látek v soustavě) Intenzivní vlastnosti (tlak, teplota, hustota, koncentrace, molární objem). Nemají aditivní charakter a nezávisí na látkovém množství.

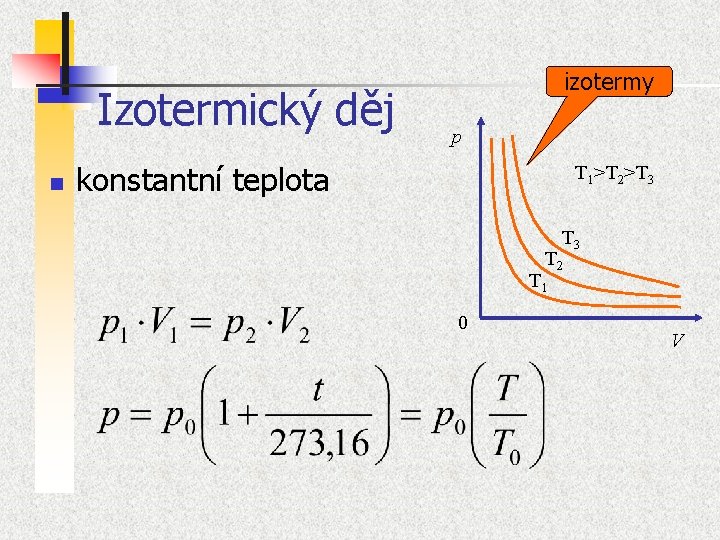
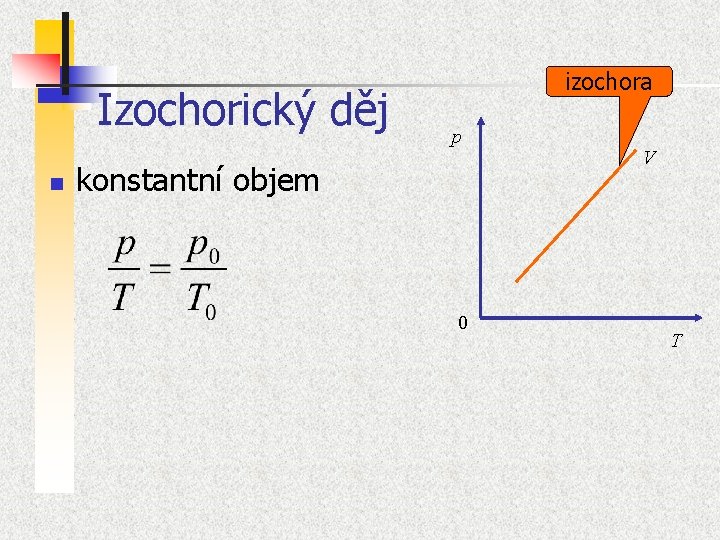
Podmíněné termodynamické děje n 1. 2. 3. 4. Termodynamické děje (chemické reakce, rozpouštění látek, kondensaci par, disociaci iontů, skupenské přechody, hoření, výbuch) můžeme realizovat tak, že některé proměnné „podržíme“ na konstantní hodnotě. Izotermické děje d. T = 0 Izobarické dp = 0 Izochorické d. V = 0 Adiabatické d. Q = 0 Zjednoduší se tak jak popis, tak často i experiment

Izotermický děj n izotermy p konstantní teplota T 1>T 2>T 3 T 2 T 1 0 V

Izochorický děj n izochora p konstantní objem 0 V T

Izobarický děj n izobara V konstantní tlak 0 p T

Adiabatické a izotermické (nejčastější) děje n n Izotermický děj probíhá při konstantní teplotě v termostatu. Termostat vyrovnává tepelné efekty. Tedy odebírá teplo soustavě, která se při (expanzi, kompresi, změně koncentrací – chemické reakce jako látkový tok) zahřívá a obráceně. Adiabatický děj (v kalorimetru) probíhá v soustavě, která je tepelně izolovaná nepřijímá a nevydává žádné teplo.

Nultá věta termodynamiky n Jsou-li dvě různá tělesa A a B v tepelné rovnováze (mají stejnou teplotu) s tělesem třetím C, potom jsou v rovnováze i navzájem.

První věta-úvod Vývoj názorů na teplo, od lodní výpravy k totálnímu diferenciálu. n n Mayer roku 1840 vyplul na trojstěžníku Jawa z Rotterdamu jako lékař. Když tzv. pustil žilou několika námořníkům, domníval se, že omylem otevřel tepnu. Krev byla jasně červená. Od místních lékařů se dověděl, že v tropech je to typické, protože k uchování tělesné teploty není potřeba tolik energie a následně kyslíku. Došel k názoru, že oxidací živin vzniká z chemické energie teplo a zároveň naše schopnost pracovat. Pokud jde z potravy získat určitou energii, která se rozdělí na tělesné teplo a práci, pak teplo a práce se mohou vzájemně přeměňovat tak, aby jejich součet byl konstantní. Tedy: U=Q + A = konst. neboli d. U = d. Q + d. A = 0, vnitřní energie má význam totální diferenciálu, a výraz je 1. větou termodynamiky.

Zachovávají se tzv. důležité veličiny Příklady n n n Celková energie U Impuls a rotační impuls Orbitalová symetrie Multiplicita spinu A ….

První věta -úvod n n Benjamin Thomson hrabě Rumdorf byl pravděpodobně první, který už v roce 1798 vyslovil názor, že původ tepla je v mechanické práci. Všiml si, že při vrtání dělových hlavní se uvolňuje teplo. Odpůrci mu říkali, že vrtáním se uvolňuje „fluidum“ nebo, že se vrtáním obnaží čerstvý povrh, který reaguje s kyslíkem. Thomson vrtal hlavně dlouho a fluidum bylo nevyčerpatelné, drtil hobliny a získal stejné množství tepla, jako při vrtání. Také zjistil, že děla se při střelbě naslepo zahřívají více než při ostrých střelbách. Setkáváme se s 1. větou termodynamiky o zachování vnitřní energie (zachování součtu tepla a práce). Energie, kterou získala střela nutně snížila množství uvolněného tepla. Věděl jakou práci vykoná kůň při vrtání hlavní za hodinu a odhadl převod jednotek energie a tepla číslem 5, 46 J/cal (chyba asi 30% oproti pozdějším experimentům-Jaul).

První věta J. P. Joul n n n James Prescot Joule r. 1840 publikoval práci o tepelných účincích elektrického proudu. Poté vykonal řadu pokusů ve kterých přeměňoval různé druhy energie na teplo (mechanickou prací – mícháním kapalin, expanzí plynů apod. ). Vytvořil dílo On the Mechanical Equivalent of Heat 1949. Jednalo se vždy o jednostrannou konverzi různých energií na energii tepelnou bez toho, že teplo konalo práci. W=Q Byl tak podán důkaz o tom, že teplo je energie. Byl formulován vztah mezi jednotkami tepla a energie, které byly pro neznalost věci původně chápány jako různé (J = 4, 184 J cal-1 ).

Pojem entalpie Při běžných podmínkách (konstantní teplota a tlak) je výhodné zavést namísto vnitřní energie jiné funkce. V podmínkách konstantního tlaku je výhodné použít Entalpie H n H = U + p. V n

Pokus Joulův-Thomsonův izoentalpický děj n Jednalo se o měření tepelných efektů při „přetlačování“ plynů přes porésní přepážku rozdílnými tlaky. Subtilnější zařízení s menší tepelnou kapacitou, než při expanzi do vakua. Při tomto ději se zachovává entalpie Um, 1 + p 1 Vm, 1 = Um, 2 + p 2 Vm, 2 Resp. Hm, 1 = Hm, 2

Entalpie II n n n Příklady (zatím nepředpokládáme chemické reakce): Při konstantním objemu se nekoná práce a změny vnitřní energie „jdou“ do tepla a promítnou se ve změnách teploty. Q = DU Při konstantním tlaku se koná navíc objemová práce p DV a potom platí, že: Q = DU + p DV resp. H(konstantního tlaku) = DU + p DV Obecně musíme připustit změnu jak objemu i tlaku a psát pro entalpii H = U +p V Z toho vyplývá, že Q(V=konst. ) = DU a Q(p=konst. ) = DH

Entalpie III Entalpie je veličinou, která od (všezahrnující) vnitřní energie odečte d(p. V) = pd. V + Vdp. Za konstantního tlaku dp = 0 lze tvrdit že odečteme objemovou práci (člen Vdp je energie). n Teplo přijaté soustavou při izobarickém ději se rovná zvýšení entalpie soustavy Qp = DH n Dvojí tepelné kapacity (podmíněné jednou d. V a podruhé dp) Cv = d. QV/d. T = (d. U/d. T)V Cp = d. Qp/d. T = (d. H/d. T)p n d. H = d. U + n RT z toho plyne že, Cm, p - Cm, v = R n

Entalpie IV Vazebná n Hydratační n Molární n Reakční n

Zkapalňování plynů n Tk - Kritická teplota n n určitá teplota, nad kterou již při žádném tlaku látka neexistuje kapalné skupenství podchladíme a proces je podobný jako v Joule – Thomsnově pokusu, kde proti sobě jde expanze (ochladí se vzduch) a stlačený vzduch ochlazený expanzí kaskádově snižuje teplotu soustavy, děj se cyklicky opakuje, dokud nedojde ke zkapalnění kaskádový efekt

Pojem práce obecně n Jakoukoli práci lze vyjádřit součinem extensivního a intensitního parametru. Jednodušeji řečeno: Práci konáme když jisté množství hmoty (nebo náboje) přemisťuje z jednoho stavu do druhého( příkladně přemístíme nějaký naboj mezi dvěma hladinami potenciálu (napětím), nebo vyzvedneme několik kilogramů vody do výšky třeba 1, 0 m. Součin hmoty vody a rozdílu „nadmořské výšky“ počátečního a konečného stavu (1 m) je práce, kterou jsme museli vykonat. Obrácené tvrzení o tom, že když voda teče dolů nám vrátí vynaloženou práci platit nemusí, protože se spontánně zahřeje v důsledku tření.

Příklady výrazů pro práci n n n Elektrická práce d. A = DE d. Q (Q je náboj, DE je rozdíl potenciálů, napětí). Objemová práce d. A = - p d. V. Právě tato práce a z tohoto výrazu pochází práce chemická, kterou chápeme jako přemisťování látky (v molech) mezi dvěma hladinami tzv. chemických potenciálů m. Chemická práce d. A = m dn (d. A =S(m- m(o)) dn) Práce spojená s vytvořením povrchů d. A = g d. S (g je povrchová napětí-energie jednotky povrchu) Práce spojená s reversibilním (vratným) zvětšením (zmenšením) chemické vazby (pružiny) d. A = F dx) Magnetická práce d. A = B dm (B je magnetická indukce a m magnetický moment)

Věta termodynamiky zatím bez chemie (zákon zachování energie) n n n 1. 2. 3. Tedy: U=Q + A = konst. neboli d. U = d. Q + d. A = 0, vnitřní energie má význam totální diferenciálu, a předcházející výraz je 1. větou termodynamiky. Tři následující výroky jsou rovnocenné: Funkce U je stavovou veličinou soustavy Diferenciál d. U je exaktním diferenciálem Integrál d. U po uzavřené cestě je roven nule

1. věta termodynamiky rozšířená o chemickou práci d. U = d. Q + d. A + Σ(μini)

1. Objemová práce reversibilní a ireversibilní expanze (komprese) ideálního plynu n n n Ireversibilní expanze plynu ve válci: snížíme tlak za pístem a zvýší se objem (získaná práce je dána velikostí plochy v p, V souřadnicích. Reversibilní expanze probíhá tak, že vnější tlak je jen málo nižší než vnitřní. Tato expanze probíhá nekonečně pomalu, ale poskytuje maximální práci. V následujícím výrazu je tlak p stejný před i za pístem d. W = - pd. V = - RT d. V/V, po integraci W = - RT ln V 2/V 1 (V 1 je počáteční objem a V 2 konečný) Poznámka protože objem V 2 je menší než V 1, práce je formálně kladná a o tuto práci má soustava menší energii (viz. výrazy pro práci). Výraz lze přepsat pomocí tlaků a koncentrací (c je úměrné

Exatní výraz pro chemický potenciál Ze stavové rovnice plynů vyplývá, že: P (osmotický tlak) = c RT kde c = n/V n Odtud poměr V 2/V 1 = c 1/c 2 a n n n W = - RT ln (c 1/c 2) a odtud m - mo= RT ln (c 1), kde mo je chemický potenciál odpovídající jednotkové koncentraci c 2. Tento výraz zavádí tzv. chemický potenciál, který patří každé složce reakce. Je to veličina parciální a molární. V našem příkladu je c 2 jednotkovou koncentrací v molaritě a mo jí příslušný chemický potenciál.

Hydratační entalpie Energie uvolněná při hydrataci, n Je poměrně velká a podporuje rozpouštění, exotermický děj n

Vazebná entalpie (disociační) energie vazby je měřena změnou entalpie při izotermických podmínkách teplotě (293 K), n atomizační teplo je teplo potřebné k rozštěpení biatomické molekuly na atomy. n

Molová entalpie zavádíme do vztahu pak je tepelná kapacita soustavy při konstantním tlaku vyjádřena vztahem

Reakční entalpie od součtu slučovacích H reaktantů odečteme slučovací H produktů Slučovací entalpie (H ) všech složek vynásobíme jejich příslušnými stechiometrickými koeficienty (n )

Reakční tepla n Výměna vnitřní energie DU resp. DH při chemických dějích při vzniku či rozpad vazeb s okolím ve formě tepla n n při konstantním objemu při konstantním tlaku reakční teplo jen při konst. tlaku

Nultá věta termodynamiky n Transitivnost na množině teplot n Pokud T 1 = T 2 a zároveň T 2 = T 3, platí, že n n T 1 = T 3 Shora uvedená vlastnost se nazývá transitivnost

1. Věta termodynamiky n n n Energetické změny lze bilancovat jen porovnáním výchozího a konečného stavu. V termodynamice nezáleží jakou cestou výchozí stav přešel na výsledný. Nezávisí na tom jakou cestou soustava dosáhla rovnováhy. Termodynamické úvahy tedy bilancují jen a porovnávají výchozí stav s konečným stavem a nezávisí na tom jak dlouho to trvalo než bylo rovnováhy dosaženo. Termodynamické úvahy neobsahují čas jako proměnnou.

Termochemické zákony příklad použití 1. věty Laplace n n Tepelný efekt chemické reakce v jednom směru je až na znaménko stejný jako ve směru opačném. Hess n n Součet reakčních tepel od výchozích látek k produktům je stejný a nezávisí na způsobu uskutečnění reakce. př. :

Degradace tepelné energie n n Zákon zachování energie (1. věta termodynamiky) platí, ale to neznamená, že je možné provádět bez omezení konverzi třeba mechanické práce na tepelnou energii a naopak. Zcela zvláštní postavení má tepelná energie, je degradovanou formou energie a nelze ji (ani v ideálním případě) 100% převést v práci. Když však provádíme konverzi (přeměnu) jakékoli energie na tepelnou, lze to provést beze zbytku. Při každé konverzi jistá část tepla zůstává nevyužita a rozptyluje se do okolí. Stačí si všimnout, že při reálných dějích se pokaždé hmota zahřívá a teplo bez užitku uniká.

Druhá věta termodynamiky n n 1. 2. 3. Jouleho pokusy nešly provést obráceně. Rok 1824 uveřejnil francouzský inženýr Said Carnot monografii „Úvahy o hybné síle ohně“. Úvaha o parním stroji, který jednou koná práci a podruhé funguje jako tepelné čerpadlo a vyrábí tepelné rozdíly. V této dvojici nemohl být jeden stroj účinnější než druhý (jednalo by se o perpetum mobile). Navíc cyklické zařízení, koná práci na základě odebírání tepla z okolí je nelze provést libovolným teplem. Na přestup tepla je potřeba tepelný rozdíl (T 2 - T 1). Perpetum mobile prvého druhu, koná práci beze změn okolí je „ošetřeno“ 1, větou termodynamiky

2. Věta, tepelné stroje a Carnotův cyklus n n Výraz pro účinnost tepelných strojů Nelze zkonstruovat tepelný stroj, který by odebíral teplo a izotermicky ho měnil na práci. Ke konání práce je potřeba rozdíl teplo T 2 – T 1 a tento rozdíl má největší hodnotu pro T 1 =O. Účinnost tepelného stroje (T 2 – T 1)/T 2.

Formulace 2. věty n n n Thomson: Není možné získat periodicky práci na útraty tepla odebíraného tělesu, které má stejnou teplotu. Clausiova: Teplo nemůže spontánně (samovolně) přecházet z chladnějšího tělesa na teplejší. Lord Kelvin vložil do 2. věty termodynamiky dovětek o tom, že platí jen pro neživé materiálové substance. Vývoj mu za pravdu nedal. Leon Brillouin: Každá. inteligentní bytost (schopná uložit informaci) musí před tím než sníží entropii okolí, zvýšit entropii svou (1951). Když chcete někoho periodicky utěšovat musíte na to doplatit náladou svou.

Termodynamická stupnice teplot n n n Naše tepelné stupnice jsou realizovány pomocí lineární závislosti roztažnosti látek na teplotě. Termodynamická stupnice teplot je odvozena tak, že změna o jeden stupeň odpovídá stále stejné změně účinnosti Carnotova cyklu (účinnosti ideálního parního stroje). h = DT/T odtud dh = dk = d. T/T = d ln T = exp (k) n k = ln T

Účinnost tepelných strojů n n Účinnost je úměrná rozdílu teplot T. Z = ((T(2) – T(1))/T(2) ((Q)(2) - Q(1))/Q)2) Entropie jako „důležitá“ veličina pro kterou v pouze v případě nejlepšího stroje (reversibilního) platí zákon zachování entropie. Q(1)/T(1) + Q(2)/T(2) = 0. Tento výraz říká, že kruhový integrál ∫d. S = 0. U ideálního tepelného stroje je tedy zachovává entropie. U reálných strojů entropie roste. Rovnice o účinnosti tepelných strojů je 2. Větou termodynamiky. V podstatě tvrdí, že stejné hodnoty tepelných energií o různých teplotách nejsou stejně hodnotné (využitelné). Teplo o vyšší teplotě je „lepší“. Entropie je po energii druhým důvodem průběhu spontánních dějů. Vše se snaží zaujmout stav s nejnižší energií (spontánně vše padá dolů) a vše se snaží zaujmout nejméně organizovaný stav tedy stav s největší entropií.

Entropie, výrazy pro entropii n n Entropie jako totální diferenciál stavové funkce Účinnost nevratně pracujícího tepelného stroje Entropie izolované soustavy při nevratných dějích vždy roste Statistická interpretace entropie. Počet mikrostavů, kterými se realizuje makrostav soustavy se označuje jako termodynamická pravděpodobnost. Soustava v makrostavu 1 má tendenci přejít do makrostavu 2, pokud počet mikrostavů je ve stavu 2 větší než ve stavu 1.

Výrazy pro entropii d. S = d. Q/T resp. d. Q = T d. S n d. Sm=d. Q/T=Cm, Vd. T/T + R d. Vm/V a odtud: n Teplotní závislost n DS = S 2 –S 1 = Cp ln (T 2/T 1) n Závislost na objemu n DSm = R ln (Vm, 2/Vm, 1) Jestliže se objem změní 10 -násobně, entropie se zvýší o 19, 145 J K-1 mol-1. n n

Ideální tepelný stroj jako příklad izoentropického děje n n Ideání tepelný (parní) stroj je izoentropický. Jiná formulace entropie je o tom, že entropie pro cyklický děj je totálním diferenciálem (zachovává se): kruhový integrál ∫d. S = 0

Jak souvisí tepelný stroj a jeho účinnost s informací. n Maxwellův démon.

Termodynamická rovnováha, spontánní děje n n d. U < 0 pro konstantní (V, S) d. S > 0 pro konstantní (U, V) Při konstantním objemu a entropii spontánně probíhají děje, které směřují k nižší vnitřní energii. V rovnováze U nabývá minimální hodnoty. Entropie stoupá a nabývá v rovnováze maximální hodnoty.

Chemický potenciál n n n n Vyjádření chemického potenciálu jako parciální derivaci podle jedné složky U (konst. S, V a ostatní složky), podle jedné složky H (konst. S, p a ostatní složky), podle jedné složky G (konst. T, p a ostatní složky), podle jedné složky A (konst. T, V a ostatní složky), Příklad mi = (d. U/dni)S, V, n(j) (j…shrnuje všechny (konstantní) složky s výjimkou i) Výraz pro chemický potenciál m - mo= RT ln (c), Podmínka rovnováhy Smi dni = 0 vyrovnání toků hmoty

Termodynamické funkce a entropie Vnitřní energie n n n n U = Q - p. V d. U = d. Q - pd. V Entalpie H = U + p. V pro změnu d. H = d. U + pd. V + Vdp Helmholtzova energie A = U – TS d. A = d. U - Td. S – Sd. T Gibbsova energie d. G = H – TS d. G = d. H - Td. S - Sd. T

Termodynamické funkce a chemické děje, Gibbsova energie a Helmholtzova energie. n n n n n d. U = Td. S - pd. V + Simi dni d. H = Td. S + Vdp + Simi dni d. G = - Sd. T + Vdp + Simi dni d. A = - Sd. T – pd. V + Simi dni Odtud podmíněné děje mohou za vybraných podmínek zobrazovat jen chemické děje: (d. U)S, V = Simi dni (d. H)S, p = Simi dni (d. G)T, p = Simi dni (d. A)T, V = Simi dni

Gibbsova (1) a Helmholtzova (2) energie Děje: 1. izobaricko-izotermické 2. izotermicko-izobarické a n Oba druhy energii mají obecnou platnost, jejich význam spočívá v tom, že podmínkách 1. a 2. Jsou užitečné pro energetický popis chemických dějů.

3. Věta termodynamiky lim (d. DG/d. T)p = lim (d. DH/d. T)p T 0 Teplotní závislosti DG a DH mají pro absolutní nulu, ale i v jejím okolí společnou tečnu. Předcházející rovnice je vyjádřením Nernstova tepelného teorému. Směrnice je rovnovběžná s osou teplot. Tedy součin TDS je nulou i pro DS blížící se nule. lim DS = 0 Nernstův tepelný teorém T 0 lim S = 0 Planckův výraz T 0 Konečným počtem operací nelze ochladit těleso na absolutní nulu.

3. Věta termodynamiky II n Cp = DS/DT Při snižování teploty, kdy T se blíží nule blíží se k nulové hodnotě i tepelné kapacity. n Chemické reakce při absolutní nule probíhají beze změny entropie (Nernstův tepelný teorém).

Chemické rovnováhy a termodynamika chemických reakcí a. A + b. B = c. C + d. D K = /A/a /B/b /C/-c/D/-d resp. K = /A/na /B/nb /C/-nc/D/-nd Pro sjednocení chemických toků se zavádí rozsah reakce x: dx = dni/ni , odtud mi dni = mi ni dx a výraz pro Gibbsovu energii d(DG) = mi dni = mi ni dx. Zavedeníme Gibbsovu reakční energie DGr = d(DG)/ dx dostáváme: DGr = Smi ni , resp. a v podmínkách rovnováhy (podmínka minima závislosti Gibbsovy reakční energie na rozsahu reakce) dostáváme: DGr 0 = – RT ln K kde K je rovnovážná konstanta formulována pomocí rovnovážných konstant.

Reakční izoterma n n DGr 0 = - RT ln Kp DGr 0 = - RT ln Kc

Clausiova Clapeyronova rovnice a teplotní závislosti rovnovážných konstant n n Opět bude výchozím bodem našich úvah tenze páry na roztokem. Nejjednodušší rovnováha (jedna složka přechází ze stavu kapaliny do stavu páry a naopak) a v rovnováze dosáhne tlak par rovnovážnou hodnotu (tenzi). Posunout tuto rovnováhu lze přídavkem netěkavých látek do roztoku. Přídavkem těkavých látek v roztoku, které se pak podílejí na tenzi par spolu (ideální plyn nerozlišuje z čeho je).

Rovnováha mezi kapalnou a plynnou fází n n n Rovnováhu mezi dvěma fázemi v jednosložkové soustavě lze formulovat jako rovnost chemických potenciálů v obou fázích: m. I = m. II V jednosložkových soustavách je chemický potenciál totožný s molární Gibbsovou energií GIm = GIIm Pro malou změnu soustavy platí, že GIm + d. GIm = GIIm + d. GIIm resp. d. GIm = d. GIIm

pokračování n n Z 1. a 2. Věty vyplývá, že: - SIm d. T + VImdp = - SIIm d. T + VIImdp Odtud teplotní kvocient tlaku dp/d. T = (DSm)/DVm pravá strana rovnice přdstavuje objemové a entropické změny při přechodu jednoho molu složky z jedné do druhé fáze. V podmínkách konstantního tlaku platí, že DS = (Qrev. )p/T = DH/T Úpravou dostáváme dp/d. T = DHm/TDVm (tento výraz se nazývá Clapeyronova rovnice)

Pokračování II n Molární objem plynné fáze (II) je mnohom větší než fáze kapalné a objem kapalné fáze (I) můžeme zanedbat a objemová změna je rovna molárním objemu plynné fáze, tedy DV = VIIm. Potom platí: dln p/d. T = DHm, výp/RT 2 Tento výraz je diferenciální podobou Clausiovy. Clapeyronova rovnice a vyjadřuje závislost tenze páry na teplotě

pokračování III n n Po integraci (předpoklad nezávislosti molární výpoarné energie na teplotě) můžeme psát: log p 2/p 1 = - DHm, výp/R (1/T 2 - 1/1 T) Říkali jsme si, že rovnováha pára/kapalina je nejjednodušší rovnováhou a že tenze páry p mají význam rovnovážné konstanty. Tento výraz lze rozšířit na teplotní závislost rovnovážných konstant (chemických). Pokud považujeme o rychlosti chemických dějů pomocí představy o rovnováze mezi výchozími látkami a „transitním“ stavem, je předcházející výraz použitelný i pro popis teplotních závislostí rychlostních konstant.

Rovnovážné konstanty n n Koncentrace Aktivity a aktivitní koeficienty

Rozsah reakce a reakční Gibbsova energie Úvaha napříč fyzikální chemií n n n Na počátku byla izotermická expanse plynu. Plyn vykonal práci, kterou jsme označili za zápornou, protože ji vykonala (ztratila) soustava n - w = RT ln V 2/V 1 n - w = RT ln p 1/p 2 n - w = RT ln c 1/c 2 Nyní zavedeme bezrozměrnou koncentraci (jakoukoli koncentraci budeme vyjadřovat počtem c 1 -počtem molů v jednotce objemu a této koncentraci připíšeme práci wo. Jenže práce, která je vztažena na jednotkové množství má název potenciál a jeho hodnotu označíme mo. Dostáváme explicitní výraz pro chemický potenciál. Tato veličina je zavedena pro každou složku (parciální) a mnohdy pro molární koncentrace (parciální a molární) n m = mo + RL ln c 1 je vybranou jednotkovou koncentrací a c = c 2

Můžeme si zvolit libovolnou rovnováhu n a. A + b. B = Cc + Dd K = [C]c [B]d / [A]a [B]b n Nyní se vrátíme k obecnému výrazu pro chemický potenciál m = mo + RL ln c a rozepíšeme jej pro každou složku rovnováhy (pro zjednodušení uvádíme jen výraz pro složku A). n m. A = m. Ao + RL ln c. A

Žádná velká věda Zavedeme veličinu, která se nazývá rozsah chemické reakce. Tato veličina respektuje skutečnost, že různé složky vstupují do reakce v různém poměru (dx) = dni/ni a d. G = S(mi ni) dx am. A + bmb + cmc + dmd = am. Ao + bmbo + cmco + dmdo + RT ln K Resp. DGr = DGro + RT ln K

A nakonec n Polohy chemické rovnováhy je dosaženo v okamžiku kdy derivace Gibbsovy energie podle rozsahu reakce je nulová, kdy zmizí důvod pro průběh makroskopického děje: n DGro = - RT K

Úplně nakonec n Tok hmoty může být spojen s tokem náboje a s prací elektrickou, která je dána součinem náboje a rozdílů potenciálů (napětí). Naší jednotkou náboje musí být jeden mol elektronů, abychom se nelišily od předchozích výrazů. - n. F DE = - n. F DEo + RT ln K resp. DE = DEo - RT ln K pro reakci Zn + Cu 2+ = Cu + Zn 2+ K = /Zn 2+//Cu///Cu 2+//Zn/ lze koncentraci kovu v materiálu pokládat za konstantní a shrnout do výrazů DEo a DE = DEo´ - RT ln /Zn 2+///Cu 2+/ Elektromotorickou sílu článku můžeme rozepsat na potenciály elektrod.

Zkapalňování plynů n pk – Kritický tlak n n potřebný tlak, aby plyn zkapalnil při kritické teplotě s příslušným molovým objemu plynu Vmk – molový kritický objem p Tk pk T 3 T 2 0 Vk T 1 V
 Reakc
Reakc Energetika fakulteti
Energetika fakulteti Elektroenergetika
Elektroenergetika Toshkent davlat texnika universiteti energetika fakulteti
Toshkent davlat texnika universiteti energetika fakulteti Promena entalpije
Promena entalpije Bug' turbinalari
Bug' turbinalari Energetika fakulteti
Energetika fakulteti Kaj je energetika
Kaj je energetika Toshkent davlat texnika universiteti energetika fakulteti
Toshkent davlat texnika universiteti energetika fakulteti Energetika fakulteti
Energetika fakulteti Elektr energetika fani
Elektr energetika fani Poloha afriky
Poloha afriky Poloha amazonka
Poloha amazonka Gastroduodenoskopie
Gastroduodenoskopie Kotouč otáčivý kolem pevné vodorovné osy
Kotouč otáčivý kolem pevné vodorovné osy Obrácená trendelenburgova poloha
Obrácená trendelenburgova poloha Klidová poloha mandibuly
Klidová poloha mandibuly Vzajomna poloha priamok priklady
Vzajomna poloha priamok priklady Prieliv bospor a dardanely
Prieliv bospor a dardanely Argentina poloha
Argentina poloha Indiánský sed poloha
Indiánský sed poloha Polsko poloha
Polsko poloha Komoce
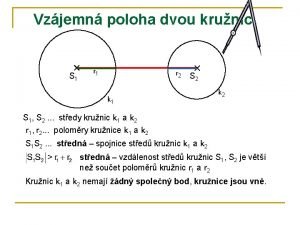
Komoce Vzájemná poloha dvou kružnic prezentace
Vzájemná poloha dvou kružnic prezentace Krikothyreotomie
Krikothyreotomie Vzajomna poloha kruznice a priamky
Vzajomna poloha kruznice a priamky Průčelná rovina
Průčelná rovina Poloha srdca
Poloha srdca Vzajomna poloha 2 priamok
Vzajomna poloha 2 priamok Vzájomná poloha dvoch kružníc
Vzájomná poloha dvoch kružníc Zotavovacia poloha
Zotavovacia poloha Taliansko poloha
Taliansko poloha Rovnovážná poloha tělesa
Rovnovážná poloha tělesa Znak polohy
Znak polohy Vodstvo australie
Vodstvo australie Walchrova poloha
Walchrova poloha Slovensko rozloha
Slovensko rozloha Poloha asie
Poloha asie Shautova poloha
Shautova poloha Soustředné kružnice
Soustředné kružnice Geografická poloha sydney
Geografická poloha sydney Hlavne europske rozvodie
Hlavne europske rozvodie Blumbergovo znamení
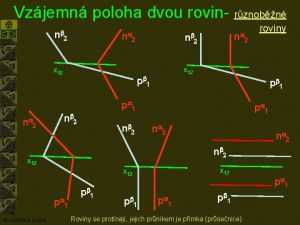
Blumbergovo znamení Vzajomna poloha 3 rovin
Vzajomna poloha 3 rovin Tetiva
Tetiva Průnik dvou rovin
Průnik dvou rovin Antarktida poloha
Antarktida poloha Rovnovážná poloha
Rovnovážná poloha Vzájemná poloha tří rovin
Vzájemná poloha tří rovin Norsko poloha
Norsko poloha Podvn
Podvn Poloha plodu pph
Poloha plodu pph Vzájemná poloha dvou kružnic
Vzájemná poloha dvou kružnic Obrátená trendelenburgova poloha
Obrátená trendelenburgova poloha Znak polohy
Znak polohy Porann
Porann štrkovka leopoldov
štrkovka leopoldov Vnější přímka
Vnější přímka Polpriamka
Polpriamka Genukubitální poloha
Genukubitální poloha Taliansko vodstvo
Taliansko vodstvo Poloha indie
Poloha indie Poloha savany
Poloha savany Nautický trojúhelník
Nautický trojúhelník