KINETIKA CHEMICKCH REAKC kol 1 n n Vymyslete






![Rychlost chemické reakce Kinetická rovnice v = k [A]a [B]b n Rychlost chemické reakce Kinetická rovnice v = k [A]a [B]b n](https://slidetodoc.com/presentation_image_h/2976e936de42a4d61e16be0cba374def/image-13.jpg)


![Vliv koncentrace v = k [ A ] a [ B] b n a Vliv koncentrace v = k [ A ] a [ B] b n a](https://slidetodoc.com/presentation_image_h/2976e936de42a4d61e16be0cba374def/image-17.jpg)

![Guldberg-Waageův zákon v 1 = v 2 k 1 [ A ] a [ Guldberg-Waageův zákon v 1 = v 2 k 1 [ A ] a [](https://slidetodoc.com/presentation_image_h/2976e936de42a4d61e16be0cba374def/image-20.jpg)





- Slides: 26

KINETIKA CHEMICKÝCH REAKCÍ

Úkol 1. n n Vymyslete vlastní definici reakční kinetiky a zapište si ji zezadu do sešitu. Porovnejte ji s definicí, kterou si vyhledáte v učebnici.

Reakční kinetika n n zabývá se studiem průběhu chemických reakcí sleduje reakční rychlost a její závislost na faktorech, které reakční rychlost ovlivňují

Úkol 2. n Co je to chemická reakce? n Co je nutno splnit, aby k reakci došlo?

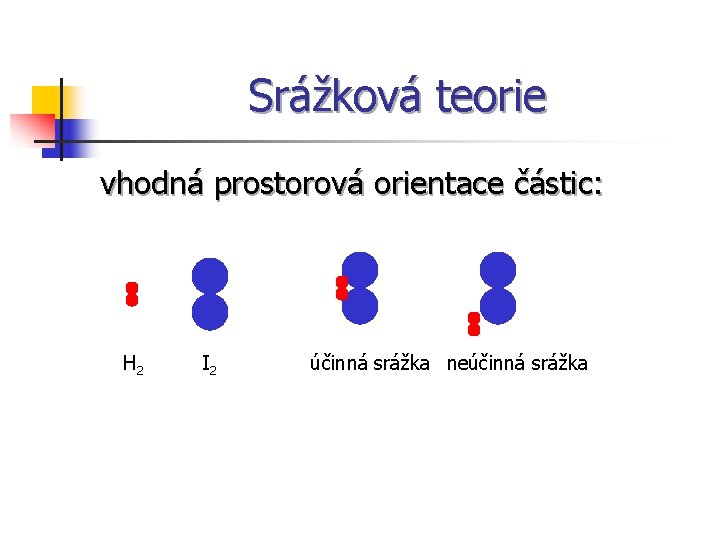
Srážková teorie n Efektivní (účinná) srážka a) vhodná prostorová orientace částic b) částice mají dostatečnou kinetickou energii

Srážková teorie vhodná prostorová orientace částic: H 2 I 2 účinná srážka neúčinná srážka

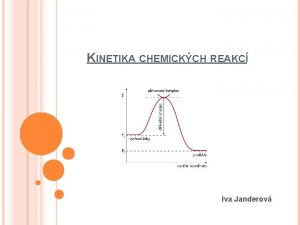
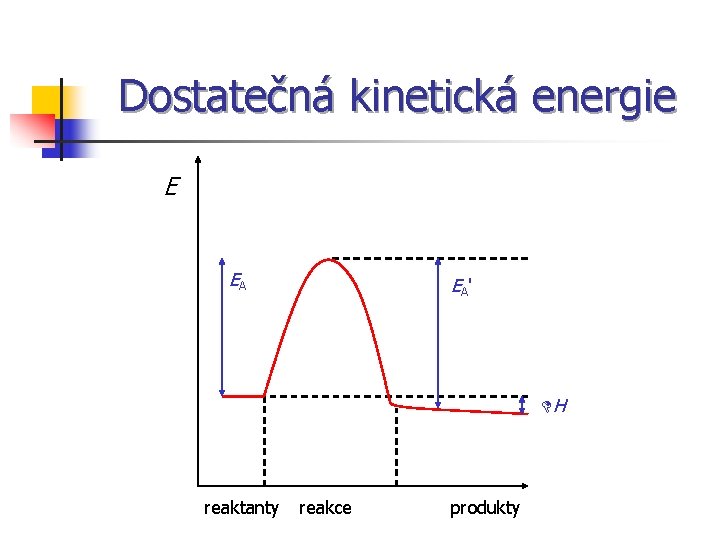
Dostatečná kinetická energie E EA EA ' DH reaktanty reakce produkty

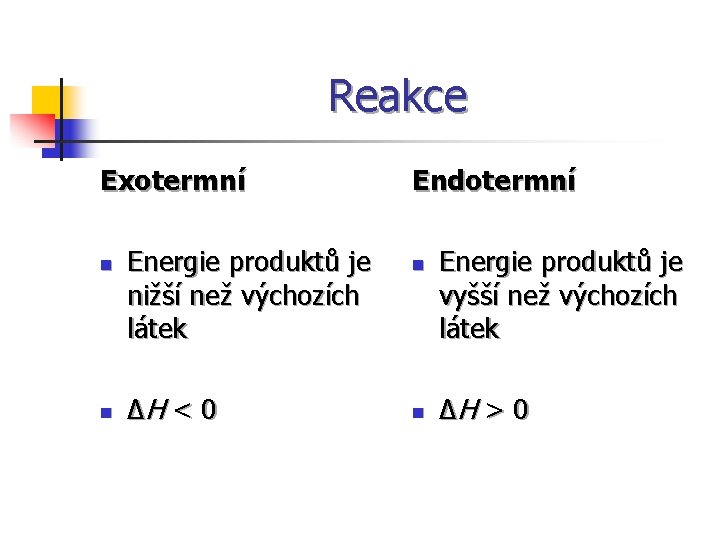
Reakce Exotermní n n Energie produktů je nižší než výchozích látek ∆H < 0 Endotermní n n Energie produktů je vyšší než výchozích látek ∆H > 0

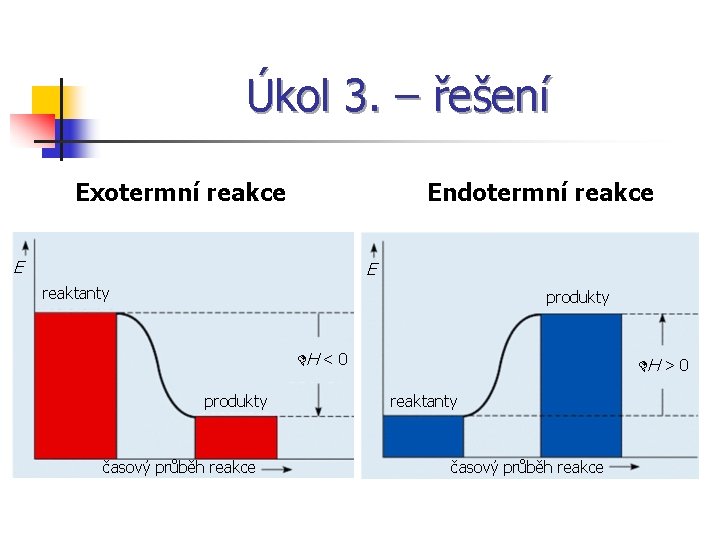
Úkol 3. n Nakresli graf exotermní a endotermní reakce.

Úkol 3. – řešení Exotermní reakce Endotermní reakce E E reaktanty produkty DH < 0 produkty časový průběh reakce DH > 0 reaktanty časový průběh reakce

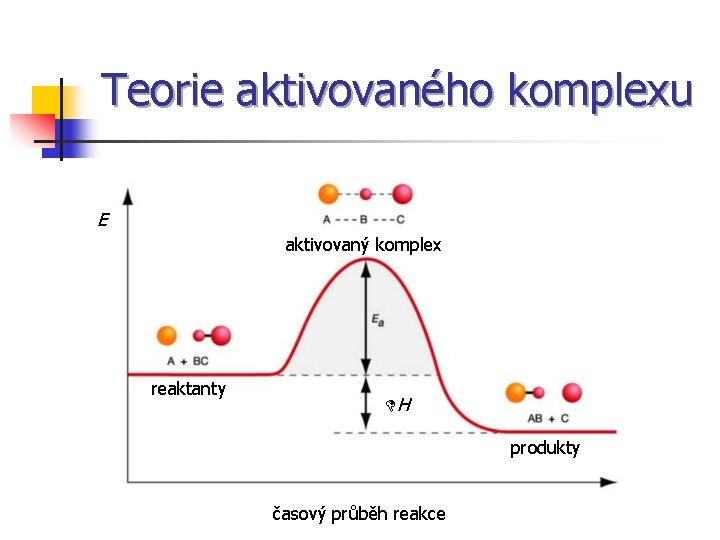
Teorie aktivovaného komplexu E aktivovaný komplex reaktanty DH produkty časový průběh reakce

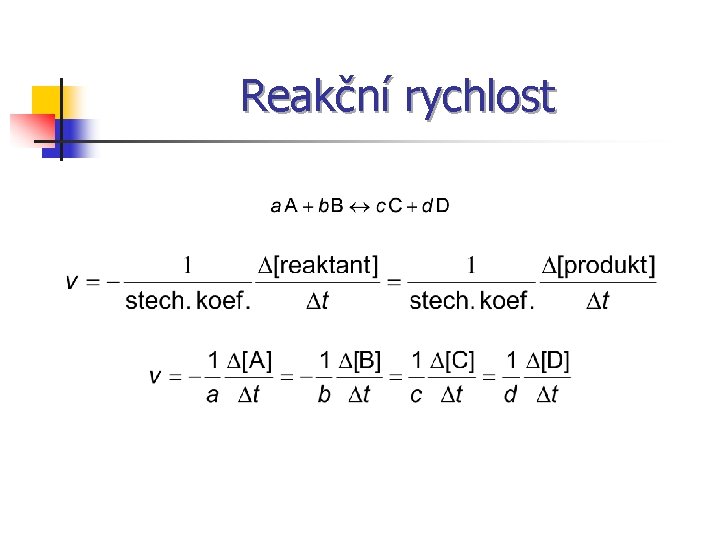
Reakční rychlost
![Rychlost chemické reakce Kinetická rovnice v k Aa Bb n Rychlost chemické reakce Kinetická rovnice v = k [A]a [B]b n](https://slidetodoc.com/presentation_image_h/2976e936de42a4d61e16be0cba374def/image-13.jpg)
Rychlost chemické reakce Kinetická rovnice v = k [A]a [B]b n

Úkol 4. n n Jaké faktory mohou ovlivňovat rychlost chemické reakce? Vycházej ze své praxe a teorií reakční kinetiky.

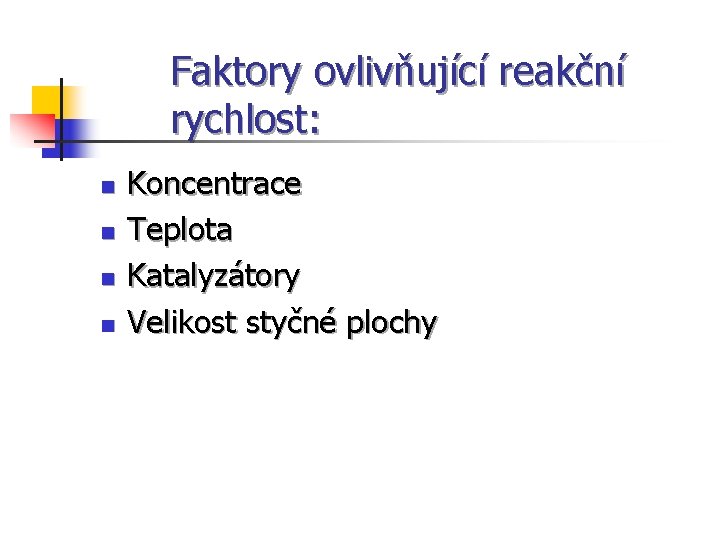
Faktory ovlivňující reakční rychlost: n n Koncentrace Teplota Katalyzátory Velikost styčné plochy

Úkol 5. n n Rozdělte se do 8 skupin a proveďte pokusy, vyplňte tabulky a svá pozorování postupně prezentujte. Vyvoďte závěry a nadiktujte je svým kolegům.
![Vliv koncentrace v k A a B b n a Vliv koncentrace v = k [ A ] a [ B] b n a](https://slidetodoc.com/presentation_image_h/2976e936de42a4d61e16be0cba374def/image-17.jpg)
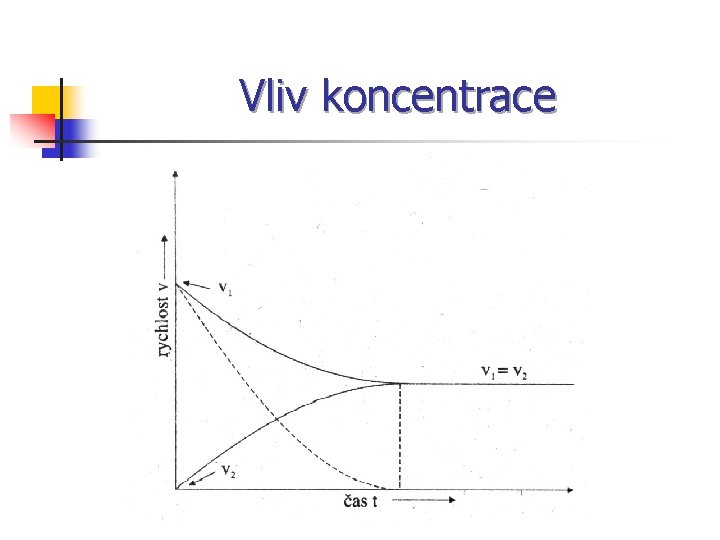
Vliv koncentrace v = k [ A ] a [ B] b n a + b = řád reakce n k – rychlostní konstanta

Vliv koncentrace n n Jaké faktory mohou ovlivňovat rychlost chemické reakce? Uveď jeden a k ní příklad z praxe.

Vliv koncentrace
![GuldbergWaageův zákon v 1 v 2 k 1 A a Guldberg-Waageův zákon v 1 = v 2 k 1 [ A ] a [](https://slidetodoc.com/presentation_image_h/2976e936de42a4d61e16be0cba374def/image-20.jpg)
Guldberg-Waageův zákon v 1 = v 2 k 1 [ A ] a [ B ] b = k 2 [ C ] c [ D ] d

Vliv teploty n Arrheniova rovnice: n k – rychlostní konstanta EA – aktivační energie reakce J mol– 1 R = 8, 314 J K– 1 mol– 1 (univerzální plynová konstanta) n A – konstanta pro danou reakci n n

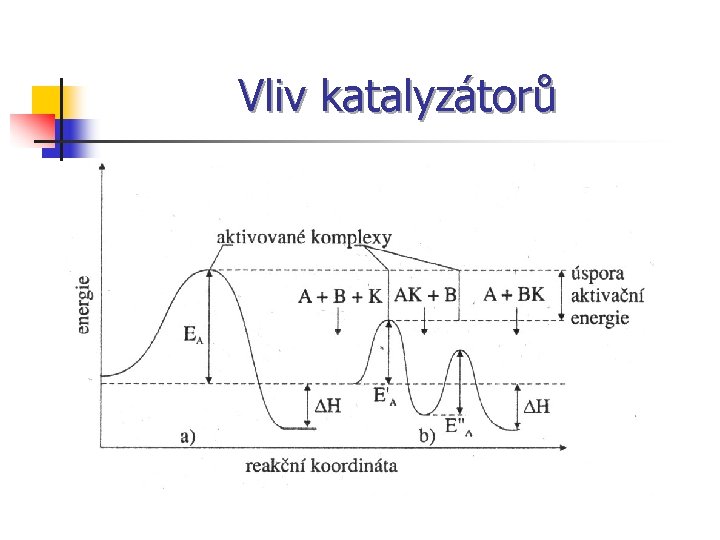
Vliv katalyzátorů Katalyzátor n Rozdělení katalyzátorů: 1. Pozitivní 2. Negativní : a) Stabilizátory b) Katalytické jedy n

Vliv katalyzátorů

Vliv katalyzátorů Katalýza: Homogenní: a) autokatalýza n b) selektivní katalyzátor Heterogenní

Úkol 5. n n Najděte v literatuře různé příklady použití katalyzátorů. V jaké souvislosti se s katalyzátorem setkáte nejčastěji?

Dělení reakcí podle reakční kinetiky Izolované n Simultánní: 1. Zvratné 2. Bočné 3. Následné (konsekutivní) n
 Grafické znázornění souvětí
Grafické znázornění souvětí Reakc
Reakc Brzina hemijske reakcije
Brzina hemijske reakcije Kinetika kimia
Kinetika kimia Elin kompartmanları
Elin kompartmanları Henle kulpu çıkan kol
Henle kulpu çıkan kol Kol cat
Kol cat Kol arka bölge kasları
Kol arka bölge kasları Modern kol
Modern kol Amorft kol
Amorft kol Gyvenimo knyga skaityk laps i lapa
Gyvenimo knyga skaityk laps i lapa ön kol kemiği
ön kol kemiği Kol grundämne
Kol grundämne Med kol
Med kol N kol
N kol Sputumpurulens
Sputumpurulens Barak kol
Barak kol üst orta kol çevresi ölçümü
üst orta kol çevresi ölçümü Iki sahanlıklı merdiven
Iki sahanlıklı merdiven Kan gazı örneği
Kan gazı örneği Kol gücünden makine gücüne geçiş
Kol gücünden makine gücüne geçiş Kol nidrei text
Kol nidrei text Respiratorisk acidose kol
Respiratorisk acidose kol Biyeli kol yırtmacı
Biyeli kol yırtmacı Dirsek ekstansörleri
Dirsek ekstansörleri Gillat kol
Gillat kol Pr��ce kol��n
Pr��ce kol��n