Tema 1 ESTRUCTURA DEL TOMO 1152022 Departamento de










































- Slides: 64

Tema 1 ESTRUCTURA DEL ÁTOMO 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 1

• Contenidos • 1. Modelos atómicos: • 1. 1. Teoría atómica de Dalton. • 1. 2. Modelo de Thomson. • 1. 3. “ “ Rutherford. • 1. 4. Radiación electromagnética. Espectros atómicos. • 1. 5. Modelo de Böhr. Correcciones de Sommerfeld y Zeeman. • 1. 6. Bases de la mecánica cuántica. Función de onda. Orbital atómico. • 2. Números cuánticos. Tipos de orbitales. • 3. Principios de distribución electrónica. Configuración electrónica. Para y diamagnetismo. • 4. Resumen de la constitución del átomo 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 2

1. Modelos atómicos 1. 1 Teoría atómica de Dalton. John Dalton enunció unos postulados que le han valido el titulo de "padre de la teoría atómicamolecular". Dalton trató de buscar la explicación de las leyes ponderales que experimentalmente habían comprobado él y otros químicos europeos. Los elementos están formados por partículas muy pequeñas, llamadas átomos, que son indivisibles e indestructibles. Todos los átomos de un elemento son iguales en masa y propiedades. Los átomos de elementos distintos son diferentes en masa y propiedades. Los átomos se combinan en relaciones sencillas para formar compuestos. Los cuerpos compuestos están formados por átomos diferentes; las propiedades del compuesto dependen del número y de la clase de átomos que tenga. En este modelo los átomos se pueden representar por bolitas (esferitas) macizas de diferente masa para así representar a los distintos elementos. El propio Dalton lo hacia así: 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 3

Este modelo se mantiene durante casi todo el siglo XIX. Sin embargo, el avance en el campo de la electricidad y la electroquímica de Ampére y Faraday hacían pensar en un átomo divisible dada la relación que se observaba entre materia y carga eléctrica. Finalizando el siglo(1896) el francés H. Becquerel descubre la radiactividad, es decir, la existencia de cierta clase de materia que emitía partículas con masa y carga positiva ( las partículas alfa) o negativa (partículas beta) o emitían radiaciones electromagnéticas ( rayos gamma) + + + Campo eléctrico + sustancia radiactiva - - - Partículas β Rayos γ Partículas α Evidentemente, estas partículas tenían que salir del interior de los átomos. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 4

1. 2. Modelo atómico de Thomson No obstante, fue el descubrimiento de la primera partícula subatómica, el electrón, por J. J. Thomson finalizando el siglo (1897) el hecho científico que acabó con el modelo de Dalton e hizo necesario un nuevo modelo de átomo. • • • Estudió los electrones. rayos tódicos Mediante campos eléctricos y magnéticos comprobó que se trataba de partículas de carga negativa. Determinó su velocidad y el cociente Q/m (carga/masa) gas vacio cátodo ánodo Tubo de Rayos Catódicos Precursor de los actuales tubos de TV y monitores (CRT) 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 5

Los rayos catódicos eran partículas veloces y con carga negativa, ya que se desviaban hacia el polo positivo en presencia de campos eléctricos. Estas partículas eran todas iguales, independientemente del gas encerrado dentro del tubo Thomson determinó la relación carga/masa de estos rayos: A estas partículas se las denominó electrones y se las consideró como parte constituyente de la materia. Millikan con su experiencia de la gota de aceite calculó su masa: A la luz de todo lo anterior Thomson propuso un nuevo modelo de átomo: • Los átomos son masas esféricas macizas y homogéneas con carga positiva e incrustados en ella están los electrones. • La carga positiva de las esferas es compensada por la carga negativa total de los electrones, de manera que el átomo es eléctricamente neutro. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 6

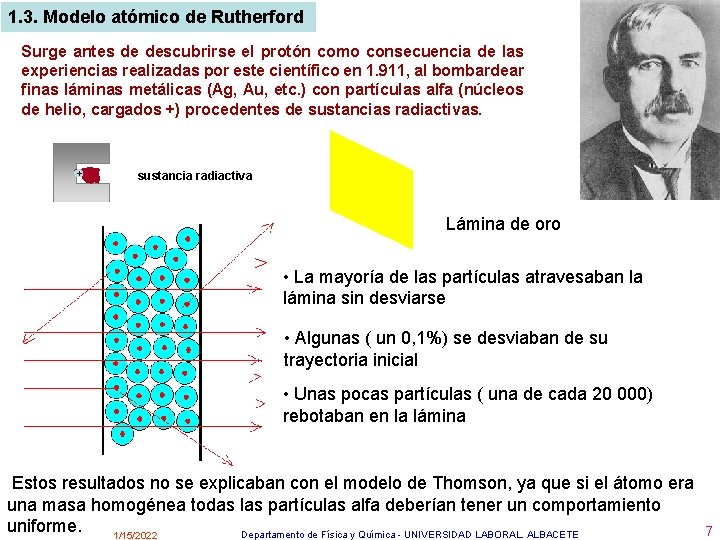
1. 3. Modelo atómico de Rutherford Surge antes de descubrirse el protón como consecuencia de las experiencias realizadas por este científico en 1. 911, al bombardear finas láminas metálicas (Ag, Au, etc. ) con partículas alfa (núcleos de helio, cargados +) procedentes de sustancias radiactivas. + + sustancia radiactiva Lámina de oro • La mayoría de las partículas atravesaban la lámina sin desviarse • Algunas ( un 0, 1%) se desviaban de su trayectoria inicial • Unas pocas partículas ( una de cada 20 000) rebotaban en la lámina Estos resultados no se explicaban con el modelo de Thomson, ya que si el átomo era una masa homogénea todas las partículas alfa deberían tener un comportamiento uniforme. Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 1/15/2022 7

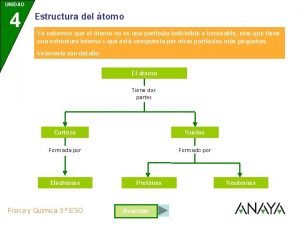
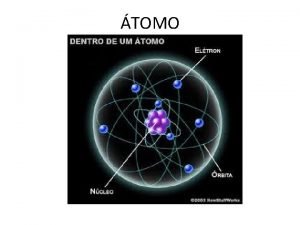
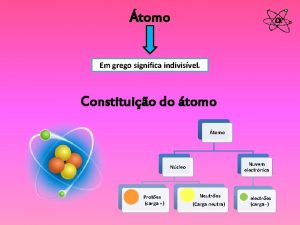
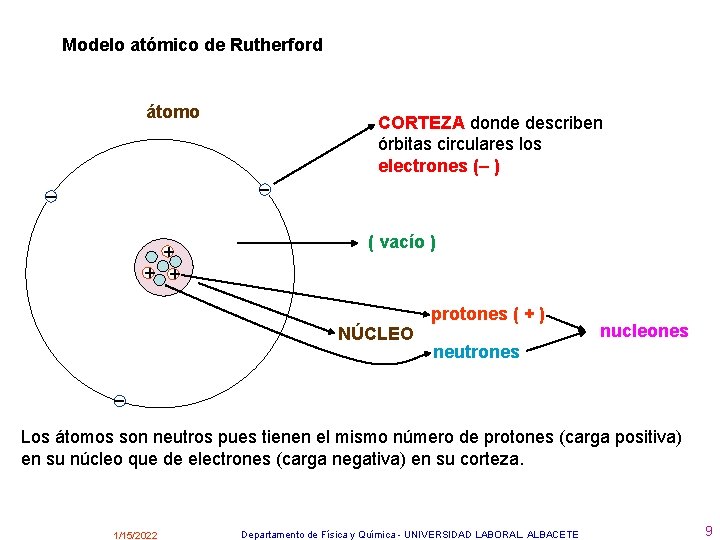
Los resultados obtenidos por Rutherford llevaron a un nuevo modelo de átomo: • El átomo está formado por un núcleo central y una corteza • Los electrones están en la corteza y giran en órbitas circulares alrededor del núcleo como los planetas alrededor del Sol (modelo planetario) • En el núcleo se alojan la carga positiva, los protones y casi la totalidad de la masa del átomo • Entre el núcleo y la corteza sólo existe el vacío Pero la sola presencia en el núcleo de los protones no explicaba el hecho de que en el núcleo se concentrara casi la totalidad de la masa del átomo. El propio Rutherford pensó que en el núcleo debería de haber “algo más” que explicara este hecho. El neutrón Pero no fue hasta el año 1931 , con el descubrimiento por Chadwick de una nueva partícula, el neutrón que se pudo explicar este hecho. El neutrón no tiene carga eléctrica y su masa es ligeramente mayor que la del protón: 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 8

Modelo atómico de Rutherford átomo CORTEZA donde describen órbitas circulares los electrones (– ) – – + + + ( vacío ) NÚCLEO protones ( + ) nucleones neutrones – Los átomos son neutros pues tienen el mismo número de protones (carga positiva) en su núcleo que de electrones (carga negativa) en su corteza. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 9

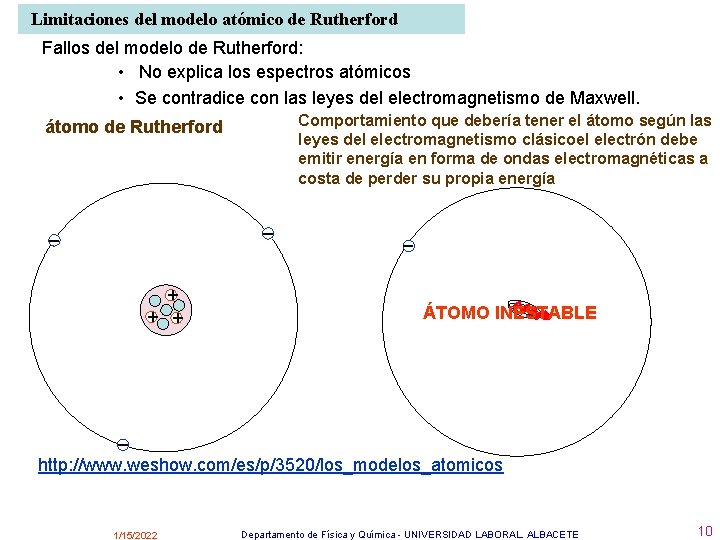
Limitaciones del modelo atómico de Rutherford Fallos del modelo de Rutherford: • No explica los espectros atómicos • Se contradice con las leyes del electromagnetismo de Maxwell. Comportamiento que debería tener el átomo según las leyes del electromagnetismo clásicoel electrón debe emitir energía en forma de ondas electromagnéticas a costa de perder su propia energía átomo de Rutherford – – + + + – + ÁTOMO INESTABLE – http: //www. weshow. com/es/p/3520/los_modelos_atomicos 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 10

ISÓTOPOS Mediante el espectrógrafo de masas se encontró que había átomos de un mismo elemento que presentaban entre sí diferente masa. Los isótopos son átomos de un mismo elemento que tienen distinto número de neutrones y por tanto masas diferentes Cada átomo queda definido por dos características: Su número atómico Z Número de protones que tiene en su núcleo. Determina el elemento de que se trata. Es el DNI de los átomos. Su número másico A Número de nucleones que tiene en su núcleo (suma de neutrones y protones). Determina el isótopo del elemento del que se trate. donde X es el símbolo químico del elemento. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 11

¿QUÉ EJERCICIOS PODEMOS HACER YA? ESPERA QUE MIRE APUNTA: DE LA PÁGINA 18 : EL 14 Y EL 15 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 12

1. 4 Radiación electromagnética. Espectros atómicos. La radiación electromagnética se origina como consecuencia de la vibración de cargas en movimiento y se propaga mediante ondas, comportándose cinéticamente como cualquier movimiento ondulatorio, pero a diferencia de las ondas mecánicas (sonido, etc. ) no necesitan un medio material para propagarse, lo pueden hacer en el vacío. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 13

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 14

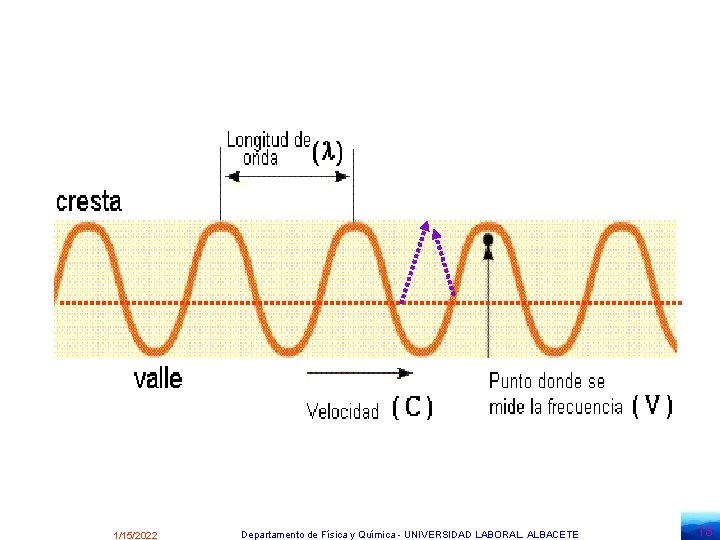
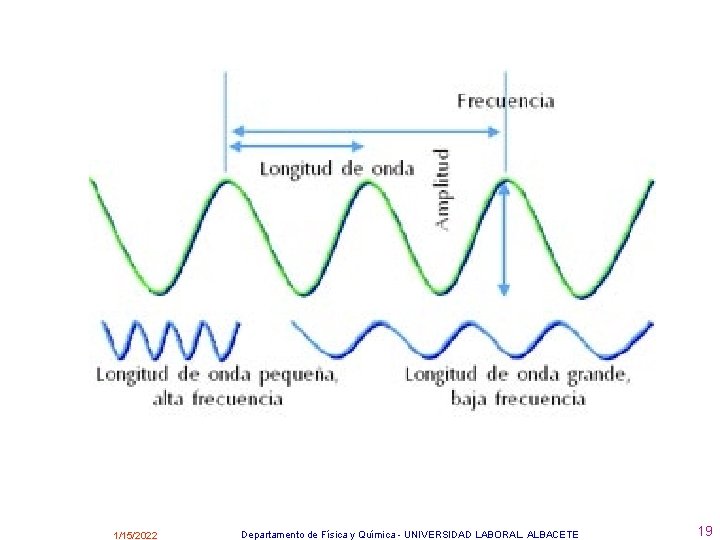
Las ondas vienen caracterizadas por varias magnitudes: Longitud de onda , , es la distancia entre dos puntos consecutivos que están en fase, es decir, tienen el mismo estado de vibración. Se mide en m. Periodo, T , es el tiempo que tarda el foco emisor en dar una vibración completa, es decir, en originarse una onda completa o bien, el tiempo que tarda la onda en recorrer una distancia igual a la longitud de onda. Se mide en s. Frecuencia, , es el número de vibraciones completas por segundo, es decir, el número de ondas completas realizadas en un segundo, o bien, el número de longitudes de onda que hay que tomar para tener una distancia igual a la recorrida por la onda en un segundo. Se mide en hertzios (Hz) o s-1 = 1 / T Número de ondas, , es el número de longitudes de onda que es necesario tomar para tener la distancia de un metro. Se mide en m-1 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 15

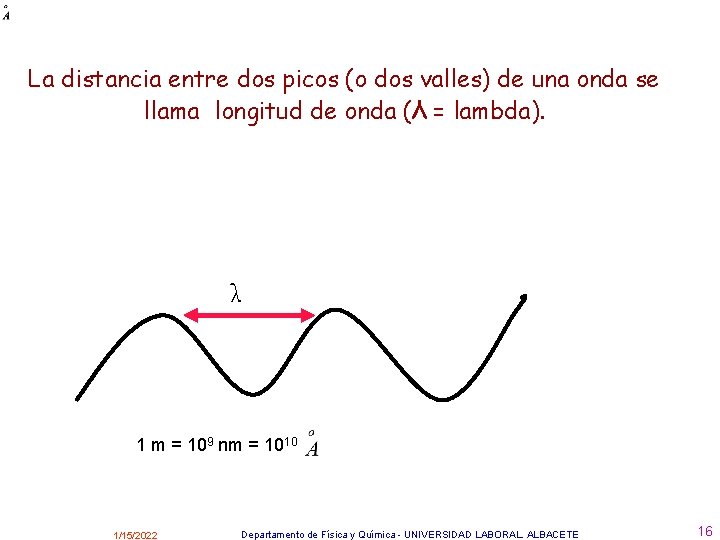
La distancia entre dos picos (o dos valles) de una onda se llama longitud de onda (λ = lambda). λ 1 m = 109 nm = 1010 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 16

frecuencia es el número de vibraciones por segundo Así frecuencia, es número de veces que la onda se repite por segundo. La frecuencia se mide en Hertz (Hz) 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 17

nodo 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 18

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 19

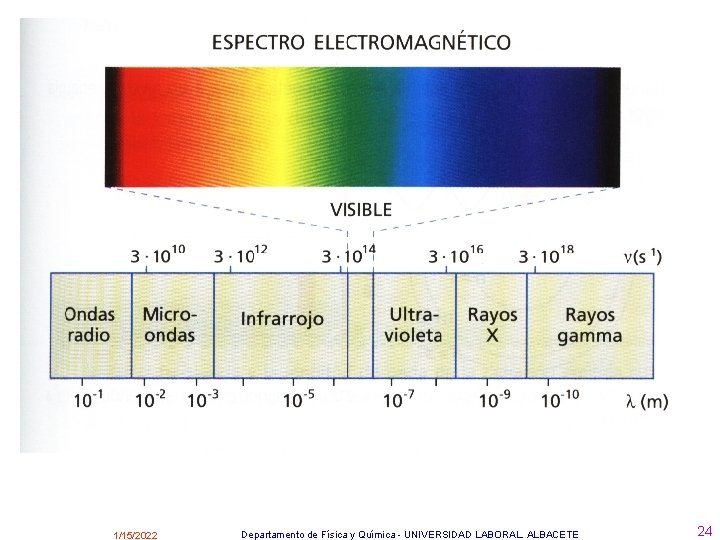
La longitud de onda y la frecuencia son inversamente proporcionales y se relacionan mediante la siguiente ecuación 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 20

En un medio homogéneo, la radiación se propaga a velocidad constante: distancia = v. t , = v. T Como T= 1/ por lo que: =c. T c = . siendo c la velocidad de propagación de la radiación electromagnética. en el vacío (aproximadamente igual en el aire): v = c = 300. 000 km/s en otro medio cualquiera v < c Las diferentes radiaciones electromagnéticas se diferencian por las anteriores magnitudes; en el caso de la longitud de onda su valor va desde cientos de metros a 10 -12 m. Según las longitudes de onda, las radiaciones tienen unas propiedades u otras, por eso se agrupan en zonas (visible, U. V. etc. ) y el conjunto de todas ellas recibe el nombre de espectro electromagnético. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 21

Esquema del funcionamiento del espectroscopio: El tubo "B" contiene la lente de observación y el tubo "A" está destinado al paso de la luz que se pretende analizar. El tubo "C" contiene una imagen fotográfica de una escala, hecha sobre una lámina de vidrio, de manera que la posición de cada raya espectral puede determinarse sobre esta escala. La imagen procedente del tubo "A" se refracta sobre el prisma "P" mientras que la imagen de la escala se refleja sobre una las caras del prisma, de modo que se pueden observar ambas imágenes a través del ocular situado en "B". 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 22

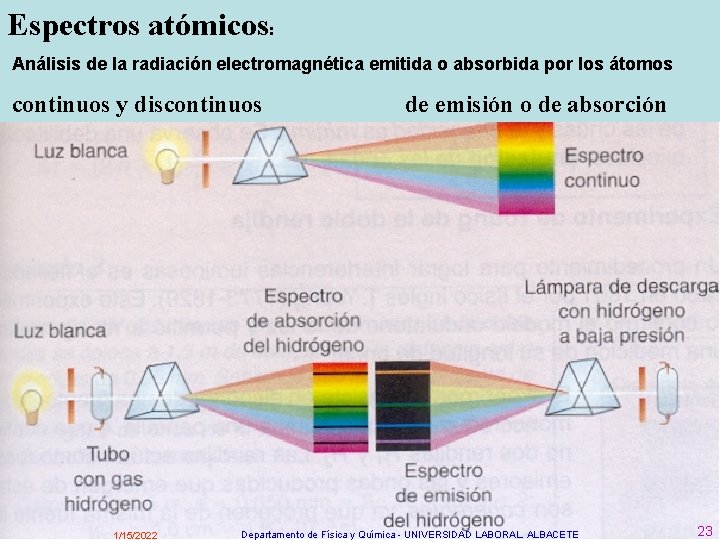
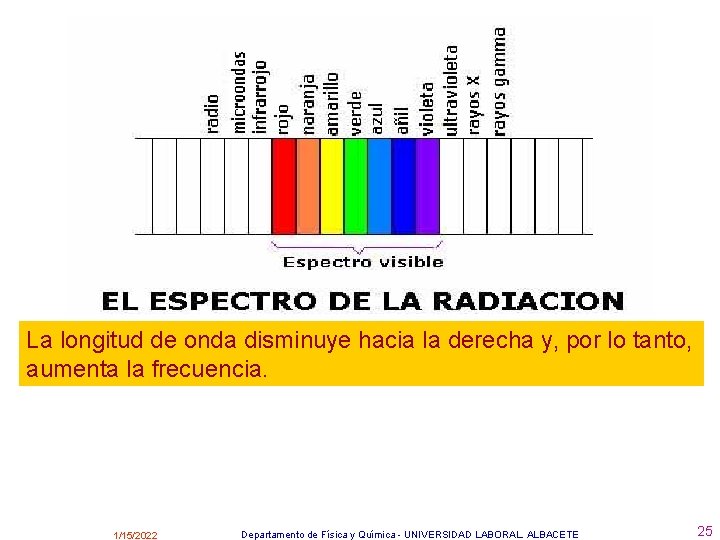
Espectros atómicos: Análisis de la radiación electromagnética emitida o absorbida por los átomos continuos y discontinuos 1/15/2022 de emisión o de absorción Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 23

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 24

La longitud de onda disminuye hacia la derecha y, por lo tanto, aumenta la frecuencia. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 25

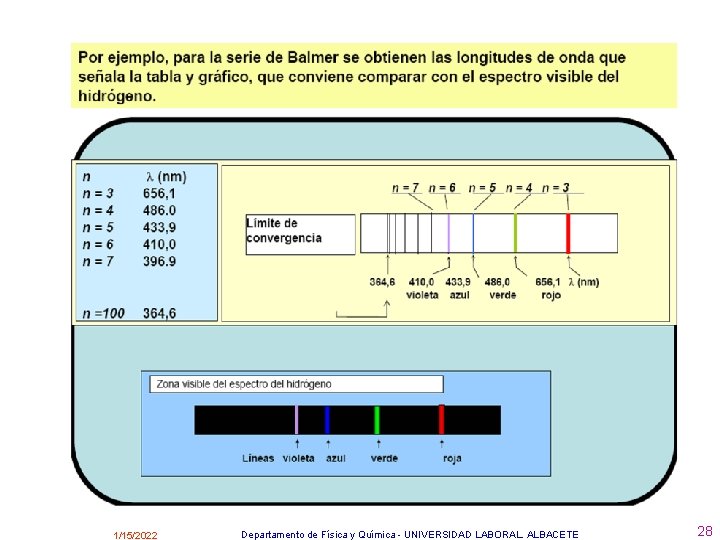
• El espectro mejor estudiado es el del Hidrógeno y en él se aprecian una serie de rayas, tanto en el visible como en el U. V. y en el I. R. , que guardan una determinada relación en su posición, constituyendo lo que se llama series espectrales. • Se conocen 5 series espectrales, en las que el número de ondas para cada raya se calcula por la fórmula encontrada empíricamente por Balmer • • siendo R = cte. de Rydberg = 1, 097. 107 m -1 n 1 y n 2 números enteros que cumplen: n 2 > n 1 http: //fisica-quimica. blogspot. com/2006/11/espectro-emisin-espectro-de-lneas. html 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 26

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 27

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 28

¿QUÉ EJERCICIOS PODEMOS HACER YA? ESPERA QUE MIRE APUNTA: DE LA PÁGINA 6 : EL 1 Y EL 2 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 29

1. 5. Modelo atómico de Bohr • La discontinuidad de los espectros atómicos no se puede justificar por el modelo de Rutherford, ya que, según éste, los electrones en su movimiento emitirían energía continuamente y podría ser de cualquier longitud de onda, dando lugar en consecuencia a un espectro continuo. • En 1913, Bohr emitió un nuevo modelo para tratar de explicarlos, tomando como referencia el modelo de Rutherford y basándose en la hipótesis cuántica de Planck 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 30

Teoría cuántica de Planck Los espectros atómicos no se podían explicar aplicando la teoría electromagnética de Maxwell. A finales del año 1900, el físico alemán Max PLANCK formuló una teoría revolucionaria para explicar los hechos experimentales: la teoría cuántica. Los cuerpos absorben o emiten energía no de forma continua sino en forma de paquetes o cuantos de energía cuanto E 0 =h. Energía Frecuencia de la radiación emitida La energía total absorbida o emitida por un cuerpo sólo puede tener un número entero n de porciones de energía E 0 E = n. E 0 = n. h. Energía cuantizada n es un número cuántico Contiene un número entero de cuantos 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 31

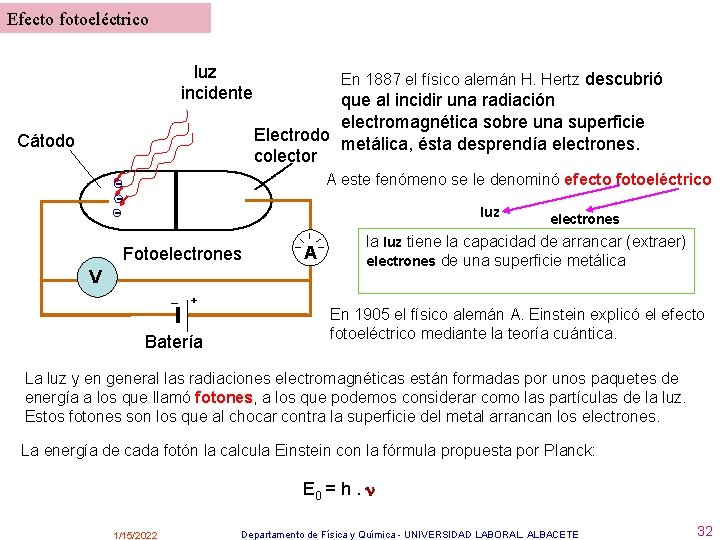
Efecto fotoeléctrico luz incidente Cátodo En 1887 el físico alemán H. Hertz descubrió que al incidir una radiación electromagnética sobre una superficie Electrodo metálica, ésta desprendía electrones. colector A este fenómeno se le denominó efecto fotoeléctrico - luz Fotoelectrones V – + Batería A electrones la luz tiene la capacidad de arrancar (extraer) electrones de una superficie metálica En 1905 el físico alemán A. Einstein explicó el efecto fotoeléctrico mediante la teoría cuántica. La luz y en general las radiaciones electromagnéticas están formadas por unos paquetes de energía a los que llamó fotones, a los que podemos considerar como las partículas de la luz. Estos fotones son los que al chocar contra la superficie del metal arrancan los electrones. La energía de cada fotón la calcula Einstein con la fórmula propuesta por Planck: E 0 = h. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 32

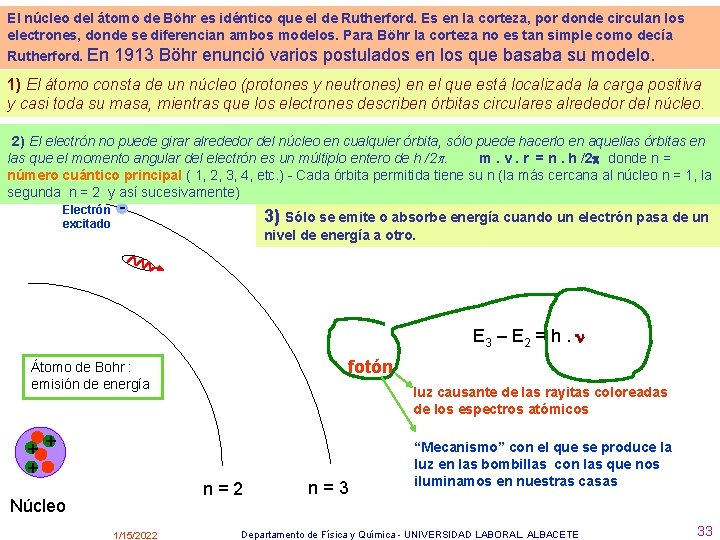
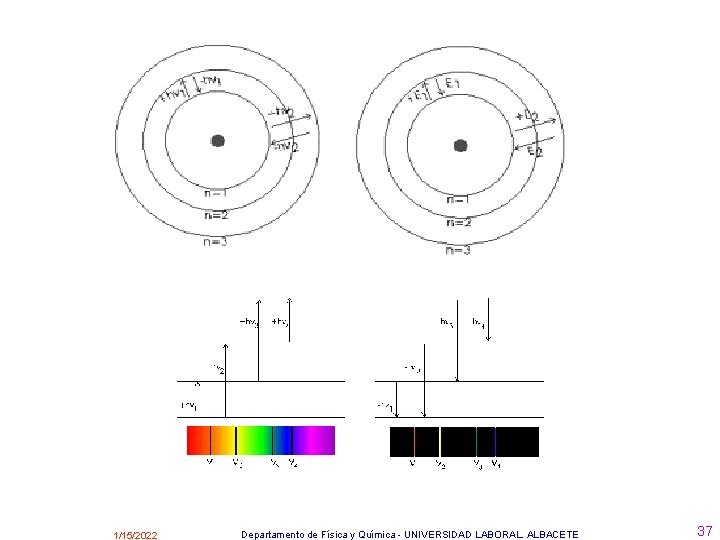
El núcleo del átomo de Böhr es idéntico que el de Rutherford. Es en la corteza, por donde circulan los electrones, donde se diferencian ambos modelos. Para Böhr la corteza no es tan simple como decía Rutherford. En 1913 Böhr enunció varios postulados en los que basaba su modelo. 1) El átomo consta de un núcleo (protones y neutrones) en el que está localizada la carga positiva y casi toda su masa, mientras que los electrones describen órbitas circulares alrededor del núcleo. 2) El electrón no puede girar alrededor del núcleo en cualquier órbita, sólo puede hacerlo en aquellas órbitas en las que el momento angular del electrón es un múltiplo entero de h /2. m. v. r = n. h /2 donde n = número cuántico principal ( 1, 2, 3, 4, etc. ) - Cada órbita permitida tiene su n (la más cercana al núcleo n = 1, la segunda n = 2 y así sucesivamente) Electrón excitado - 3) Sólo se emite o absorbe energía cuando un electrón pasa de un nivel de energía a otro. E 3 – E 2 = h. fotón Átomo de Bohr : emisión de energía luz causante de las rayitas coloreadas de los espectros atómicos + + + n=2 Núcleo 1/15/2022 n=3 “Mecanismo” con el que se produce la luz en las bombillas con las que nos iluminamos en nuestras casas Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 33

Consecuencias del modelo de Bohr: • • • De estos postulados se deduce que los radios de las órbitas y, por tanto, las energías de los electrones están cuantizados, es decir, no pueden adquirir cualquier valor, solo pueden tomar unos concretos. Para el átomo de H se ha obtenido: E = - k / n 2 Energía de la órbita r = n 2. a Radio de la órbita siendo n el número de la órbita , a = 0, 529 y k = 13, 6 e. V , constantes. Por tanto, los valores del radio y de la energía dependen del valor de n (solo valores enteros); al alejarnos del núcleo aumenta n y, en consecuencia, aumentan el radio y la energía de las órbitas. 1 e. V=1, 6. 10 -19 J 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 34

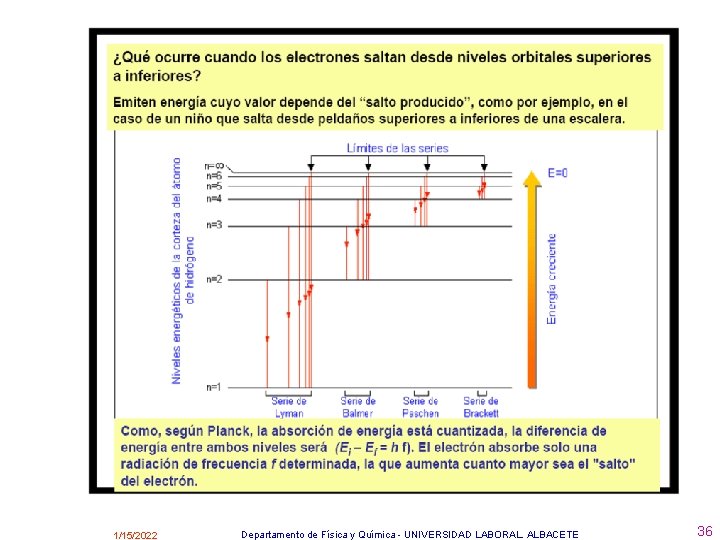
Como cada órbita tiene una determinada energía, también se suele decir que en el átomo hay una serie de capas o niveles de energía ( K, L, M, N, O, P, Q …). Los electrones en condiciones ordinarias de P y T, se encuentran en la capa o nivel más bajo permitido y entonces se dice que el átomo está en su estado fundamental, aunque, al darle energía al átomo, los electrones pueden pasar a otros niveles superiores y se dice que el átomo se encuentra en un estado excitado • - La serie de Lyman aparece cuando el electrón salta de una órbita superior a la primera. • - La serie de Balmer aparece cuando el electrón salta de una órbita superior a la segunda. • - La serie de Paschen aparece cuando el electrón salta de una órbita superior a la tercera. • - La serie de Brackett aparece cuando el electrón salta de una órbita superior a la cuarta. • - La serie de Pfund aparece cuando el electrón salta de una órbita superior a la quinta. • A partir de los postulados de Bhor se puede demostrar la ecuación general que permite calcular el número de ondas y la longitud de onda de las líneas espectrales. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 35

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 36

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 37

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 38

Tienes que hacer los siete primeros ejercicios de la página 18 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 39

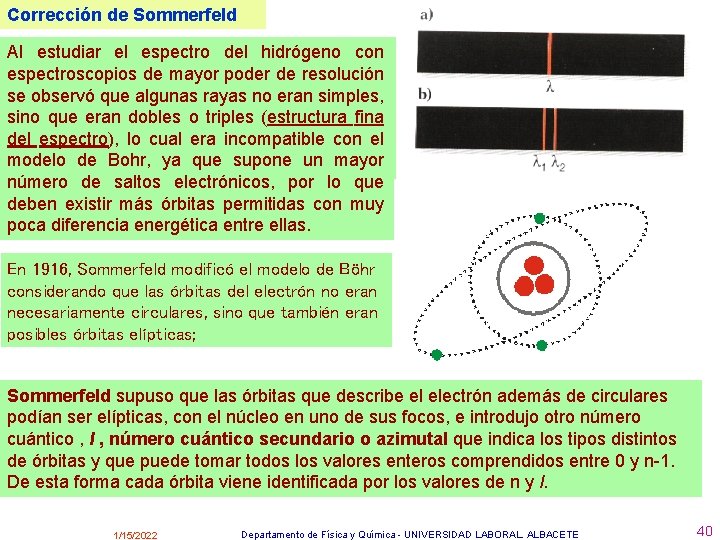
Corrección de Sommerfeld Al estudiar el espectro del hidrógeno con espectroscopios de mayor poder de resolución se observó que algunas rayas no eran simples, sino que eran dobles o triples (estructura fina del espectro), lo cual era incompatible con el modelo de Bohr, ya que supone un mayor número de saltos electrónicos, por lo que deben existir más órbitas permitidas con muy poca diferencia energética entre ellas. En 1916, Sommerfeld modificó el modelo de Böhr considerando que las órbitas del electrón no eran necesariamente circulares, sino que también eran posibles órbitas elípticas; Sommerfeld supuso que las órbitas que describe el electrón además de circulares podían ser elípticas, con el núcleo en uno de sus focos, e introdujo otro número cuántico , l , número cuántico secundario o azimutal que indica los tipos distintos de órbitas y que puede tomar todos los valores enteros comprendidos entre 0 y n-1. De esta forma cada órbita viene identificada por los valores de n y l. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 40

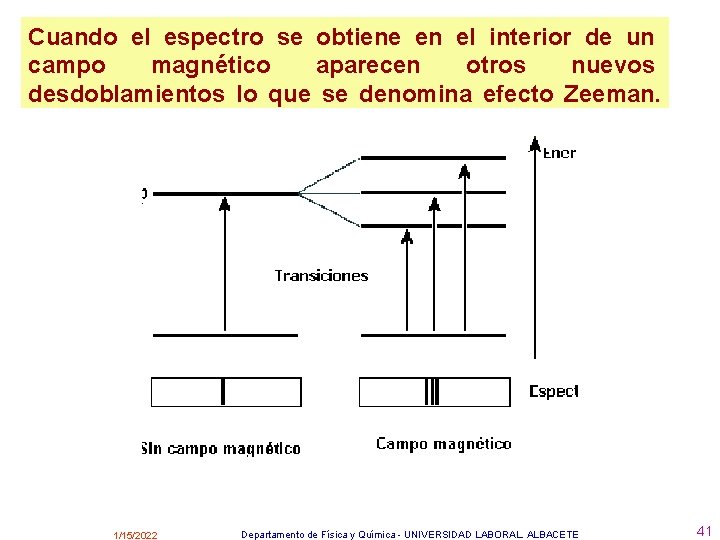
Cuando el espectro se obtiene en el interior de un campo magnético aparecen otros nuevos desdoblamientos lo que se denomina efecto Zeeman. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 41

• Eso es debido a las posibles orientaciones en el espacio que puede adoptar la órbita del electrón cuando éste es sometido a un campo magnético externo (efecto Zeemann). El efecto Zeemann se debe a que cualquier carga eléctrica en movimiento crea un campo magnético; por lo tanto, también el electrón lo crea, así que deberá sufrir la influencia de cualquier campo magnético externo que se le aplique. Introdujo otro número cuántico, m , número cuántico magnético, que indica las posibles orientaciones espaciales de las órbitas y que puede tomar los valores enteros comprendidos entre - l y + l incluido el 0. Por ejemplo, si el número cuántico secundario vale l = 2, los valores permitidos para m serán: -2, -1, 0, 1, 2. Significa que hay cinco órbitas posibles. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 42

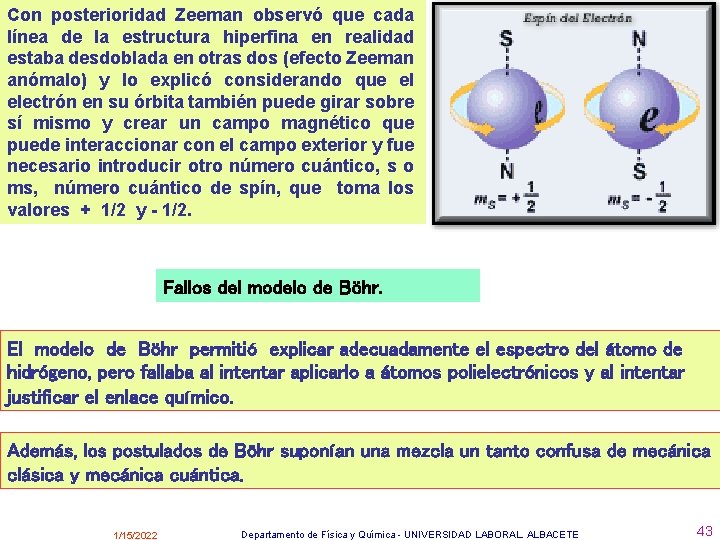
Con posterioridad Zeeman observó que cada línea de la estructura hiperfina en realidad estaba desdoblada en otras dos (efecto Zeeman anómalo) y lo explicó considerando que el electrón en su órbita también puede girar sobre sí mismo y crear un campo magnético que puede interaccionar con el campo exterior y fue necesario introducir otro número cuántico, s o ms, número cuántico de spín, que toma los valores + 1/2 y - 1/2. Fallos del modelo de Böhr. El modelo de Böhr permitió explicar adecuadamente el espectro del átomo de hidrógeno, pero fallaba al intentar aplicarlo a átomos polielectrónicos y al intentar justificar el enlace químico. Además, los postulados de Böhr suponían una mezcla un tanto confusa de mecánica clásica y mecánica cuántica. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 43

1. 6 Bases de la Mecánica Cuántica. Función de onda. Orbital. Hasta principios del siglo XX la comunidad científica consideraba el electrón como una partícula, y la radiación electromagnética como una onda. La radiación térmica del cuerpo negro, el efecto fotoeléctrico, los espectros atómicos y la explicación que de estos fenómenos se dio ( hipótesis de Planck, teoría cuántica de Einstein con la existencia de los fotones, los postulados de Bohr, …) no estaban de acuerdo con lo establecido hasta entonces por la comunidad científica. Esto llevó a los físicos de la época a desarrollar una nueva teoría, la mecánica cuántica Dos aspectos característicos de esta teoría son: ▪ La dualidad onda- partícula (Hipótesis de De Broglie) ▪ El principio de indeterminación de Heisemberg 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 44

• Dualidad corpúsculo-onda: hipótesis de Louis de Broglie. • Tradicionalmente, los electrones se han considerado como partículas, y por tanto un haz de electrones sería algo claramente distinto de una onda. Louis de Broglie propuso (1923) eliminar esta distinción: un haz de partículas y una onda son esencialmente el mismo fenómeno; simplemente, dependiendo del experimento que realicemos, observaremos un haz de partículas u observaremos una onda. Así, el electrón posee una longitud de onda (que es un parámetro totalmente característico de las ondas) que viene dada por: (El producto m · v se denomina momento lineal o cantidad de movimiento) Esta idea, que en un principio era una simple propuesta teórica, fue confirmada experimentalmente en 1927, cuando se consiguió que haces de electrones experimentasen un fenómeno muy característico de las ondas: la difracción de la onda al atravesar una rendija muy estrecha. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 45

¿QUÉ EJERCICIOS PODEMOS HACER YA? ESPERA QUE MIRE APUNTA: DE LA PÁGINA 10 EL 3 Y DE LA 18 EL 8 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 46

Principio de indeterminación de Heisenberg. • Este Principio supone un cambio básico en nuestra forma de estudiar la Naturaleza, ya que se pasa de un conocimiento teóricamente exacto (o al menos, que en teoría podría llegar a ser exacto con el tiempo) a un conocimiento basado sólo en probabilidades y en la imposibilidad teórica de superar nunca un cierto nivel de error. • Establece que es imposible conocer simultáneamente la posición y la velocidad del electrón, y por tanto es imposible determinar su trayectoria. Cuanto mayor sea la exactitud con que se conozca la posición, mayor será el error en la velocidad, y viceversa. Solamente es posible determinar la probabilidad de que el electrón se encuentre en una región determinada. • 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 47

MODELO ATÓMICO DE LA MECÁNICA CUÁNTICA ECUACIÓN DE SCHRÖDINGER. La naturaleza ondulatoria del electrón requiere un tratamiento matemático diferente al utilizado en el modelo de Bohr. Una onda queda determinada por lo que se llama FUNCIÓN DE ONDA. Esto es una función matemática más o menos compleja, según el tipo de movimiento ondulatorio estudiado. • En 1927, Erwin Schrödinger propuso una ecuación de la cual podía determinarse la función de onda correspondiente al electrón (llamada psi) en función de la energía total (E) y de la energía potencial (V) del electrón en el sistema atómico. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 48

• La función de ondas del electrón no tienen significado físico concreto, no indica ni la posición ni la velocidad del electrón. • Al resolver la ecuación diferencial, se obtiene que la función depende de una serie de parámetros, que se corresponden con los números cuánticos, tal y como se han definido en el modelo de Böhr- Sommerfeld. La ecuación sólo se cumplirá cuando esos parámetros tomen determinados valores permitidos (los mismos valores que se han indicado antes para el modelo de Böhr). • Sin embargo el cuadrado de la función de ondas, 2, corresponde a la probabilidad de encontrar al electrón en una región determinada, con lo cual se está introduciendo en el modelo el Principio de Heisenberg. Por ello, en este modelo aparece el concepto de orbital: región del espacio en la que hay una máxima probabilidad de encontrar al electrón. (No debe confundirse el concepto de orbital con el de órbita, que corresponde al modelo de Böhr: una órbita es una trayectoria perfectamente definida que sigue el electrón, y por tanto es un concepto muy alejado de la mecánica probabilística. ) • Cada solución de 2 se llama orbital atómico y se define como la región del espacio donde la probabilidad de encontrar el electrón es máxima, superior al 99 %. • http: //cdpdp. blogspot. com/2008/04/el-modelo-atmico-actual. html 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 49

2. Números • Cada orbital viene definido por los valores de tres números cuánticos n , l , m , existiendo tantos orbitales como combinaciones se puedan formar con ellos. cuántico. Tipos • Cada electrón viene definido, además de los tres números cuánticos del orbital correspondiente, por un cuarto número cuántico s o m. de orbitales. s • n, número cuántico principal: indica el volumen, el tamaño del orbital. A mayor n mayor volumen. Puede tomar los valores enteros del uno al . n = 1 , 2 , 3 , . . . . • l, número cuántico secundario, orbital o azimutal: indica la forma, el tipo de orbital. Puede tomar los valores enteros desde 0 hasta ( n - 1 ). l = 0 , 1 , 2 , . . . ( n - 1 ) m, número cuántico magnético: indica la orientación espacial del orbital. Puede tomar los valores enteros comprendidos entre - 1 y + l, incluido el cero. m = - l , . . , 0, . . . , + l s o ms número cuántico de spín o spín: representa las posibles orientaciones, sentido de giro, del electrón respecto a un eje tomado como referencia. Tan sólo puede tomar valores + 1/2 y - 1/2. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 50

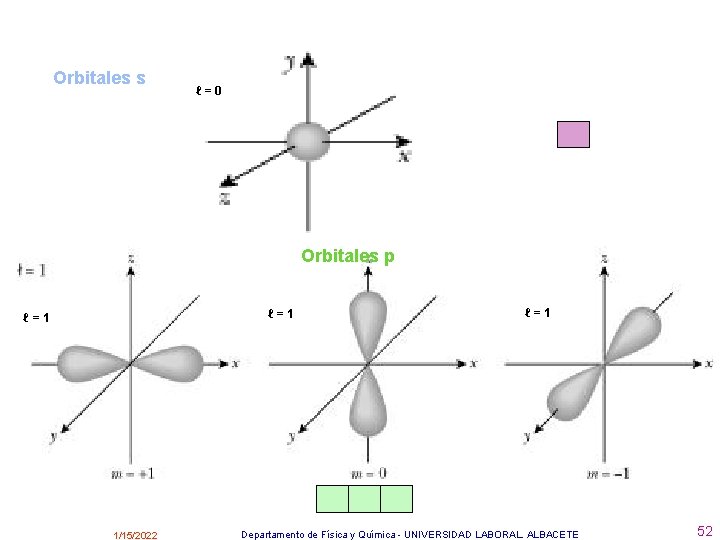
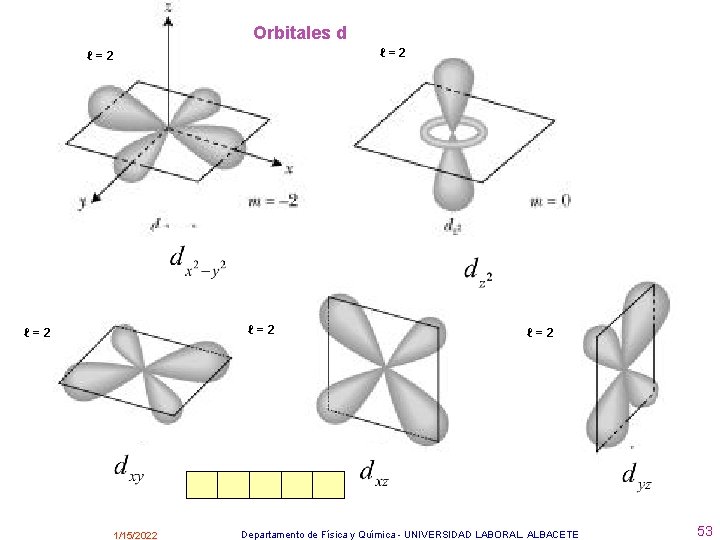
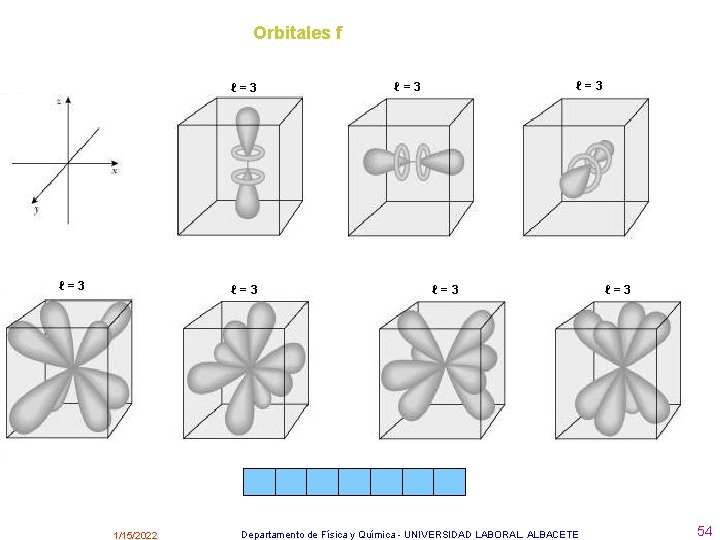
Los orbitales se representan mediante superficies imaginarias dentro de las cuales la probabilidad de encontrar el electrón con una determinada energía es muy grande. Hay distintos tipos de orbitales: Si l=0 se llaman orbitales s y hay 1 en cada nivel. Si l=1 se llaman orbitales p y hay 3 en cada nivel. Si l=2 se llaman orbitales d y hay 5 en cada nivel. Si l=3 se llaman orbitales f y hay 7 en cada nivel. • http: //www. deciencias. net/proyectos/4 particulares/quimica/atomo/modeloactual. htm 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 51

Orbitales s ℓ=0 Orbitales p ℓ=1 1/15/2022 ℓ=1 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 52

Orbitales d ℓ=2 ℓ=2 1/15/2022 ℓ=2 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 53

Orbitales f ℓ=3 ℓ=3 1/15/2022 ℓ=3 ℓ=3 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE ℓ=3 54

¿QUÉ EJERCICIOS PODEMOS HACER YA? ESPERA QUE MIRE APUNTA: DE LA PÁGINA 13 EL 4 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 55

3. - Principios de distribución electrónica. Configuración electrónica. Los electrones se colocan alrededor del núcleo ocupando los diferentes niveles y orbitales. Para saber cómo se ordenan en la corteza hay que tener en cuenta las siguientes reglas: • Principio de mínima energía o de Aufbau: • “ Los electrones ocupan en primer lugar los orbitales de menor energía que están disponibles”. • Además de la otra incógnita de la ecuación de Schrödinger es E, la energía total del electrón. Su valos depende los valores de los números cuánticos n y l. • • El orden de energía de los orbitales se puede deducir de forma cualitativa: a) por la regla del n + l: • • • “A mayor n + l mayor energía, y cuando la suma vale lo mismo, tiene más energía el de mayor n”. Ejemplos: Los tres orbitales p de igual n tienen la misma energía. Se llaman orbitales degenerados. De los orbitales 4 s y 3 p (que tienen igual valor la suma n+l, tiene más energía el 4 s, pues tiene mayor n. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 56

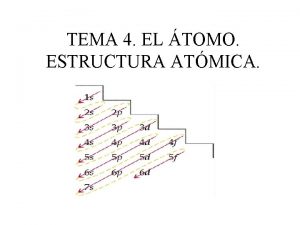
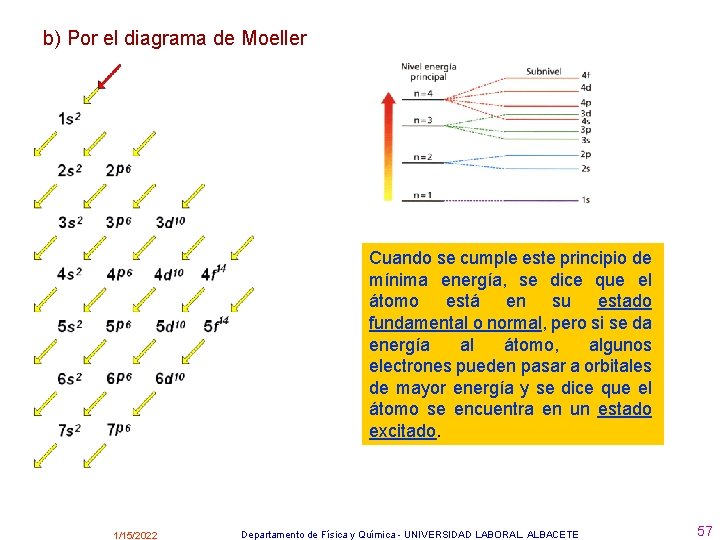
b) Por el diagrama de Moeller Cuando se cumple este principio de mínima energía, se dice que el átomo está en su estado fundamental o normal, pero si se da energía al átomo, algunos electrones pueden pasar a orbitales de mayor energía y se dice que el átomo se encuentra en un estado excitado. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 57

Principio de exclusión de Pauli: • “En un átomo no puede haber dos electrones con los cuatro números cuánticos iguales”. De este principio se deduce: 1º. En un orbital sólo caben dos electrones y deben tener spines opuestos o antiparalelos, ya que tienen iguales los números n , l y m, pero se diferencian en el spín, que solo puede valer + 1/2 o -1/2. 2º. En un nivel energético caben 2 n 2 electrones. Los orbitales se representan abreviadamente con un círculo o un cuadrado y los electrones con flechas en las que el sentido indica el spín: Dos electrones en un orbital s con espines contrarios. 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 58

Principio de máxima multiplicidad de Hund: • “ Si en un subnivel hay disponibles varios orbitales (tienen la misma energía, ej: los tres orbitales p, los cinco d, etc. ), los electrones tienden a ocupar el mayor número de ellos y, además, se colocan con spines iguales, paralelos, es decir, los electrones están desapareados”. • Ejemplo: el átomo de N tiene 7 electrones y se distribuyen así: • 1 s 1/15/2022 2 s 2 p Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 59

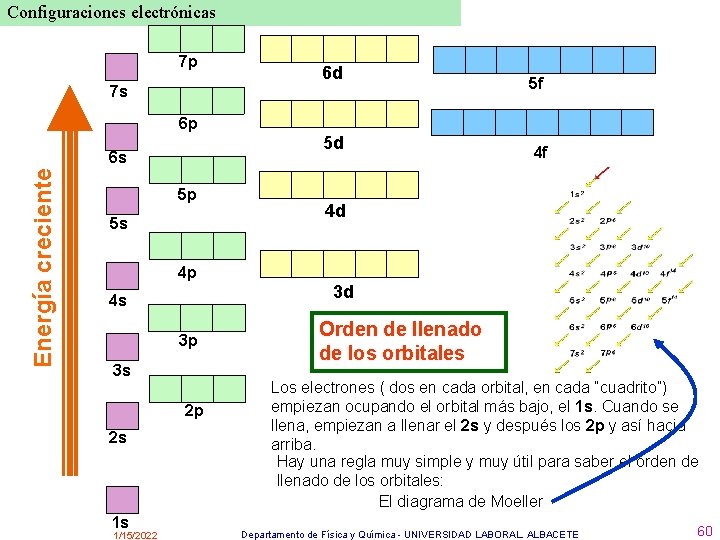
Configuraciones electrónicas 7 p 7 s 6 p Energía creciente 6 s 5 p 5 s 6 d 5 d 5 f 4 f 4 d 4 p 3 d 4 s 3 p 3 s 2 p 2 s 1 s 1/15/2022 Orden de llenado de los orbitales Los electrones ( dos en cada orbital, en cada “cuadrito”) empiezan ocupando el orbital más bajo, el 1 s. Cuando se llena, empiezan a llenar el 2 s y después los 2 p y así hacia arriba. Hay una regla muy simple y muy útil para saber el orden de llenado de los orbitales: El diagrama de Moeller Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 60

Podemos escribir la configuración electrónica de cualquier elemento conociendo su número atómico y aplicando el diagrama de Moeller: Empieza aquí Sigue el camino que indican las flechas amarillas H (Z=1) 1 s 1 He ( Z = 2 ) 1 s 2 Li ( Z = 3 ) 1 s 2 2 s 1 Be ( Z = 4 ) 1 s 2 2 s 2 B (Z=5) 1 s 2 2 p 1 1 s 2 2 s 2 p 1 C (Z=6) 1 s 2 2 p 2 1 s 2 2 s 2 p 2 Ne ( Z = 10 ) 1 s 2 2 p 6 1 s 2 2 s 2 p 6 Cl ( Z = 17 ) 1 s 2 1/15/2022 2 s 2 2 p 6 3 s 2 3 p 5 1 s 2 2 s 2 p 6 3 s 2 p 5 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 61

PARAMAGNETISMO Y DIAMAGNETISMO. • Decimos que una sustancia es paramagnética cuando es atraída débilmente por un imán. Por el contrario, una sustancia diamagnética es aquella que no es atraída por un imán (incluso es ligeramente repelida). • • ¿A qué es debido este comportamiento en los átomos aislados? . La razón hay que buscarla en la existencia o no de electrones desapareados, ya que si: A) Existen electrones desapareados, por tanto, con espines paralelos (regla de Hund), los campos magnéticos creados por cada electrón se refuerzan. El resultado es un campo magnético neto que interacciona con el campo magnético creado por el imán. Estamos ante una especie paramagnética, por ejemplo, el C y el N: • [C] = 1 s 2 2 p 2 • Por el contrario, si los electrones se encuentran apareados, esto es, con espines antiparalelos (u opuestos), los efectos magnéticos se contrarrestan, por lo que no existe interacción favorable con el campo magnético del imán. Nos encontramos ante una especie diamagnética, como el Be y el Ne: • [Be] = 1 s 2 2 s 2 1/15/2022 [N] = 1 s 2 2 p 3 [Ne] = 1 s 2 2 p 6 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 62

¿QUÉ EJERCICIOS PODEMOS HACER YA? ESPERA QUE MIRE APUNTA: DE LA PÁGINA 18 EL 9 Y EL 10 Y DE LA 19 EL 11, 12, Y 13 1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 63

1/15/2022 Departamento de Física y Química - UNIVERSIDAD LABORAL. ALBACETE 64
 Huila clima
Huila clima Partes del tomo
Partes del tomo Organización del departamento de enfermería
Organización del departamento de enfermería Organigrama
Organigrama Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Cuál es la potencialidad de cochabamba
Cuál es la potencialidad de cochabamba Universidad ixil
Universidad ixil Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Subtema
Subtema Tipos de entrevista psicológica
Tipos de entrevista psicológica Aliran seni lukis tertua di dunia adalah
Aliran seni lukis tertua di dunia adalah Delimitacion del tema ejemplo
Delimitacion del tema ejemplo Codigo nacional de electricidad utilizacion
Codigo nacional de electricidad utilizacion Tomo fix
Tomo fix Mientras cenaban jesus tomo el pan y pronuncio
Mientras cenaban jesus tomo el pan y pronuncio Asumo riesgos y tomo la iniciativa
Asumo riesgos y tomo la iniciativa Tomo goto
Tomo goto Tömő utca onkológia
Tömő utca onkológia Hologic's low dose 3d mammography
Hologic's low dose 3d mammography Esde tomo 2
Esde tomo 2 Mensajes selectos tomo 1 pdf
Mensajes selectos tomo 1 pdf Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni Tomo cerovšek
Tomo cerovšek Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni Tomo mano romanas veimare
Tomo mano romanas veimare Penjelasan pertempuran medan area
Penjelasan pertempuran medan area Stanka hrastelj
Stanka hrastelj Ajla tomo
Ajla tomo Nivel subestándar de la lengua
Nivel subestándar de la lengua Tomo el jugo en un a. cuchillo b. vaso c. plato
Tomo el jugo en un a. cuchillo b. vaso c. plato Estructura del atomo
Estructura del atomo Tomi keber
Tomi keber 1 tomo
1 tomo Ves
Ves Leo primero tomo 1 primero basico
Leo primero tomo 1 primero basico Zootecnia ufpr
Zootecnia ufpr Estructura de una agencia publicitaria
Estructura de una agencia publicitaria Departamento solicitante
Departamento solicitante Departamento de marketing organigrama
Departamento de marketing organigrama Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad Departamento forestal
Departamento forestal Departamento de higiene de los alimentos
Departamento de higiene de los alimentos La señora guajardo compra un departamento
La señora guajardo compra un departamento Departamento de farmacologia
Departamento de farmacologia Departamentos en una empresa
Departamentos en una empresa Projeto doutorado
Projeto doutorado Modelo entidad relacion atributo multivaluado
Modelo entidad relacion atributo multivaluado Departamento de economia
Departamento de economia Preparatoria abierta gratuita
Preparatoria abierta gratuita Ies suel naturales
Ies suel naturales Departamento ceres
Departamento ceres Departamento ceres
Departamento ceres El significado de departamento
El significado de departamento Tema el cantar del mio cid
Tema el cantar del mio cid Romances del rey rodrigo
Romances del rey rodrigo Solo chi vuole s'infinita significato
Solo chi vuole s'infinita significato Tema del diverso
Tema del diverso Il tema del diverso in letteratura
Il tema del diverso in letteratura Sintesis del evangelio de mateo
Sintesis del evangelio de mateo Destinatario de san marcos
Destinatario de san marcos Tema del mensaje
Tema del mensaje Objetivo de un tema
Objetivo de un tema Caratteristiche di un testo argomentativo
Caratteristiche di un testo argomentativo Los dos reyes y los dos laberintos autor
Los dos reyes y los dos laberintos autor Resumen de aparecida
Resumen de aparecida