El tomo Estructura electrnica del tomo 2 1



























- Slides: 31

* El átomo Estructura electrónica del átomo

* 2. 1 El átomo 2. 1. 1 Concepto 2. 1. 2 Modelos atómicos 2. 1. 3 Función de los átomos en los cambios físicos, químicos y nucleares 2. 1. 4 Isótopos 2. 1. 5 Iones 2. 2 Estructura electrónica del átomo 2. 2. 1 2. 2. 2. 3 2. 2. 4 Fundamentos de la teoría cuántica ondulatoria Principios de la teoría cuántica Números cuánticos Configuración electrónica Regla de Auf-Bav Regla de Hund Electrón diferencial Gloria Angélica Fuentes Zenteno 2 01/11/2020

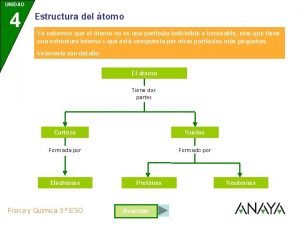
* Concepto según Dalton: De 1850 -siglo XX Se define como la unidad básica de un elemento que puede intervenir en una combinación química. Tiene estructura interna con partículas subatómicas: Protones, Neutrones y Electrones. Extremadamente pequeña e indivisible La masa del núcleo constituye la mayor parte de la masa total. El núcleo ocupa sólo 1/10^13 del volumen total del átomo. Gloria Angélica Fuentes Zenteno 3 01/11/2020

*Descubierto a través *Localizados en el del tubo de rayos catódicos *Partículas con carga negativa *Thompson relacionó la carga eléctrica y la masa: -1. 76 x 10^8 C/g *Millikan encontró la carga de un electrón: 1. 6022 x 10^-19 C. *La masa es 9. 10 x 10^-28 g Gloria Angélica Fuentes Zenteno núcleo del átomo *Poseen carga positiva *Tienen la misma carga que los electrones *Su masa es de 1. 67262 X 10^-24 g, *Aproximadamente 1840 veces la masa del electrón 4 01/11/2020

* *Rutherford propuso la *Partículas existencia de otra partícula subatómica en el núcleo eléctricamente neutras *Masa ligeramente mayor que la de los protones *James Chadwick lo probó en 1932 y los llamo: neutrones Gloria Angélica Fuentes Zenteno *Masa: 1. 67493 x 10^-24 g *Cero carga eléctrica 5 01/11/2020

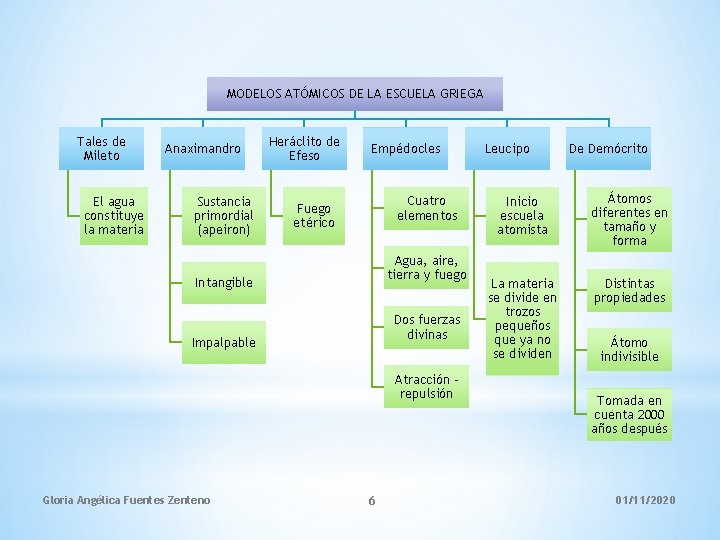
MODELOS ATÓMICOS DE LA ESCUELA GRIEGA Tales de Mileto El agua constituye la materia Anaximandro Sustancia primordial (apeiron) Heráclito de Efeso Empédocles Cuatro elementos Fuego etérico Agua, aire, tierra y fuego Intangible Dos fuerzas divinas Impalpable Atracción repulsión Gloria Angélica Fuentes Zenteno 6 Leucipo De Demócrito Inicio escuela atomista Átomos diferentes en tamaño y forma La materia se divide en trozos pequeños que ya no se dividen Distintas propiedades Átomo indivisible Tomada en cuenta 2000 años después 01/11/2020

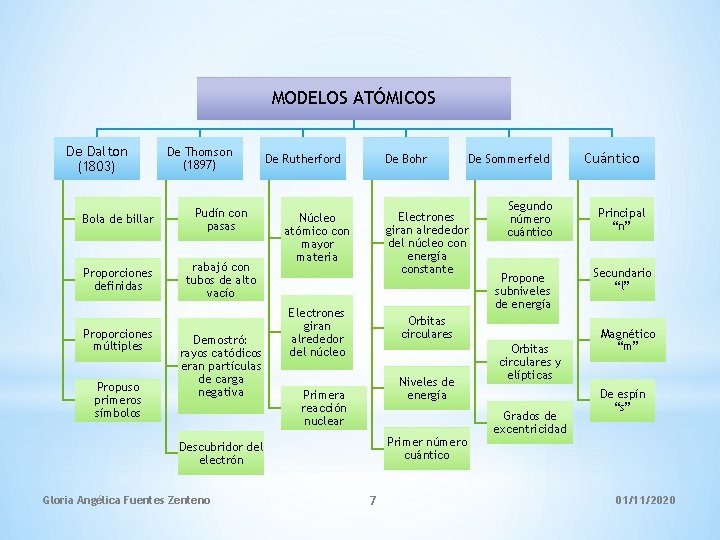
MODELOS ATÓMICOS De Dalton (1803) De Thomson (1897) Bola de billar Pudín con pasas Proporciones definidas rabajó con tubos de alto vacío Proporciones múltiples Propuso primeros símbolos Demostró: rayos catódicos eran partículas de carga negativa De Rutherford De Bohr Electrones giran alrededor del núcleo con energía constante Núcleo atómico con mayor materia Electrones giran alrededor del núcleo Segundo número cuántico Propone subniveles de energía Orbitas circulares Niveles de energía Primera reacción nuclear Primer número cuántico Descubridor del electrón Gloria Angélica Fuentes Zenteno De Sommerfeld 7 Orbitas circulares y elípticas Grados de excentricidad Cuántico Principal “n” Secundario “l” Magnético “m” De espín “s” 01/11/2020

* Químicos: *Dos o más sustancias (reactantes) se transforman en otras (productos) *Cambia la composición y propiedades *Cambio de color, de temperatura *Formación de gases o de precipitados Físicos: *Varía la apariencia física *No cambia la composición ni la estructura *Sólo cambia el tamaño, forma, posición o estado de agregación Gloria Angélica Fuentes Zenteno 8 01/11/2020

LOS ÁTOMOS Y LOS CAMBIOS NUCLEARES: Fusión nuclear: *Implican la *Dos núcleos atómicos se *Implican una gran Fisión nuclear: *Por fusión o fisión *Proceso nuclear *El núcleo se divide en transformación de los átomos unen para formar uno de mayor peso cantidad de energía dos o más núcleos pequeños Gloria Angélica Fuentes Zenteno 9 01/11/2020

* * Gloria Angélica Fuentes Zenteno 10 01/11/2020

* Gloria Angélica Fuentes Zenteno 11 01/11/2020

* Indica el número de protones , neutrones y electrones para cada uno de los siguientes elementos: Elemento Gloria Angélica Fuentes Zenteno Protones Neutrones Electrones 8 17 - 8 = 9 8 80 199 – 80 = 119 80 80 200 – 80 = 120 80 29 63 – 29 = 34 29 12 01/11/2020

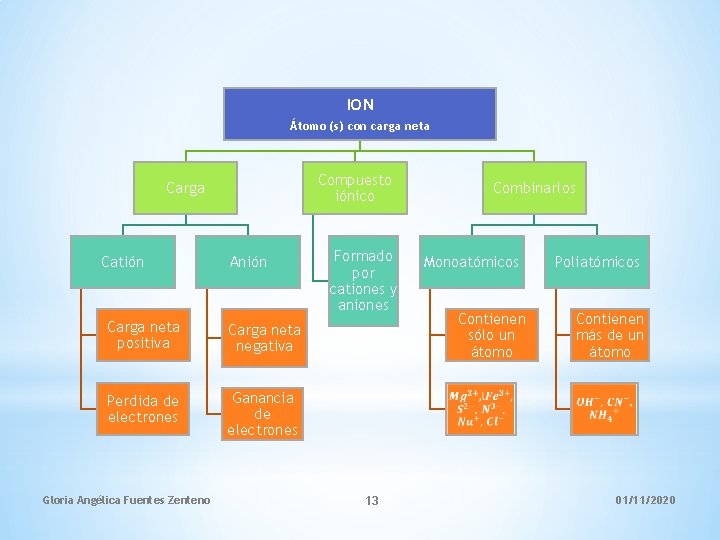
ION Átomo (s) con carga neta Compuesto iónico Carga Catión Anión Carga neta positiva Carga neta negativa Perdida de electrones Ganancia de electrones Gloria Angélica Fuentes Zenteno Formado por cationes y aniones Combinarlos Monoatómicos Contienen sólo un átomo 13 Poliatómicos Contienen más de un átomo 01/11/2020

* Gloria Angélica Fuentes Zenteno 14 01/11/2020

* En el siglo XIX los intentos para comprender el comportamiento de los átomos y de las moléculas no fue exitoso del todo. La física clásica asumía que los átomos y las moléculas emitían o absorbían cualquier cantidad de energía radiante. Planck (1900) proponía que los átomos y las moléculas emitían o absorbían energía sólo en cantidades discretas como pequeños paquetes o cúmulos. Cuanto es la mínima cantidad de energía (E=hv) que se puede emitir o absorber en forma de radiaciones electromagnéticas. H: constante de Planck , v es la frecuencia de radiación Gloria Angélica Fuentes Zenteno 15 01/11/2020

En 1905 Albert Einstein utilizó la teoría cuántica de Planck para resolver el misterio del efecto fotoeléctrico. Efecto fotoeléctrico es un fenómeno en el que los electrones son expulsados desde la superficie de ciertos metales que se han expuesto a la luz de al menos determinada frecuencia mínima, y que se conoce como frecuencia de umbral. El número de electrones liberados era proporcional a la intensidad (brillantes) de la luz. Los electrones no se liberaban cuando la frecuencia no llegaba al umbral. Einstein dedujo que cada una de las partículas de luz (fotones) debe poseer una energía E (E=hv). la luz posee propiedades tanto de partícula como de onda. Gloria Angélica Fuentes Zenteno 16 01/11/2020

Las investigaciones de Einstein prepararon el camino para resolver otro “misterio” de la física del siglo XIX: los espectros de emisión de los átomos (espectros continuos o de líneas de radiación emitida por las sustancias). Cada elemento tiene un espectro de emisión único. Las líneas características de un espectro atómico se emplean en el análisis químico para identificar átomos desconocidos, de la misma forma en que las huellas digitales sirven para identificar a una persona. En 1913 Niels Bohr dio a conocer una explicación teórica del espectro de emisión del átomo de hidrógeno. * Gloria Angélica Fuentes Zenteno 17 01/11/2020

*Los electrones se movían en orbitas circulares *Cada orbita tiene una energía particular (cuantizada) *Demostró que las energías que tiene el electrón en el átomo de hidrógeno están dadas por: * = constante de Rydberg = * n = número cuántico principal * - indica que la energía del electrón del átomo es menor que la energía del electrón libre (0) *Cuando n=1, estado energético más estable (estado fundamental o nivel basal), estado de energía más bajo. * Gloria Angélica Fuentes Zenteno 18 01/11/2020

En 1924 Louis de Broglie dio respuesta al por qué las energías del electrón de hidrógeno eran cuantizadas. De Broglie razonó que si las ondas luminosas se comportan como una corriente de partículas (fotones), quizá las partículas como los electrones tuvieran propiedades ondulatorias. Un electrón enlazado al núcleo se comporta como una onda estacionaria. Cuanto mayor sea la frecuencia de vibración, menor la longitud de la onda estacionaria y mayor el número de nodos. Como la energía del electrón depende del tamaño de la orbita se debe de cuantizar. * Gloria Angélica Fuentes Zenteno 19 01/11/2020

Clinton Davisson, Lester Germer y G. P. Thompson demostraron que los electrones poseen propiedades ondulatorias. Werner Heisenberg formuló la teoría principio de incertidumbre de Heisenberg: es imposible conocer con certeza el momento p (definido como la masa por la velocidad) y la posición de una partícula simultáneamente. En 1926 Erwin Schrödinger formuló una ecuación que describe el comportamiento y la energía de las partículas subatómicas en general; incorpora el comportamiento de partícula (masa), como el de onda (función de onda) que depende de la ubicación del sistema en el espacio. * Gloria Angélica Fuentes Zenteno 20 01/11/2020

Con la ecuación de Schrödinger comenzó una nueva era en la física y la química, ya que dio inicio un nuevo campo, la mecánica cuántica (mecánica ondulatoria). de 1913 a 1926 se le conoce como “vieja teoría cuántica” La ecuación de Schrödinger especifica los posibles estados de energías que puede ocupar el electrón del átomo de hidrógeno e identifica las respectivas funciones de onda. Los estados de energía y sus funciones de onda se caracterizan por un conjunto de números cuánticos. * Gloria Angélica Fuentes Zenteno 21 01/11/2020

Para describir la distribución de los electrones en el hidrógeno y otros átomos, la mecánica cuántica precisa de tres números cuánticos (derivados de la ecuación de Schrödinger): *Número cuántico principal *Número cuántico del momento angular *Número cuántico magnético *Número cuántico de espín * Gloria Angélica Fuentes Zenteno 22 01/11/2020

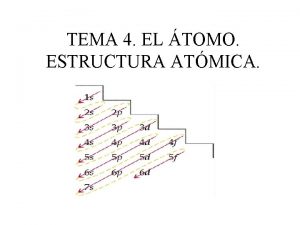
*El número cuántico principal (n) puede tomar valores enteros de 1, 2, 3, … etc. *Define la energía de un orbital *Se relaciona con la distancia promedio del electrón al núcleo en determinado orbital *Cuanto mayor es el valor de n, mayor es la distancia entre un electrón en el orbital respecto del núcleo y en consecuencia el orbital es más grande. * Gloria Angélica Fuentes Zenteno 23 01/11/2020

* Expresa la forma de los orbitales * Los valores de l dependen del valor del número cuántico principal, n. * L tiene los valores posibles de 0 hasta n-1 * El valor de l se designa con las letras s, p, d, f, g, h, …… l 0 1 2 3 4 5 Nombre del orbital s p d f g h La secuencia especial de letras s, p, y d tiene origen histórico: * Líneas finas (sharp) s * Líneas difusas d * Líneas intensas o principales p * Gloria Angélica Fuentes Zenteno 24 01/11/2020

*Describe la orientación del orbital en el espacio *Depende del valor que tenga el número cuántico del momento angular *Para cierto valor de l existen (2 l+1) valores enteros de m *El número de valores que tenga m indica el número de orbitales presentes en un subnivel * Gloria Angélica Fuentes Zenteno 25 01/11/2020

*Define el giro del electrón * En sentido de las manecillas del reloj * En sentido contrario a las manecillas del reloj *Toma valores de +1/2 o -1/2 *El movimiento del espín es aleatorio *Los electrones presentes en el átomo: * La mitad gira en una dirección y se desvían en un sentido * La otra mitad gira en sentido opuesto y se desvían en sentido opuesto * Gloria Angélica Fuentes Zenteno 26 01/11/2020

*Es la manera en que están distribuidos los electrones entre los distintos orbitales atómicos *También es posible representarla por medio de un diagrama de orbital que muestra el espín del electrón *Se puede determinar a partir del Principio de Exclusión de Pauli * Gloria Angélica Fuentes Zenteno 27 01/11/2020

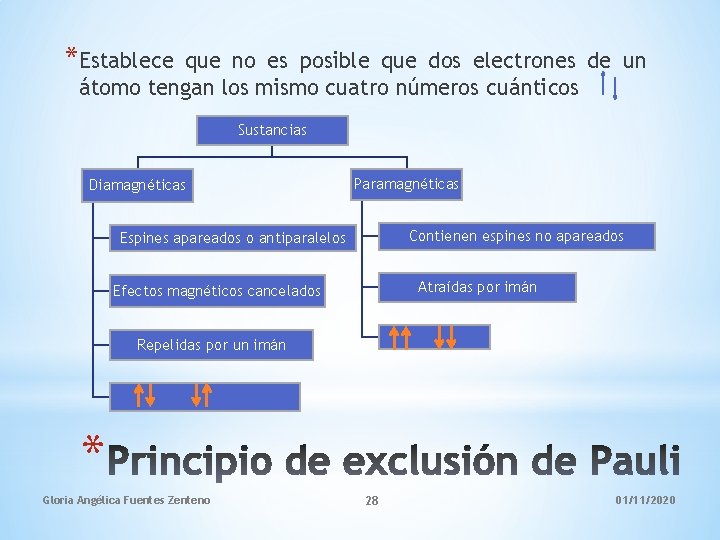
*Establece que no es posible que dos electrones de un átomo tengan los mismo cuatro números cuánticos Sustancias Diamagnéticas Paramagnéticas Contienen espines no apareados Espines apareados o antiparalelos Atraídas por imán Efectos magnéticos cancelados Repelidas por un imán * Gloria Angélica Fuentes Zenteno 28 01/11/2020

Establece que la distribución electrónica más estable en los subniveles es la que tiene el mayor número de espines paralelos Ejemplo: *Configuración electrónica del carbono (Z=6) 1 s 2 s 2 p 2 p Configuración electrónica del nitrógeno (Z=7) 1 s 2 s 2 p 2 p 2 p * Gloria Angélica Fuentes Zenteno 29 01/11/2020

*Establece que cuando los protones se incorporan al núcleo de uno en uno para construir los elementos, los electrones se suman de la misma forma a los orbitales atómicos. * Gloria Angélica Fuentes Zenteno 30 01/11/2020

Gloria Angélica Fuentes Zenteno 31 01/11/2020
 Partes del tomo
Partes del tomo Codigo nacional de electricidad tomo v
Codigo nacional de electricidad tomo v Tomo fix
Tomo fix Mientras cenaban jesus tomo
Mientras cenaban jesus tomo Asumo riesgos y tomo la iniciativa
Asumo riesgos y tomo la iniciativa Tomo goto
Tomo goto Tömő utca onkológia
Tömő utca onkológia Standard screening tomohd
Standard screening tomohd Esde tomo 2
Esde tomo 2 Cercano esta jehova a los quebrantados de corazon
Cercano esta jehova a los quebrantados de corazon Principi di chimica moderna tomo b soluzioni
Principi di chimica moderna tomo b soluzioni Tomo cerovšek
Tomo cerovšek Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni Tomo mano romanas veimare
Tomo mano romanas veimare Perjuangan bung tomo
Perjuangan bung tomo Stanka hrastelj
Stanka hrastelj Ajla tomo
Ajla tomo Lenguaje estandar subestandar y superestandar
Lenguaje estandar subestandar y superestandar Tomo el jugo en un a. cuchillo b. vaso c. plato
Tomo el jugo en un a. cuchillo b. vaso c. plato Estructura del atomo
Estructura del atomo Tomi keber
Tomi keber 1 tomo
1 tomo Mensajes selectos tomo 1
Mensajes selectos tomo 1 Leo primero tomo 1 primero basico
Leo primero tomo 1 primero basico Romance de don rodrigo y la pérdida de españa
Romance de don rodrigo y la pérdida de españa Clasificación de la vitamina d
Clasificación de la vitamina d Estructura programatica
Estructura programatica Future perfect simple estructura
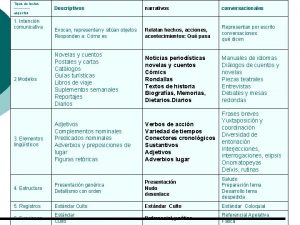
Future perfect simple estructura Estructura del texto conversacional
Estructura del texto conversacional Estructura del sintagma adjetival
Estructura del sintagma adjetival Poder present progressive
Poder present progressive Estructura del suelo en bloques
Estructura del suelo en bloques