SECRETARIA DE ESTADO DE SAUDE DO DISTRITO FEDERAL















































- Slides: 49

SECRETARIA DE ESTADO DE SAUDE DO DISTRITO FEDERAL HOSPITAL REGIONAL DA ASA SUL UNIDADE DE PEDIATRIA FISIOLOGIA DA HEMOSTASIA www. paulomargotto. com. br Brasília, 18/4/2010 Melina Swain

INTRODUÇÃO Hemostasia Mecanismo que garante o equilíbrio entre a coagulação excessiva (trombose) e hemorragia. Dependente das atividades realizadas Parede vascular (endotélio) Plaquetas Sistema de coagulação Fibrinólise

PLAQUETAS • Pequenos fragmentos citoplasmáticos anucleados – Formados a partir da fragmentação citoplasmática dos megacariócitos – Forma discóide – circulam por 7 a 10 dias, sem interagir com outras plaquetas ou outras células do sangue • Quando expostas a agente agonista → passam de estado não adesivo para condição adesiva • Na hemostasia as plaquetas desempenham as funções de adesão, secreção, agregação, e atividade pró- coagulante

Adesão e ativação – Ocorrem nos locais de lesão vascular • Processo de várias etapas – Envolvem • Interação plaquetária com a matriz extracelular subendotelial, onde se encontram o colágeno e fator de Von Willebrand • Tecido subendotelial exposto – Fator de Von Willebrand sofre alteração da sua configuração →capaz de interagir com receptor plaquetário → glicoproteína (GP) Ib/V/IX • • • Essa ligação faz as plaquetas passarem mais lentamente sobre a superfície lesada→ interagindo com receptor para colágeno, a GP VI - induz processos intracelulares de sinalização, provocando ativação de integrinas plaquetárias como: – αIIb β 3 (GP IIB/IIIa) ou α 2β 1 ( GPIa/IIa) Se ligarão à matriz extracelular→ligação firme das plaquetas à parede vascular lesada → monocamada plaquetária

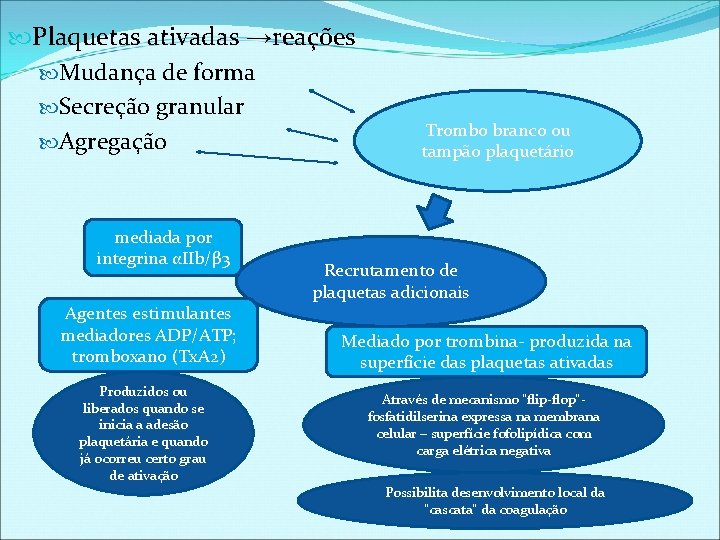
Plaquetas ativadas →reações Mudança de forma Secreção granular Agregação mediada por integrina αIIb/β 3 Agentes estimulantes mediadores ADP/ATP; tromboxano (Tx. A 2) Produzidos ou liberados quando se inicia a adesão plaquetária e quando já ocorreu certo grau de ativação Trombo branco ou tampão plaquetário Recrutamento de plaquetas adicionais Mediado por trombina- produzida na superfície das plaquetas ativadas Através de mecanismo “flip-flop”fosfatidilserina expressa na membrana celular – superfície fofolipídica com carga elétrica negativa Possibilita desenvolvimento local da “cascata” da coagulação

Três tipos de grânulos Alfa Denso Lisossomas Secretam seu conteúdo quando há aumento da concentração intracitoplasmática de cálcio nas plaquetas ativadas Grânulos alfa Contém proteínas como o fator de crescimento derivado de plaquetas (PDGF) , fibrinogênio e fator de Von Willebrand. P-seletina e GP IIb/IIIa (proteínas de membrana): translocadas para a membrana citoplasmática quando o grânulo sofre processo de exocitose→ ligação dos fatores de coagulação, que após interações culmina na geração local de trombina Grânulos densos Armazenam ADP e 5 -hidroxitriptamina ou serotonina ( 5 -HT). Como as plaquetas apresentam receptores específicos para ADP e 5 HT, a secreção destas substâncias aumenta a ativação plaquetária (retroalimentação positiva) Lisossomas Estocam enzimas hidrolíticas, que contribuem para remodelação vascular.

Plaquetas ativadas Tromboxano A 2 (Tx A 2 ) produzido a partir do ácido araquidônico da membrana celular, após sua secreção atua como agonista plaquetário → papel na ativação sinérgica das plaquetas no local de formação do trombo. GPIIb/IIIa – medidor do processo de agregação plaquetária - na membrana plasmática e nos grânulos alfa das plaquetas não ativadas GPIIb/IIIa não expressa atividade de ligação, quando as plaquetas estão em estado não estimulado. Com ativação da plaqueta sofre alteração conformacional, passando a ter capacidade de ligar-se ao fibrinogênio e fator de Von Willebrand Vários sítios de ligação com a GPIIb/IIIa ativada e induzem agregação plaquetária ao promover interligação de plaquetas adjacentes Ativação da GPIIb/IIIa é o resultado final de varias vias de sinalização, também chamada de “via final comum” GPIIb/IIIa pode se ligar ao fibrinogênio e fator de Von Willebrand na dependencia do estresse de cisalhamento local: estresse elevado → fator de Von Willebrand Estresse reduzido→fibrinogênio

MECANISMO DE COAGULAÇÃO Processo de coagulação Série de reações enzimáticas que ocorrem sobre uma superfície fosfolípidica→ a membrana citoplasmática de uma célula ativada Ativação do mecanismo de coagulação tem inicio por duas vias diferentes Via intrinseca via extrinseca Evento central é geração de trombina Quatro fatores II VII IX Dependem de vitamina K para expressar suas funções biológicas X Produzidos no fígado Carboxil depende de vit. K, que cataliza reação de adição do grupo carboxil em residuo de ácido glutâmico→ dois resíduos de ácido caboxiglutâmico. Duplo resíduo de carboxiglutâmico +cálcio promove ligação do fator à superficie fosfolipidica possibita a atvidade biológica do fator ativado

Via intrinseca Fator XII se liga a fibrila de colágeno sub endotelial, que fica exposta após lesão do vaso sanguíneo Ao unir-se à fibrila de colágeno→formação de complexo com o cininogênio de alto peso molecular (HMWK) e com a pré-calicreína (PK)→ ativando o fator XII→FXIIa ativa o fator XI, que por sua vez ativa outros fatores de coagulação FXIa também ativa a pré-calicreína e a transforma em calicreína→ acelera a ativação do FXII


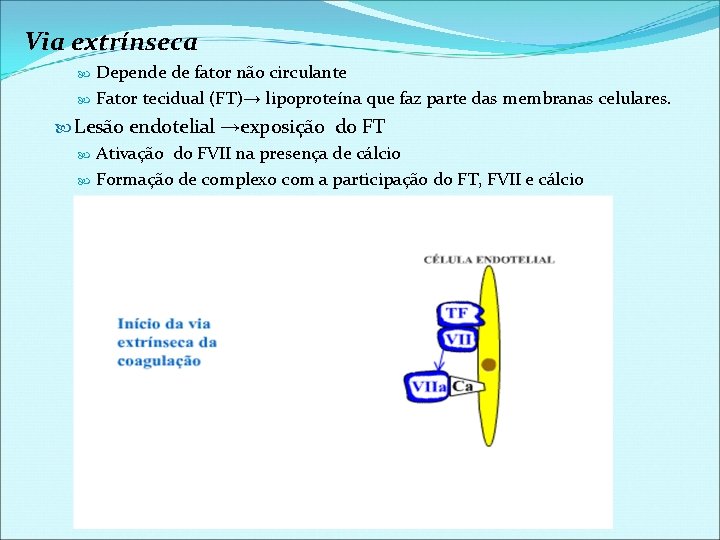
Via extrínseca Depende de fator não circulante Fator tecidual (FT)→ lipoproteína que faz parte das membranas celulares. Lesão endotelial →exposição do FT Ativação do FVII na presença de cálcio Formação de complexo com a participação do FT, FVII e cálcio

Via comum Ponto de convergência das duas vias FVIIa → via extrínseca FXIa → via intrínseca ativação dos fatores IX e X com a participação do fator VIII Formação de complexo onde os FIX e FX estão ligados pelo cálcio a fofolipídeos de membrana celular FXa - consequência das duas vias que iniciam a coagulação Geração da trombina→ agente principal da coagulação


Geração da trombina Ação do FXa sobre a protrombina (FII) Participação do FV e cálcio na presença do fosfolipídio da membrana de qualquer célula Quando acontece na membrana plaquetária a geração da trombina é acelerada milhares de vezes Trombina: ação em múltiplos pontos no processo hemostático Ativação das plaquetas no trombo hemostático Ativa os fatores V, VIII, XIII Atua sobre fibrinogênio Liberação de fibrinopeptídios A e B → gerando monômeros de fibrina, que ligam-se longitudinalmente e lateralmente→ formando os polímeros de fibrina Fibrina é solúvel pois monômeros são ligados por pontes de hidrogênio Atuação do FXIIIa que confere insolubilidade à fibrina


MECANISMO DE COAGULAÇÃO

ANTICOAGULAÇÃO MECANISMOS REGULADORES DA COAGULAÇÃO Reações bioquímicas da coagulação do sangue Reguladas para evitar ativação excessiva do sistema, formação inadequada de fibrina, e, oclusão vascular Atividade das proteases atuantes na ativação da coagulação é regulada por numerosas proteínas inibidoras→ anticoagulantes naturais Principais inibidores fisiológicos da coagulação TFPI→ “tissue factor pathway inhibitor” PC→ proteína C PS→ proteína S AT→ antitrombina

Complexo FVIIa/FT Atua sobre dois substratos principais – Ativação de FIX e FX Reações reguladas pelo inibidor da via do fator tecidual (TFPI) TFPI Proteína produzida pelas células endoteliais Apresentam 3 domínios do tipo “Kunitz” 1º domínio→ liga-se e inibe o complexo FVIIa/FT 2º domínio→ liga-se e inibe o FXa Ativação direta do FX é regulada negativamente de modo rápido na presença do TFPI→ limita produção do FXa e FIXa Ligação do FXa - necessária para inibição do complexo FVIIa/FT pelo TFPI.

Proteína C ativada (PCa) Ativada pela ligação ao seu receptor no endotélio. EPCR (“endothelial PC recptor”) após ligação da trombina ao receptor endotelial trombomodulina (TM) PCa inibe a coagulação clivando e inativando os FVa e FVIIa Processo potencializado pela PS Atua como cofator não enzimático nas reações de inativação Função procoagulante quando gerada em excesso Potente anticoagulante, em pequena quantidade → sua ligação à TM endotelial é o ponto chave para ativação da via inibitória da PC

AT (anteriormente denominada AT III) Inibidor primário da trombina Efeito inibitório sobre diversas enzimas da coagulação FIXa, FXIa Acelera a dissociação do complexo FVIIa/FT e impede sua reassociação Elimina qualquer atividade enzimática procoagulante excessiva ou indesejável Molécula de heparan-sulfato Proteoglicana presente na membrana das células endoteliais Acelerador das reações catalisadas pela AT Atividade inibitória da AT é potentemente acelerada pela heparina Polissacarídeo linear estruturalmente similar ao heparan-sulfato

SISTEMA PLASMINOGÊNIO/PLASMINA (Sistema fibrinolítico) Fibrinólise Degradação da fibrina mediada pela plasmina Composto por diversas proteínas (proteases séricas e inibidores) Regulam a geração de plasmina→ enzima ativa produzida a partir de proenzima inativa (plasminogênio) Função: degradar a fibrina e ativar metaloproteinases de matriz extracelular Outras funções do sistema plasminogênio/plasmina em outros processos Remodelagem da matriz extracelular Crescimento e disseminação tumoral Cicatrização Infecção

Dois ativadores fisiológico do plasminogênio Ativador do plasminogênio do tipo tecidual (t-PA) Ativador do plasminogênio tipo uroquinase (u-PA) Formação de seríno-protease ativa → Plasmina não degrada apenas a fibrina, também o fibrinogênio, FV e FVIII Em condições fisiológicas fibrinólise → processo altamente específico para fibrina Ativação localizada e restrita, não sistêmica Função de remover o excesso de fibrina do intravascular de modo equilibrado

TROMBOFILIAS HEREDITÁRIAS

Trombofilia Definição Tendência à trombose decorrente de alterações hereditárias ou adquiridas da coagulação ou da fibrinólise, que levam a um estado pró-trombótico

Classificados em dois grupos distintos : I - indivíduos que desenvolveram fenômenos tromboembólicos associados a doenças neoplásicas, traumas, imobilização prolongada no leito ou devido à presença de anticorpo antifosfolipídeo. II - indivíduos com tendência trombótica geneticamente determinada, independente dos fatores de risco exógenos, sendo definido como trombofilia hereditária ( TH ).

Mecanismo de hipercoguabilidade Geração de trombina - evento básico na hemostasia sanguínea. Papel central nos dois sistemas de hemostasia Efeito anticoagulante observado com baixos níveis plasmáticos; Tendência para coagulação paulatinamente observada com o aumento da concentração plasmática.

Causas de TH Frequentes ou bem estabelecidas deficiência de antitrombina III (AT) deficiência de proteína C (PC) deficiência de proteína S (PS) resistência à PCa (FVQ 506 / Fator V Leiden) hiperhomocisteinemia

Raras ou não bem estabelecidas Disfibrinogenemia Hipo ou displasminogenemia Deficiência do cofator II da heparina Anormalidades da glicoproteína rica em histidine Aumento do inibidor do ativador de plasminogênio Deficiência do ativador do plasminogênio Trombomodulina anormal

Deficiência de Antitrombina III Glicoproteína sintetizada no fígado e meia-vida plasmática de 65 horas. Herança autossômica dominante, F: M - igualmente afetados; Indivíduos heterozigotos - 40 a 70% da atividade funcional da proteína. Não há descrição de homozigose Especula-se que a mesma possa ser incompatível com a vida

Fenotipicamente - dois tipos de deficiência AT. Tipo I - caracterizado pela redução simultânea da atividade funcional e antigênica alelo mutante não codifica a proteína. Tipo II - desproporção entre a atividade funcional reduzida, na presença de níveis antigênicos normais Sugere uma molécula anormal com defeito no centro reativo (fundamental para a ligação com a trombina) Defeito no sítio de ligação com a heparina ou ambos.

Deficiência de Proteína C Glicoproteína dependente de vitamina K, Sintetizada no fígado Meia vida de 6 a 8 horas. Herança autossômica dominante Heterozigotos - níveis variados da proteína Habitualmente normal com valores inferiores à 50% da concentração homozigotos - níveis indetectáveis da proteína.

Classificação Fenotípica Tipo I - redução equivalente da atividade funcional e níveis antigênicos Tipo II -níveis antigênicos normais e a atividade funcional reduzida 10% dos casos. Aproximadamente 160 mutações identificadas no gene da PC. 60% das mutações tipo I resultam da troca de um aminoácido por outro.

Deficiência de Proteína S Glicoproteína dependente de vitamina K Produzida no fígado, células endoteliais, células de Leydig e megacariócitos. Meia vida de 42 horas 60% da PS está ligada com a fração C 4 b do sistema complemento 40% na forma livre. Heterozigotos - nível de PS total varia de 30 -65% dos valores normais e de PS livre 15 -50%. Homozigotos - níveis inferiores a 5%.

Classificação Tipo I – redução dos níveis antigênicos da PS total e livre, e concomitante redução da atividade da PS livre. Tipo II- níveis antigênicos normais de PS total e livre, e redução da atividade funcional. Tipo III- níveis antigênicos de PS total normais e PS livre com atividade e níveis antigênicos reduzidos.

Resistência à PCa Principal etiologia de TH. Adição de PCa purificada ao plasma humano normal proteólise dos fatores Va e VIIIa e consequente prolongamento do tempo de tromboplastina ativada (ttpa). resistência à proteína C ativada (RPCa) Mutação de ponto caracterizada pela transição G→A no nucleotídeo 1691, resulta na mudança Arg→Gln no codon 506, um dos sítios de ligação com a PCa fator V Leiden (FVL). essa molécula foi denominada

Fator V mutante inativação deficiente do fator Va com desequilíbrio entre o fator V inativo e ativo → geração maior de trombina e hipercoagulabilidade. Fenótipo e presente em até 98% dos casos de RPCa. Heterozigotos - risco para desenvolvimento de trombose venosa 8 -10 vezes superior àquele da população geral, mulheres vezes em uso de ACO ou durante a gravidez – aumento em 30 -40 Prevalência entre indivíduos normais 2 - 10% dos descendentes de caucasóides menos de 1% entre descendentes de orientais, africanos ou populações indígenas.

Diagnóstico prolongamento do ttpa pela adição de PCa pesquisa da mutação Arg 506 -Gln amplificação por PCR.

Hiperhomocisteinemia Resultante de anormalidades funcionais das enzimas do metabolismo da metionina ou da deficiência de cofatores enzimáticos com vitamina B 6, B 12 ou ácido fólico. Aumento moderado de homocisteina – variante termolábil da enzima metileno tetrahidrofolato (MTHFR). Transição 677 C →T no gene da MTHFR mudança de Ala-Val → redução na ligação com o ác. Fólico → níveis inferiores aos normais de ác. fólico ativo (que apresenta atividade cofatora no metabolismo da homocisteina). atividade funcional inferior a 50% da forma normal O risco para o desenvolvimento de trombose é variado entre as distintas populações.

Protrombina mutante Transição G→A na posição 20. 210 na extremidade 3’ do gene correlação com níveis plasmáticos elevados de protrombina e desenvolvimento de trombose venosa. Alelo mutante da protrombina identificado em 2, 3% da população geral Elevação para 6% entre indivíduos com pelo menos um episódio de trombose venosa. prevalência desse alelo mutante varia de 4 -7% dos casos de TH. variante TH. da protrombina - segunda causa mais frequente de

Manifestações Clínicas Caracterizada pelo desenvolvimento de manifestações tombóticas em indivíduos com idade inferior a 45 anos TVP e/ou EP observadas na maioria dos casos Os episódios trombóticos recorrentes ou envolvendo sítios incomuns veia cava, hepática ou de membros inferiores. 50% dos casos - história familiar de trombose defeitos genéticos específicos.

Indivíduos heterozigotos para as deficiências de PC, PS e AT e a presença do fator V Leiden manifestações clínicas associadas a fatores desencadeantes exógenos durante o ciclo gravídico puerperal , após cirurgias ou imobilização. Associação com fatores adquiridos desencadeantes de trombose mais frequente (62%) em pacientes com fator V Leiden 30 -40% dos casos de deficiência de AT, PC ou PS.

ACO associado ao aumento do risco de TH particularmente de AT. na presença do fator V Leiden e deficiência Episódios trombóticos raramente observados na infância. Formas homozigóticas para deficiência PC, PS no período neonatal - “purpura fulminans” ( trombose de microcirculação que se manifesta logo após o nascimento).

Diagnóstico A avaliação global da coagulação pelo tempo de tromboplastina parcial ativado ou tempo de protrombina não permite identificar pacientes com TH. Necessidade da utilização de métodos específicos para cada fator custo elevado limitado a determinados centros. Seleção dos casos Baseado no quadro clínico Reservada para casos onde não há associação com doenças sistêmicas como neoplasias, doenças autoimunes ou síndrome antifosfolípide. A ausência de história familiar não exclui a possibilidade de TH

Testes laboratoriais específicos Testes diagnósticos iniciais Hemograma e esfregaço periferico Tempo de protrombina TTPA Tempo de trombina e Screening para Lupus Anticardiolipina e anticorpo anti β 2 glicoproteina Proteina C ativada Fibrinogênio Protrombina mutante (G 20210 GA) homocisteína

Testes laboratoriais específicos Testes adicionais específicos Mutação do fator V leiden Antitrombina Atividade Proteína C Atividade Proteína S Atividade do Plasminogênio Teste de trombocitopenia induzido por heparina Mutação JAK 2 por PCR

Testes laboratoriais - quando solicitar História familiar sugestiva Após 1º evento trombótico Fase aguda: diminuição da proteína C e S Aumento do fibrinogênio e fator VIII Aguardar normalização: em média 6 semanas Níveis de antitrombina diminuídos em vigência de terapia com heparina Fatores dependentes da vitamina K diminuídos em vigência de terapia com Warvarin Teste para fator V de leiden e protrombina mutante não sofrem alterações em vigência de terapia anticoagulante Resultados alterados Necessidade de confirmação Repetir exames - ausência de anticoagulação Avaliar familiares

Tratamento Anticoagulação Ausência 2 de protocolos específicos para crianças semanas a 3 meses para neonatos 3 a 6 meses para crianças

Nota DO Editor do site www. paulomargotto. com. br , Dr. Paulo R. Margotto Consultem Hemorragia intraventricular no recémnascido a termo, uma condição onde os fatores protrombóticos estão envolvidos. Hemorragia intraventricular no recém-nascido a termo Autor(es): Paulo R. Margotto -investigação laboratorial para distúrbios trombóticos: -tempo de tromboplastina parcial, tempo de atividade de protrombina, fibrinogênio, antitrombina, atividade da proteína S, atividade da proteína C, fatores V, VIII, X e fator Von Willebrand -níveis de plasminogênio-homocisteína -anticorpos maternos anti-fosfolipídicos -análise genética para as deficiências associadas à trombose, incluindo a análise do DNA para a mutação da termolábil metilenotetrahidrofolato redutase

Hemorragia intraventricular e talâmica em um recém-nascido a termo com aumento de anticorpos antifosfolípides Autor(es): Paulo R. Margotto RN de ECB, registro. 180704, de parto cirúrgico por parada de progressão, Apgar de 9/10, 40 semanas 3 dias de idade gestacional, peso ao nascer de 3640 g, 7 consultas pré-natais, sem intercorrências na gravidez. No 4º dia de vida apresentou convulsão tônica, seguida de irritabilidade. Na internação, a punção lombar revelou líquido céfalo-raquidiano hemorrágico. Usou ampicilina e gentamicina por 4 dias, sendo suspenso quando se afastou infecção. Usado fenobarbital endovenoso para o controle das crises convulsivas. A primeira ecografia cerebral Doppler com transdutor de 5 Mhz foi realizada no 8º dia de vida revelou hemorragia peri/intraventricular grau III bilateral, além de hemorragia talâmica á esquerda. A 2ª ecografia cerebral Doppler com transdutor de 5 MHz, foi realizada 7 dias após (com 15 dias de vida) revelou coágulos em ambos os ventrículos e cisto porencefálico no tálamo esquerdo. A ressonância magnética, realizada no dia 13/8/04, 22 dias após a ocorrência da hemorragia intraventricular, revelou: lesão hemorrágica de 2, 5 x 2 cm no tálamo esquerdo de comportamento hipertenso em todas as seqüências obtidas, traduzindo, portanto, fase subaguda (acima de duas semanas). Observa-se extensão da hemorragia para a região da matriz germinativa, situada na região caudo-talâmica esquerda. Grande dilatação simétrica dos ventrículos laterais, terceiro e quarto ventrículos. Conclusão: hemorragia da matriz germinativa, ocupando o tálamo esquerdo e região caudo-talâmica ipsilateral; moderada hidrocefalia comunicante provavelmente por obstrução da drenagem liquórica nas granulações aracnóides. ( A investigação laboratorial incluiu: plasminogênio, Fator VIII, Fator IX, Fator VII, Tempo de tromboplastina parcial, Tempo de Atividade de Protrombina, contagem de plaquetas (valores normais), Fator V Leiden (negativo), Anticoagulante Lúpico Positivo, Antitrombina III (68%-normal de 80 a 120%), Proteína S (normal), Homocisteína (normal, Anti-cardiolipina Ig. G (normal), Auto-anticorpos anti-cardiolipina Ig. M (elevado) e Teste do pezinho Plus normal (17 -OH progesterona, TSH neonatal, Toxoplasmose Ig. M, ácido fenilpirúvico ou fenilalanina, T 4 neonatal, galactose, biotinidasee, galactose e cromatografia de aminoácidos). Foram realizadas pesquisas da mutação do gene da protrombina, do gene da anti-trombina III e do gene da tetrahidrofolatoredutase, tanto no RN como na mãe, sendo negativas. Os anticorpos antifosfolípides (anticardiolipina Ig. G e anticardiolipina Ig. M) na mãe estavam elevados.
 Secretaria da saude são paulo
Secretaria da saude são paulo Tudo no estado
Tudo no estado Secretaria do estado de santa catarina
Secretaria do estado de santa catarina Observatorio fiscal del distrito
Observatorio fiscal del distrito Limites del distrito de chitre
Limites del distrito de chitre Distrito unico andaluz grados superiores
Distrito unico andaluz grados superiores Mapa de chota
Mapa de chota Dsei
Dsei Coordinador de distrito
Coordinador de distrito Centro salud pino montano b
Centro salud pino montano b Distrito ld1
Distrito ld1 Pamahalaan ng malalaki at mauunlad na lungsod
Pamahalaan ng malalaki at mauunlad na lungsod Distrito 4355
Distrito 4355 Estado actual estado deseado
Estado actual estado deseado Caps saude mental
Caps saude mental Dr sheref hassan
Dr sheref hassan Eu fico com a pureza da resposta das crian
Eu fico com a pureza da resposta das crian Pd ped
Pd ped Posto de saúde santa odila
Posto de saúde santa odila Promov saude
Promov saude Rede de atenção a saude
Rede de atenção a saude Determinantes de saude
Determinantes de saude Ministério da saúde
Ministério da saúde Casa de saude são josé
Casa de saude são josé Usf d dinis
Usf d dinis Ministério da saúde
Ministério da saúde Educação permanente em saúde
Educação permanente em saúde Parabens saude felicidade que tu colha
Parabens saude felicidade que tu colha Aborto ministerio da saude
Aborto ministerio da saude Sus pacto pela vida
Sus pacto pela vida Www.cross.saude.sp.gov.br/principal.php
Www.cross.saude.sp.gov.br/principal.php Agente de saude
Agente de saude Determinantes saude
Determinantes saude Serviço nacional saude
Serviço nacional saude Gerenciamento de resíduos sólidos de serviços de saúde
Gerenciamento de resíduos sólidos de serviços de saúde Conceito ampliado de saúde
Conceito ampliado de saúde Psf
Psf Celk navegantes
Celk navegantes Conceito ampliado de saúde
Conceito ampliado de saúde Pacto pela saúde
Pacto pela saúde Caps saude mental
Caps saude mental Saude do idoso
Saude do idoso Qsms qualidade segurança meio ambiente e saúde
Qsms qualidade segurança meio ambiente e saúde Luz mundo vieste a terra
Luz mundo vieste a terra Poesia kona ba eskola
Poesia kona ba eskola Saude suplementar
Saude suplementar Processo saude doença
Processo saude doença Avaliação de tecnologias em saúde
Avaliação de tecnologias em saúde Listaunica.saude.ba.gov.br
Listaunica.saude.ba.gov.br Brazilian sistema único de saúde
Brazilian sistema único de saúde