QFL 0341 Estrutura e propriedades de Compostos Orgnicos
















- Slides: 53

QFL- 0341 – Estrutura e propriedades de Compostos Orgânicos 2. Ligações químicas localizadas em moléculas orgânicas Prof. Dr. Daniel Nopper Silva Rodrigues dannopper@usp. br

Tópicos da Aula QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos A) Literatura recomendada. 2 B) Estrutura atômica. a) Orbitais atômicos b) O carbono c) Hibridização C) Ligações químicas. a) Ligações iônicas b) Ligações covalentes - Orbitais ligantes e antiligantes - Ordem de ligação - Ligações polares e não polares - Orbitais σ e π - Ligações em moléculas poliatômicas - Ligações de Valência e Teoria dos Orbitais Moleculares - Considerações finais.

Literatura recomendada QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos • Organic Chemistry: J. Clayden, N. Greeves, S. Warren, P. 3 Wothers. (Capítulo IV) • Atkins, Jones, Príncipios de Química: (Capítulos II e III) • Volhardt (4ª ou 5ª ed. ): : (Capítulos I)

Estrutura atômica QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Orbital “Wavefunction depending explicitly on the spatial coordinates of only one electron. ” – IUPAC, Gold Book (24/02/2014) Orbital atômico “One-electron wavefunction obtained as a solution of the Schrödinger equation for an atom. ” – IUPAC, Gold Book (24/02/2014) Equação de Schrödinger Erwin Schrödinger 4

Estrutura atômica QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos A função de onda e seu quadrado A função de onda, Ψ, contém toda informação referente à um dado elétron, no entanto ela carece de significado físico. Por outro lado, o seu quadrado (Ψ 2) é proporcional a densidade de elétrons em um dado espaço. Exemplo: A função de onda do orbital 1 s do átomo de hidrogênio. ψ1 s= 2 Z 3/2 e-ρ/2 × (1/4π)1/2 r = Raio em Bohrs (52, 9 pm) Z = Carga efetiva do núcleo (no caso é 1) ρ = 2 Zr/n onde n é o número quântico principal (no caso é 1) 5

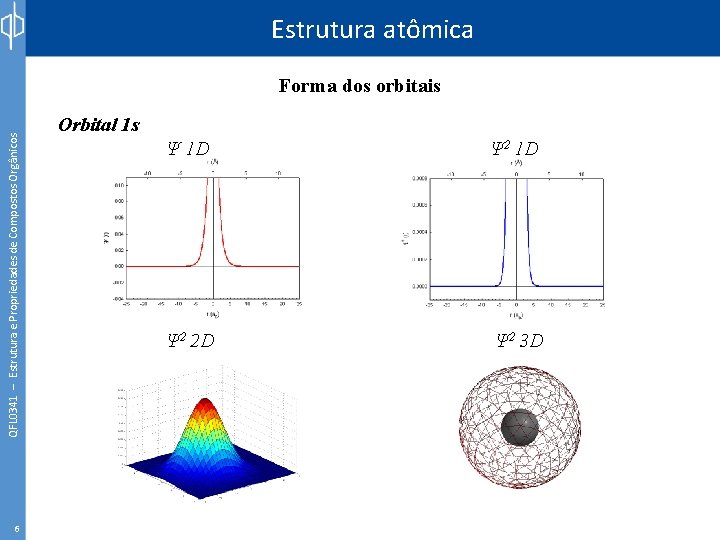
Estrutura atômica QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Forma dos orbitais 6 Orbital 1 s Ψ 1 D Ψ 2 2 D Ψ 2 3 D

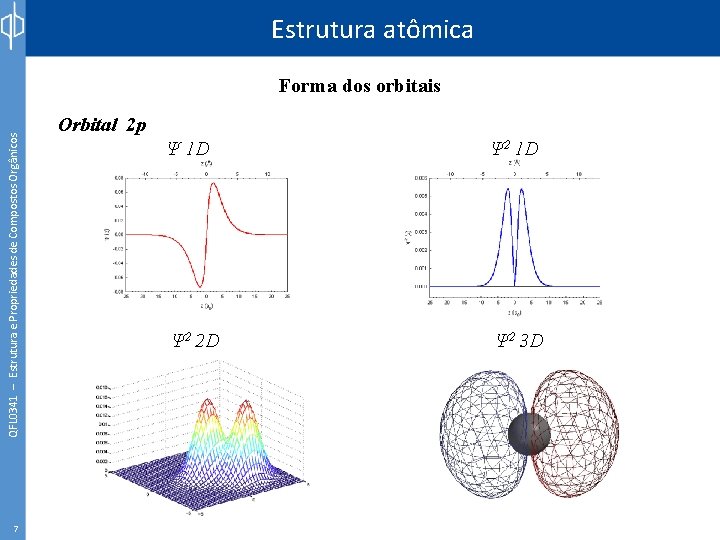
Estrutura atômica QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Forma dos orbitais 7 Orbital 2 p Ψ 1 D Ψ 2 2 D Ψ 2 3 D

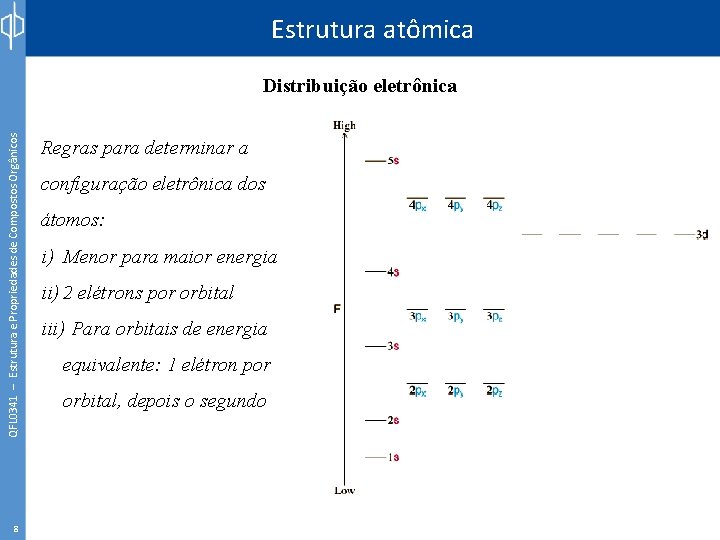
Estrutura atômica QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica 8 Regras para determinar a configuração eletrônica dos átomos: i) Menor para maior energia ii) 2 elétrons por orbital iii) Para orbitais de energia equivalente: 1 elétron por orbital, depois o segundo

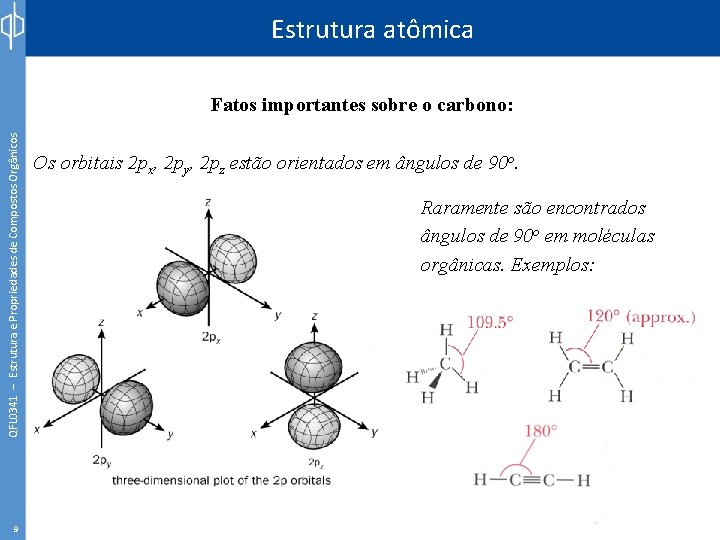
Estrutura atômica QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Fatos importantes sobre o carbono: 9 Os orbitais 2 px, 2 py, 2 pz estão orientados em ângulos de 90 o. Raramente são encontrados ângulos de 90 o em moléculas orgânicas. Exemplos:

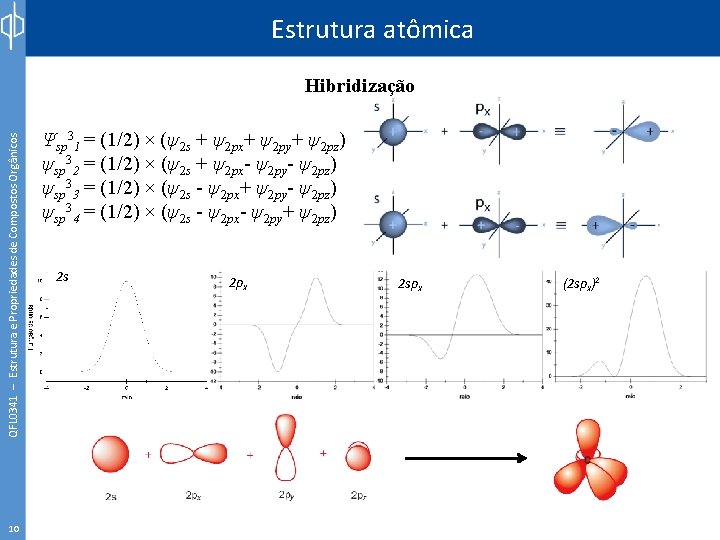
Estrutura atômica QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Hibridização 10 Ψsp 31 = (1/2) × (ψ2 s + ψ2 px+ ψ2 py+ ψ2 pz) ψsp 32 = (1/2) × (ψ2 s + ψ2 px- ψ2 py- ψ2 pz) ψsp 33 = (1/2) × (ψ2 s - ψ2 px+ ψ2 py- ψ2 pz) ψsp 34 = (1/2) × (ψ2 s - ψ2 px- ψ2 py+ ψ2 pz) 2 s 2 px 2 spx (2 spx)2

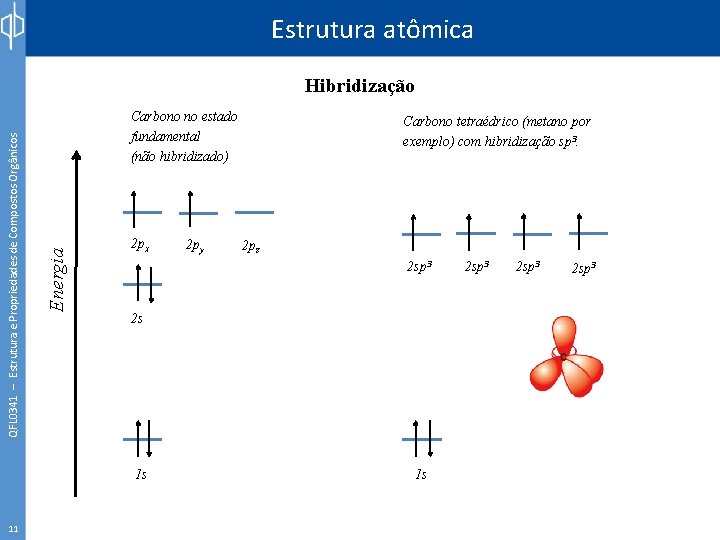
Estrutura atômica Carbono no estado fundamental (não hibridizado) Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Hibridização 2 px 2 pz 2 sp 3 2 s 1 s 11 2 py Carbono tetraédrico (metano por exemplo) com hibridização sp 3. 1 s 2 sp 3

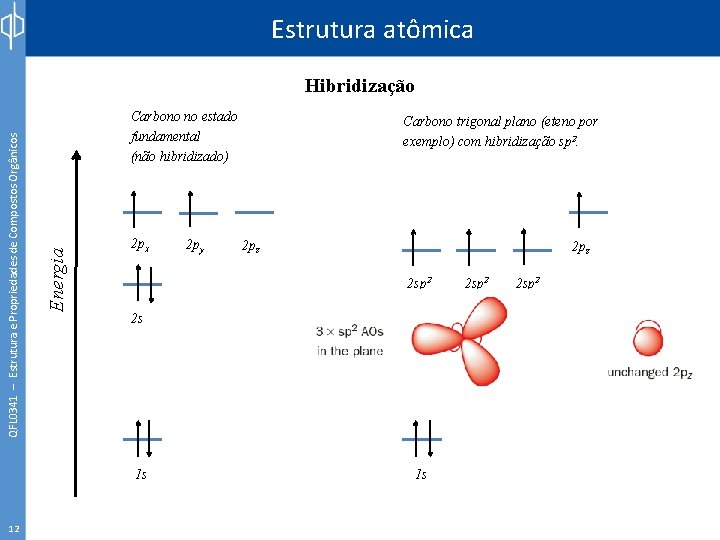
Estrutura atômica Carbono no estado fundamental (não hibridizado) Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Hibridização 2 px 2 pz 2 sp 2 2 s 1 s 12 2 py Carbono trigonal plano (eteno por exemplo) com hibridização sp 2. 1 s 2 sp 2

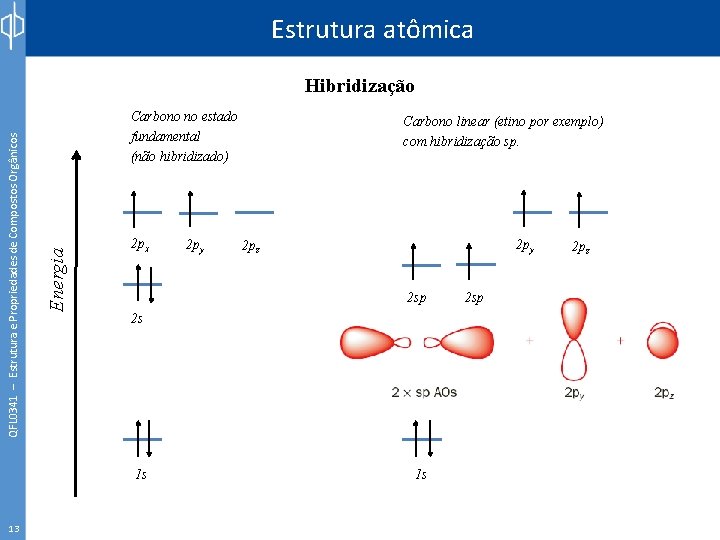
Estrutura atômica Carbono no estado fundamental (não hibridizado) Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Hibridização 2 px 2 py 2 pz 2 sp 2 s 1 s 13 2 py Carbono linear (etino por exemplo) com hibridização sp. 1 s 2 sp 2 pz

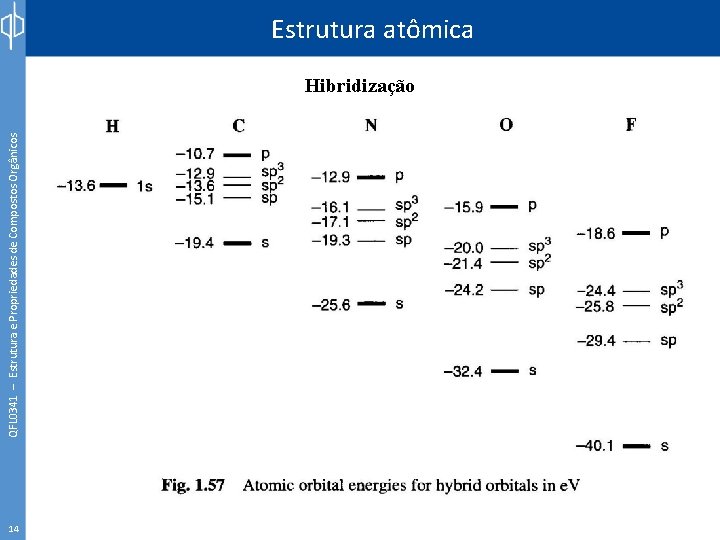
QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Estrutura atômica Hibridização 14

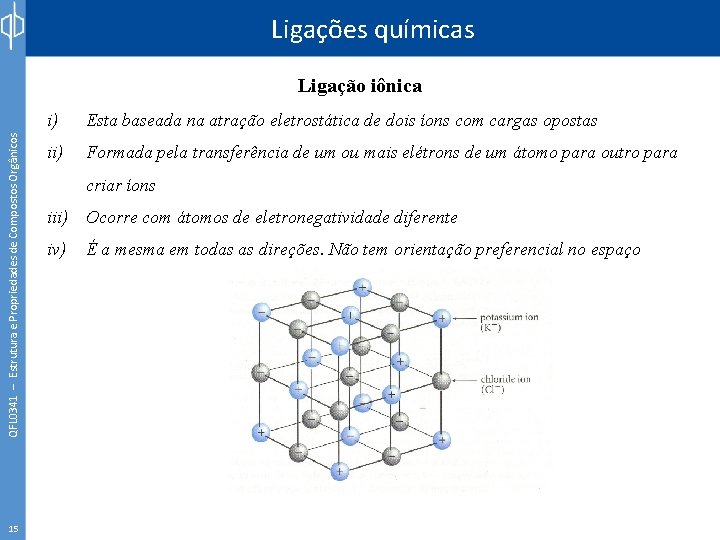
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligação iônica 15 i) Esta baseada na atração eletrostática de dois íons com cargas opostas ii) Formada pela transferência de um ou mais elétrons de um átomo para outro para criar íons iii) Ocorre com átomos de eletronegatividade diferente iv) É a mesma em todas as direções. Não tem orientação preferencial no espaço

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligação covalente i) Ocorre entre átomos de ametais com eletronegativa iguais ou similares. ii) Há o compartilhamento de elétrons. iii) O compartilhamento de elétrons decorre da sobreposição de orbitais atômicos. iv) É direcional e o formato dos orbitais envolvidos determina onde e como a ligação irá ocorrer. Estruturas de Lewis i) Lewis propôs pela primeira vez a ideia de ligações químicas poderiam ocorrer pelo compartilhamento de elétrons entre átomos. ii) Apenas elétrons da camada de valência participam da ligação química. iii) Apenas dois elétrons (um de cada átomo) podem formar uma ligação química. Gilbert Newton Lewis 16

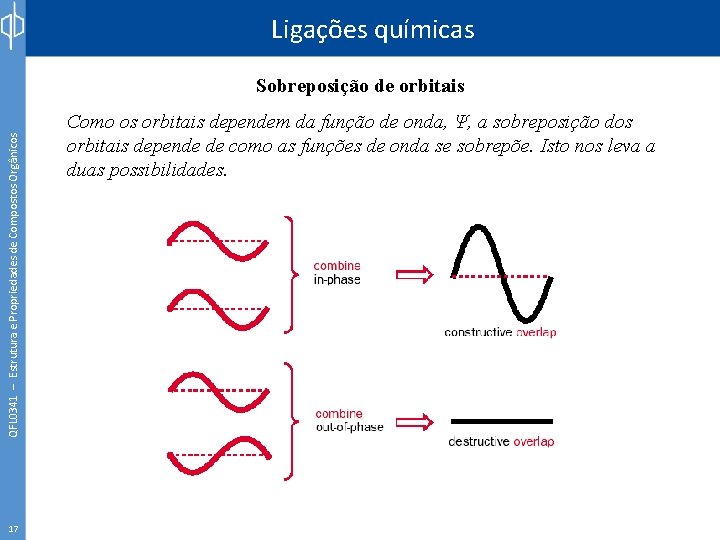
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Sobreposição de orbitais 17 Como os orbitais dependem da função de onda, Ψ, a sobreposição dos orbitais depende de como as funções de onda se sobrepõe. Isto nos leva a duas possibilidades.

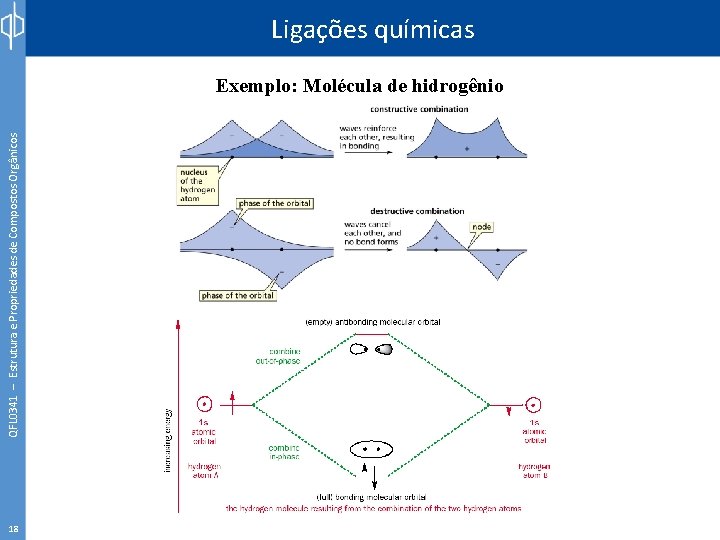
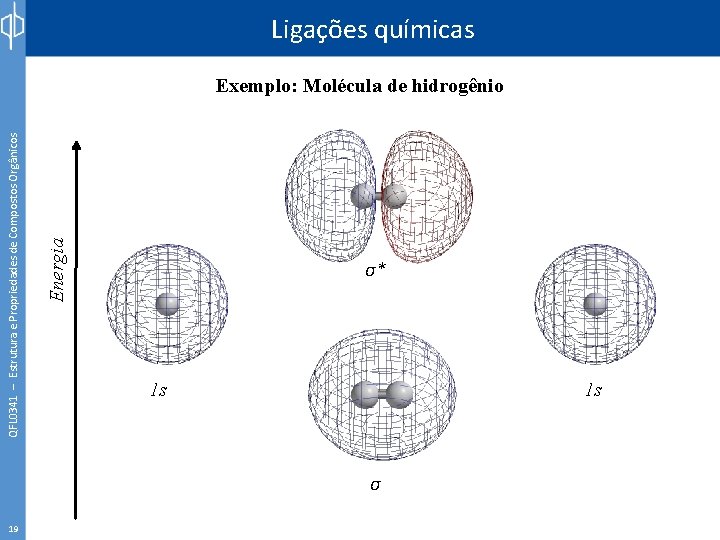
QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações químicas Exemplo: Molécula de hidrogênio 18

19 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações químicas Exemplo: Molécula de hidrogênio σ* 1 s 1 s σ

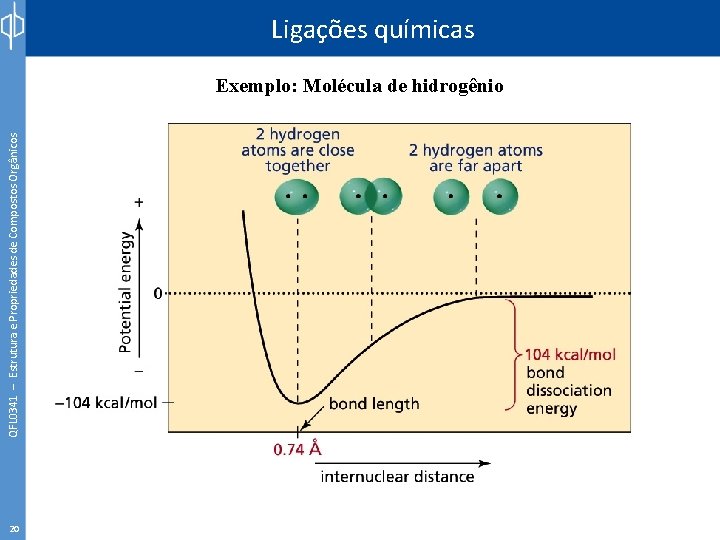
QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações químicas Exemplo: Molécula de hidrogênio 20

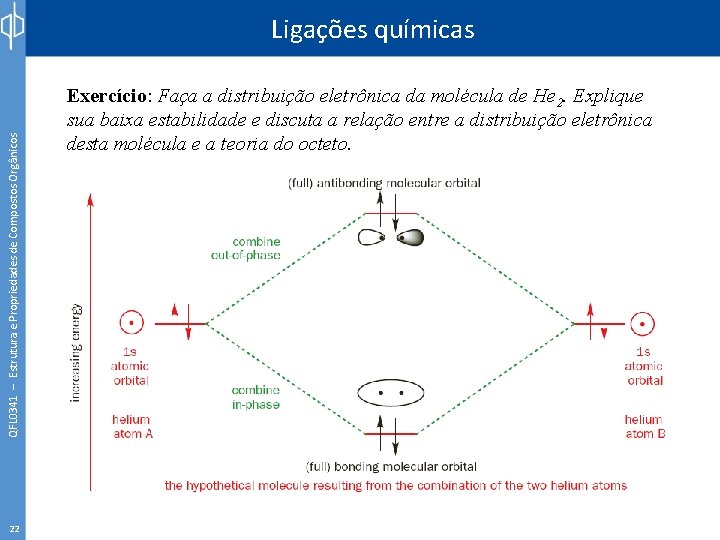
QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações químicas 21 Exercício: Faça a distribuição eletrônica da molécula de He 2. Explique sua baixa estabilidade e discuta a relação entre a distribuição eletrônica desta molécula e a teoria do octeto.

QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações químicas 22 Exercício: Faça a distribuição eletrônica da molécula de He 2. Explique sua baixa estabilidade e discuta a relação entre a distribuição eletrônica desta molécula e a teoria do octeto.

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ordem de ligação 23 Exemplos: A ordem de ligação obtida através da distribuição eletrônica nos orbitais moleculares normalmente coincide com o número de ligações da estrutura de Lewis. Entretanto, podemos obter através de orbitais moleculares estruturas com ordens de ligações fracionadas. Exemplos:

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Exercício: Faça a distribuição eletrônica das moléculas de O 2 e N 2 e calcule suas ordens de ligação. 24

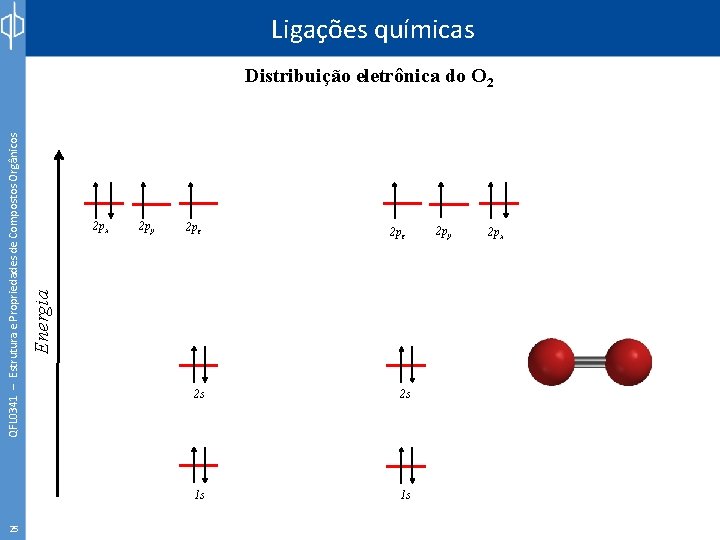
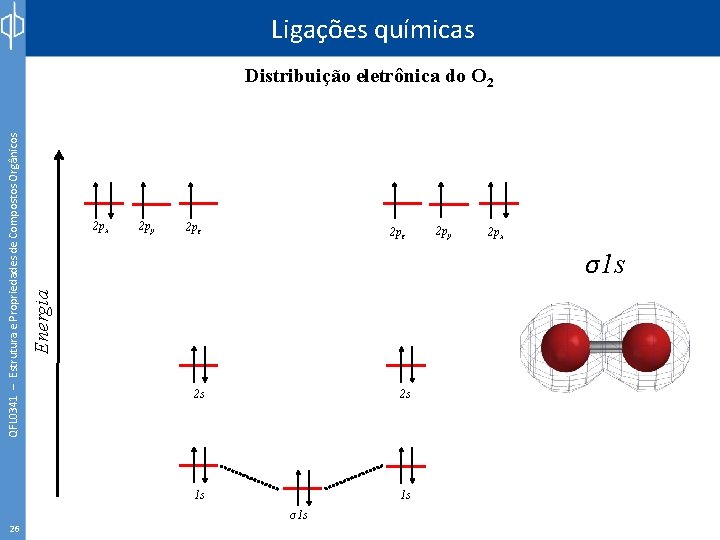
Ligações químicas 25 2 px 2 py 2 pz Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 2 s 2 s 1 s 1 s 2 py 2 px

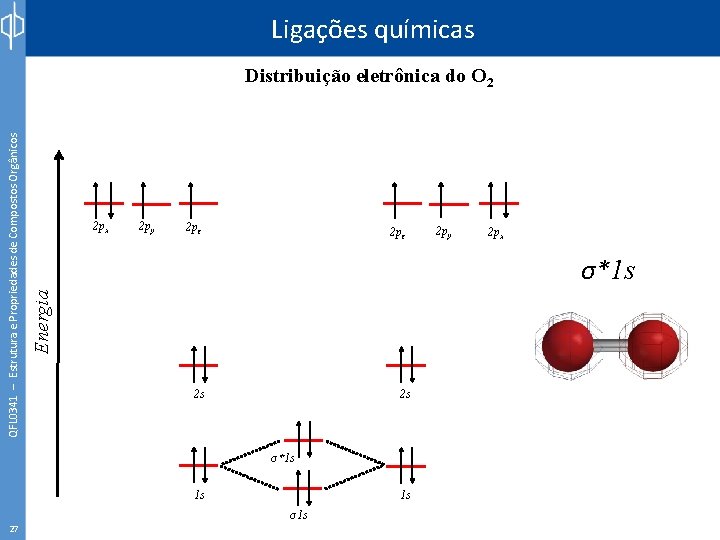
Ligações químicas 26 2 px 2 py 2 pz 2 py 2 px σ1 s Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 2 s 2 s 1 s 1 s σ1 s

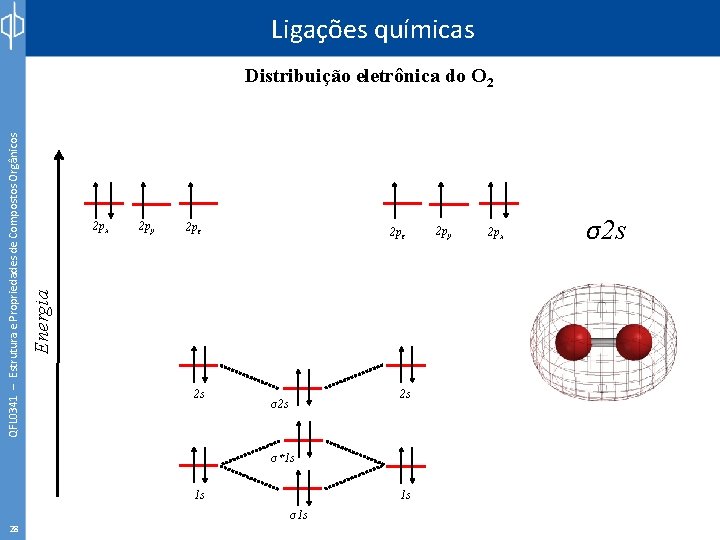
Ligações químicas 2 px 2 py 2 pz 2 s 2 s σ*1 s 1 s 27 2 py 2 px σ*1 s Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 1 s σ1 s

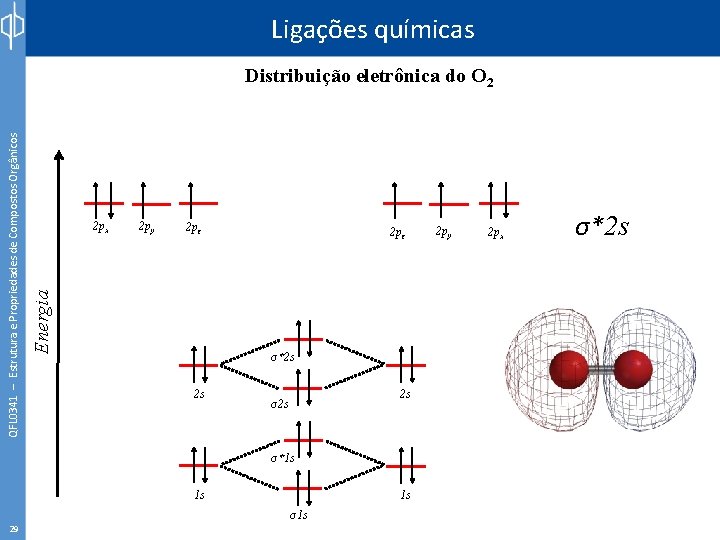
Ligações químicas 2 px 2 py 2 pz Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 2 s 2 s σ*1 s 1 s 28 1 s σ1 s 2 py 2 px σ2 s

Ligações químicas 2 px 2 py 2 pz Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 2 pz σ*2 s 2 s 2 s σ*1 s 1 s 29 1 s σ1 s 2 py 2 px σ*2 s

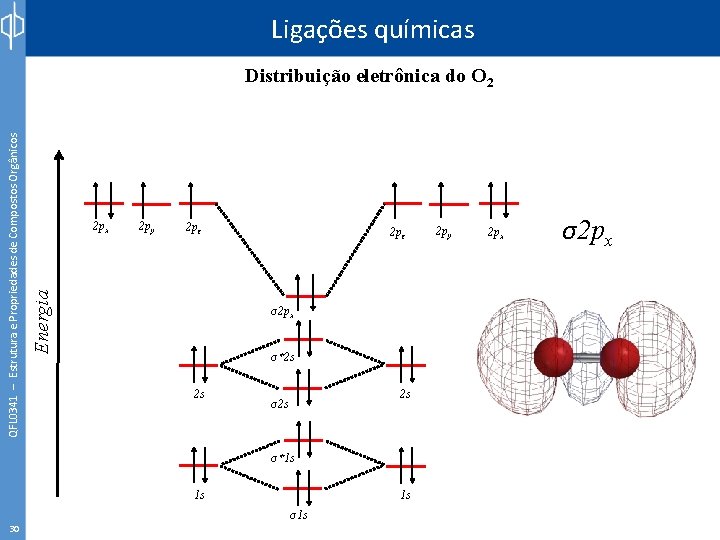
Ligações químicas 2 px 2 py 2 pz Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 2 pz σ2 px σ*2 s 2 s 2 s σ*1 s 1 s 30 1 s σ1 s 2 py 2 px σ2 px

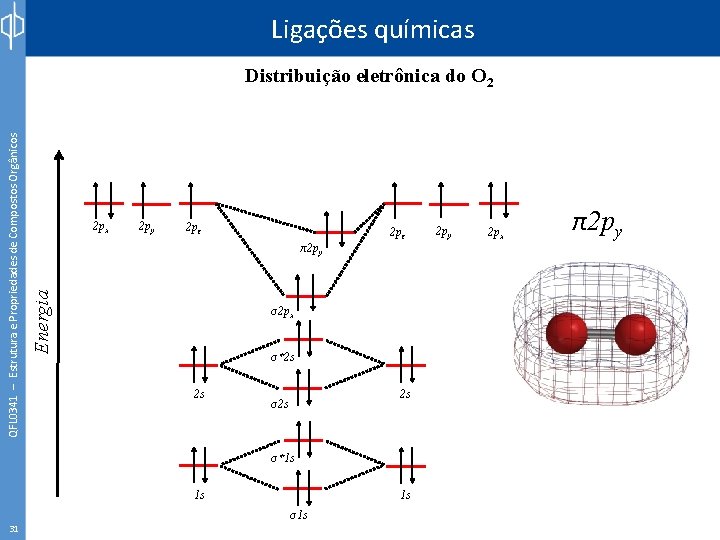
Ligações químicas 2 px 2 py 2 pz π2 py Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 2 pz σ2 px σ*2 s 2 s 2 s σ*1 s 1 s 31 1 s σ1 s 2 py 2 px π2 py

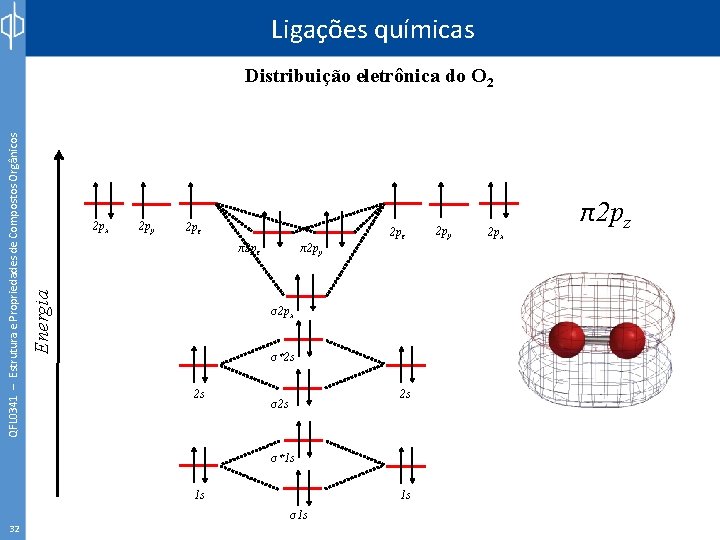
Ligações químicas 2 px 2 py 2 pz π2 pz Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 π2 py 2 pz σ2 px σ*2 s 2 s 2 s σ*1 s 1 s 32 1 s σ1 s 2 py 2 px π2 pz

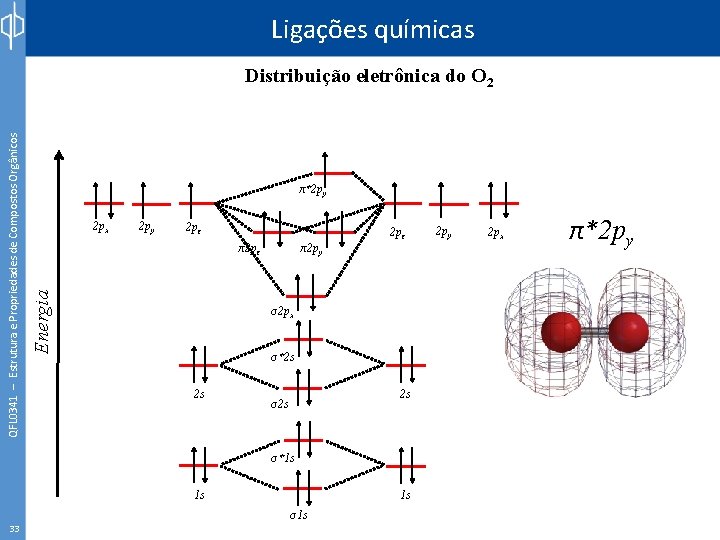
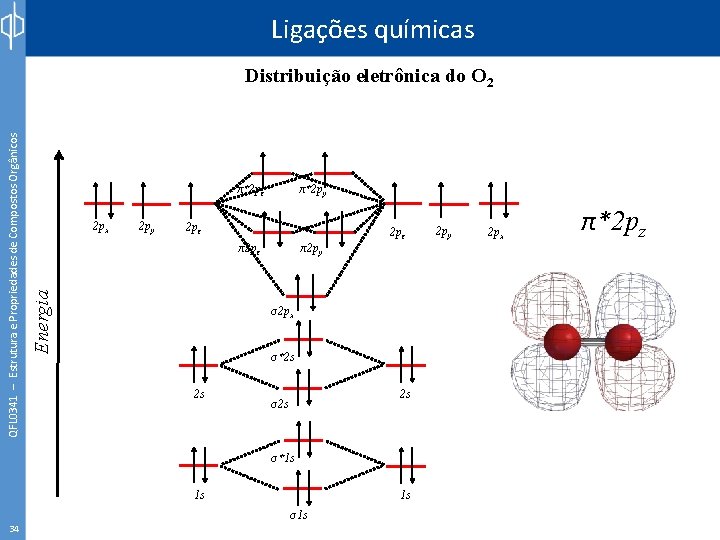
Ligações químicas π*2 py 2 px 2 py 2 pz π2 pz Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 π2 py 2 pz σ2 px σ*2 s 2 s 2 s σ*1 s 1 s 33 1 s σ1 s 2 py 2 px π*2 py

Ligações químicas π*2 pz 2 px 2 py π*2 py 2 pz π2 pz Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Distribuição eletrônica do O 2 π2 py 2 pz σ2 px σ*2 s 2 s 2 s σ*1 s 1 s 34 1 s σ1 s 2 py 2 px π*2 pz

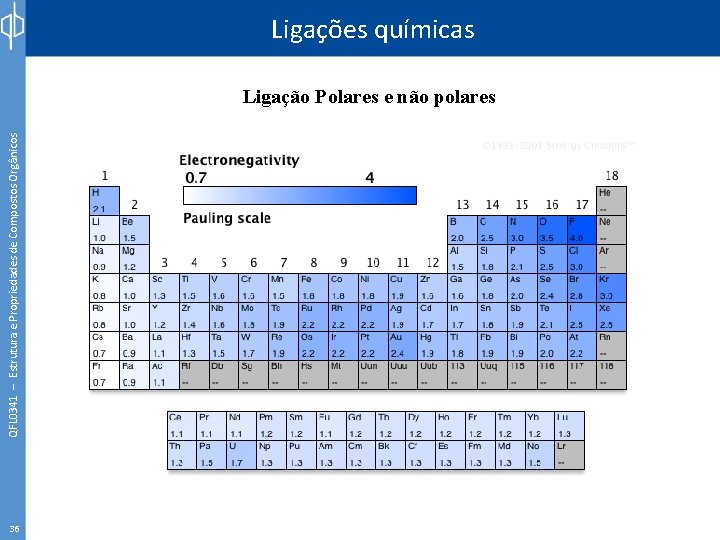
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligação Polares e não polares Classificação das Ligações Químicas Diferença de eletronegatividade entre os átomos ligados menor do 0, 5 a 1, 9 maior do que 1, 9 covalente não polar covalente polar iônica Em ligações covalentes polares átomo mais eletronegativo: δ átomos menos eletronegativo: δ+ Exemplo: ligação C–O: 3, 5 – 2, 5 = 1, 0 covalente polar 35 Tipo de ligação δ+ δC–O

QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações químicas Ligação Polares e não polares 36

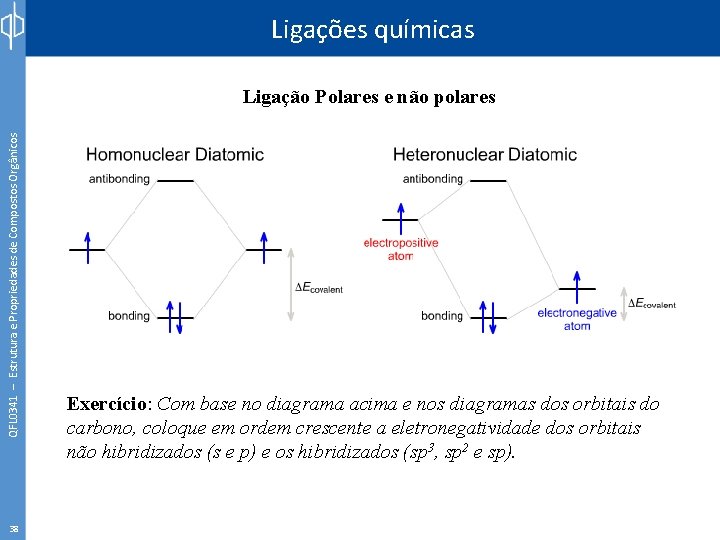
QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações químicas Ligação Polares e não polares 37

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligação Polares e não polares 38 Exercício: Com base no diagrama acima e nos diagramas dos orbitais do carbono, coloque em ordem crescente a eletronegatividade dos orbitais não hibridizados (s e p) e os hibridizados (sp 3, sp 2 e sp).

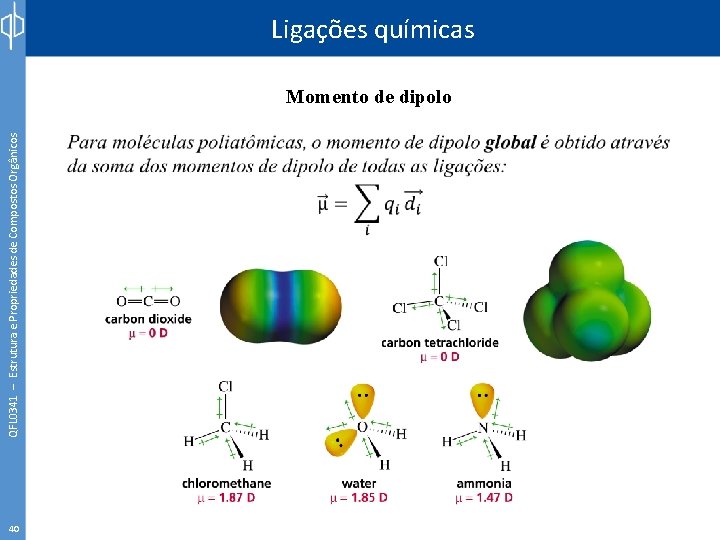
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Momento de dipolo 39 É a medida da separação entre cargas opostas e de suas respectivas magnitudes. A unidade que descreve o momento de dipolo (μ) é Debye (D). Peter Joseph William Debye +0, 437 - 0, 437

QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações químicas Momento de dipolo 40

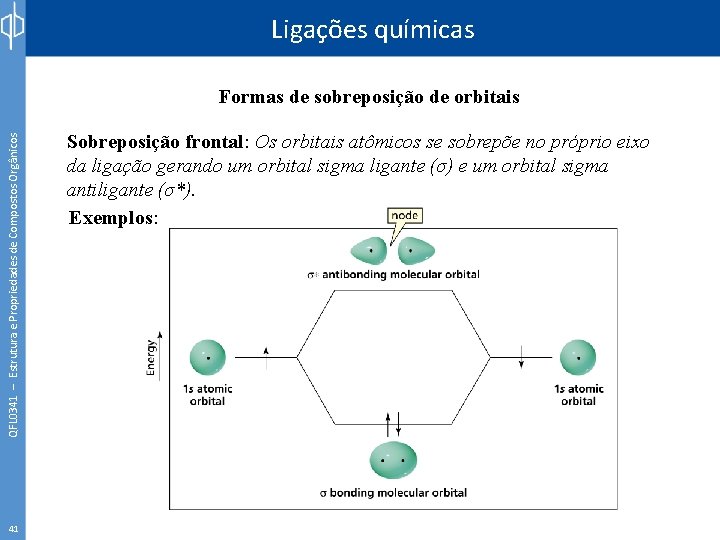
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Formas de sobreposição de orbitais 41 Sobreposição frontal: Os orbitais atômicos se sobrepõe no próprio eixo da ligação gerando um orbital sigma ligante (σ) e um orbital sigma antiligante (σ*). Exemplos:

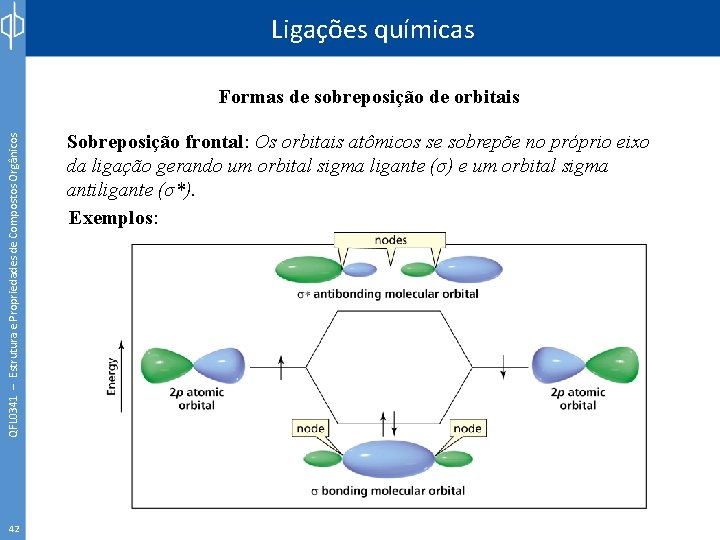
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Formas de sobreposição de orbitais 42 Sobreposição frontal: Os orbitais atômicos se sobrepõe no próprio eixo da ligação gerando um orbital sigma ligante (σ) e um orbital sigma antiligante (σ*). Exemplos:

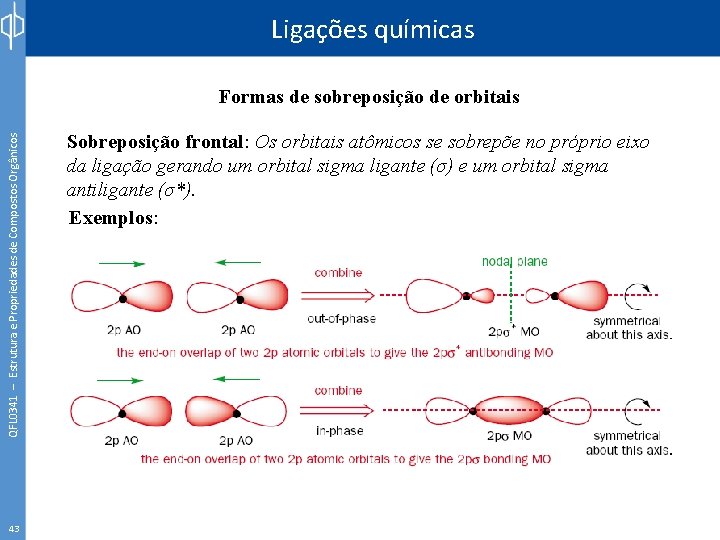
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Formas de sobreposição de orbitais 43 Sobreposição frontal: Os orbitais atômicos se sobrepõe no próprio eixo da ligação gerando um orbital sigma ligante (σ) e um orbital sigma antiligante (σ*). Exemplos:

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Formas de sobreposição de orbitais 44 Sobreposição frontal: Os orbitais atômicos se sobrepõe no próprio eixo da ligação gerando um orbital sigma ligante (σ) e um orbital sigma antiligante (σ*). Exemplos:

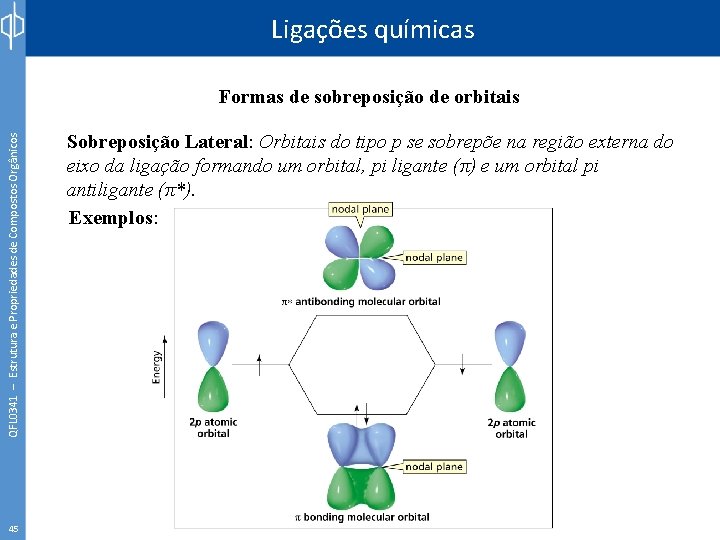
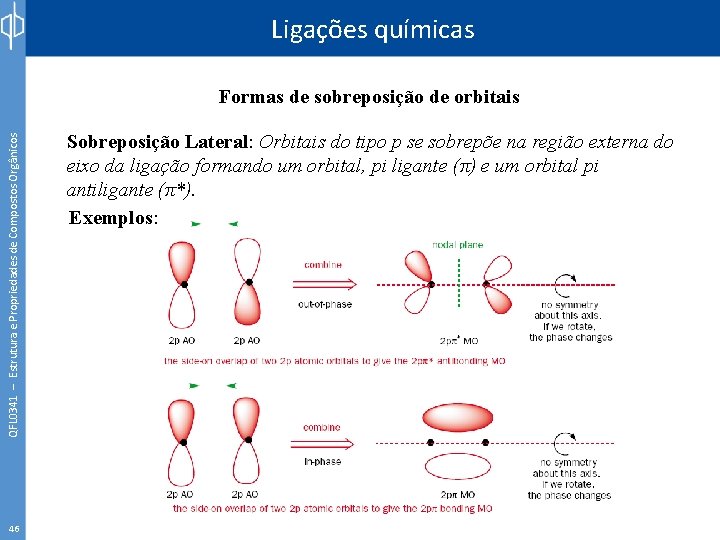
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Formas de sobreposição de orbitais 45 Sobreposição Lateral: Orbitais do tipo p se sobrepõe na região externa do eixo da ligação formando um orbital, pi ligante (π) e um orbital pi antiligante (π*). Exemplos:

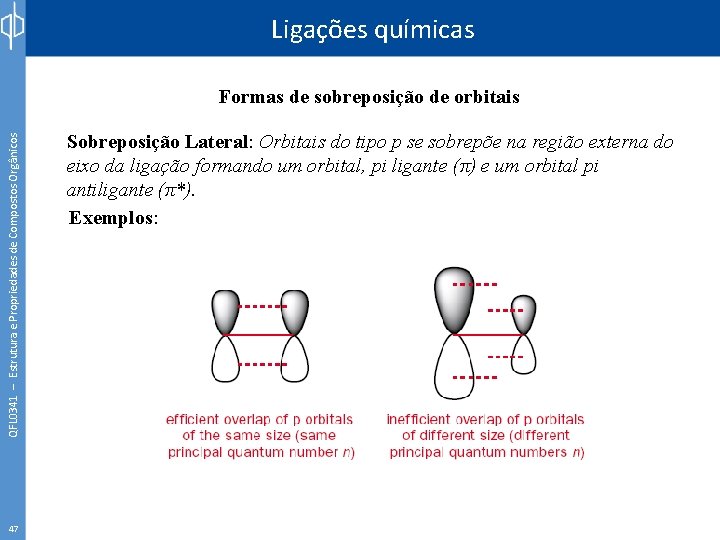
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Formas de sobreposição de orbitais 46 Sobreposição Lateral: Orbitais do tipo p se sobrepõe na região externa do eixo da ligação formando um orbital, pi ligante (π) e um orbital pi antiligante (π*). Exemplos:

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Formas de sobreposição de orbitais 47 Sobreposição Lateral: Orbitais do tipo p se sobrepõe na região externa do eixo da ligação formando um orbital, pi ligante (π) e um orbital pi antiligante (π*). Exemplos:

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Formas de sobreposição de orbitais 48 Exercício: Procure representar as diferentes ligações σ e π para as moléculas abaixo. a) Metano b) Etano c) Formaldeído d) Etino e) nion cianeto f) Aleno

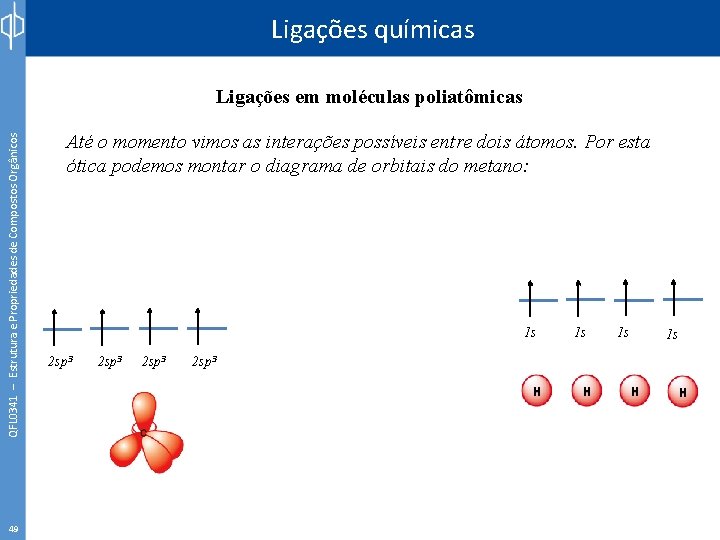
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações em moléculas poliatômicas 49 Até o momento vimos as interações possíveis entre dois átomos. Por esta ótica podemos montar o diagrama de orbitais do metano: 1 s 2 sp 3 1 s 1 s 1 s

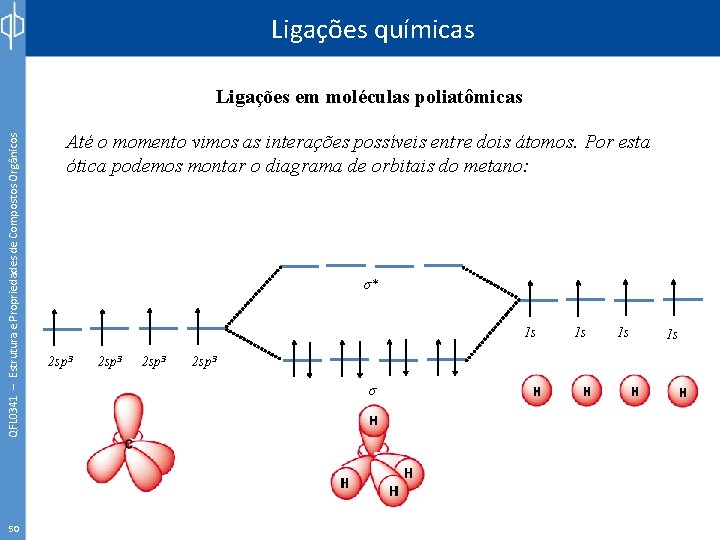
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações em moléculas poliatômicas 50 Até o momento vimos as interações possíveis entre dois átomos. Por esta ótica podemos montar o diagrama de orbitais do metano: σ* 1 s 2 sp 3 σ 1 s 1 s 1 s

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações de Valência e Teoria dos Orbitais Moleculares 51 Ligações de Valência: - Apenas orbitais da camada de valência interagem. - Cada elétron está confinado à um orbital ligante e sofre a influência dos núcleos. - A hibridização e/ou ressonância são conceitos necessários. - As energias são obtidas através da combinação em fase e fora de fase dos orbitais atômicos envolvidos. Orbitais moleculares: - Todos os orbitais atômicos interagem. - Os elétrons são livres e para movimentar-se ao longo da molécula e sofrem a influência de todos os núcleos da molécula. - As energias são obtidas a partir da Combinação Linear de Orbitais Atômicos (LCAO). Ambos conceitos possuem limitações tornando-se complementares.

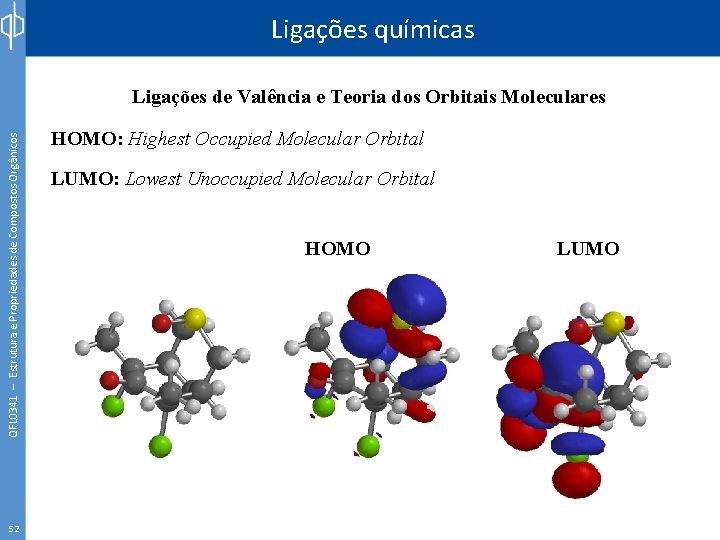
Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Ligações de Valência e Teoria dos Orbitais Moleculares 52 HOMO: Highest Occupied Molecular Orbital LUMO: Lowest Unoccupied Molecular Orbital HOMO LUMO

Ligações químicas QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Considerações finais 53 - As ligações covalentes ocorrem em decorrência da sobreposição de orbitais atômicos, gerando sempre um par de orbitais, ligante e antiligante. - O grau de hibridização do orbital de um átomo depende da vizinhança do átomo. - Os orbitais podem se sobrepor frontalmente originando orbitais sigma (σ) ou lateralmente originando orbitais pi (π). - Existem duas teorias que explicam as ligações químicas Ligações de Valência (VB) e Teoria dos Orbitais Moleculares (MO) e estas são complementares.
 Propiedades físicas del amoniaco
Propiedades físicas del amoniaco Orgnicos
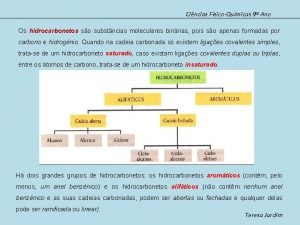
Orgnicos Compostos binaris
Compostos binaris Compostos
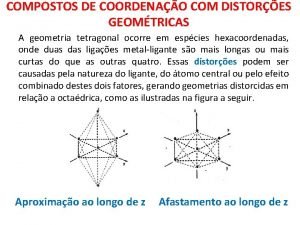
Compostos Distores
Distores Montante juros compostos
Montante juros compostos Pronomes pessoais retos e oblíquos
Pronomes pessoais retos e oblíquos Cristall ionic
Cristall ionic Compostos ternarios
Compostos ternarios O que são elementos organógenos
O que são elementos organógenos Compostos
Compostos Subclasses dos verbos
Subclasses dos verbos Formula juro composto
Formula juro composto Formula estrutural
Formula estrutural Ciclopenteno
Ciclopenteno Compostos alifáticos
Compostos alifáticos Infinitivo impessoal composto
Infinitivo impessoal composto Sais
Sais Ion enolato
Ion enolato Incloure conjugació
Incloure conjugació Compostos ionicos
Compostos ionicos Compostos fenólicos
Compostos fenólicos Juros compostos formula
Juros compostos formula Valencies sofre
Valencies sofre Reação de condensação
Reação de condensação Substantivo composto plural
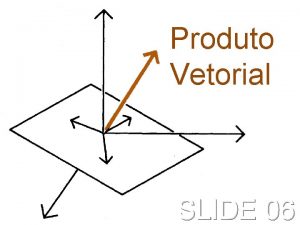
Substantivo composto plural Identidade de lagrange produto vetorial
Identidade de lagrange produto vetorial Propriedades específicas da matéria
Propriedades específicas da matéria Propriedades logaritmo
Propriedades logaritmo Propiedades aperiodicas
Propiedades aperiodicas /7
/7 Perispírito formação propriedades e funções
Perispírito formação propriedades e funções Tonoscopia ou tonometria
Tonoscopia ou tonometria Quais são as propriedades básicas da pantomima?
Quais são as propriedades básicas da pantomima? Propriedades produto escalar
Propriedades produto escalar Propriedades probabilidades
Propriedades probabilidades Diagrama arvore
Diagrama arvore Propriedades dos minerais
Propriedades dos minerais Exemplo de intencionalidade textual
Exemplo de intencionalidade textual Associativa
Associativa Propriedades específicas da matéria
Propriedades específicas da matéria Calor especifico madeira
Calor especifico madeira Constante tonoscopica
Constante tonoscopica Propriedades das isometrias
Propriedades das isometrias Divisores
Divisores Ebulioscopia slide
Ebulioscopia slide Propriedades de um elemento quimico
Propriedades de um elemento quimico Propriedades gerais exemplos
Propriedades gerais exemplos Regra de cramer
Regra de cramer Produto misto
Produto misto Propriedades da mediatriz
Propriedades da mediatriz Propriedade de log
Propriedade de log Tecido conjuntivo denso modelado
Tecido conjuntivo denso modelado Particionada
Particionada