Qumica Lays Omena Propriedades Coligativas Propriedades Coligativas Tonoscopia




















- Slides: 26

Química – Lays Omena Propriedades Coligativas

Propriedades Coligativas Tonoscopia Ebulioscopia Crioscopia Osmose • Todas estão relacionadas com a pressão máxima de vapor das soluções.

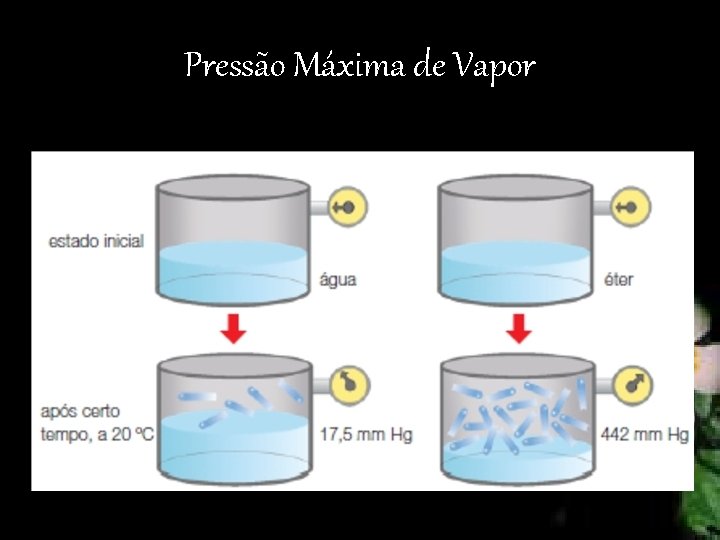
Pressão Máxima de Vapor

Pressão máxima de vapor (PV): situação de equilíbrio entre as duas fases (líquido e vapor), à temperatura de 20 ºC.

• Líquidos diferentes T 0 = T 1 PMV diferentes • Sólidos : PMV Desprezível. No entanto, a naftalina, mesmo sendo um sólido, apresenta uma considerável pressão máxima de vapor. • Líquido aquecido Energia cinética média das moléculas aumenta, logo aumenta a PMV.


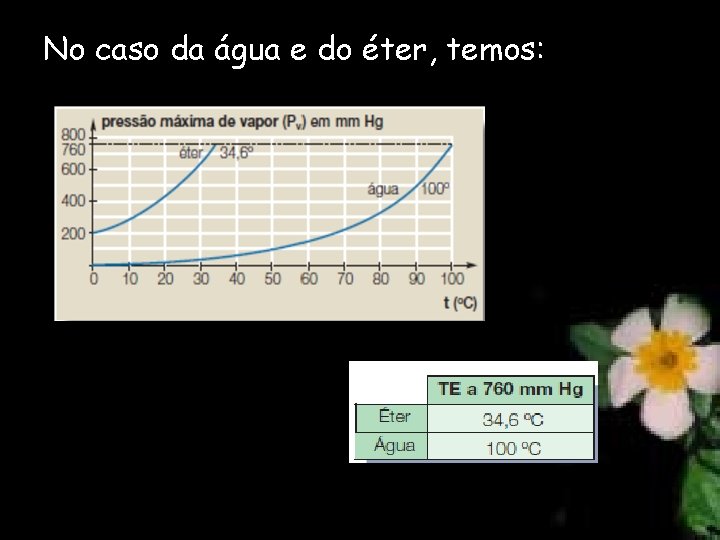
Pressão Máxima de Vapor e a Temperatura de ebulição Um líquido entra em ebulição à temperatura na qual a pressão máxima de vapor se iguala à pressão atmosférica. PMV = Patm

No caso da água e do éter, temos:

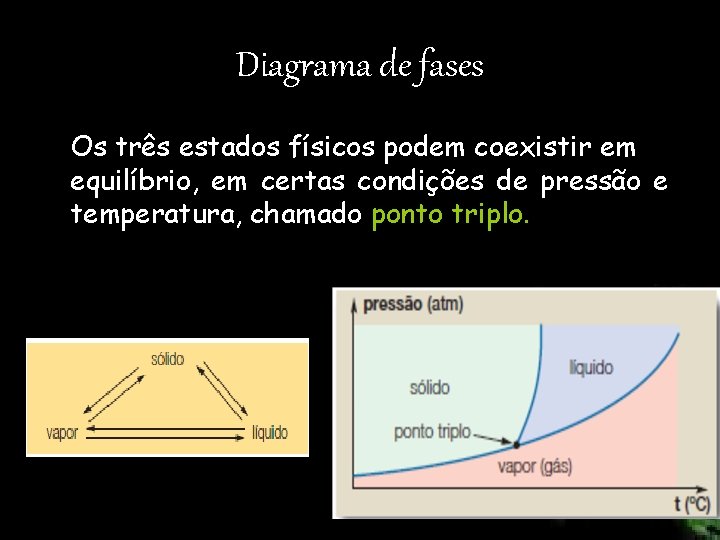
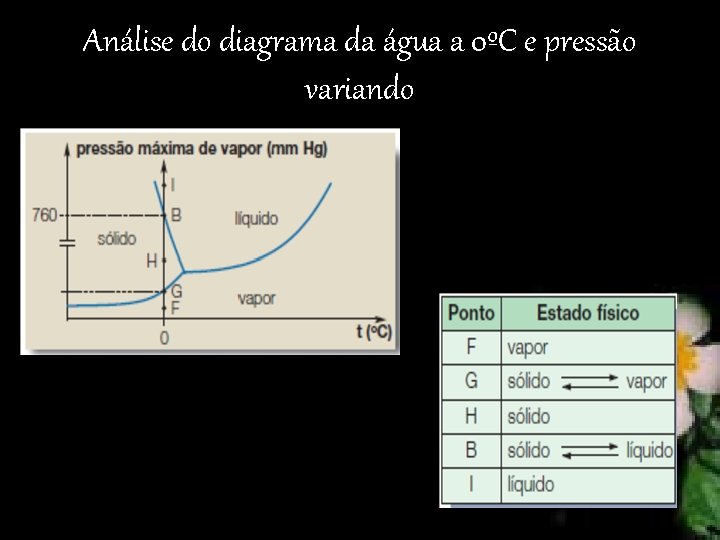
Diagrama de fases Os três estados físicos podem coexistir em equilíbrio, em certas condições de pressão e temperatura, chamado ponto triplo.

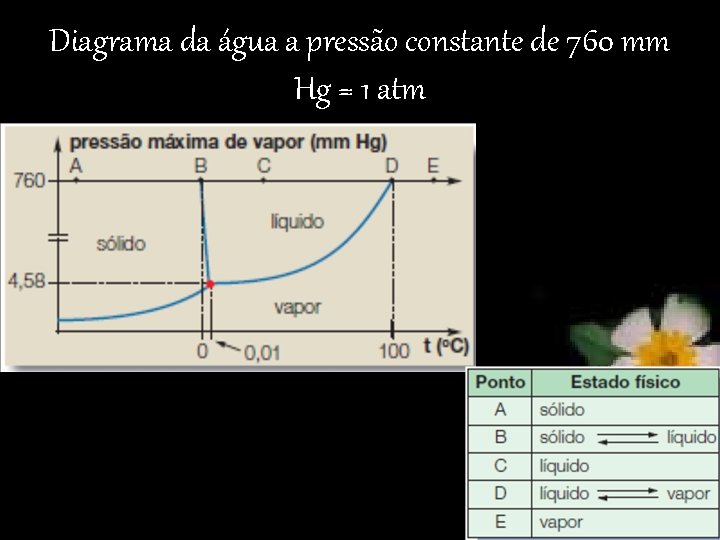
Diagrama da água a pressão constante de 760 mm Hg = 1 atm

Análise do diagrama da água a 0ºC e pressão variando

Propriedades Coligativas

Tonoscopia ou Tonomeria • Tonoscopia ou tonometria é o estudo da diminuição da pressão máxima de vapor de um solvente, provocada pela adição de um soluto não-volátil. • A pressão máxima de vapor da água a 30 ºC é igual a 31, 82 mm Hg. Soluções aquosas de solutos não-voláteis apresentam pressões máximas de vapor menores que a da água.

• Quanto maior for o número de partículas (nº de mol) do soluto não-volátil na solução, maior será o abaixamento absoluto da pressão máxima de vapor (ΔP).



Ebulioscopia ou Crioscopia O aumento (variação) da temperatura de ebulição (Δt. E) pode ser justificado pela diminuição da pressão máxima de vapor, que se deve à presença das partículas do soluto. Para que ocorra a ebulição da solução, é necessário que ela seja aquecida até que sua pressão de vapor se iguale à pressão atmosférica.

A adição de um soluto não-volátil a um solvente provoca um abaixamento na temperatura de congelamento (Δt. C) desse solvente, o que pode ser explicado pelo fato de as partículas do soluto dificultarem a cristalização do solvente.

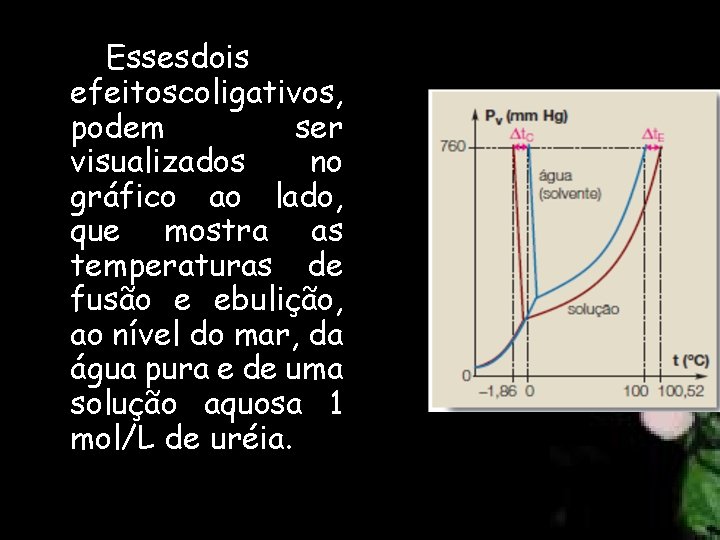
Essesdois efeitoscoligativos, podem ser visualizados no gráfico ao lado, que mostra as temperaturas de fusão e ebulição, ao nível do mar, da água pura e de uma solução aquosa 1 mol/L de uréia.

Pela observação do gráfico, podemos concluir que a temperatura de fusão (congelamento) da solução é igual a – 1, 86ºC e a sua temperatura de ebulição é de 100, 52 ºC. Assim, para soluções que contenham 1 mol de partículas por litro de água, temos Δt. C = 1, 86 ºC e Δt. E = 0, 52 ºC. Generalizando, temos:

Osmose A bexiga de porco, o papel celofane e as paredes de células de organismos são denominados membranas semipermeáveis. Recebem esse nome porque permitem a passagem de moléculas do solvente, mas não do soluto. Esse fenômeno é denominado osmose.



relacionada com a molaridade da solução (M) e com a temperatura na escala Kelvin (T), da seguinte maneira:

A pressão osmótica normal do sangue é de aproximadamente 7, 4 atm quando comparada com a da água pura. Os glóbulos vermelhos (hemácias) do sangue, assim como todas as células vivas do organismo, são afetados por diferenças de pressão osmótica. Veja o aspecto dessas células em soluções com diferentes concentrações:

 Propriedades coligativas tonoscopia
Propriedades coligativas tonoscopia Tonoscopia formula
Tonoscopia formula Propriedades coligativas
Propriedades coligativas Formula de las propiedades coligativas
Formula de las propiedades coligativas Ebulioscopia
Ebulioscopia Tonoscopia
Tonoscopia Tonoscopia que es
Tonoscopia que es Aapacs
Aapacs Lays vs lies
Lays vs lies High- level format of disk lays down:
High- level format of disk lays down: High-level format of disk lays down
High-level format of disk lays down Bcg matrix of pepsico
Bcg matrix of pepsico Lays mascot
Lays mascot Campesinas lay's
Campesinas lay's Lays mascot
Lays mascot Lays mascot
Lays mascot Advantage and disadvantage of lays chips
Advantage and disadvantage of lays chips Reaccion de condensacion
Reaccion de condensacion Stoicheon
Stoicheon Cintica
Cintica Qumica
Qumica Cintica
Cintica Enlace dativo
Enlace dativo Qumica
Qumica Formula estrutural
Formula estrutural Tabla qumica
Tabla qumica Os atomos sao formados por protons neutrons e eletrons
Os atomos sao formados por protons neutrons e eletrons















































