Propriedades peridicas Propriedades peridicas e aperidicas Propriedades peridicas










- Slides: 17

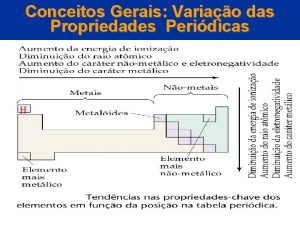
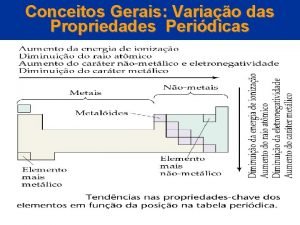
Propriedades periódicas

Propriedades periódicas e aperiódicas Propriedades periódicas: ocorrem à medida que o número atômico de um elemento químico aumenta, ou seja, assume valores que crescem e decrescem em cada período da Tabela Periódica. Entre as propriedades periódicas temos: raio atômico, energia de ionização, eletroafinidade, eletronegatividade

Propriedades periódicas e aperiódicas Propriedades aperiódicas: os valores desta propriedade variam à medida que o número atômico aumenta, mas não obedecem a posição na Tabela, ou seja, não se repetem em períodos regulares. Entre as propriedades aperiódicas temos: calor específico, índice de refração, dureza e massa atômica.

Raio atômico É a distância do núcleo do átomo até o seu elétron mais externo (camada de valência). Como consequência do átomo não ser rígido é impossível calcular o seu raio atômico exato. Deste modo, calcula-se o seu raio atômico médio.

Propriedades periódicas Raio atômico


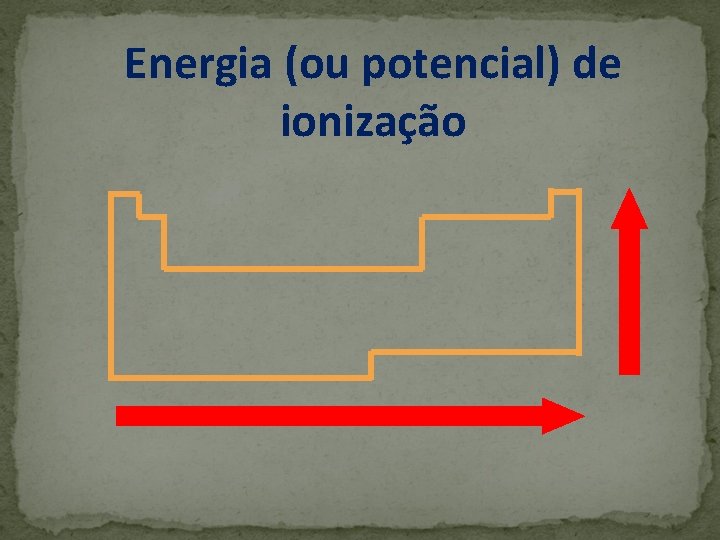
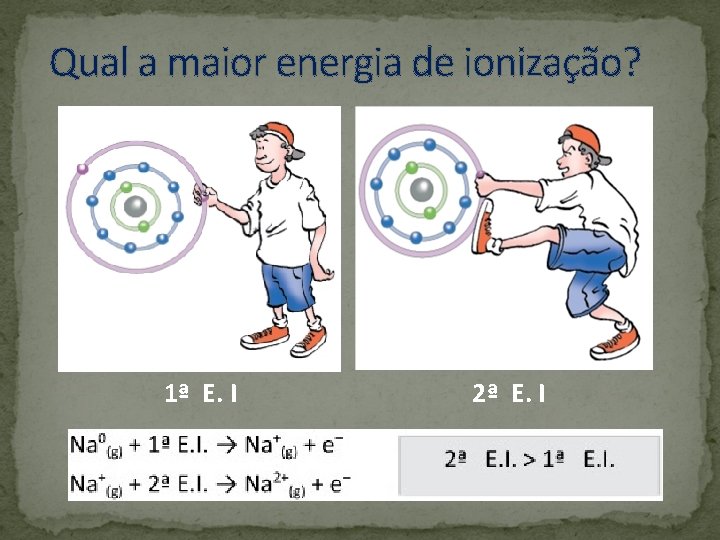
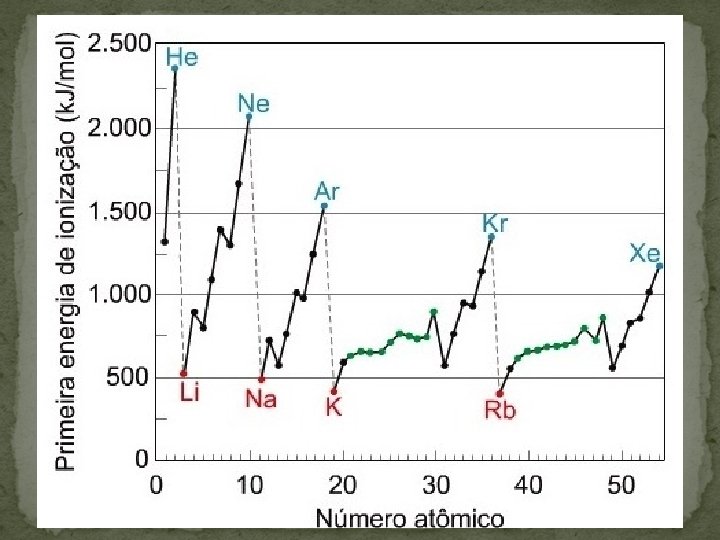
Energia (ou potencial) de ionização É a energia necessária para remover um ou mais elétrons de um átomo isolado no estado gasoso. Em uma família cresce de cima para baixo, a medida em que as camadas eletrônicas aumentam, sendo o elétron menos atraído pelo núcleo. No período, cresce da direita para a esquerda, acompanhando o crescimento do número atômico (Z), o que faz a camada de valência ficar mais próxima do núcleo. X (g) + Energia → X+(g) + e-

Energia (ou potencial) de ionização


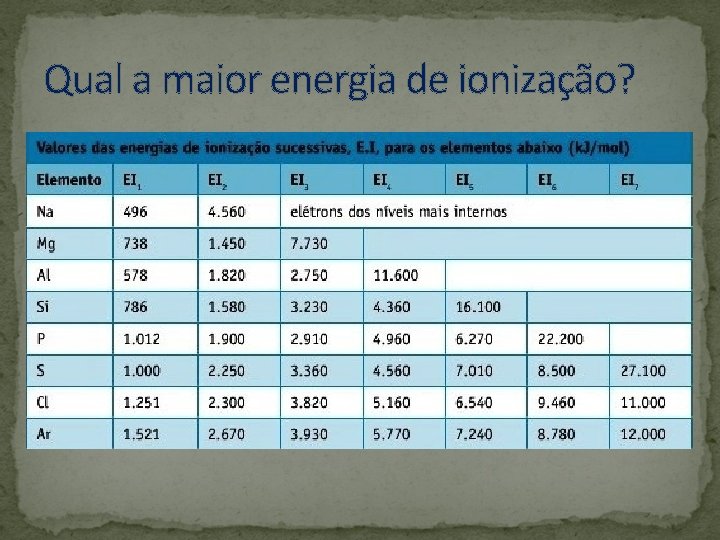
Qual a maior energia de ionização? 1ª E. I 2ª E. I

Qual a maior energia de ionização?


Afinidade eletrônica ou eletroafinidade É a quantidade de energia envolvida quando um átomo isolado, no estado gasoso, recebe um elétron formando um íon negativo. X (g) + e- → X-(g) + Energia

Afinidade eletrônica ou eletroafinidade

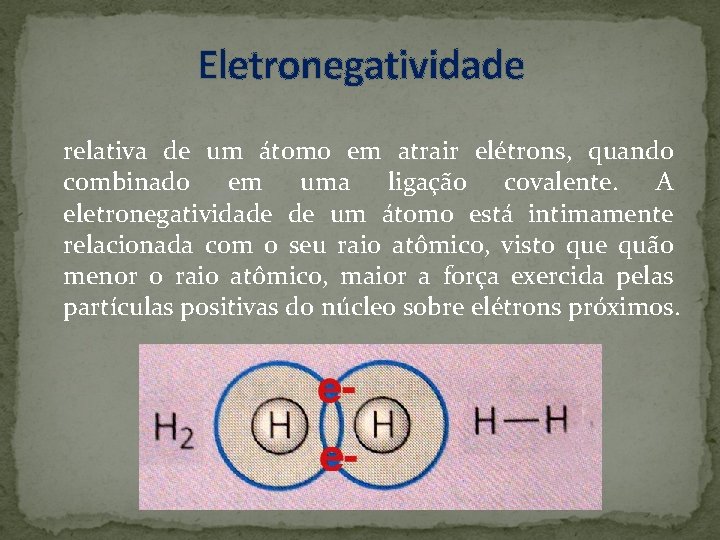
Eletronegatividade relativa de um átomo em atrair elétrons, quando combinado em uma ligação covalente. A eletronegatividade de um átomo está intimamente relacionada com o seu raio atômico, visto que quão menor o raio atômico, maior a força exercida pelas partículas positivas do núcleo sobre elétrons próximos.

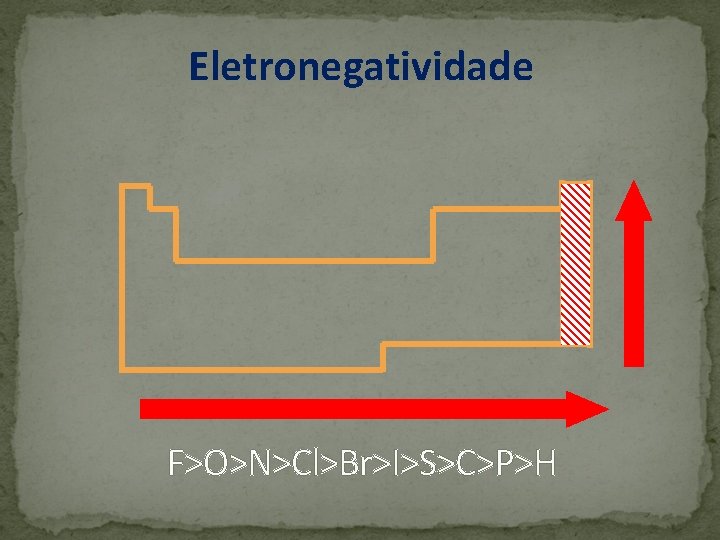
Eletronegatividade F>O>N>Cl>Br>I>S>C>P>H

 Peridicas
Peridicas Propriedades aperiodicas
Propriedades aperiodicas Raio atômico
Raio atômico Peridicas
Peridicas Isoeletronicos
Isoeletronicos Peridicas
Peridicas Peridicas
Peridicas Volumen atomico
Volumen atomico Peridicas
Peridicas Isoelectrónico
Isoelectrónico Características de los no metales
Características de los no metales Peridicas
Peridicas Característica de los metales
Característica de los metales Numero natural
Numero natural Efeitos coligativos
Efeitos coligativos Aplique as propriedades dos logaritmos
Aplique as propriedades dos logaritmos Propriedades gerais exemplos
Propriedades gerais exemplos Regra de cramer
Regra de cramer