PROPRIEDADES COLIGATIVAS Presso DIAGRAMA DE FASES DA GUA



















- Slides: 31

PROPRIEDADES COLIGATIVAS

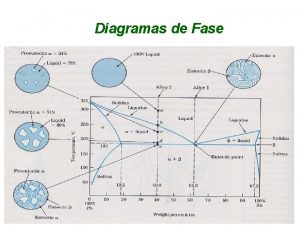
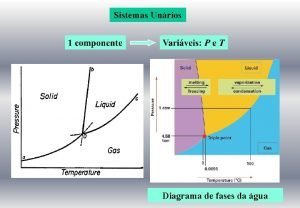
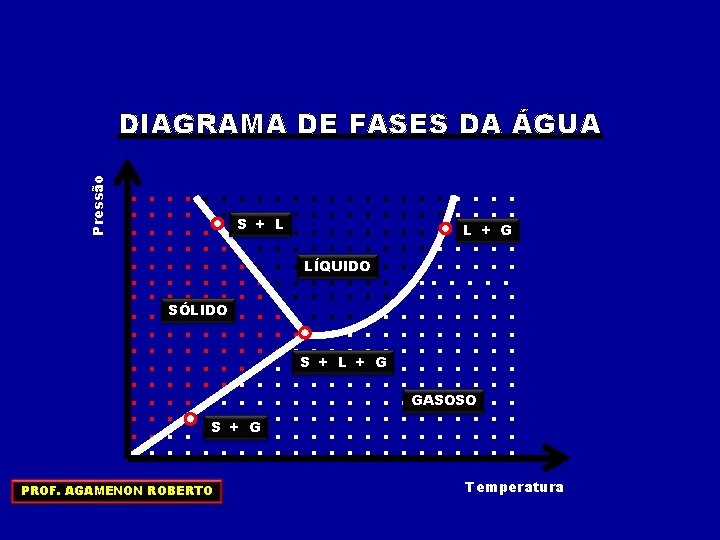
Pressão DIAGRAMA DE FASES DA ÁGUA. . . S. +. . . SÓLIDO. . . S. +. G. . . . PROF. AGAMENON ROBERTO . . L. . . . . LÍQUIDO. . . . . S. +. L. +. G. . . . . . . GASOSO. . . . Temperatura

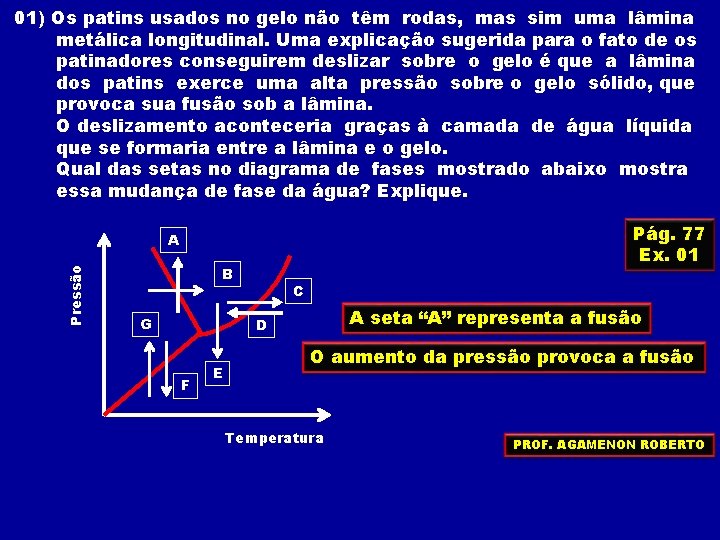
01) Os patins usados no gelo não têm rodas, mas sim uma lâmina metálica longitudinal. Uma explicação sugerida para o fato de os patinadores conseguirem deslizar sobre o gelo é que a lâmina dos patins exerce uma alta pressão sobre o gelo sólido, que provoca sua fusão sob a lâmina. O deslizamento aconteceria graças à camada de água líquida que se formaria entre a lâmina e o gelo. Qual das setas no diagrama de fases mostrado abaixo mostra essa mudança de fase da água? Explique. Pág. 77 Ex. 01 Pressão A B G C A seta “A” representa a fusão D F E O aumento da pressão provoca a fusão Temperatura PROF. AGAMENON ROBERTO

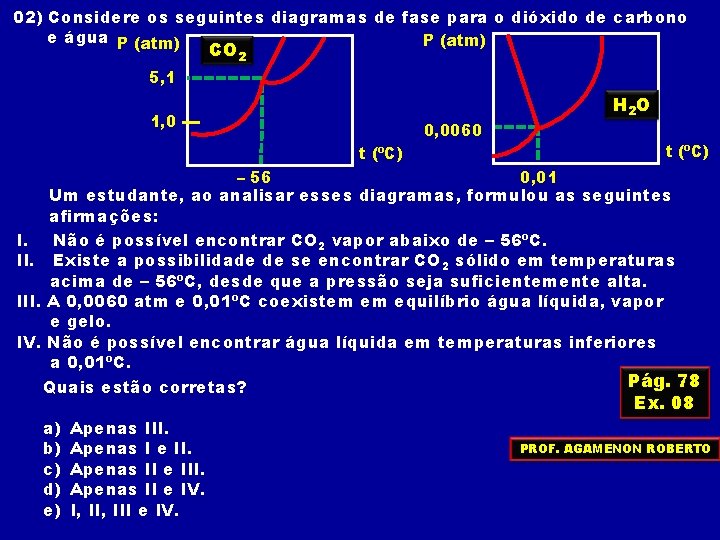
02) Considere os seguintes diagramas de fase para o dióxido de carbono e água P (atm) CO 2 5, 1 1, 0 H 2 O 0, 0060 t (ºC) – 56 0, 01 Um estudante, ao analisar esses diagramas, formulou as seguintes afirmações: I. Não é possível encontrar CO 2 vapor abaixo de – 56ºC. II. Existe a possibilidade de se encontrar CO 2 sólido em temperaturas acima de – 56ºC, desde que a pressão seja suficientemente alta. III. A 0, 0060 atm e 0, 01ºC coexistem em equilíbrio água líquida, vapor e gelo. IV. Não é possível encontrar água líquida em temperaturas inferiores a 0, 01ºC. Pág. 78 Quais estão corretas? Ex. 08 a) b) c) d) e) Apenas III. Apenas I e II. Apenas II e IV. I, III e IV. PROF. AGAMENON ROBERTO

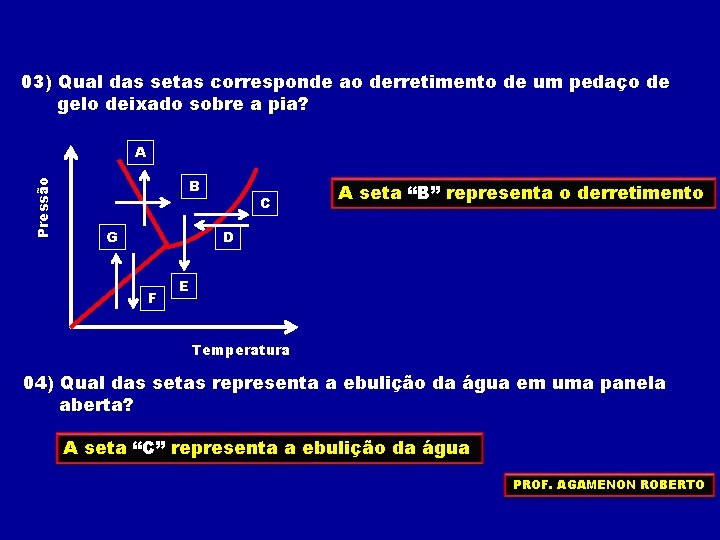
03) Qual das setas corresponde ao derretimento de um pedaço de gelo deixado sobre a pia? Pressão A B G C A seta “B” representa o derretimento D F E Temperatura 04) Qual das setas representa a ebulição da água em uma panela aberta? A seta “C” representa a ebulição da água PROF. AGAMENON ROBERTO

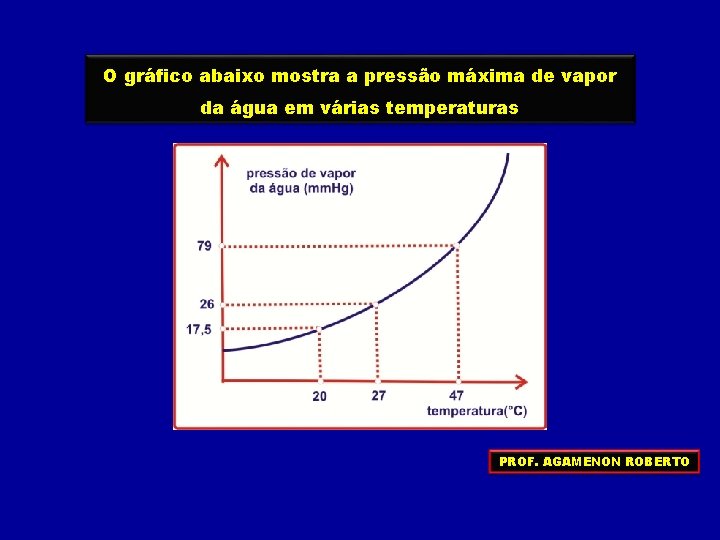
PRESSÃO DE VAPOR DE UM LÍQUIDO VÁCUO ÁGUA 0 mm. Hg a 20°C TEMPO ÁGUA 17, 5 mm. Hg a 20°C Temos um líquido se encontra em um e, A pressão queque oevapora vapor exerce no Inicialmente o líquido rapidamente recipiente fechado e que entre o líquido e a tampa do equilíbrio líquido-vapor denomina-se de constante depois esta evaporação vai diminuindo, até ficar recipiente tem vácuo PRESSÃO MÁXIMA DE VAPOR PROF. AGAMENON ROBERTO

FATORES QUE INFLUEM NA PRESSÃO MÁXIMA DE VAPOR NATUREZA DO LÍQUIDO ÁGUA 17, 5 mm. Hg a 20°C 442 mm. Hg a 20°C ÉTER Líquidos MAIS VOLÁTEIS possuem MAIOR PRESSÃO MÁXIMA DE VAPOR PROF. AGAMENON ROBERTO

FATORES QUE INFLUEM NA PRESSÃO MÁXIMA DE VAPOR TEMPERATURA EM QUE SE ENCONTRA O LÍQUIDO ÁGUA 26 mm. Hg a 27°C ÁGUA 79 mm. Hg a 47°C Como a formação dos vapores é um fenômeno endotérmico, um aumento de temperatura favorece a sua formação, aumentando, assim, a pressão máxima dos vapores. PROF. AGAMENON ROBERTO

O gráfico abaixo mostra a pressão máxima de vapor da água em várias temperaturas PROF. AGAMENON ROBERTO

A PRESSÃO DE VAPOR NÃO DEPENDE DO VOLUME DO LÍQUIDO PROF. AGAMENON ROBERTO

A EBULIÇÃO DE UM LÍQUIDO Quando um líquido é aquecido. . . forma-se bolhas de vapores do líquido. . . essas bolhas não sobem imediatamente à superfície. . . isto só ocorre quando a pressão dentro da bolha iguala-se à pressão externa A esse fenômeno damos o nome de EBULIÇÃO PROF. AGAMENON ROBERTO

pressão externa diminui pressão externa aumenta temperatura de ebulição diminui aumenta PROF. AGAMENON ROBERTO

PROF. AGAMENON ROBERTO

01) Tendo em vista o momento em que um líquido se encontra em equilíbrio com seu vapor, leia as afirmações a seguir: I. A evaporação e a condensação ocorrem com a mesma velocidade verdadeiro II. Não há transferência de moléculas entre o líquido e o vapor falso III. A pressão de vapor do sistema se mantém constante verdadeiro IV. A concentração do vapor depende do tempo Pág. 83 Ex. 17 falso Das afirmações citadas, são FALSAS a) b) c) d) e) I e III. II e IV. II e III. I e II. III e IV. PROF. AGAMENON ROBERTO

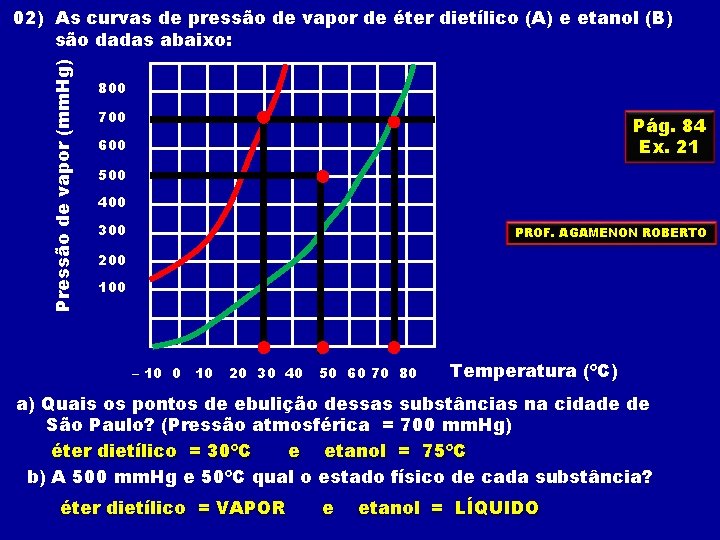
Pressão de vapor (mm. Hg) 02) As curvas de pressão de vapor de éter dietílico (A) e etanol (B) são dadas abaixo: 800 700 Pág. 84 Ex. 21 600 500 400 300 PROF. AGAMENON ROBERTO 200 100 – 10 0 10 20 30 40 50 60 70 80 Temperatura (ºC) a) Quais os pontos de ebulição dessas substâncias na cidade de São Paulo? (Pressão atmosférica = 700 mm. Hg) éter dietílico = 30ºC e etanol = 75ºC b) A 500 mm. Hg e 50ºC qual o estado físico de cada substância? éter dietílico = VAPOR e etanol = LÍQUIDO

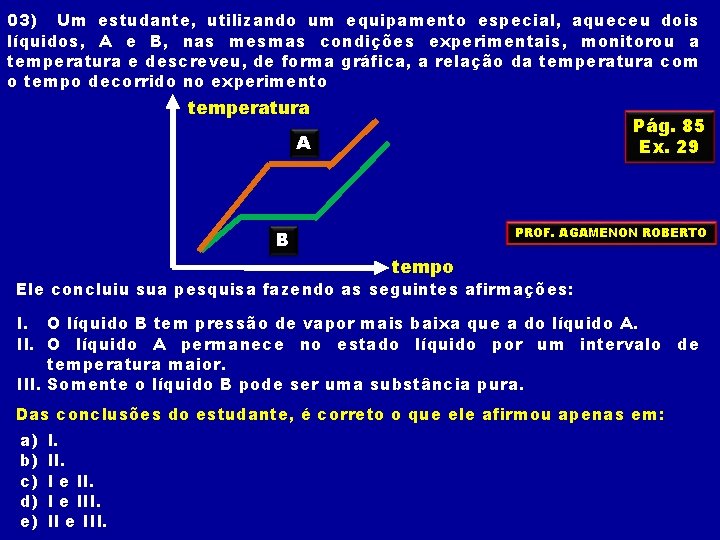
03) Um estudante, utilizando um equipamento especial, aqueceu dois líquidos, A e B, nas mesmas condições experimentais, monitorou a temperatura e descreveu, de forma gráfica, a relação da temperatura com o tempo decorrido no experimento temperatura Pág. 85 Ex. 29 A PROF. AGAMENON ROBERTO B tempo Ele concluiu sua pesquisa fazendo as seguintes afirmações: I. O líquido B tem pressão de vapor mais baixa que a do líquido A. II. O líquido A permanece no estado líquido por um intervalo de temperatura maior. III. Somente o líquido B pode ser uma substância pura. Das conclusões do estudante, é correto o que ele afirmou apenas em: a) b) c) d) e) I. I e III. II e III.

PROPRIEDADES COLIGATIVAS São propriedades observadas em uma solução, quando comparada com seu solvente puro, que dependem apenas da quantidade do soluto As propriedades coligativas são. . . Ø Tonoscopia. Ø Crioscopia. Ø Ebulioscopia. Ø Osmometria. PROF. AGAMENON ROBERTO

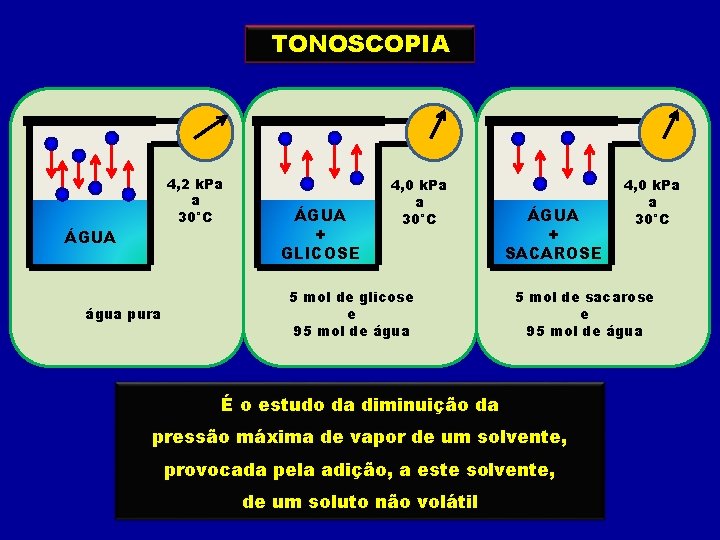
TONOSCOPIA 4, 2 k. Pa a 30°C ÁGUA água pura ÁGUA + GLICOSE 4, 0 k. Pa a 30°C 5 mol de glicose e 95 mol de água ÁGUA + SACAROSE 5 mol de sacarose e 95 mol de água É o estudo da diminuição da pressão máxima de vapor de um solvente, provocada pela adição, a este solvente, de um soluto não volátil 4, 0 k. Pa a 30°C

EBULIOSCOPIA te te t’e ÁGUA + GLICOSE ÁGUA É o estudo da elevação da temperatura de ebulição de um solvente, provocada pela adição, a este solvente, de um soluto não volátil PROF. AGAMENON ROBERTO

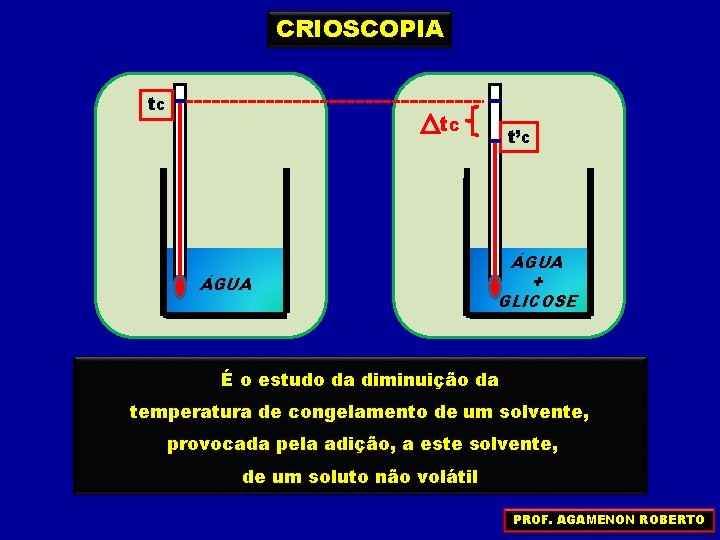
CRIOSCOPIA t. C ÁGUA t’C ÁGUA + GLICOSE É o estudo da diminuição da temperatura de congelamento de um solvente, provocada pela adição, a este solvente, de um soluto não volátil PROF. AGAMENON ROBERTO

Alguns materiais permitem a passagem de moléculas de solvente, mas não permitem a passagem do soluto desta solução MESMA CONCENTRAÇÃO SOLUÇÃO DILUÍDA CONCENTRADA SOLVENTE O fenômeno da passagem do solvente de um meio mais diluído Tais materiais são denominados de para um meio mais concentrado, MEMBRANAS SEMIPERMEÁVEIS por meio de uma membrana semipermeável chama-se OSMOSE PROF. AGAMENON ROBERTO

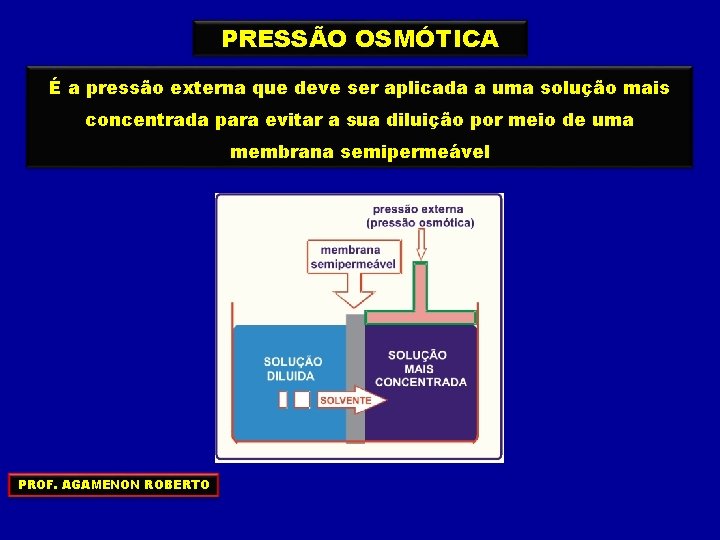
PRESSÃO OSMÓTICA É a pressão externa que deve ser aplicada a uma solução mais concentrada para evitar a sua diluição por meio de uma membrana semipermeável PROF. AGAMENON ROBERTO

A pressão externa que deve ser aplicada a uma solução mais concentrada para evitar a sua diluição por meio de uma membrana semipermeável chama-se PRESSÃO OSMÓTICA ( Л ) PRESSÃO EXTERNA SOLVENTE SOLUÇÃO DILUÍDA SOLUÇÃO CONCENTRADA PROF. AGAMENON ROBERTO

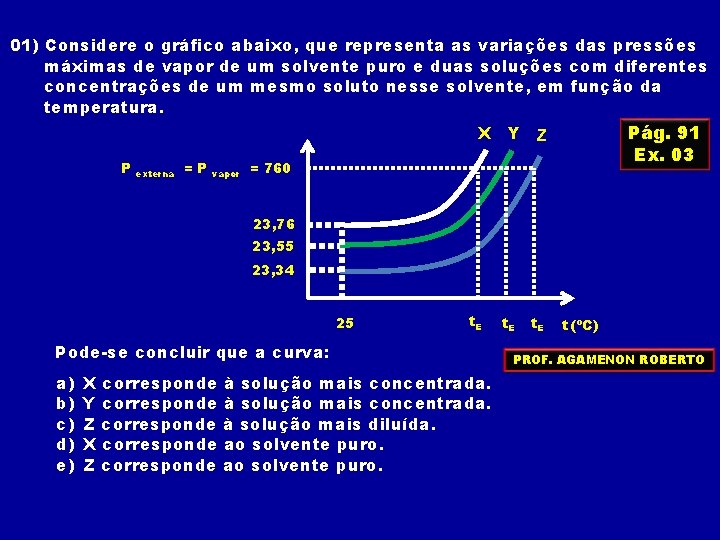
01) Considere o gráfico abaixo, que representa as variações das pressões máximas de vapor de um solvente puro e duas soluções com diferentes concentrações de um mesmo soluto nesse solvente, em função da temperatura. Pág. 91 Ex. 03 X Y Z P externa =P vapor = 760 23, 76 23, 55 23, 34 25 t. E Pode-se concluir que a curva: a) b) c) d) e) X corresponde à solução mais concentrada. Y corresponde à solução mais concentrada. Z corresponde à solução mais diluída. X corresponde ao solvente puro. Z corresponde ao solvente puro. t. E t (ºC) PROF. AGAMENON ROBERTO

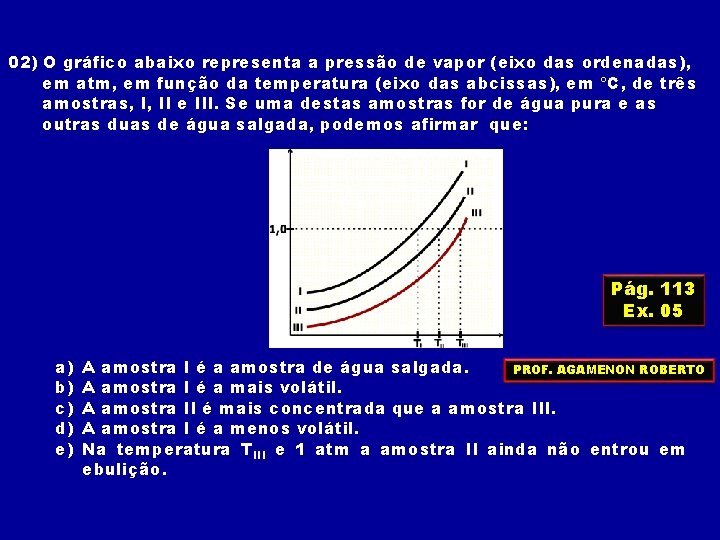
02) O gráfico abaixo representa a pressão de vapor (eixo das ordenadas), em atm, em função da temperatura (eixo das abcissas), em C, de três amostras, I, II e III. Se uma destas amostras for de água pura e as outras duas de água salgada, podemos afirmar que: Pág. 113 Ex. 05 a) b) c) d) e) A amostra I é a amostra de água salgada. PROF. AGAMENON ROBERTO A amostra I é a mais volátil. A amostra II é mais concentrada que a amostra III. A amostra I é a menos volátil. Na temperatura TIII e 1 atm a amostra II ainda não entrou em ebulição.

03) Algumas pessoas requentam em banho-maria o café preparado, conforme a ilustração abaixo. Sobre essa situação, cada um de cinco estudantes afirmaram: café I. água pura Pág. 95 Ex. 14 O café e a água do banho-maria começam a ferve ao mesmo tempo. II. O café vai ferver, mas a água do banho-maria não. III. O café não vai ferver, mas a água do banho-maria sim. IV. Nem a água do banho-maria nem o café podem ferver. V. O café e a água do banho-maria podem ferver, mas o café começa a ferver primeiro. PROF. AGAMENON ROBERTO Considerando o café uma solução aquosa de solutos não voláteis, responda: com qual dessas afirmações você concorda? Explique.

03) Sabe-se que por osmose o solvente de uma solução mais diluída atravessa uma membrana semipermeável em direção da solução mais concentrada. Sabe-se, também, que um peixe de água doce é hipertônico em relação a água do rio e hipotônico a água do mar. Se um peixe de água doce for colocado na água do mar ele: a) morre porque entra água do mar no seu corpo. b) morre porque sai água do seu corpo. c) morre porque entra sal no seu corpo. d) morre porque sai sal do seu corpo. e) sobrevive normalmente. Pág. 105 Ex. 05 PROF. AGAMENON ROBERTO


04) Em dois recipientes A e B, (conforme o esquema abaixo) colocamos, respectivamente, uma solução 2, 0 mol/L de sacarose em água e uma solução 0, 2 mol/L de sacarose em água, ambos no mesmo nível inicial. Com o passar do tempo, observa-se que: Solução A a) b) c) d) e) o nível de A sobe e o nível de B baixa. o nível de A baixa e o nível de B sobe. ambos os níveis sobem. ambos os níveis descem. os níveis permanecem inalterados. Solução B PROF. AGAMENON ROBERTO

05) (Puccamp-SP) Considere o texto adiante. “Se as células vermelhas do sangue forem removidas para um béquer contendo água destilada, há passagem da água para. . . (I). . das células. Se as células forem colocadas numa solução salina concentrada, há migração da água para. . (II). . . das células com o. . (III). . . das mesmas. As soluções projetadas para injeções endovenosas devem ter. . . (IV). . . próximas às das soluções contidas nas células. ” Para completar correta-lo corretamente, I, III e IV devem ser substituídos, respectivamente, por: a) dentro – fora – enrugamento – pressão osmótica. b) fora – dentro – inchaço – condutividade térmica. c) dentro – fora – enrugamento – colorações. d) fora – enrugamento – temperatura de ebulição. e) dentro – inchaço – densidades. PROF. AGAMENON ROBERTO

06) Os compartimentos A, B e C são iguais e separados por uma membrana semipermeável ao solvente. Em um dos compartimentos colocou-se água destilada; e, nos outros, igual volume de soluções de cloreto de sódio (sistema I). Após algum tempo os volumes iniciais se modificaram como está ilustrado no sistema (II). Use essas informações e outras que forem necessárias para analisar os itens: (II) (I) A B C 0 0 A alteração do volume se deve à osmose. 1 1 A concentração inicial das soluções é a mesma. 2 2 A água destilada foi colocada no compartimento B. 3 3 A pressão osmótica em A é maior que em C. 4 4 As soluções têm mesma pressão de vapor, a dada temperatura. PROF. AGAMENON ROBERTO
 Propriedades coligativas
Propriedades coligativas Agua gua gua
Agua gua gua Propriedades coligativas tonoscopia
Propriedades coligativas tonoscopia Efeitos coligativos
Efeitos coligativos La senna al ponte di iena gauguin
La senna al ponte di iena gauguin Diagrama t vs v
Diagrama t vs v Diagrama de fases solido liquido
Diagrama de fases solido liquido Diagrama de fases eutético
Diagrama de fases eutético Aleacion hipoeutectica
Aleacion hipoeutectica @gua siapa:https://workupload.com/file/e2mbajkfbpc
@gua siapa:https://workupload.com/file/e2mbajkfbpc Gua apa
Gua apa Batu sisa di malaysia
Batu sisa di malaysia Gua de
Gua de Porta gua
Porta gua Gua n
Gua n Gua de
Gua de A noite estava fria
A noite estava fria Gua n
Gua n Gua de
Gua de Como gua
Como gua Habilidad locomoción
Habilidad locomoción Gua 9
Gua 9 Gua n
Gua n Genesis capitulo 1
Genesis capitulo 1 Mapa conceptual sobre el sismo
Mapa conceptual sobre el sismo Mispagosprovincial
Mispagosprovincial Encuentra diptongos
Encuentra diptongos Gua itzel
Gua itzel Como calcular la constante ebulloscopica
Como calcular la constante ebulloscopica Propiedad coligativa
Propiedad coligativa Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Propiedades coligativas
Propiedades coligativas