PROPRIEDADES COLIGATIVAS Propriedades Coligativas n So mudanas que















































- Slides: 51

PROPRIEDADES COLIGATIVAS

Propriedades Coligativas n São mudanças que ocorrem no comportamento de um líquido ao se adicionar um soluto não volátil. n Quando comparamos, em análise química, um líquido puro e uma solução desse líquido como solvente, a presença de soluto provoca mudanças.

Propriedades Coligativas n As propriedades coligativas dependem unicamente do número de entidades dispersas de soluto e não da natureza do mesmo. NÃO DEPENDEM DA Natureza da molécula! Ex. : • Massa molecular • Geometria da molécula

Situações Cotidianas n. O uso de aditivos, como o etilenoglicol, à água do radiador de carros evita que ela entre em ebulição, no caso de um superaquecimento do motor.

Situações Cotidianas n Nos países em que o inverno é rigoroso, esse mesmo aditivo tem o efeito de evitar o congelamento da água do radiador.

Situações Cotidianas n Em países onde no inverno a neve é frequente, o cloreto de cálcio ou cloreto de sódio espalhados nas rodovias para abaixar o ponto de congelamento da água.

Situações Cotidianas n Em verduras cruas com sal, as células perdem água mais rapidamente, murchando em pouco tempo.

Situações Cotidianas n Formação de icebergs a partir da água do mar, ocorre congelamento somente da água. Icebergs são constituídos de água pura. A água do mar permanece líquida mesmo abaixo de 0ºC.

Situações Cotidianas n É comum o uso do gelo em mictórios masculinos de bares. O gelo diminui a temperatura da urina e desta forma, reduz a volatilidade das substâncias que exalam cheiro desagradável, ou seja diminui a pressão de vapor.

Situações Cotidianas n Se adiciona sal a uma mistura de água e gelo para gelar mais rápido certas bebidas.

Propriedades Coligativas n TONOSCOPIA - Diminui a pressão de vapor. n EBULIOSCOPIA - Aumenta o ponto de ebulição. n CRIOSCOPIA congelamento. n OSMOSCOPIA osmótica. - Diminui - o Aumenta ponto a de pressão

PRESSÃO MÁXIMA DE VAPOR Todos sabem que um franco aberto, a evaporação ocorre continuamente até o líquido desapareça. Nesse processo, as ligações intermoleculares se rompem e o líquido passa para o estado vapor.

n Num sistema fechado: o líquido tende a evaporar e o vapor tende a se condensar até que atinjam um equilíbrio. n Quando a Vevaporação = Vcondensação dizemos que a pressão exercida pelos vapores saturantes do líquido atingiram a Pressão Máxima de Vapor.

Líquidos diferentes, em uma dada temperatura, apresentam diferentes pressões máximas de vapor.


PRESSÃO DE VAPOR E TEMPERATURA DE EBULIÇÃO * Um líquido entra em ebulição quando a sua pressão de vapor se iguala a pressão externa (atmosférica).

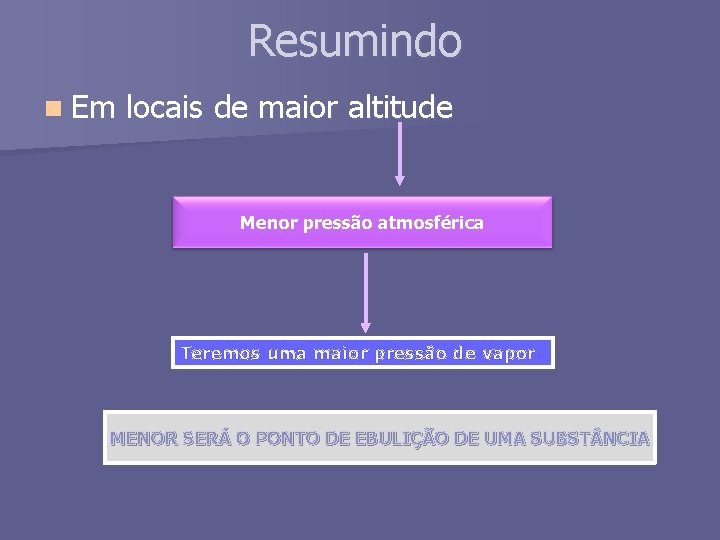
Resumindo n Em locais de maior altitude Menor pressão atmosférica Teremos uma maior pressão de vapor MENOR SERÁ O PONTO DE EBULIÇÃO DE UMA SUBST NCIA

TONOSCOPIA n Diminuição da pressão de vapor de um líquido, provocada pela presença de um soluto não-volátil. n Líquido Puro tem uma pressão de vapor (P 0). n Líquido na solução tem pressão de vapor P 2 (menor). n Pela adição de um soluto essa pressão de vapor tende a diminuir.

TONOSCOPIA

Diminuição da Pressão de Vapor

Fatores que influenciam a Pressão Máxima de Vapor n Temperatura: A pressão de vapor aumenta como aumento da temperatura. n Natureza do Soluto: Cada líquido apresenta uma pressão de vapor característica numa mesma temperatura.




Pressão de Vapor Pressão de vapor T ebulição volatilidade

PRESSÃO n n n Pressão de vapor de um líquido puro: cresce com o aumento da temperatura. Onde a pressão é menor 1 atm, a evaporação é mais rápida. Se sobre a superfície do líquido não existe nenhuma pressão (vácuo), a evaporação ocorre de forma violenta e rápida. Onde a pressão é maior que 1 atm, e evaporação é mais lenta. Quanto menor a pressão do vapor do líquido, maior o ponto de ebulição do mesmo. Quanto maior a pressão do vapor do liquido, menor o ponto de ebulição do mesmo.

EBULIOSCOPIA n Elevação do ponto de ebulição de um líquido, provocada pela presença de um soluto não-volátil. n Um líquido entra em ebulição (ferve) quando a pressão de vapor é igual pressão atmosférica.

Exemplo prático de A água do mar (mistura de água+Sal) ferve a uma temperatura maior que a água pura ebulição É como se as partículas do soluto "segurassem" as partículas do solvente, dificultando sua passagem ao estado gasoso.

No nível do mar n Pressão Atmosférica = 760 mm. Hg = 1 atm n Água ferve à 100 ºC n Onde a pressão for menor, a temperatura de ebulição será menor. Ex: [La Paz (Bolívia) 90ºc] n Onde a pressão for maior que 1 atm, a temperatura de ebulição será maior. Ex: [panela de pressão 120 ºC]

CRIOSCOPIA n Abaixamento do ponto de congelamento de um líquido, provocado pela presença de um soluto não-volátil. n Com a adição de soluto, a pressão de vapor diminui, a temperatura de ebulição aumenta e a temperatura de congelamento diminui.

CRIOSCOPIA Exemplo prático de CRIOSCOPIA A água do mar (mistura de água+Sal) CONGELA a uma temperatura MENOR que a água pura

CRIOSCOPIA x EBULIOSCOPIA

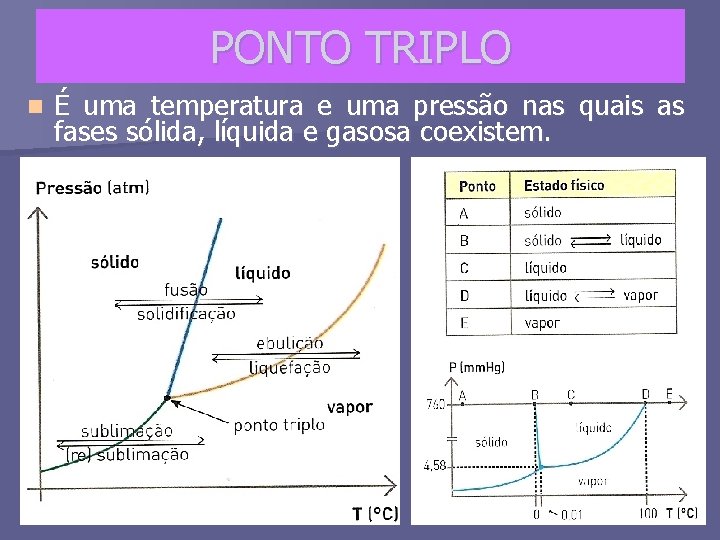
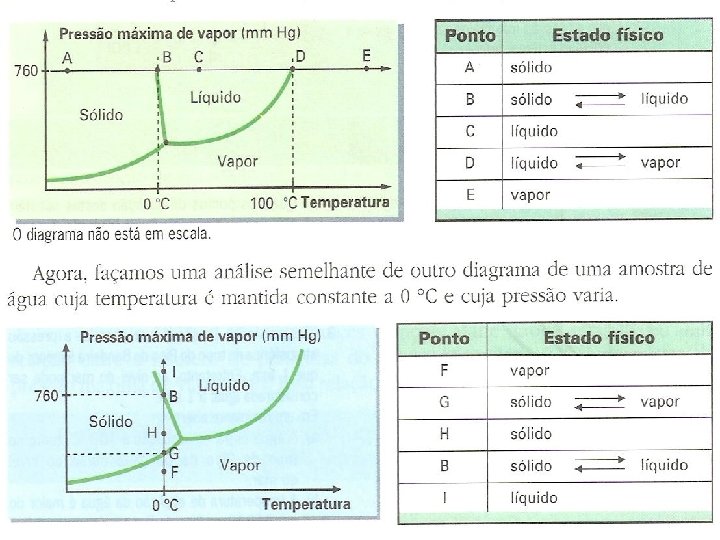
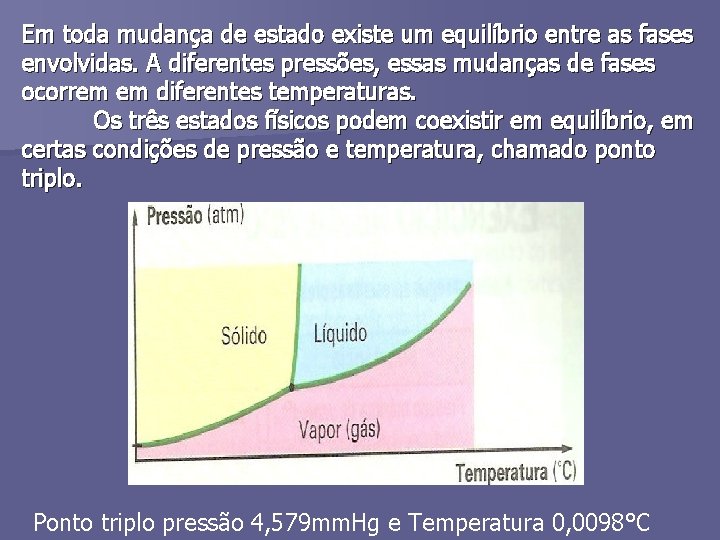
PONTO TRIPLO n É uma temperatura e uma pressão nas quais as fases sólida, líquida e gasosa coexistem.


Em toda mudança de estado existe um equilíbrio entre as fases envolvidas. A diferentes pressões, essas mudanças de fases ocorrem em diferentes temperaturas. Os três estados físicos podem coexistir em equilíbrio, em certas condições de pressão e temperatura, chamado ponto triplo. Ponto triplo pressão 4, 579 mm. Hg e Temperatura 0, 0098°C

Ponto Triplo n A Figura ilustra o ponto triplo. Gelo (iceberg) coexistindo com o líquido no qual flutua, e com a fase gasosa (ar e vapor de água).

OSMOSCOPIA n Fenômeno da disseminação espontânea entre um líquido em outro e vice-versa. n. A difusão de um líquido para outro através de membranas semipermeáveis recebe o nome de OSMOSE

Osmose n. A PRESSÃO DE VAPOR DA ÁGUA PURA (P 0) É MAIOR QUE A DA ÁGUA NA SOLUÇÃO (P). n. A ÁGUA SE DESLOCA DE UMA REGIÃO MENOS CONCETRADA PARA UMA REGIÃO MAIS CONCENTRADA.

Osmose

Hemácias e Bacalhau

PRESSÃO OSMÓTICA n. A mínima pressão externa que deve ser aplicada à solução quando separada do seu solvente puro para impedir a osmose. n Pressão osmótica depende da concentração da solução.

Equação de Van´t Hoff n. A equação da pressão osmótica é igual à equação dos gases perfeitos.

Osmose Reversa Ocorre quando se aplica uma pressão no lado da solução mais salina ou concentrada, revertendose a tendência natural. n Neste caso, a água da solução salina passa para o lado da água pura, ficando retidos os íons dos sais nela dissolvidos. n A pressão a ser aplicada equivale a uma pressão maior do que a pressão osmótica característica da solução. n

Osmose Reversa

Dessalinizadores

BIBLIOGRAFIA n SARDELLA, Antônio. QUÍMICA. Série Novo Ensino Médio. Edição compacta. Volume único. Ática. São Paulo – SP, 2003. http: //www. mspc. eng. br/tecdiv/im 01/agua_diagr_est 1. gif. Acesso em 13/06/09 n n www. profpc. com. br/propri 7. gif acesso em 13/06/09.

Efeitos coligativos Parte quantitativa

LEI DE RAOULT n. A pressão de vapor de um líquido (p 2) como solvente numa solução é igual ao produto da pressão de vapor desse líquido puro (p 0) pela fração molar do solvente.

Depois de algumas Deduções de Fórmulas Para soluções aquosas Kt = 0, 018 EFEITO TONOSCÓPICO

LEI DE RAOULT (ebulioscopia) n. A elevação do ponto de ebulição de um líquido, provocada pela presença de um soluto não-volátil, é diretamente proporcional à molalidade da solução. R = constante de gases T = temperatura em Kelvin Lv = calor latente de vaporização

LEI DE RAOULT (crioscopia) n. O abaixamento da temperatura de congelação de um líquido, provocado pela presença de um soluto não-volátil, é diretamente proporcional à molalidade da solução. R = constante de gases T = temperatura absoluta de congelação do solvente puro Lv = calor latente de fusão do solvente puro