Propriedades Coligativas das solues Propriedades Coligativas So propriedades

















- Slides: 22

Propriedades Coligativas das soluções

Propriedades Coligativas São propriedades observadas em uma solução, quando comparada com seu solvente puro, que dependem apenas da quantidade do soluto Propriedades de uma substância Dentre as propriedades físicas que caracterizam uma substância pura, temos as temperaturas nas quais ocorrem as MUDANÇAS DE ESTADO

AS PROPRIEDADES COLIGATIVAS SÃO: TONOSCOPIA EBULIOSCOPIA CRIOSCOPIA OSMOMETRIA

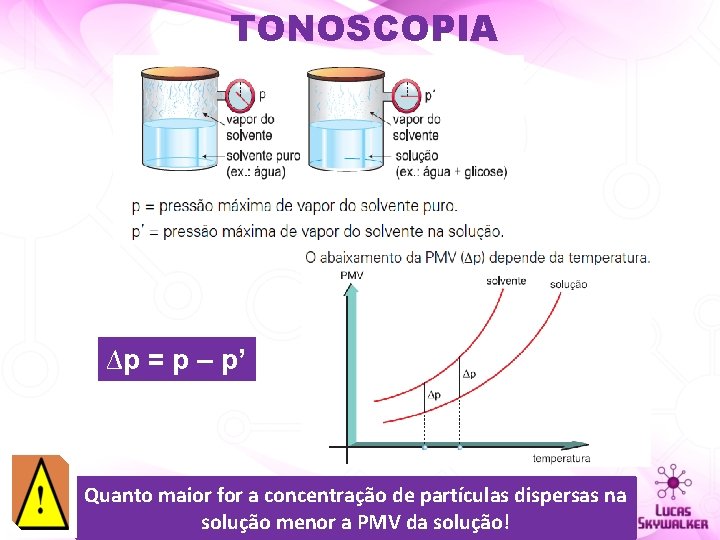
TONOSCOPIA ÁGUA 17, 5 mm. Hg a 20°C ÁGUA + GLICOSE 15 mm. Hg a 20°C É o estudo da diminuição da pressão máxima de vapor de um solvente, provocada pela adição, a este solvente, de um soluto não volátil

TONOSCOPIA ∆p = p – p’ Quanto maior for a concentração de partículas dispersas na solução menor a PMV da solução!

Os três frascos a seguir contêm as seguintes soluções à 25ºC: A – C 12 H 22 O 11(aq) B – Na. Cl(aq) C – Ca. Cl 2(aq) B A PA PB C PC A – C 12 H 22 O 11(aq) → C 12 H 22 O 11(aq) 1 partícula B – Na. Cl(aq) → Na+(aq) + Cl-(aq) 2 partículas C – Ca. Cl 2(aq) → Ca 2+(aq) + 2 Cl-(aq) 3 partículas p. A > p B > p C

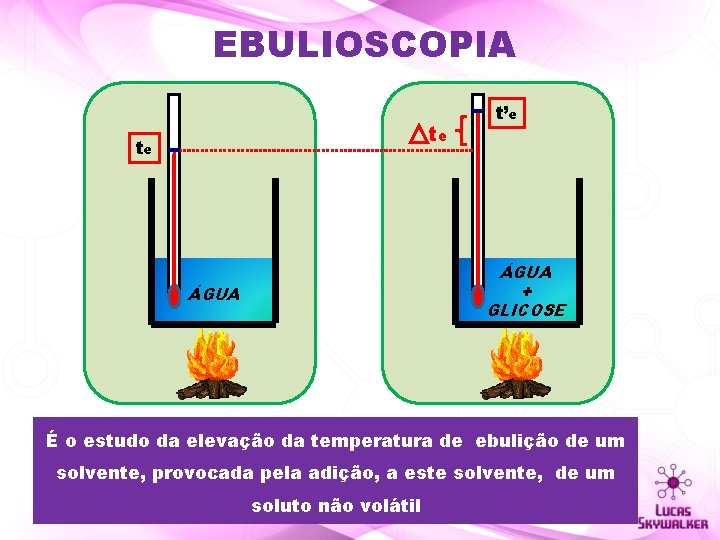
EBULIOSCOPIA te te t’e ÁGUA + GLICOSE ÁGUA É o estudo da elevação da temperatura de ebulição de um solvente, provocada pela adição, a este solvente, de um soluto não volátil

EBULIOSCOPIA ∆te = te 1 – te 0 Quanto maior for a concentração de partículas dispersas na solução maior a temperatura de ebulição da solução!

Exemplo 1: Foi observado que o cozimento de meio quilo de batatas em 1 L de água é mais rápido se adicionarmos 200 g de sal à água do cozimento. Considere as seguintes possíveis explicações para o fato: I. A adição de sal provoca um aumento da temperatura de ebulição da água. II. A adição de sal provoca um aumento da pressão de vapor. III. O sal adicionado não altera a temperatura de ebulição da água, mas reage com o amido das batatas. Está(ao) correta(s) explicação(ões): a) I apenas. b) II apenas. c) III apenas. d) I e II apenas. e) I, II e III.

CRIOSCOPIA t. C ÁGUA t’C ÁGUA + GLICOSE É o estudo da diminuição da temperatura de congelamento de um solvente, provocada pela adição, a este solvente, de um soluto não volátil

CRIOSCOPIA Quanto maior for a concentração de partículas dispersas na solução menor a temperatura de fusão da solução!

Exemplo: A presença de um soluto não-volátil dissolvido em um solvente líquido altera o comportamento deste (x) DIMINUI líquido na sua pressão de vapor que. . . . , no seu ponto (y) AUMENTA de ebulição que. . . . . e no seu ponto de solidificação DIMINUI (z) que. . . Respectivamente, podemos substituir x, y e z por: a) aumenta, diminui e aumenta. b) diminui, aumenta e diminui. c) aumenta, aumenta e diminui. d) diminui, diminui e aumenta. e) diminui, aumenta e aumenta.

Alguns materiais permitem a passagem de moléculas de solvente, mas não permitem a passagem do soluto desta solução SOLUÇÃO MESMA CONCENTRAÇÃO SOLUÇÃO DILUÍDA CONCENTRADA SOLVENTE O fenômeno da passagem do solvente de um meiode mais diluído Tais materiais são denominados para um meio mais concentrado, por meio de uma membrana MEMBRANAS SEMIPERMEÁVEIS semipermeável chama-se OSMOSE

Ex: Uma salada de alface foi temperada com uma solução de vinagre e sal. Após certo tempo, as folhas de alface murcharam. A esse fenômeno chamamos de: a) dispersão. b) tonometria. c) ebuliometria. d) crioscopia. e) osmose.

Ex: Sabe-se que por osmose o solvente de uma solução mais diluída atravessa uma membrana semipermeável em direção da solução mais concentrada. Sabe-se, também, que um peixe de água doce é hipertônico em relação a água do rio e hipotônico a água do mar. Se um peixe de água doce for colocado na água do mar ele: a) morre porque entra água do mar no seu corpo. b) morre porque sai água do seu corpo. c) morre porque entra sal no seu corpo. d) morre porque sai sal do seu corpo. e) sobrevive normalmente.

Osmose “ Aprender por Osmose!” Osmose é a difusão de um líquido através de uma membrana semipermeável

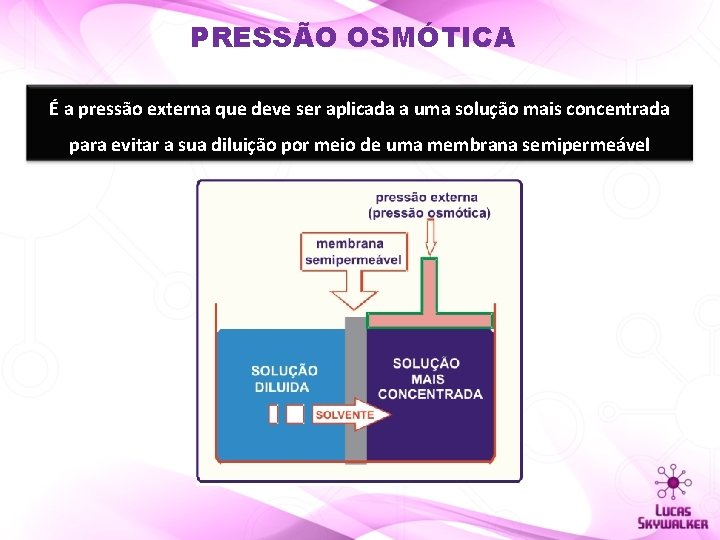
PRESSÃO OSMÓTICA É a pressão externa que deve ser aplicada a uma solução mais concentrada para evitar a sua diluição por meio de uma membrana semipermeável

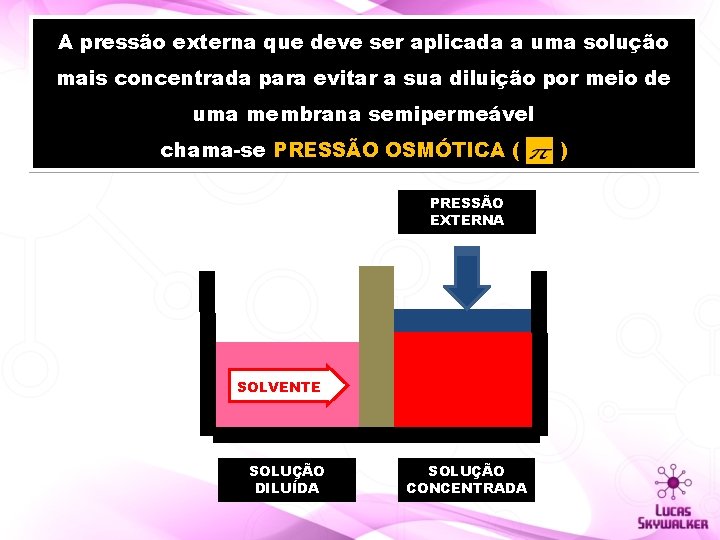
A pressão externa que deve ser aplicada a uma solução mais concentrada para evitar a sua diluição por meio de uma membrana semipermeável chama-se PRESSÃO OSMÓTICA ( PRESSÃO EXTERNA SOLVENTE SOLUÇÃO DILUÍDA SOLUÇÃO CONCENTRADA )

Van’t Hoff Equação da pressão osmótica

Pressão Osmótica (π) Soluções Isotônicas: mesma pressão osmótica. Soluções Hipertônicas: maior pressão osmótica. Soluções Hipotônicas: menor pressão osmótica. Quanto maior for a concentração de partículas dispersas na solução maior a pressão osmótica!

Ex: Considere o texto adiante. “Se as células vermelhas do sangue forem removidas para um béquer contendo água destilada, há passagem da água para. . . (I). . das células. Se as células forem colocadas numa solução salina concentrada, há migração da água para. . (II). . . das células com o. . (III). . . das mesmas. As soluções projetadas para injeções endovenosas devem ter. . . (IV). . . Próximas às das soluções contidas nas células. ” Para completar correta-lo corretamente, I, III e IV devem ser substituídos, respectivamente, por: a) dentro – fora – enrugamento – pressão osmótica. b) fora – dentro – inchaço – condutividade térmica. c) dentro – fora – enrugamento – colorações. d) fora – enrugamento – temperatura de ebulição. e) dentro – inchaço – densidades.

 Propriedades coligativas tonoscopia
Propriedades coligativas tonoscopia Propriedades coligativas slides
Propriedades coligativas slides Propiedades coligativas
Propiedades coligativas Solues
Solues Mistura de solução com reação quimica
Mistura de solução com reação quimica Mistura
Mistura 7 tipos de frisos
7 tipos de frisos Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen Canto v est 92 a 100
Canto v est 92 a 100 Eu fico com a pureza das cri
Eu fico com a pureza das cri Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Jesus spricht ich bin das licht der welt
Jesus spricht ich bin das licht der welt Propiedades constitutivas y coligativas
Propiedades constitutivas y coligativas Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Propiedades coligativas fórmulas
Propiedades coligativas fórmulas Propiedades coligativas
Propiedades coligativas Tecido conjuntivo denso modelado
Tecido conjuntivo denso modelado Divisores de 16
Divisores de 16 Propriedades dos minerais
Propriedades dos minerais Aplique as propriedades dos logaritmos
Aplique as propriedades dos logaritmos Regra de cramer
Regra de cramer Produto escalar de vetores
Produto escalar de vetores Propriedades térmicas da madeira
Propriedades térmicas da madeira






































