QFL 0341 Estrutura e propriedades de Compostos Orgnicos


- Slides: 18

QFL- 0341 – Estrutura e propriedades de Compostos Orgânicos 2. Ligações químicas localizadas Em moléculas orgânicas Prof. Dr. Daniel Nopper Silva Rodrigues dannopper@usp. br

QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos Tópicos da Aula A) Comparações 2

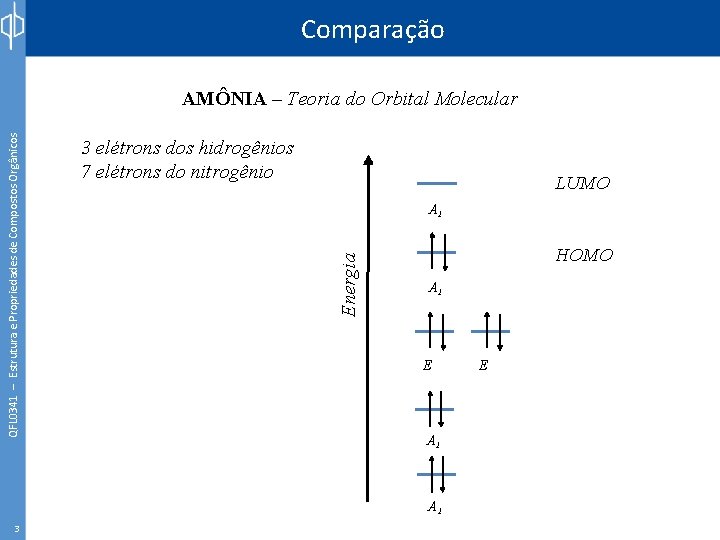
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio LUMO A 1 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 3 E

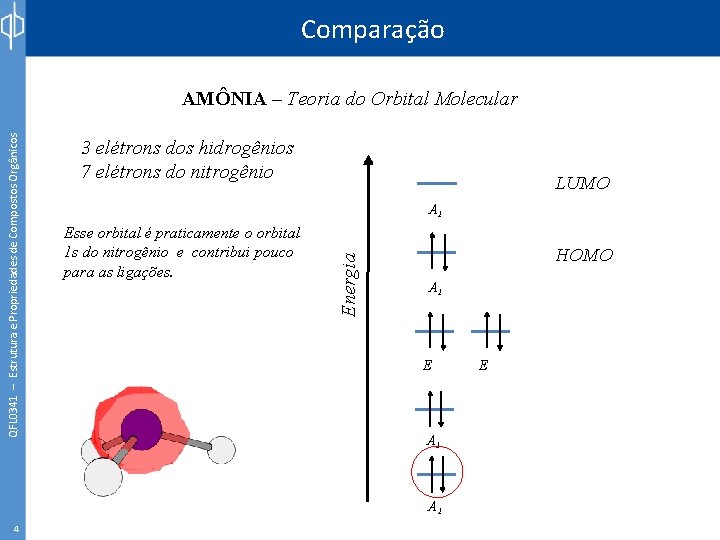
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio LUMO A 1 Esse orbital é praticamente o orbital 1 s do nitrogênio e contribui pouco para as ligações. Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 4 E

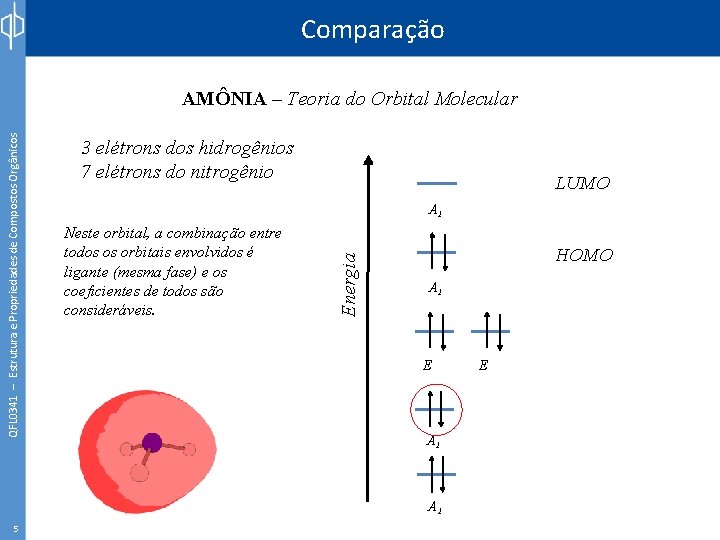
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio LUMO A 1 Neste orbital, a combinação entre todos os orbitais envolvidos é ligante (mesma fase) e os coeficientes de todos são consideráveis. Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 5 E

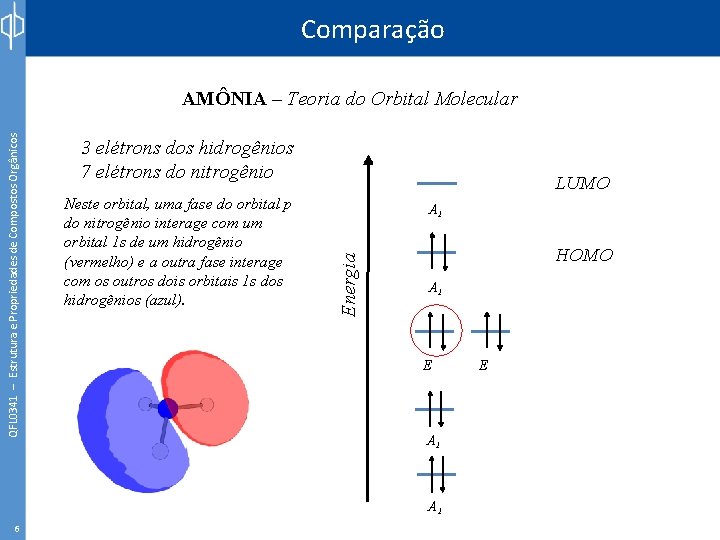
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio Neste orbital, uma fase do orbital p do nitrogênio interage com um orbital 1 s de um hidrogênio (vermelho) e a outra fase interage com os outros dois orbitais 1 s dos hidrogênios (azul). LUMO A 1 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 6 E

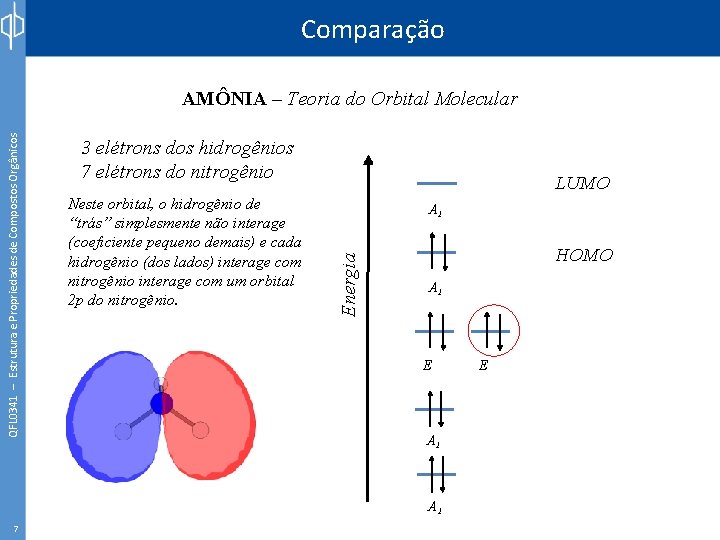
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio Neste orbital, o hidrogênio de “trás” simplesmente não interage (coeficiente pequeno demais) e cada hidrogênio (dos lados) interage com nitrogênio interage com um orbital 2 p do nitrogênio. LUMO A 1 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 7 E

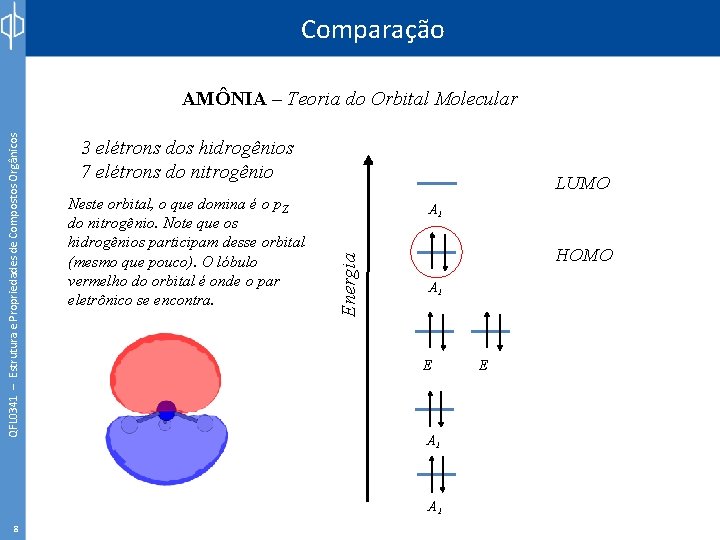
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio Neste orbital, o que domina é o p. Z do nitrogênio. Note que os hidrogênios participam desse orbital (mesmo que pouco). O lóbulo vermelho do orbital é onde o par eletrônico se encontra. LUMO A 1 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 8 E

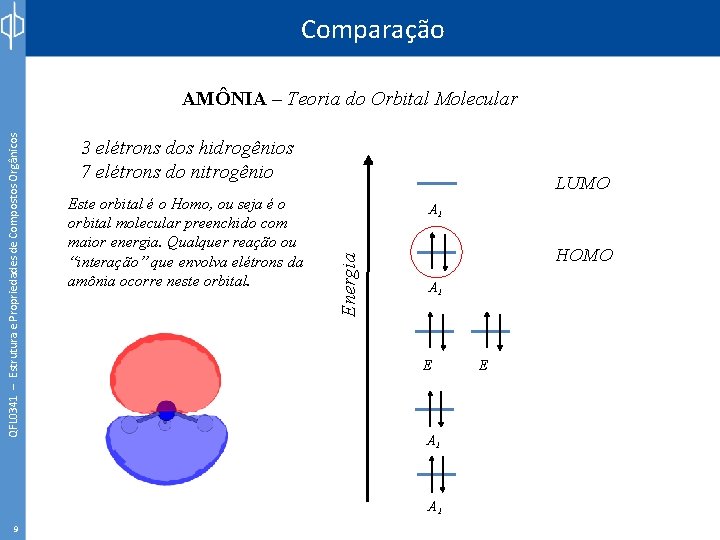
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio Este orbital é o Homo, ou seja é o orbital molecular preenchido com maior energia. Qualquer reação ou “interação” que envolva elétrons da amônia ocorre neste orbital. LUMO A 1 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 9 E

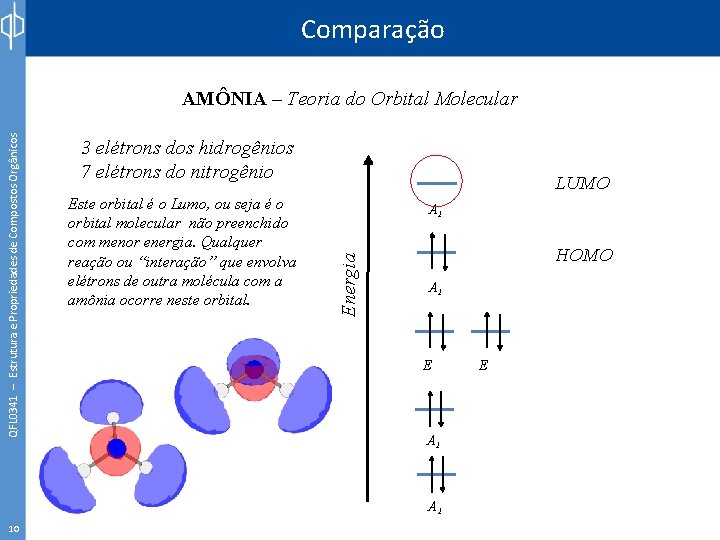
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio Este orbital é o Lumo, ou seja é o orbital molecular não preenchido com menor energia. Qualquer reação ou “interação” que envolva elétrons de outra molécula com a amônia ocorre neste orbital. LUMO A 1 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 10 E

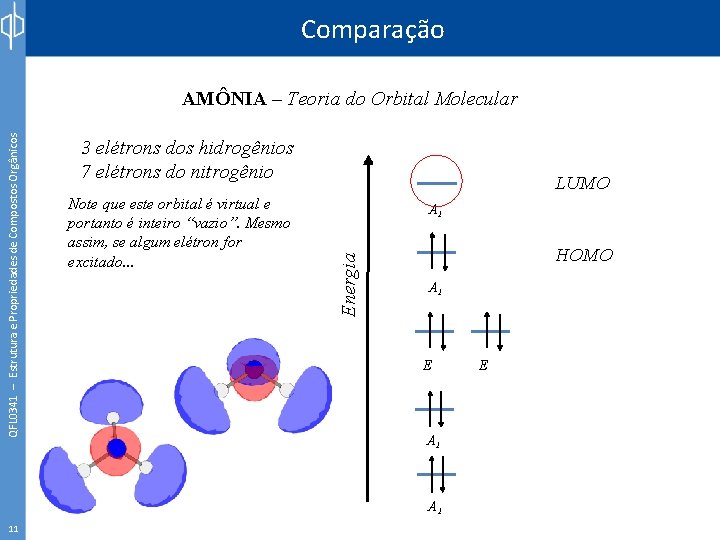
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio Note que este orbital é virtual e portanto é inteiro “vazio”. Mesmo assim, se algum elétron for excitado. . . LUMO A 1 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 11 E

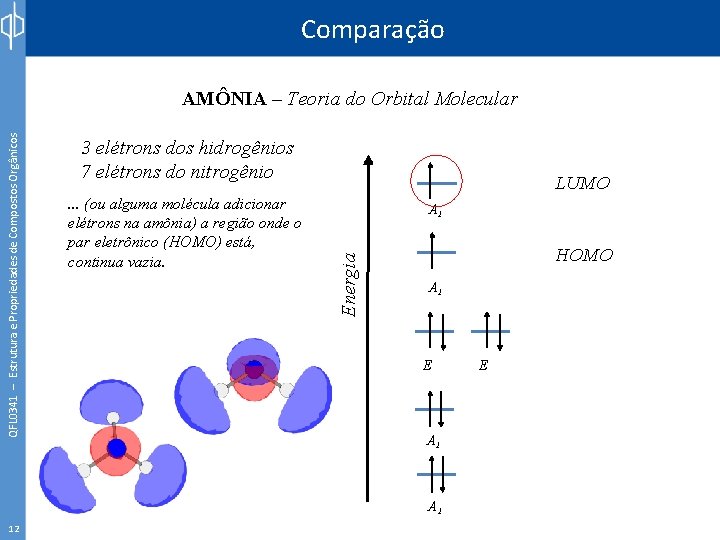
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio. . . (ou alguma molécula adicionar elétrons na amônia) a região onde o par eletrônico (HOMO) está, continua vazia. LUMO A 1 Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Teoria do Orbital Molecular HOMO A 1 E A 1 12 E

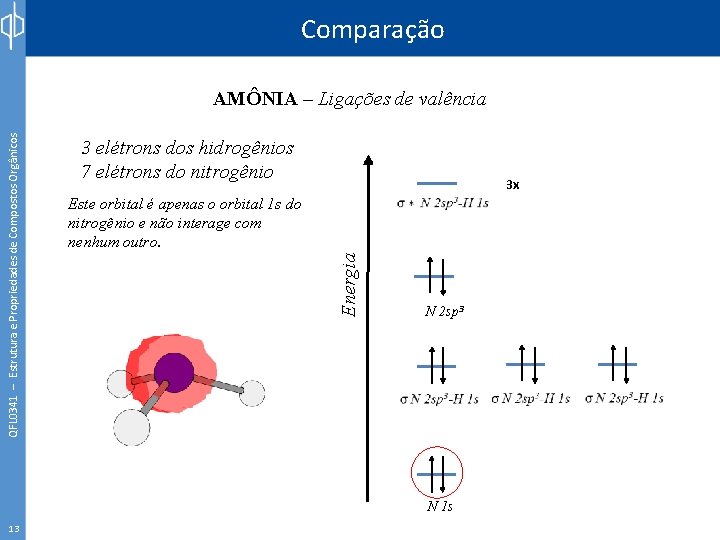
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio 3 x Este orbital é apenas o orbital 1 s do nitrogênio e não interage com nenhum outro. Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Ligações de valência N 2 sp 3 N 1 s 13

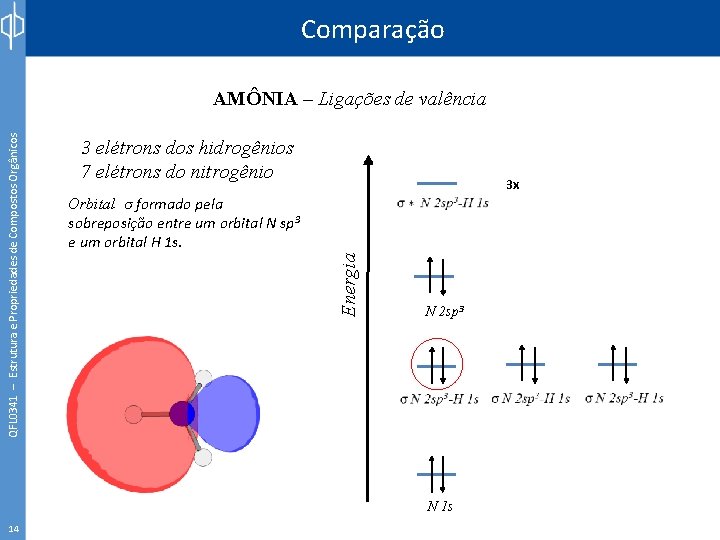
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio 3 x Orbital σ formado pela sobreposição entre um orbital N sp 3 e um orbital H 1 s. Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Ligações de valência N 2 sp 3 N 1 s 14

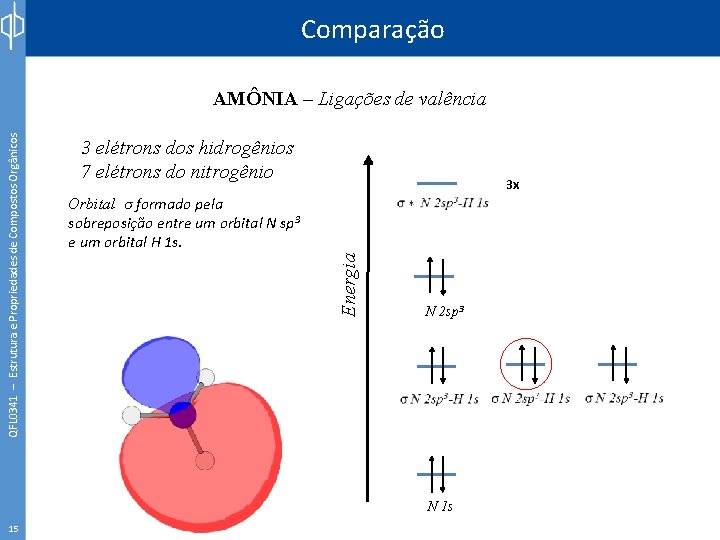
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio 3 x Orbital σ formado pela sobreposição entre um orbital N sp 3 e um orbital H 1 s. Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Ligações de valência N 2 sp 3 N 1 s 15

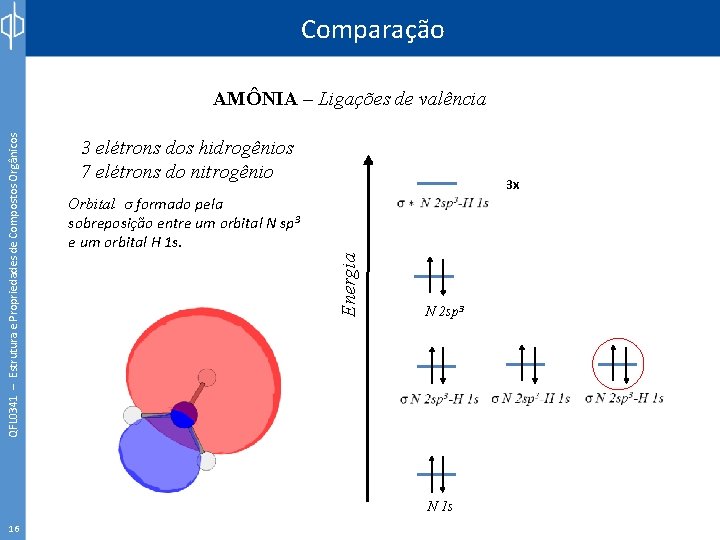
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio 3 x Orbital σ formado pela sobreposição entre um orbital N sp 3 e um orbital H 1 s. Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Ligações de valência N 2 sp 3 N 1 s 16

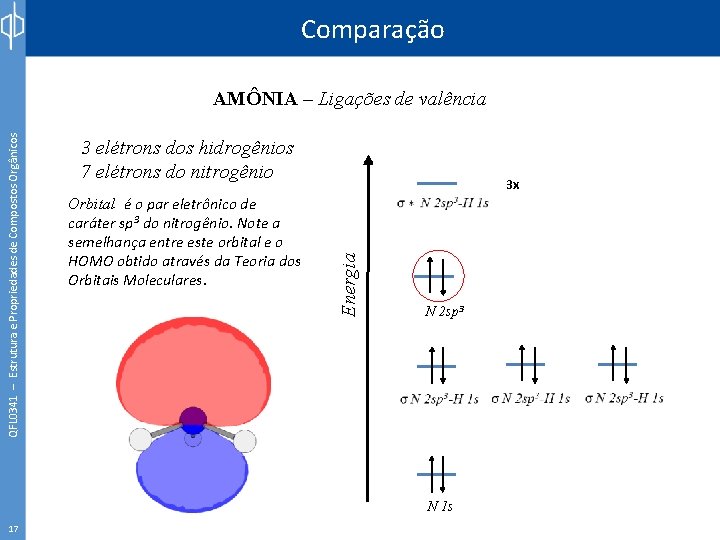
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio Orbital é o par eletrônico de caráter sp 3 do nitrogênio. Note a semelhança entre este orbital e o HOMO obtido através da Teoria dos Orbitais Moleculares. 3 x Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Ligações de valência N 2 sp 3 N 1 s 17

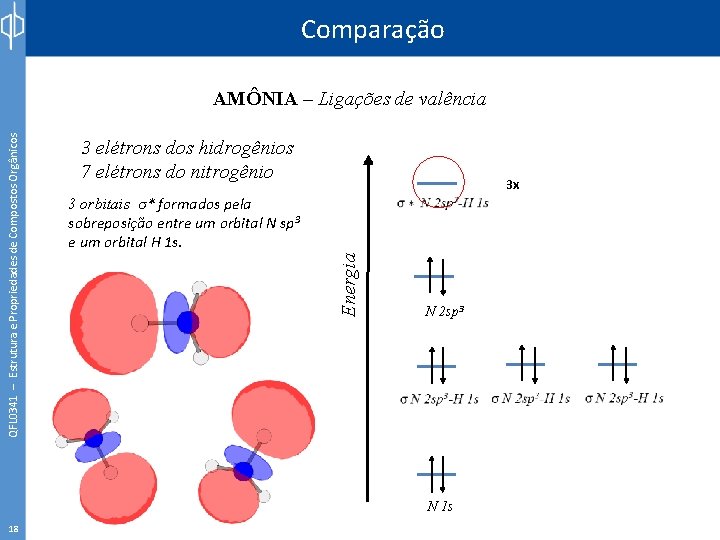
Comparação 3 elétrons dos hidrogênios 7 elétrons do nitrogênio 3 x 3 orbitais σ* formados pela sobreposição entre um orbital N sp 3 e um orbital H 1 s. Energia QFL 0341 – Estrutura e Propriedades de Compostos Orgânicos AMÔNIA – Ligações de valência N 2 sp 3 N 1 s 18
 Orgnicos
Orgnicos Propiedades de los compuestos organicos
Propiedades de los compuestos organicos Infinitivo pessoal composto
Infinitivo pessoal composto Compostos fenólicos
Compostos fenólicos Conceito de oxido
Conceito de oxido Juros compostos formula
Juros compostos formula Compostos ionicos
Compostos ionicos Substantivo exemplos
Substantivo exemplos Compostos binaris
Compostos binaris Compostos binaris
Compostos binaris Mecanismo de reação
Mecanismo de reação Capitalização composta
Capitalização composta Compostos
Compostos Cristall ionic
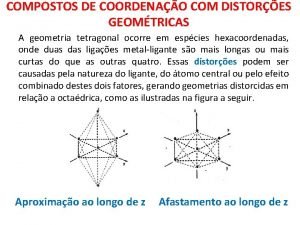
Cristall ionic Geometria tetragonal
Geometria tetragonal Compostos ternarios
Compostos ternarios Pronome classificação
Pronome classificação Locuçao verbal
Locuçao verbal Formula de juros compostos
Formula de juros compostos