Potencial de eletrodo Eletrodo metal imerso em soluo











- Slides: 38

Potencial de eletrodo

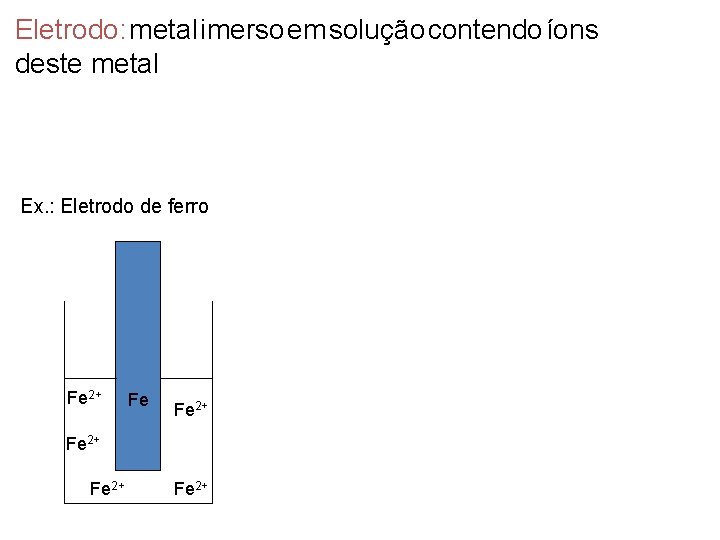
Eletrodo: metal imerso em solução contendo íons deste metal Ex. : Eletrodo de ferro Fe 2+ Fe 2+

Eletrodo: metal imerso em solução contendo íons deste metal Notação: M|Mn+ (Concentração) Ex. : Eletrodo de ferro Fe 2+ Fe 2+ Fe|Fe 2+ (1 M)

Eletrodo: metal imerso em solução contendo íons deste metal Notação: M|Mn+ (Concentração) Atividade x Concentração Ex. : Eletrodo de ferro a=y. c Coeficiente de atividade <1 Sólidos e água, y = 1 Soluções diluídas, y 1 Fe 2+ Fe 2+ Fe|Fe 2+ (1 M)

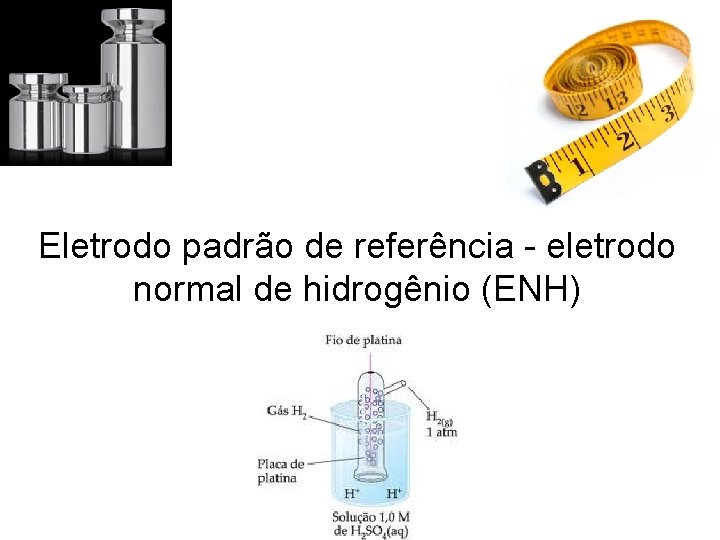
Eletrodo padrão de referência - eletrodo normal de hidrogênio (ENH)

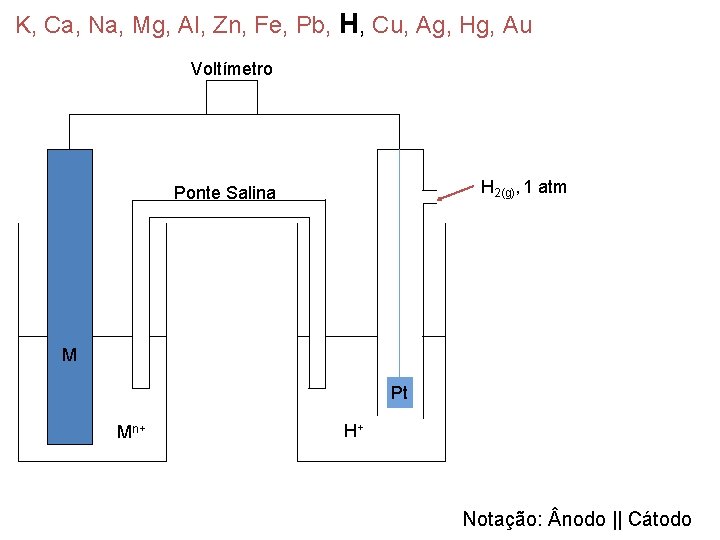
K, Ca, Na, Mg, Al, Zn, Fe, Pb, H, Cu, Ag, Hg, Au Voltímetro H 2(g), 1 atm Ponte Salina M Pt Mn+ H+ Notação: nodo || Cátodo

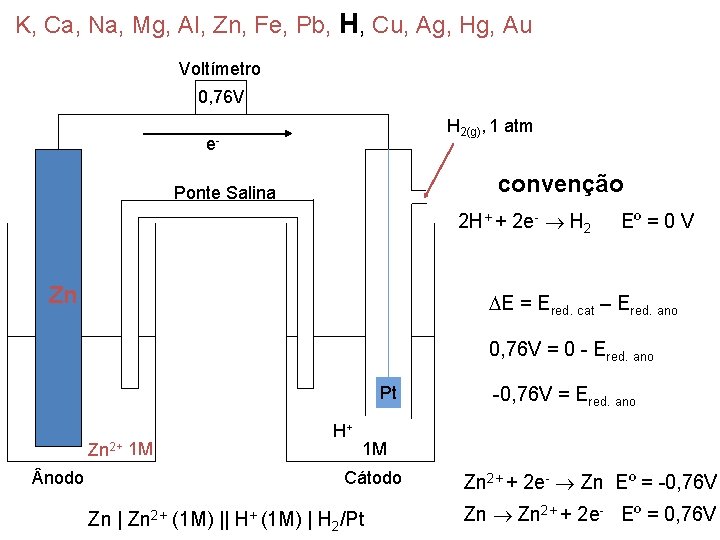
K, Ca, Na, Mg, Al, Zn, Fe, Pb, H, Cu, Ag, Hg, Au Voltímetro 0, 76 V H 2(g), 1 atm e- convenção Ponte Salina 2 H+ + 2 e- H 2 Zn Eº = 0 V E = Ered. cat – Ered. ano 0, 76 V = 0 - Ered. ano Pt Zn 2+ 1 M nodo H+ -0, 76 V = Ered. ano 1 M Cátodo Zn | Zn 2+ (1 M) || H+ (1 M) | H 2/Pt Zn 2+ + 2 e- Zn Eº = -0, 76 V Zn 2+ + 2 e- Eº = 0, 76 V

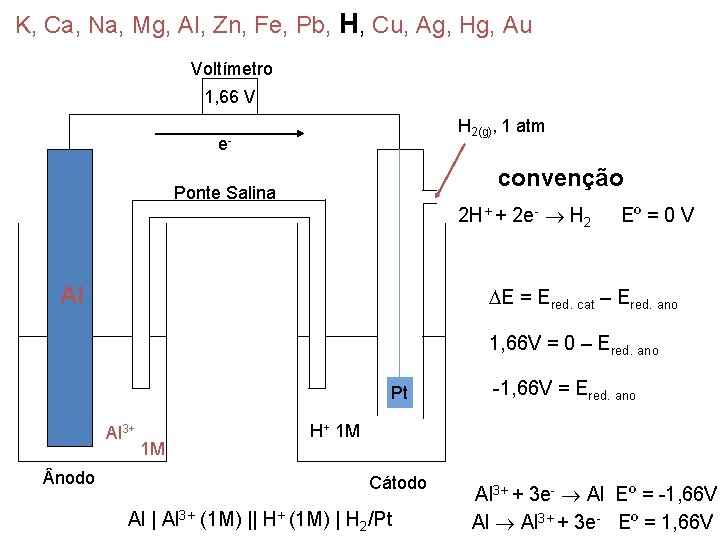
K, Ca, Na, Mg, Al, Zn, Fe, Pb, H, Cu, Ag, Hg, Au Voltímetro 1, 66 V H 2(g), 1 atm e- convenção Ponte Salina 2 H+ + 2 e- H 2 Al Eº = 0 V E = Ered. cat – Ered. ano 1, 66 V = 0 – Ered. ano Pt Al 3+ nodo 1 M -1, 66 V = Ered. ano H+ 1 M Cátodo Al | Al 3+ (1 M) || H+ (1 M) | H 2/Pt Al 3+ + 3 e- Al Eº = -1, 66 V Al 3+ + 3 e- Eº = 1, 66 V

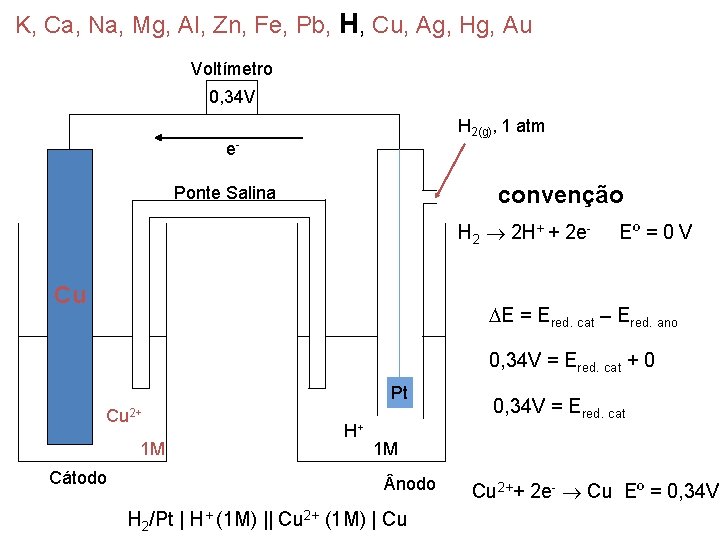
K, Ca, Na, Mg, Al, Zn, Fe, Pb, H, Cu, Ag, Hg, Au Voltímetro 0, 34 V H 2(g), 1 atm e- convenção Ponte Salina H 2 2 H+ + 2 e- Cu Eº = 0 V E = Ered. cat – Ered. ano 0, 34 V = Ered. cat + 0 Pt Cu 2+ 1 M Cátodo H+ 0, 34 V = Ered. cat 1 M nodo H 2/Pt | H+ (1 M) || Cu 2+ (1 M) | Cu Cu 2++ 2 e- Cu Eº = 0, 34 V

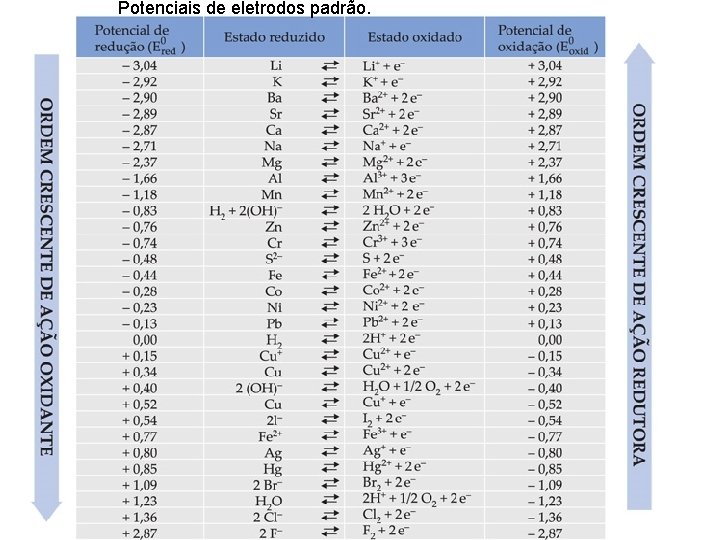
Potenciais de eletrodos padrão.

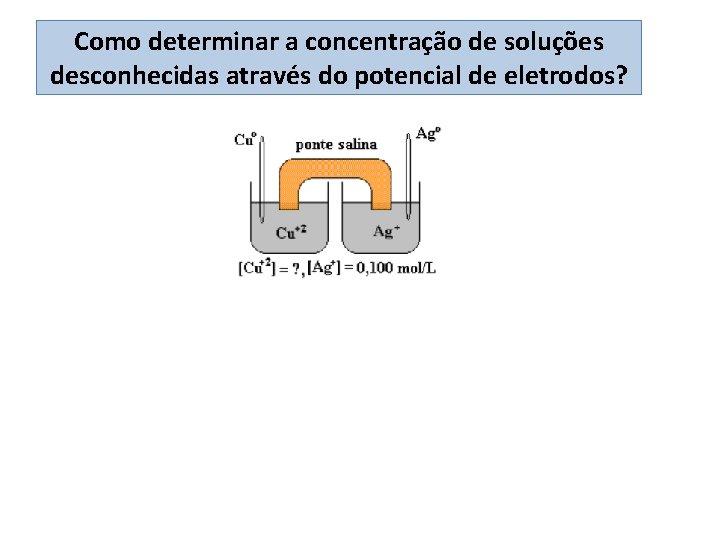
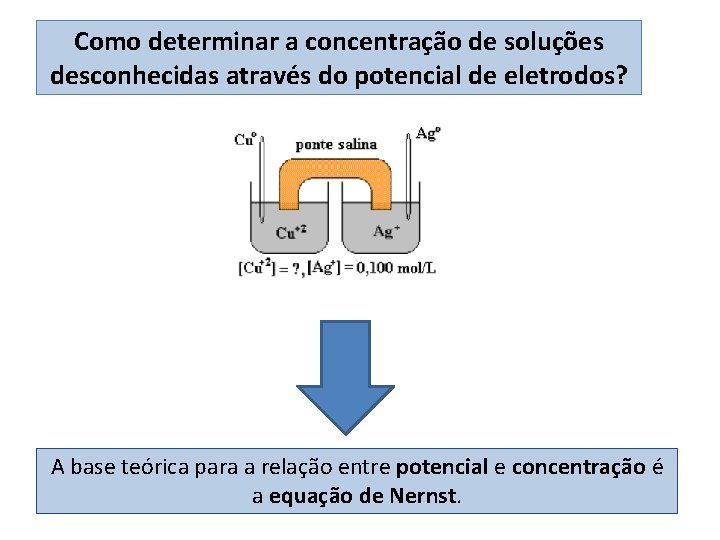
Como determinar a concentração de soluções desconhecidas através do potencial de eletrodos?

Como determinar a concentração de soluções desconhecidas através do potencial de eletrodos? A base teórica para a relação entre potencial e concentração é a equação de Nernst.

Equação de Nernst E: potencial observado; E°: potencial padrão; R: constante dos gases perfeitos ( 8, 314 j K-1 mol-1); T: temperatura em graus Kelvin (298 K é a mais utilizada); n: números de elétrons envolvidos; F: constante de Faraday (96500 coulombs); a: atividade (p: produtos; r: reagentes).

Equação de Nernst E: potencial observado; E°: potencial padrão; R: constante dos gases perfeitos ( 8, 314 j K-1 mol-1); T: temperatura em graus Kelvin (298 K é a mais utilizada); n: números de elétrons envolvidos; F: constante de Faraday (96500 coulombs); a: atividade (p: produtos; r: reagentes).

1) Qual o potencial do eletrodo: cobre imerso em solução 0, 01 M de Cu 2+? Cu 2+ + 2 e- Cu 0 E° = 0, 337 V 2) Qual o potencial para a meia pilha de equação Pb 2+ + 2 e- Pb, sabendo que [Pb 2+] = 0, 001 M? Pb 2+ + 2 e- Pb 0 E° = -0, 13 V 3) Qual o potencial da pilha? Pt | H 2 | H+ (1 M) || Fe 3+ (0, 1 M), Fe 2+ (0, 001 M) | Pt Fe 3+ + e- Fe 2+ E° = 0, 77 V

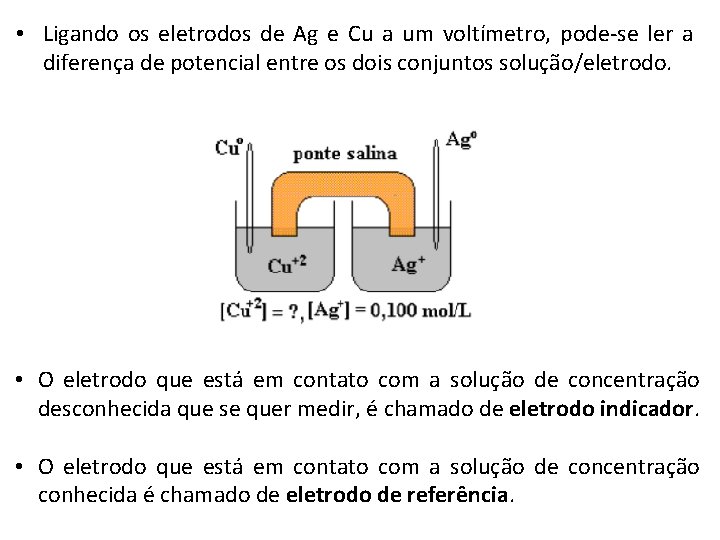
• Ligando os eletrodos de Ag e Cu a um voltímetro, pode-se ler a diferença de potencial entre os dois conjuntos solução/eletrodo. • O eletrodo que está em contato com a solução de concentração desconhecida que se quer medir, é chamado de eletrodo indicador. • O eletrodo que está em contato com a solução de concentração conhecida é chamado de eletrodo de referência.

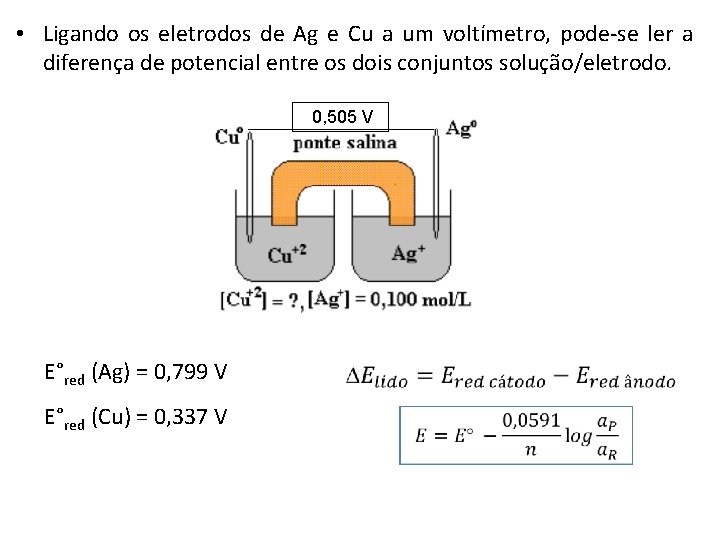
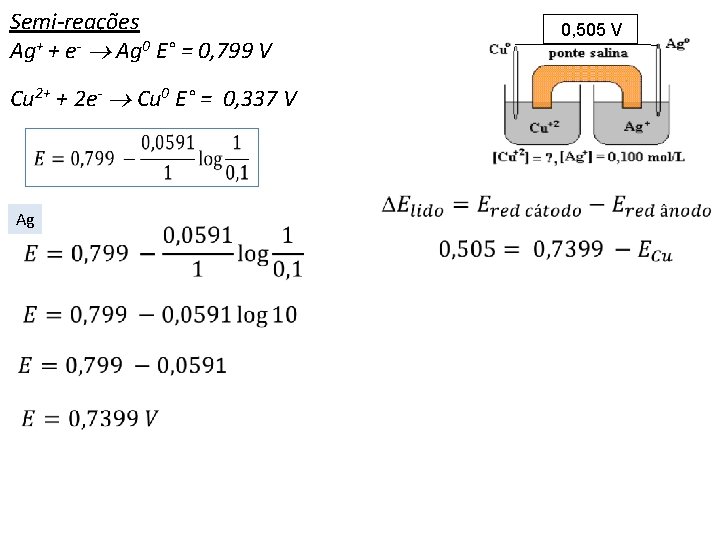
• Ligando os eletrodos de Ag e Cu a um voltímetro, pode-se ler a diferença de potencial entre os dois conjuntos solução/eletrodo. 0, 505 V E°red (Ag) = 0, 799 V E°red (Cu) = 0, 337 V

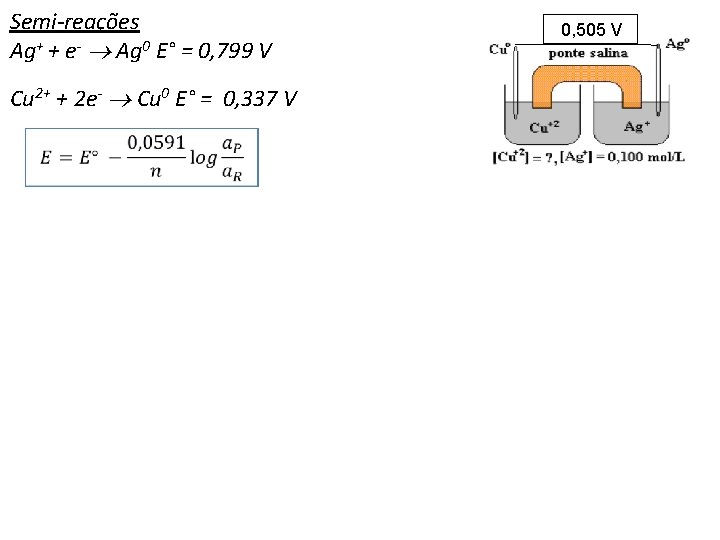
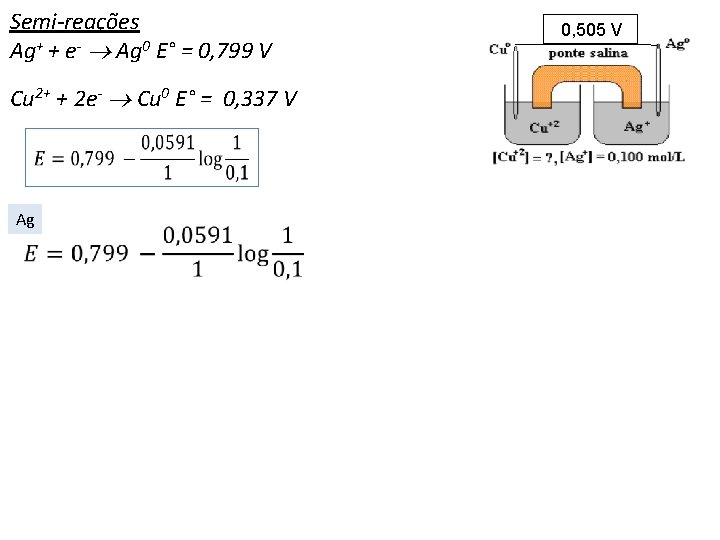
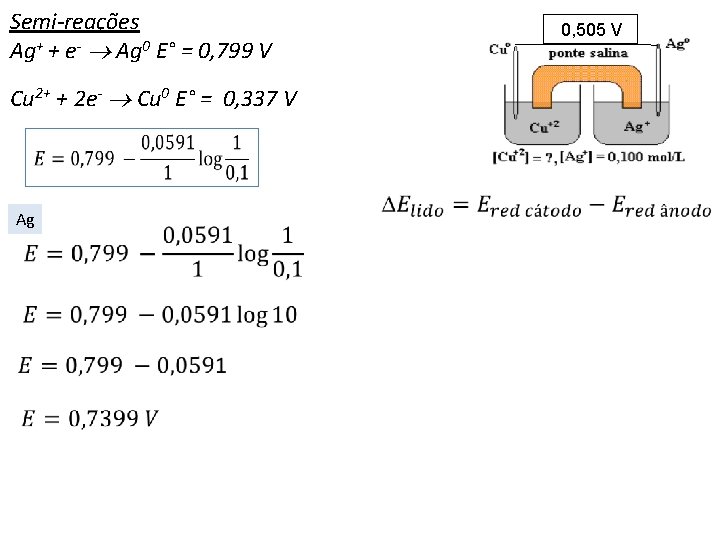
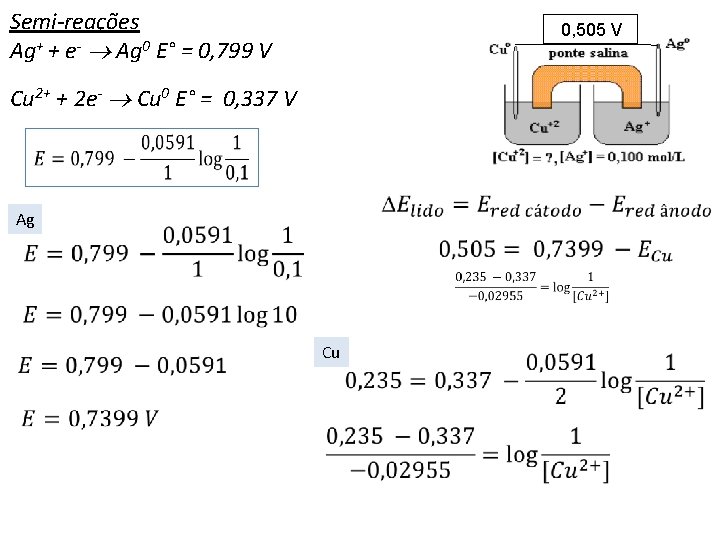
Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V 0, 505 V

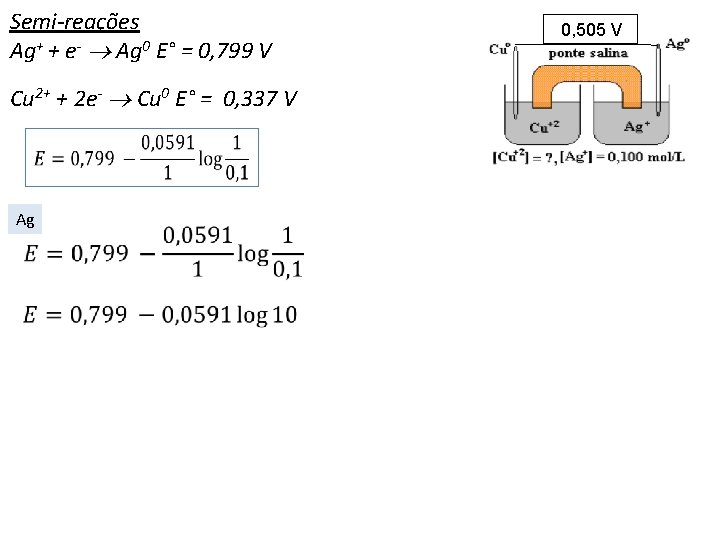
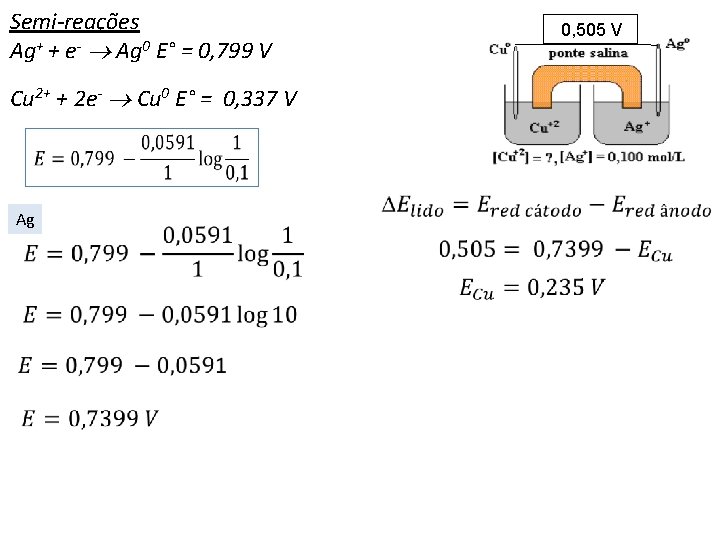
Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag 0, 505 V

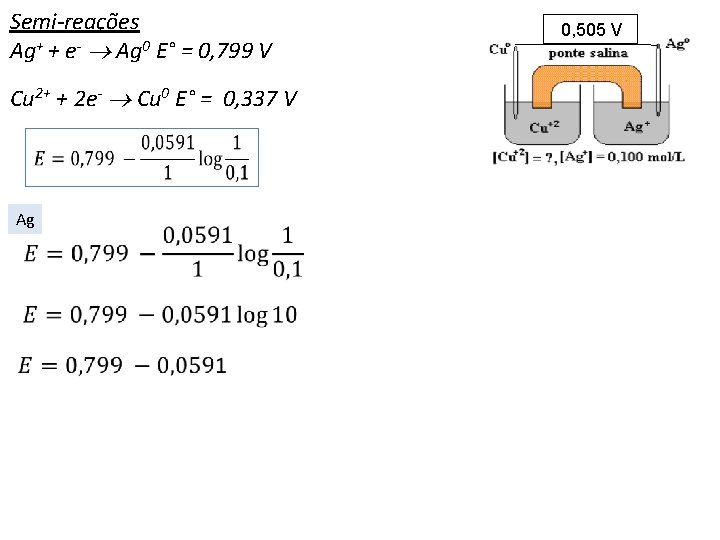
Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag 0, 505 V

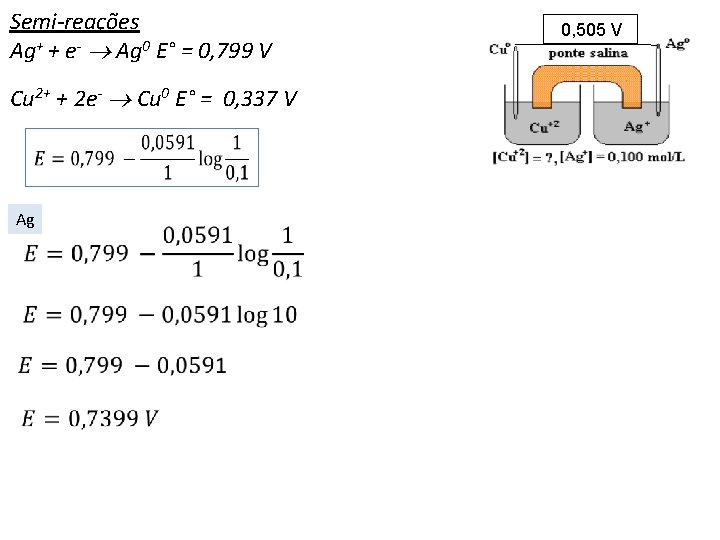
Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag 0, 505 V

Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag 0, 505 V

Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag 0, 505 V

Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag 0, 505 V

Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag 0, 505 V

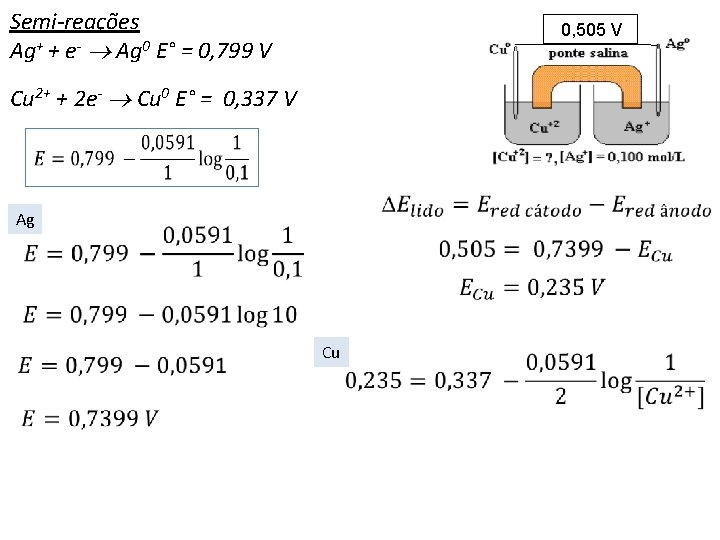
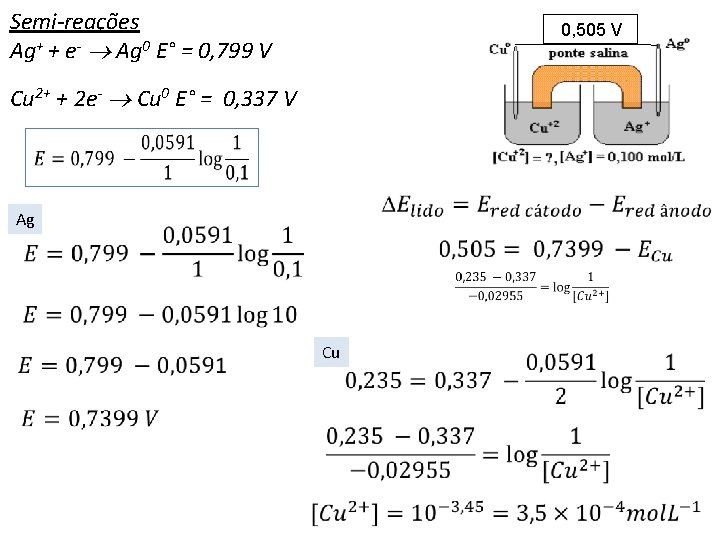
Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V 0, 505 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag Cu

Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V 0, 505 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag Cu

Semi-reações Ag+ + e- Ag 0 E° = 0, 799 V 0, 505 V Cu 2+ + 2 e- Cu 0 E° = 0, 337 V Ag Cu

Eletrodo de referência Característica fundamental manter o potencial constante durante a medição

ü Eletrodos que, na prática, não são bons como referência: 1. Eletrodos do tipo metal/íon • Sofrem a influência do O 2 dissolvido na solução. • Qualquer alteração das espécies em solução altera o próprio potencial fornecido pelo eletrodo. • Não são práticos. 2. Eletrodo normal de hidrogênio (ENH) • É difícil de construir e manusear. 1. Requer uma fonte de H 2 de alta pureza e com pressão parcial bem controlada. 2. A platina precisa ser platinizada para aumentar a adsorção de hidrogênio e catalisar a reação. 3. Seu uso é limitado à calibração de outros eletrodos de referência, ou então como eletrodo indicador de H+ (também esse uso muito restrito).

ELETRODO DE CALOMELANO COM JUNÇÃO CER MICA (“FRIT”) Pasta de Hg 2 Cl 2 e Hg em contato com solução de KCl.

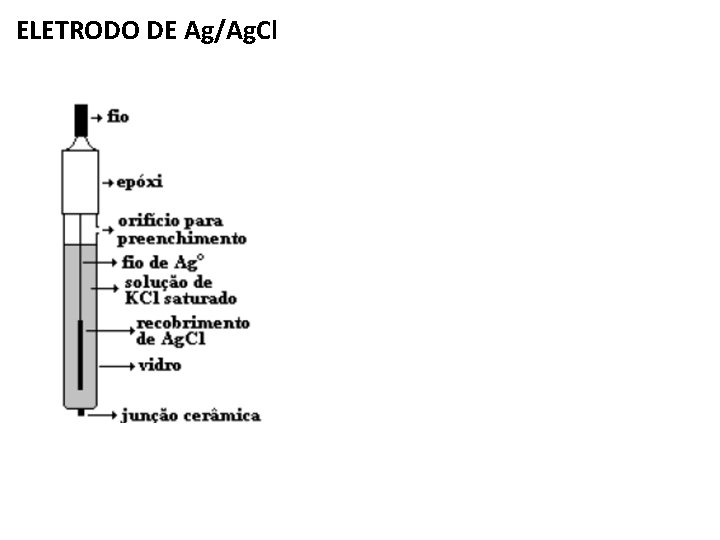
ELETRODO DE Ag/Ag. Cl


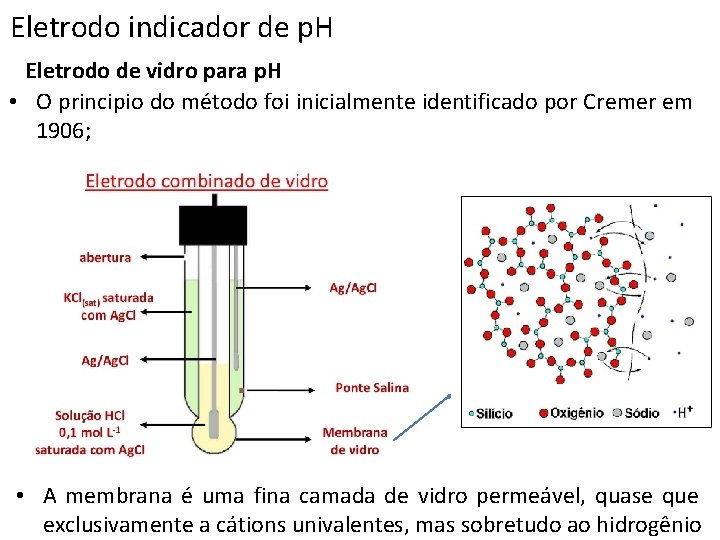
Eletrodo indicador de p. H Eletrodo de vidro para p. H • O principio do método foi inicialmente identificado por Cremer em 1906; • A membrana é uma fina camada de vidro permeável, quase que exclusivamente a cátions univalentes, mas sobretudo ao hidrogênio

TITULAÇÃO POTENCIOMÉTRICA ü As técnicas de titulação potenciométrica são largamente aplicadas e podem se basear em vários tipos de reação: • • Neutralização ácido-base; Precipitação; Oxirredução; Complexação.

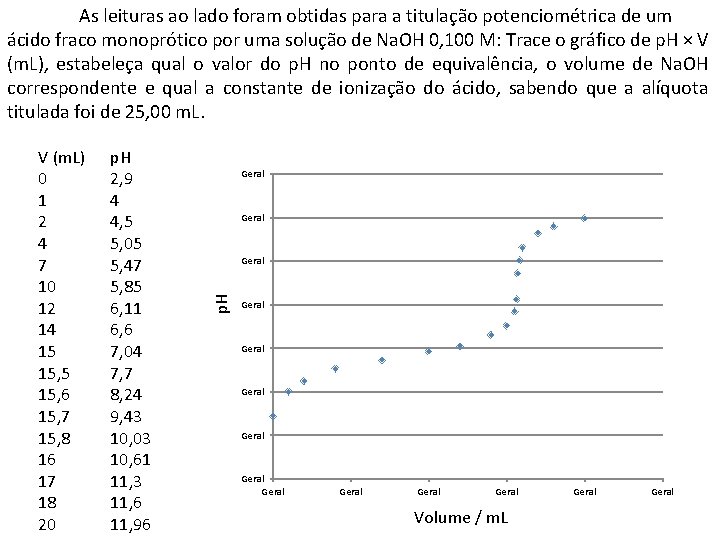
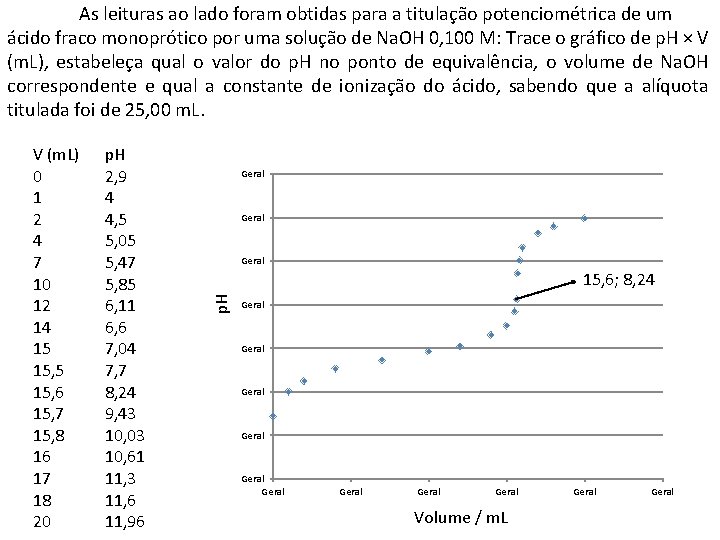
As leituras ao lado foram obtidas para a titulação potenciométrica de um ácido fraco monoprótico por uma solução de Na. OH 0, 100 M: Trace o gráfico de p. H × V (m. L), estabeleça qual o valor do p. H no ponto de equivalência, o volume de Na. OH correspondente e qual a constante de ionização do ácido, sabendo que a alíquota titulada foi de 25, 00 m. L. V (m. L) 0 1 2 4 7 10 12 14 15 15, 6 15, 7 15, 8 16 17 18 20 p. H 2, 9 4 4, 5 5, 05 5, 47 5, 85 6, 11 6, 6 7, 04 7, 7 8, 24 9, 43 10, 03 10, 61 11, 3 11, 6 11, 96 1 - bureta contendo solução padrão de Na. OH; 2 - solução de ácido; 3 - eletrodo de referência; 4 - eletrodo indicador; 5 agitador magnético; 6 - medidor de p. H operando no modo potenciométrico (em m. V).

As leituras ao lado foram obtidas para a titulação potenciométrica de um ácido fraco monoprótico por uma solução de Na. OH 0, 100 M: Trace o gráfico de p. H × V (m. L), estabeleça qual o valor do p. H no ponto de equivalência, o volume de Na. OH correspondente e qual a constante de ionização do ácido, sabendo que a alíquota titulada foi de 25, 00 m. L. p. H 2, 9 4 4, 5 5, 05 5, 47 5, 85 6, 11 6, 6 7, 04 7, 7 8, 24 9, 43 10, 03 10, 61 11, 3 11, 6 11, 96 Geral p. H V (m. L) 0 1 2 4 7 10 12 14 15 15, 6 15, 7 15, 8 16 17 18 20 Geral Geral Geral Volume / m. L Geral

As leituras ao lado foram obtidas para a titulação potenciométrica de um ácido fraco monoprótico por uma solução de Na. OH 0, 100 M: Trace o gráfico de p. H × V (m. L), estabeleça qual o valor do p. H no ponto de equivalência, o volume de Na. OH correspondente e qual a constante de ionização do ácido, sabendo que a alíquota titulada foi de 25, 00 m. L. p. H 2, 9 4 4, 5 5, 05 5, 47 5, 85 6, 11 6, 6 7, 04 7, 7 8, 24 9, 43 10, 03 10, 61 11, 3 11, 6 11, 96 Geral 15, 6; 8, 24 p. H V (m. L) 0 1 2 4 7 10 12 14 15 15, 6 15, 7 15, 8 16 17 18 20 Geral Geral Geral Volume / m. L Geral