Solues Caracterizao de uma soluo Uma soluo uma




















- Slides: 21

Soluções

Caracterização de uma solução Uma solução é uma mistura homogénea de duas ou mais substâncias. Por exemplo, o dicromato de potássio dissolve-se em água formando uma mistura homogénea, isto é, uma solução. M 18

Caracterização de uma solução Na solução obtida por dissolução em água de dicromato de potássio, a água é o solvente o dicromato de potássio é o soluto. Água Dicromato de potássio quando se misturam + Solvente forma-se uma Soluto Solução M 18

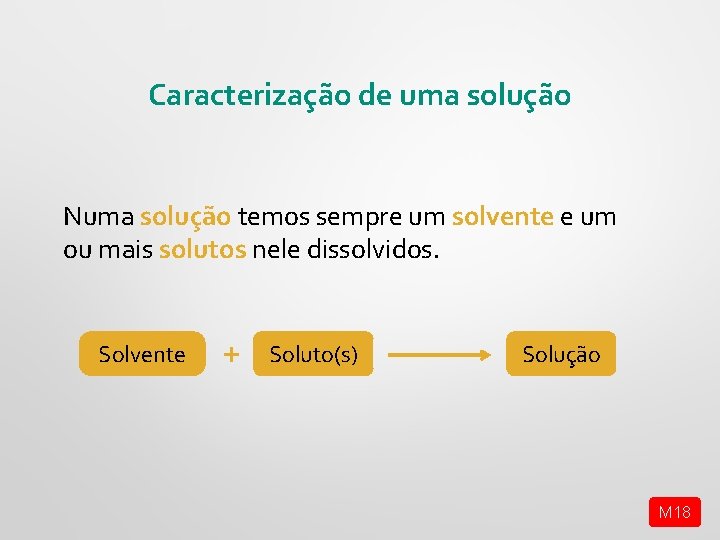
Caracterização de uma solução Numa solução temos sempre um solvente e um ou mais solutos nele dissolvidos. Solvente + Soluto(s) Solução M 18

Caracterização de uma solução Como se identifica o soluto e o solvente numa solução? • Se o soluto e o solvente estiverem em estados físicos diferentes, o solvente é o que tem o mesmo estado físico da solução. Água (solvente) Dicromato de potássio (soluto) Solução M 18

Caracterização de uma solução Como se identifica o soluto e o solvente numa solução? • Se o soluto e o solvente estiverem no mesmo estado físico, o solvente é o que se encontra em maior quantidade na solução. Água (soluto) Etanol (solvente) Solução M 18

Em síntese Uma solução é uma mistura homogénea constituída por um solvente e por um ou mais solutos nele dissolvidos. Se o soluto e o solvente estiverem: • em estados físicos diferentes, o solvente é o que tem o mesmo estado físico da solução; • no mesmo estado físico, o solvente é o que se encontra em maior quantidade na solução.

Caracterização de uma solução As soluções podem ser: sólidas, líquidas ou gasosas. Por exemplo: • as ligas metálicas, como o bronze, o latão e o aço, são soluções sólidas. • as soluções aquosas, como a solução de dicromato de potássio em água, são soluções líquidas. • o ar isento de poeiras é uma solução gasosa. M 18

Concentração de uma solução Podemos preparar muitas soluções diferentes com um mesmo soluto e um mesmo solvente. Estas soluções são diferentes porque as quantidades relativas de soluto e de solvente podem ser diferentes, isto é, não são necessariamente iguais. M 18

Concentração de uma solução Observa as seguintes soluções aquosas, A e B, de dicromato de potássio. Massa de soluto 1, 0 g Massa de soluto 2, 0 g Volume de solução 40 cm 3 Solução A Solução B A solução B tem maior quantidade de soluto do que a solução A, no mesmo volume de solução. Logo, a solução B é mais concentrada do que a solução A. M 18

Concentração de uma solução Observa as seguintes soluções aquosas, C e D, de dicromato de potássio. Massa de soluto 2, 0 g Volume de solução 40 cm 3 Volume de solução 80 cm 3 Solução C Solução D A solução C tem a mesma quantidade de soluto que a solução D, num menor volume de solução. Logo, a solução D é menos concentrada do que a solução C. M 18

Concentração de uma solução De duas soluções com o mesmo soluto e o mesmo solvente, a solução mais concentrada é a que tem: • maior quantidade de soluto no mesmo volume de solução ou • a mesma quantidade de soluto num menor volume de solução. M 18

Síntese de conteúdos As soluções podem ser: De duas soluções com o mesmo soluto e o mesmo solvente, a solução mais concentrada é a que tem: maior quantidade de soluto no mesmo volume de solução ou sólidas, líquidas ou gasosas. a mesma quantidade de soluto num menor volume de solução.

Concentração de uma solução Quando já se tem uma solução preparada, também é possível fazer variar a sua concentração diluindo ou concentrando a solução. • Diluir uma solução significa diminuir a sua concentração por adição de mais solvente. • Concentrar uma solução significa aumentar a sua concentração por adição de mais soluto ou por vaporização do solvente. M 18

Concentração de uma solução Não é possível concentrar indefinidamente uma solução por adição de soluto, pois, em dado momento, o solvente não dissolve mais soluto, a essa temperatura. Quando isso acontece, a solução diz-se saturada. M 18

Concentração de uma solução Estas soluções são diferentes porque têm concentrações diferentes, isto é, têm composição quantitativa diferente. Uma das formas de saber a composição quantitativa de uma solução é calculando a sua concentração mássica. M 18

Concentração de uma solução A concentração mássica, c, de uma solução calculase dividindo a massa de soluto, m, pelo volume de solução, V. A concentração mássica exprime-se, geralmente, em gramas por decímetro cúbico, g/dm 3. M 18

Síntese de conteúdos A concentração mássica, c, de uma solução dá-nos a composição quantitativa da solução e calcula-se dividindo a massa de soluto, m, pelo volume de solução, V. M 18

Preparação laboratorial de uma solução de concentração conhecida Para se preparar uma solução aquosa, de concentração conhecida, de um soluto (sólido), devem ser seguidos os seguintes passos: • Medir, numa balança, a massa do soluto utilizando um vidro de relógio. M 18

Preparação laboratorial de uma solução de concentração conhecida • Transferir o soluto para um balão volumétrico com o auxílio de um funil, lavando o vidro de relógio com um pouco de água para completa remoção do soluto. M 18

Preparação laboratorial de uma solução de concentração conhecida • Adicionar água ao balão e agitar cuidadosamente para dissolver completamente o soluto. • Adicionar água com muito cuidado até a solução atingir exatamente a marca do balão M 18