SOLUO TAMPO Uma soluo tampo ou soluo Tamponada














- Slides: 18


SOLUÇÃO TAMPÃO Uma solução tampão ou solução Tamponada é aquela que resiste bem a variações de p. H quando nela introduzimos uma pequena quantidade de ácido ou base. São muito importantes em sistemas químicos e biológicos!

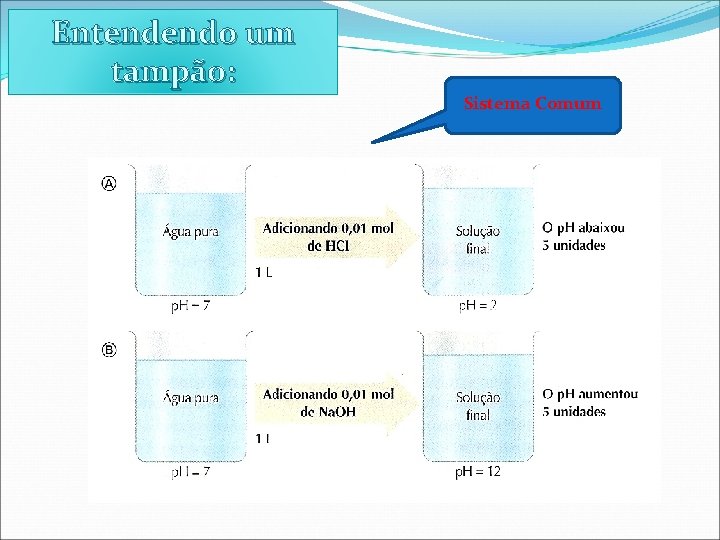
Entendendo um tampão: Sistema Comum

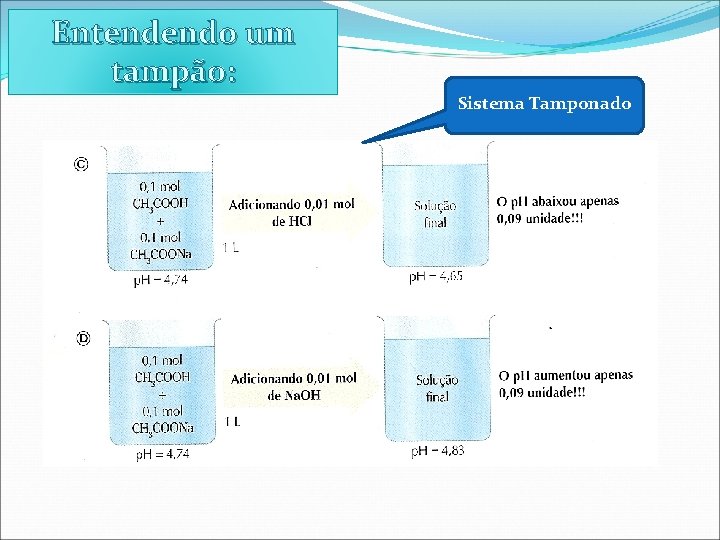
Entendendo um tampão: Sistema Tamponado

Entendendo um tampão: A solução tampão dá conta de gastar todo o H+ ou OHadicionado, impedindo bruscas variações de p. H.

Tampão: Tipos Podem ser preparadas dissolvendo-se em água: Um ácido fraco e um sal derivado dele. Ex. : CH 3 COOH/CH 3 COONa Uma base fraca e um sal dela derivado. Ex. : NH 4 OH/NH 4 Cl ou seja, NH 3/NH 4 Cl

O que atua na solução-tampão? O ácido FRACO e seu NION Exs. : CH 3 COOH/CH 3 COO-; H 2 CO 3/HCO 3 -; HCN/CN- A base FRACA e seu CÁTION Ex. : NH 4 OH/NH 4+ ou seja, NH 3/NH 4+

Observações: a)Certos ânions não conseguem remover os íons H+, formando moléculas de ácido. É o que acontece, por exemplo, com o ânion Cl-: como o ácido clorídrico que seria formado é forte, ele não possui a tendência de se apresentar, em solução aquosa, na forma de moléculas de HCl. Portanto, uma solução contendo um ácido forte e um sal derivado desse ácido não atua como um tampão. b) Uma solução contendo uma base forte e um sal derivado dessa base não atua como um tampão, pois seu cátion não consegue remover os íons OH-.

Calculando o p. H de um tampão: Tampão ácido p. H = p. Kw - p. Kb - log [sal] [base] ácido fraco/ânion do Tampão base fraca/cátion da base ►p. K se refere ao logaritmo negativo de uma constante de equilíbrio. Quando K aumenta, sua função p decresce e vice-versa. ► quanto maior o Ka e menor o p. Ka mais forte é o ácido.

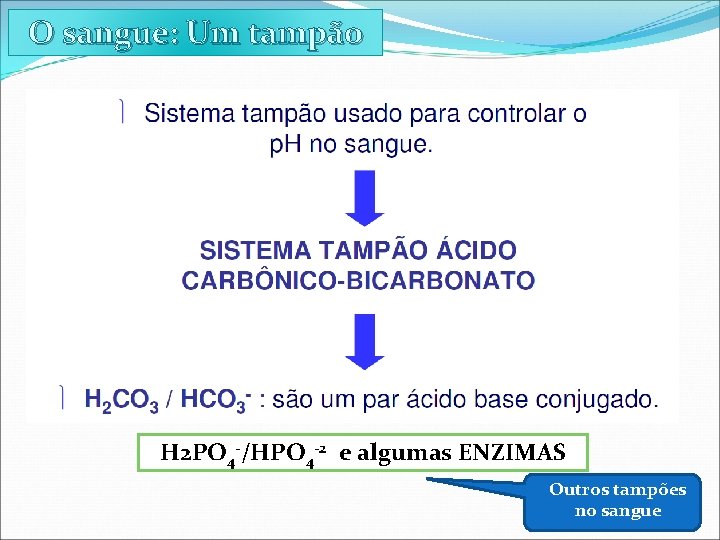
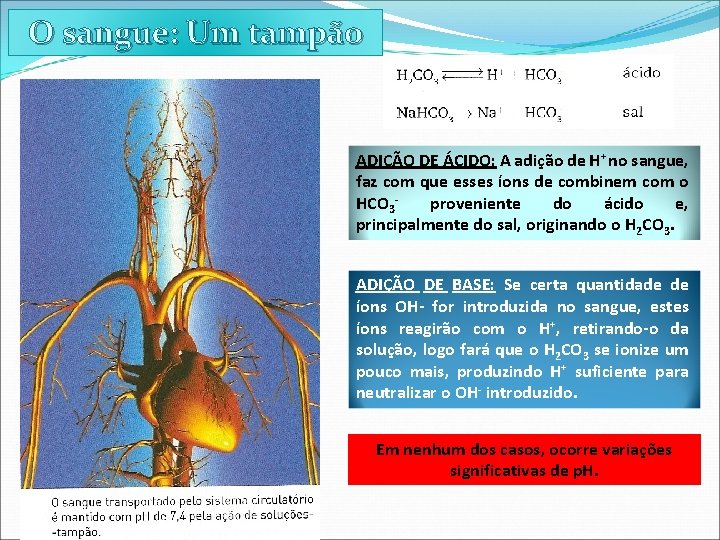
O sangue: Um tampão

O sangue: Um tampão

O sangue: Um tampão

O sangue: Um tampão H 2 PO 4 -/HPO 4 -2 e algumas ENZIMAS Outros tampões no sangue

O sangue: Um tampão ADIÇÃO DE ÁCIDO: A adição de H+ no sangue, faz com que esses íons de combinem com o HCO 3 proveniente do ácido e, principalmente do sal, originando o H 2 CO 3. ADIÇÃO DE BASE: Se certa quantidade de íons OH- for introduzida no sangue, estes íons reagirão com o H+, retirando-o da solução, logo fará que o H 2 CO 3 se ionize um pouco mais, produzindo H+ suficiente para neutralizar o OH- introduzido. Em nenhum dos casos, ocorre variações significativas de p. H.

Base conjugada

Capacidade de Tampão e p. H

Capacidade de Tampão e p. H

Capacidade de Tampão e p. H
 Tamponada bellocqa
Tamponada bellocqa Traumatismele toracice
Traumatismele toracice Era uma vez uma ilha onde moravam todos os sentimentos
Era uma vez uma ilha onde moravam todos os sentimentos Cenoura raiz aprumada
Cenoura raiz aprumada Uma equipe de cientistas lançará uma expedição
Uma equipe de cientistas lançará uma expedição Sorteando uma das n pessoas de uma sala
Sorteando uma das n pessoas de uma sala Uma onda possui uma frequencia angular de 110 rad/s
Uma onda possui uma frequencia angular de 110 rad/s Era uma vez uma ilha onde moravam todos os sentimentos
Era uma vez uma ilha onde moravam todos os sentimentos Abo
Abo A borda de um precipicio de um certo planeta
A borda de um precipicio de um certo planeta Os bilhetes de uma rifa são numerados de 1 a 100
Os bilhetes de uma rifa são numerados de 1 a 100 Concava e convexa
Concava e convexa Vou lhe contar uma história de uma jovem chamada maria
Vou lhe contar uma história de uma jovem chamada maria Roberta lacerda
Roberta lacerda Vi uma estrela tão alta
Vi uma estrela tão alta Galinha azulzinha
Galinha azulzinha Uma pessoa de estatura mediana pretende fazer um alambrado
Uma pessoa de estatura mediana pretende fazer um alambrado Uma flecha lançada uma palavra dita
Uma flecha lançada uma palavra dita Atitude é uma pequena coisa que faz uma grande diferença
Atitude é uma pequena coisa que faz uma grande diferença