Soluo Ideal Uma soluo ideal aquela onde no














- Slides: 17

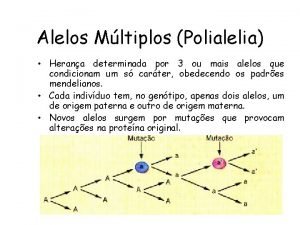
Solução Ideal Uma solução ideal é aquela onde não há efeitos importantes pela mudanças nas interações atômicas/moleculares na formação da solução Uma solução real se aproxima do comportamento ideal quando os components são quimicamente idênticos. Ex. (Ag, Au) Potencial químico do componente i relativo àquele do componente puro na pressão pi*

Em soluções líquidas e sólidas, estamos interessados efetivamente em situações onde p = 1 atm. Assim, eliminamos a dependência com a pressão. Comparação com a equação anterior conduz a uma definição de uma solução ideal para fases condensadas:

A equação anterior pode ser escrita na forma: O subescrito mix é usado quando o estado de referência para os components puros corresponde ao mesmo estado de agregação da solução Soluções que seguem a equação acima são chamadas Raoultianas

A partir das expressões apresentadas anteriormente, vê- se que, para uma solução ideal: Onde: ai é a atividade do componente i na solução e xi a fração molar do componente na solução condensada. Lei de Raoult

As seguintes expressões para grandezas parciais de mistura, a xi constante, se aplicam a soluções ideiais:

As quantidade integrais de mistura podem ser obtida a partir das quantidades parciais molares de mistura, para qualquer propriedade Y, através da expressão:



Como pode ser visto em uma das figuras anteriores, a energia de Gibbs de mistura para a solução ideal é simétrica com relação à composição. Ela atinge um valor mínimo de – 0, 69315 RT para a composição equiatômica e aproxima-se de zero para os elementos puros. As quantidades parciais de mistura mudam de maneira muito mais marcante com a composição, devido ao termo logarítmico da expressão. 1 0

Solução Real Os resultados experimentais para vários sistemas reais indicam desvio em relação ao comportamento ideal.

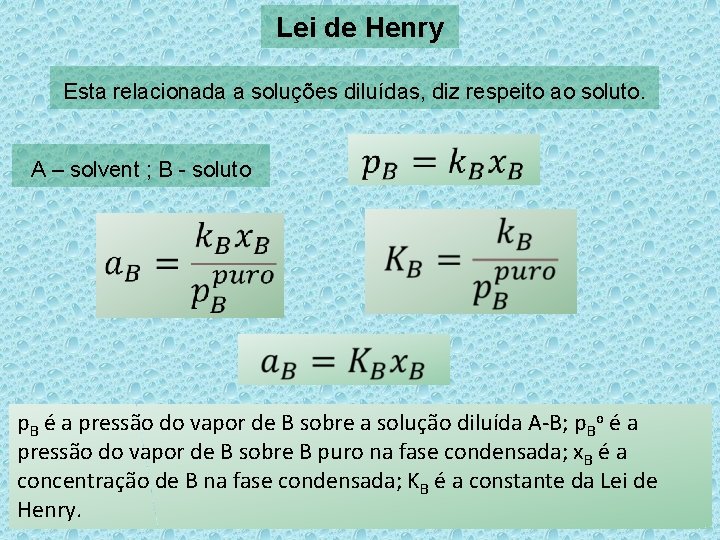
Lei de Henry Esta relacionada a soluções diluídas, diz respeito ao soluto. A – solvent ; B - soluto p. B é a pressão do vapor de B sobre a solução diluída A-B; p. Bo é a pressão do vapor de B sobre B puro na fase condensada; x. B é a concentração de B na fase condensada; KB é a constante da Lei de Henry.



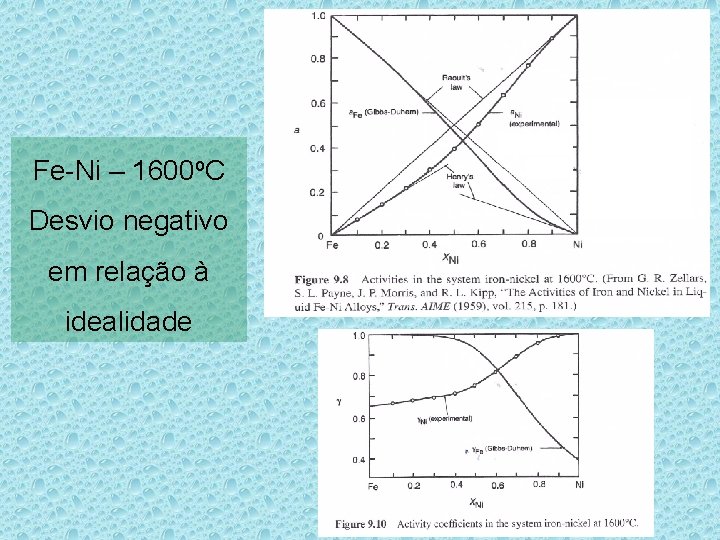
Fe-Ni – 1600 o. C Desvio negativo em relação à idealidade

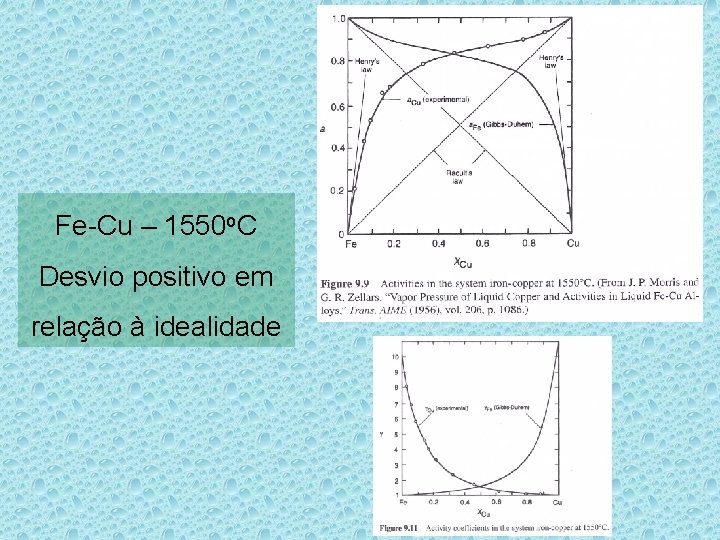
Fe-Cu – 1550 o. C Desvio positivo em relação à idealidade

Termos de excesso

Pode ser visto que o potencial químico de excesso é relacionado com o coeficiente de atividade através da relação:
 Era uma vez uma ilha onde moravam todos os sentimentos
Era uma vez uma ilha onde moravam todos os sentimentos Era uma vez uma ilha onde moravam todos os sentimentos
Era uma vez uma ilha onde moravam todos os sentimentos Atividade de projeto de vida 7 ano
Atividade de projeto de vida 7 ano Endechas a bárbara escrava retrato
Endechas a bárbara escrava retrato Eu sou aquela mulher
Eu sou aquela mulher Eu sou aquela mulher que fez a escalada
Eu sou aquela mulher que fez a escalada Uma caixa de coelhos continha uma fêmea himalaia
Uma caixa de coelhos continha uma fêmea himalaia Considerando que a lampada led rende 100 mil horas
Considerando que a lampada led rende 100 mil horas Fuvest sp uma estudante quer utilizar uma lâmpada
Fuvest sp uma estudante quer utilizar uma lâmpada Uma onda possui uma frequencia angular de 110 rad/s
Uma onda possui uma frequencia angular de 110 rad/s Uma pessoa agachada perto de uma fogueira
Uma pessoa agachada perto de uma fogueira Galinha azulzinha
Galinha azulzinha Sementinha ave
Sementinha ave Os bilhetes de uma rifa são numerados de 1 a 100
Os bilhetes de uma rifa são numerados de 1 a 100 Atitude é uma pequena coisa que faz uma grande diferença
Atitude é uma pequena coisa que faz uma grande diferença Só sei que maria de nazaré resolveu se casar com josé
Só sei que maria de nazaré resolveu se casar com josé Raiz tuberculosa aprumada
Raiz tuberculosa aprumada Uma equipe de cientistas lançará uma expedição
Uma equipe de cientistas lançará uma expedição