LARUTAN 1 LARUTAN DAN LELEHAN 2 Larutan gas
































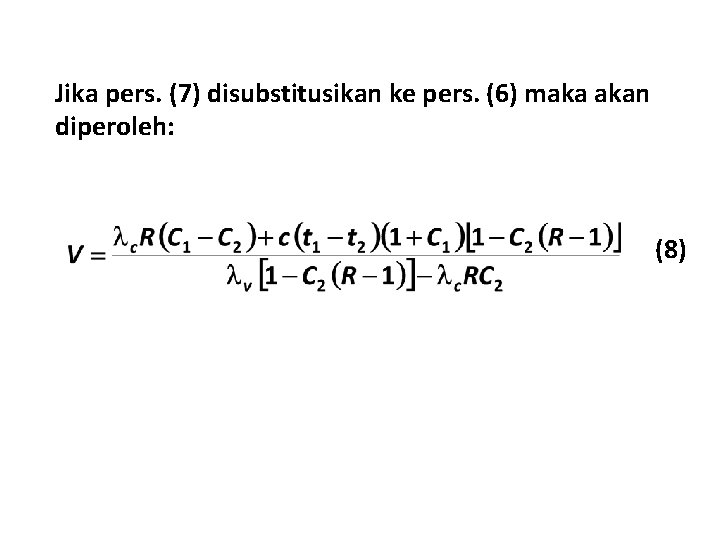













- Slides: 62

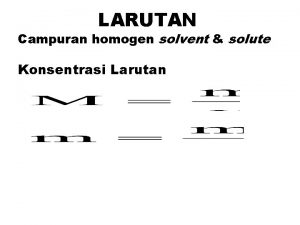
LARUTAN 1

LARUTAN DAN LELEHAN 2

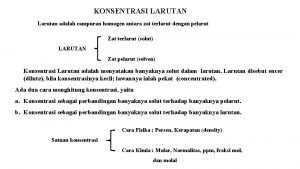
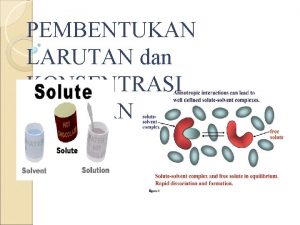
Larutan (gas, cair, atau padat) adalah campuran homogen antara dua komponen atau lebih LARUTAN SOLVEN • Cair • Tunggal/majemuk • Jumlahnya lebih banyak SOLUT • Padat/Cair/gas • Tunggal/majemuk • Jumlahnya lebih sedikit 3

• Lelehan adalah cairan yang berada pada temperatur yang dekat dengan titik bekunya • Lelehan adalah campuran homogen dari dua senyawa atau lebih yang akan membeku (baik secara bersama maupun individual) apabila didinginkan pada temperatur kamar. 4

LARUTAN PADAT-PADAT Substitutional Solid Solution Rules For substitutional solid solutions, the Hume-Rothery rules are: 1. The atomic radii of the solute and solvent atoms must differ by no more than 15%:

2. The crystal structures of solute and solvent must match. 3. Complete solubility occurs when the solvent and solute have the same valency. Metals with lower valency will tend to dissolve in metals with higher valency. 4. The solute and solvent should have similar electronegativity. If the electronegativity difference is too great, the metals will tend to form intermetallic compounds instead of solid solutions. 6

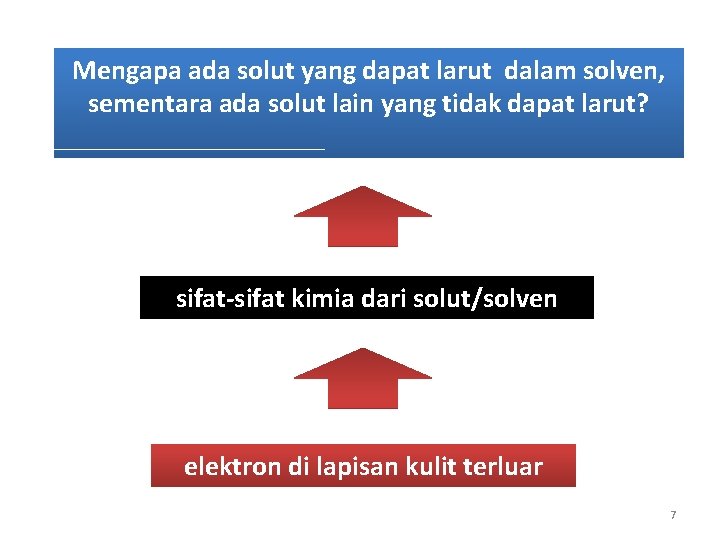
Mengapa ada solut yang dapat larut dalam solven, sementara ada solut lain yang tidak dapat larut? sifat-sifat kimia dari solut/solven elektron di lapisan kulit terluar 7

§ Setiap atom selalu berusaha membuat susunan elektron di kulit terluarnya seperti gas mulia, yaitu jumlahnya 2 (seperti He) atau 8 (Ne). § Untuk memenuhi hal itu, atom akan melepas atau menerima elektron (ikatan ionik), ataupun bekerjasama dengan atom lain (ikatan kovalen), dan ikatan logam. 8

9

Dalam satu senyawa kovalen, sering terjadi ketidakseimbangan densitas elektron di kulit terluar. Ketidakseimbangan densitas elektron di kulit terluar akan menyebabkan ketidakseimbangan magnetik sesaat yang selanjutnya akan menyebabkan molekul menjadi magnet kecil / dipole. + O + H H 10

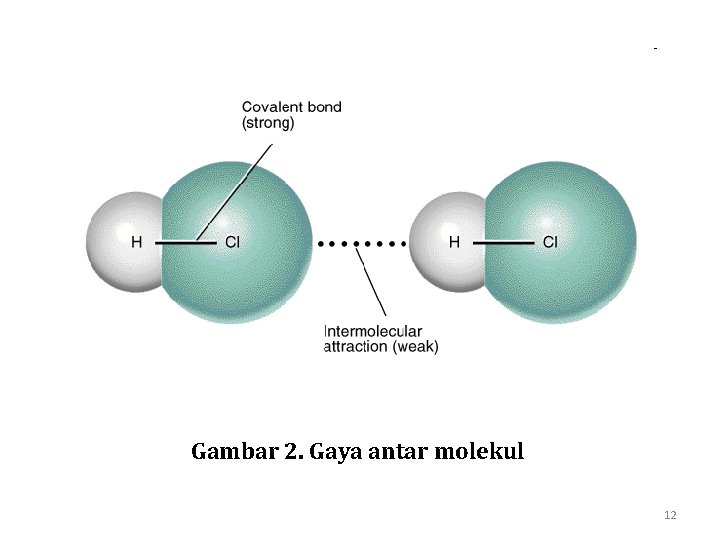
§ Penyimpangan densitas elektron ini tergantung pada susunan elektron di kulit terluar molekul: ada molekul yang sangat polar dan ada yang tidak polar. § Perbedaan tingkat kepolaran ini akan menyebabkan perbedaan gaya tarik antara satu molekul dengan molekul lainnya. § Gaya antar molekul (Intermolecular Forces) adalah gaya tarik elektrostatik antara daerah bermuatan negatif pada satu molekul dengan daerah bermuatan positif pada molekul lain. 11

Gambar 2. Gaya antar molekul 12

• Gaya ini bekerja di antara molekul - molekul stabil atau antar gugus-gugus fungsional dari makromolekul. • Gaya antar molekul ini menyebabkan molekul “berkumpul”. • Energi yang diperlukan untuk memisahkan masing molekul jauh lebih kecil daripada energi ikatan. • Gaya antar molekul berperan penting pada sifat-sifat senyawa. 13

Tipe gaya antar molekul: 1. Antar molekul non-polar: a. Gaya dispersi London/gaya van der Waals 2. Antar molekul non polar dan molekul polar: b. Interaksi dipole – induced dipole c. Interaksi ion – induced dipole 3. Antar molekul polar: d. Interaksi dipole – dipole e. Ikatan hidrogen f. Interaksi ion – dipole 14

15

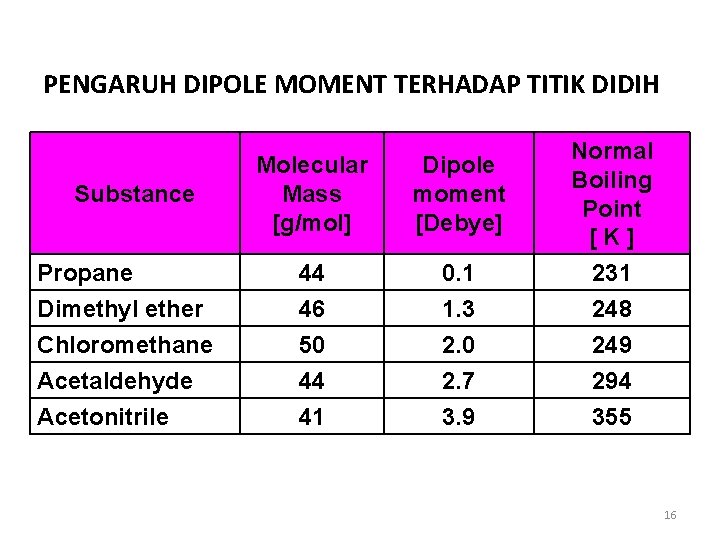
PENGARUH DIPOLE MOMENT TERHADAP TITIK DIDIH Substance Propane Dimethyl ether Chloromethane Acetaldehyde Acetonitrile Molecular Mass [g/mol] Dipole moment [Debye] 44 46 50 44 41 0. 1 1. 3 2. 0 2. 7 3. 9 Normal Boiling Point [K] 231 248 249 294 355 16

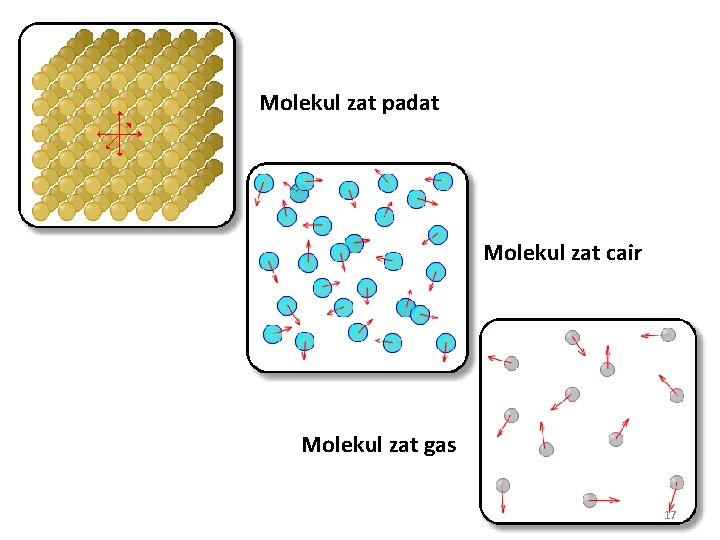
Molekul zat padat Molekul zat cair Molekul zat gas 17

Berdasarkan gaya antar molekul, solven dapat dibagi menjadi 3 kelompok: 1. Polar protic : air, metanol, asam asetat 2. Dipolar apriotic : nitrobenzene, acetonitrile, furfural 3. Non-polar apriotic : hexane, benzene, ethyl ether 18

• Dalam solven polar protic, molekul-molekul solven saling berinteraksi dengan membentuk ikatan hidrogen yang kuat. • Agar suatu solut dapat larut, maka molekul solut harus mampu memecah ikatan hidrogen antar molekul solven, dan menggantinya dengan ikatan yang sama kuat. • Agar dapat larut, molekul solut harus dapat membentuk ikatan hidrogen dengan solven. • Hal ini dapat terjadi jika molekul solut juga memiliki ikatan hidrogen, atau bersifat cukup basa sehingga mampu menerima atom hidrogen untuk membentuk ikatan hidrogen. 19

• Solven dipolar apriotic ditandai dengan nilai dielectric constant yang besar. • Dalam solven dipolar aprotic, molekul-molekul solven saling berinteraksi dengan membentuk dipole-dipole. • Jika solut juga termasuk dipolar apriotic, maka solut segera dapat berinteraksi dengan solven dan larut. • Jika solut termasuk jenis non-polar, maka solut tidak dapat berinteraksi dengan dipole dari molekul solven, sehingga tidak dapat larut. 20

• Solven non-polar apriotic ditandai dengan nilai dielectric constant yang rendah; molekul berinteraksi dengan menggunakan gaya van der Waals. • Solut non-polar aprotic mudah larut dalam solven nonpolar apriotic, karena gaya van der Waals antar molekul solut akan diganti dengan gaya yang sama dengan molekul solven. • Solut dipolar dan polar protic tidak akan larut atau hanya sangat sedikit larut dalam solven non-polar. 21

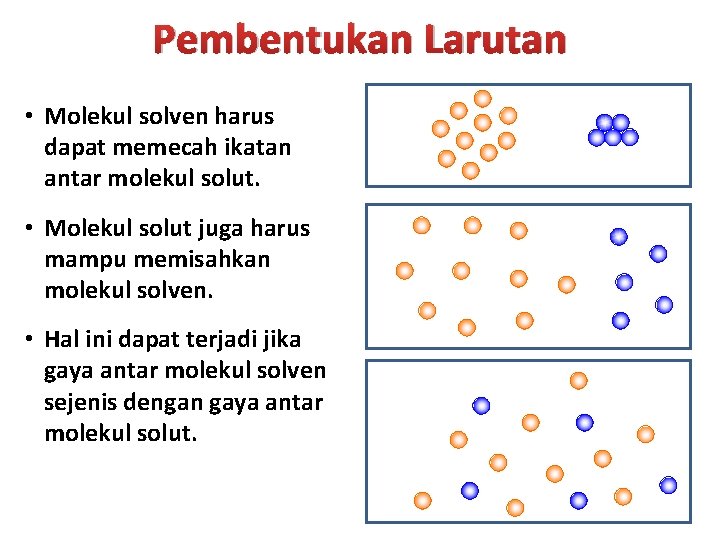
Pembentukan Larutan • Molekul solven harus dapat memecah ikatan antar molekul solut. • Molekul solut juga harus mampu memisahkan molekul solven. • Hal ini dapat terjadi jika gaya antar molekul solven sejenis dengan gaya antar molekul solut.

23

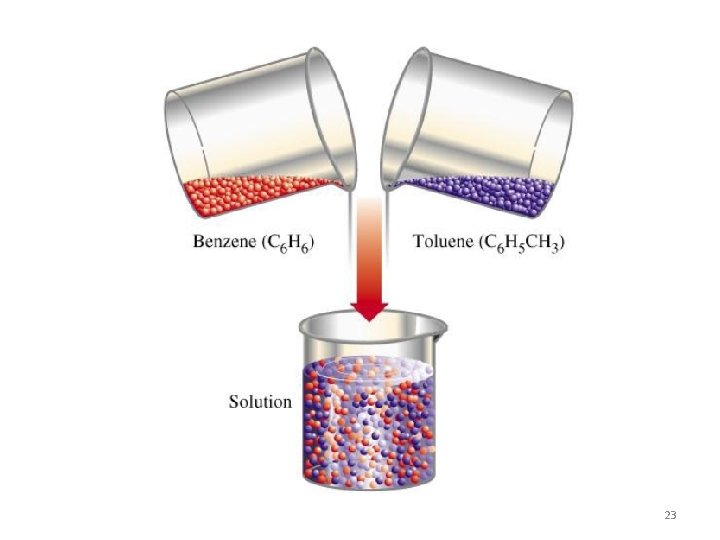
Jika gaya tarik antar molekul solut jauh berbeda dengan gaya antar molekul solven, maka molekul yang memiliki gaya tarik lebih besar akan tetap terikat satu dengan lainnya, dan akan menolak molekul lainnya, sehingga tidak terjadi pelarutan. Minyak dan air tidak dapat ber-campur, karena molekul air yang saling terikat kuat dengan ikatan hidrogen, tidak akan mengijinkan molekul minyak yang memiliki gaya tarik lemah. 24

Solubility Rule: LIKES DISSOLVE LIKES Ionic or polar solutes dissolve in polar solvents. Na. Cl dissolves in water Sugar dissolves in water Alcohol dissolves in water Non-polar solutes dissolve in non-polar solvents. • Vegetable oil dissolves in hexane • Lub. oil dissolves in kerosene • Jack fruit gum dissolves in kerosene Polar and ionic solutes DO NOT dissolve in non-polar solvents and vice versa. 25

KELARUTAN 26

Mekanisme pelarutan 27

§ Pada temperatur tertentu, jumlah maksimum solut yang dapat terlarut disebut KELARUTAN. § Jika jumlah solut yang terlarut telah mencapai harga kelarutannya, larutan tersebut disebut larutan jenuh. § Kelarutan merupakan fungsi temperatur. § Pada umumnya kelarutan bertambah dengan naiknya temperatur. 28

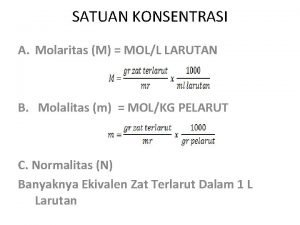
Ada beberapa cara untuk menyatakan komposisi larutan: 29 29

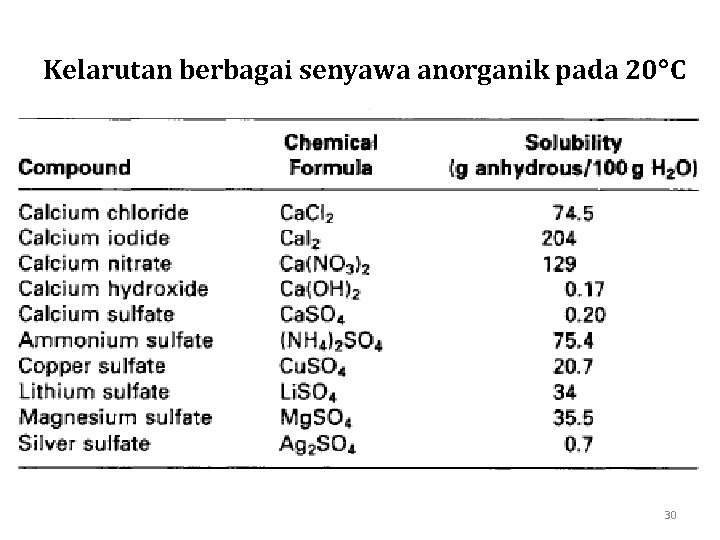
Kelarutan berbagai senyawa anorganik pada 20 C 30

Kelarutan KNO 3, CUSO 4, dan Na. Cl dalam air 31

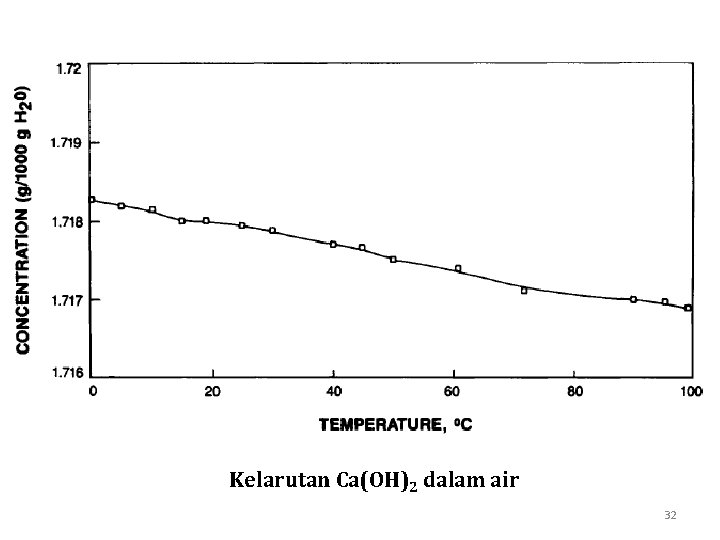
Kelarutan Ca(OH)2 dalam air 32

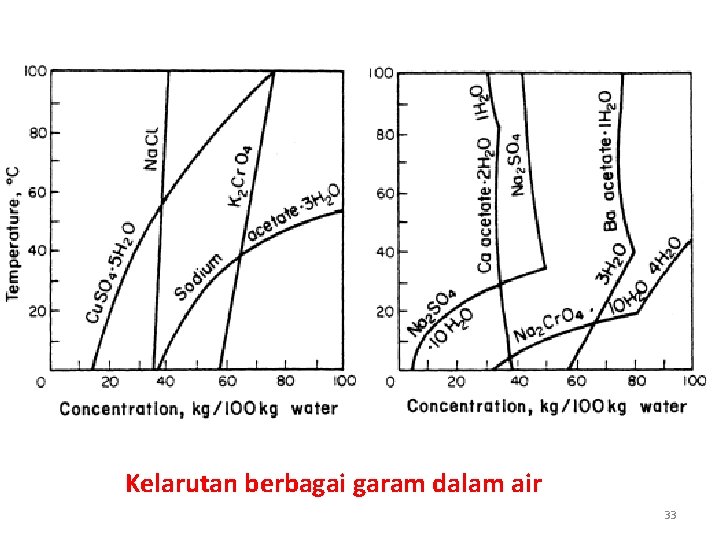
Kelarutan berbagai garam dalam air 33

Kelarutan berbagai garam dalam air

Pengaruh temperatur terhadap kelarutan dapat dinyatakan dalam suatu korelasi: c = A + Bt + Ct 2 log x = A + BT + CT 2 log x = A + BT-1 log x = A + BT 1 + CT-2 log x = A + BT-1 + C log T

HASIL TEORITIS KRISTAL C 1 : konsentrasi awal (kg garam anhidrat/kg solven) C 2 : konsentrasi akhir (kg garam anhidrat/kg solven) W : berat awal solven (kg) V : solven yang hilang karena menguap (kg/kg solven mula-mula) R : rasio berat molekul garam hidrat dan anhidrat Y : crystal yield (kg) 36

Kristal garam anhidrat Total loss of solvent : Y = W C 1 (1) No loss of solvent : Y = W (C 1 – C 2) (2) Partial loss of solvent : Y = W [C 1 – C 2 (1 – V)] (3)

Kristal garam hidrat/solvat Total loss of solvent : Y = W C 1 (4) No loss of solvent : (5) Partial loss of solvent : (6)

CONTOH Hitung hasil teoritis kristal murni yang dapat diperoleh dari larutan yang mengandung 100 kg Na 2 SO 4 (BM = 142) dalam 500 kg air dengan cara pendinginan sampai 10 C. Kelarutan Na 2 SO 4 pada 10 C adalah 9 kg anhidrat per 100 kg air, dan kristal yang mengendap berupa dekahidrat (BM = 322). Anggap bahwa 2% dari air akan hilang karena menguap 39

PENYELESAIAN R = 322/142 = 2, 27 C 1 = 0, 2 kg Na 2 SO 4 per kg air C 2 = 0, 09 kg Na 2 SO 4 per kg air W = 500 kg air V = 0, 02 kg per kg air mula-mula = 143 kg Na 2 SO 4. 10 H 2 O 40

• Untuk yield kristal dari kristaliser vakum, perlu diperkirakan jumlah solven yang menguap, V. • V tergantung pada panas yang digunakan dalam kristaliser. • Neraca panas: (7) dengan v: enthalpy penguapan solven (k. J kg-1) c : enthalpy kristalisasi solut (k. J kg-1) t 1 : temperatur awal dari larutan ( C) t 2 : temperatur akhir dari larutan ( C) c : kapasitas panas rata-rata dari larutan (k. J kg-1 K-1)
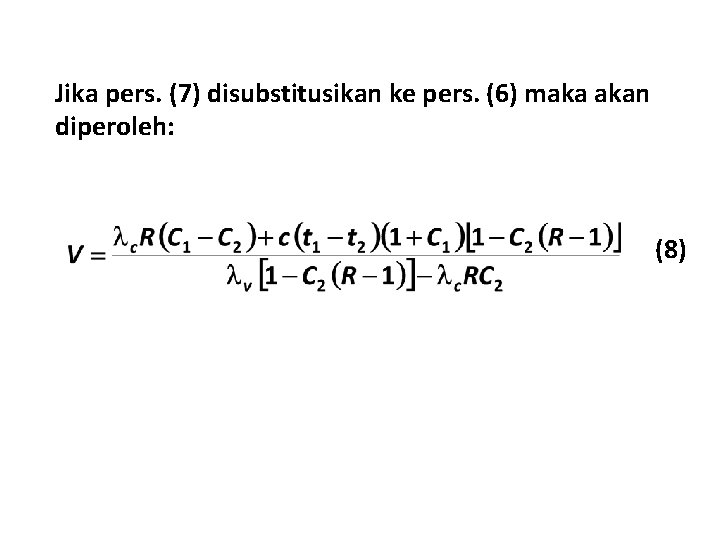
Jika pers. (7) disubstitusikan ke pers. (6) maka akan diperoleh: (8)

CONTOH Perkirakan hasil teoritis kristal sodium asetat (CH 3 COONa. 3 H 2 O) dari kristaliser vakum dengan tekanan 15 mbar apabila kristaliser tersebut disupply larutan sebesar l 2000 kg/jam larutan sodium asetat 40% pada 80 C. Kenaikan titik didih larutan 11, 5 C. 43

Panas kristalisasi CH 3 COONa. 3 H 2 O ( c) = 144 k. J/kg Kapasitas panas larutan (c) = 3, 5 k. J kg-1 K-1 Panas laten penguapan air pada 15 mbar ( v) = 2, 46 MJ/kg Titik didih air pada 15 mbar = 17, 5 C Temperatur operasi = 17, 5 + 11, 5 = 29 C Kelarutan pada 29 C (C 2) = 0, 539 kg/kg H 2 O Konsentrasi awal (C 2) = 0, 667 kg/kg H 2 O Massa air mula-mula dalam feed (W) = 0, 6 2000 = 1200 kg/jam Rasio berat molekul (R) = 136/82 = 1, 66 44

= 0, 153 kg/kg air mula-mula = 660 kg/jam 45

Kelarutan senyawa organik Kelarutan asam adipat dalam berbagai solven

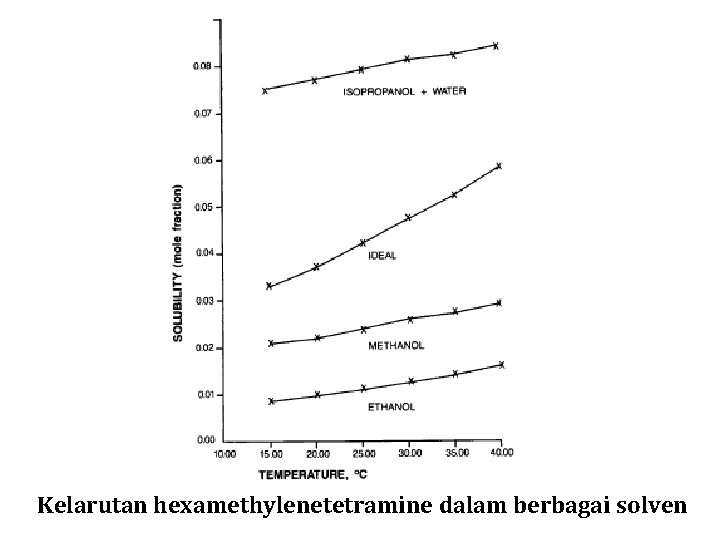
Kelarutan hexamethylenetetramine dalam berbagai solven

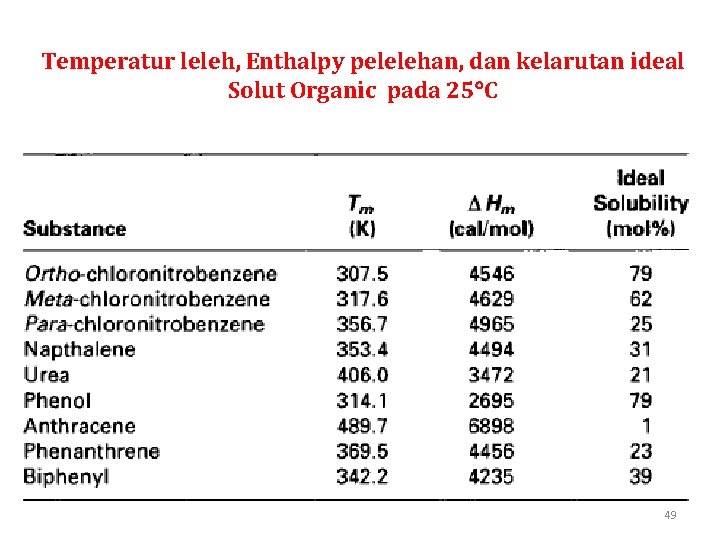
Kelarutan solut organik dalam larutan ideal dapat dihitung dengan menggunakan persamaan sbb. : (9) dengan x 2 Hm R Tm T : fraksi mol solut dalam larutan : enthalpy pelelehan : konstanta gas universal : titik leleh solut : temperatur larutan

Temperatur leleh, Enthalpy pelelehan, dan kelarutan ideal Solut Organic pada 25 C 49

SENYAWA DENGAN KELARUTAN SANGAT KECIL LARUTAN ENCER Contoh: Ag. Cl, yang mengalami disosiasi: Ag. Cl(s) Ag++ Cl. Konstanta keseimbangan reaksi: (10) Jika padatan Ag. Cl berada dalam bentuk kristal yang stabil dan berada pada tekanan atmosferis, maka kondisi tersebut merupakan kondisi standar dan aktifitasnya = 1. 50

Pers. (10) menjadi: (11) dengan : koefisien aktivitas m : konsentrasi ions dalam larutan (molal) Untuk solut dengan kelartutan sangat kecil seperti Ag. Cl, 1, sehingga pers. (2) menjadi (12)

Untuk elektrolit yang terdiri atas ion univalen dan bivalen, seperti Ag 2 SO 4, yang terdisosiasi menjadi 2 mol Ag+ dan 1 mol SO 42 -, hasil kali kelarutannya adalah: (13)

Hasil kali kelarutan berbagai macam senyawa 53

§ Prinsip hasil kali kelarutan dapat digunakan untuk menghitung pengaruh suatu spesies terhadap kelarutan solut tertentu dan menentukan spesies yang akan mengendap dalam suatu larutan elektrolit. § Salah satu contoh adalah EFEK ION SEJENIS, yang disebabkan oleh penambahan satu jenis spesies ionik yang memiliki ion sejenis dengan senyawa yang kita tinjau. § Karena kelarutan suatu spesies merupakan hasil kali antara konsentrasi ion-ionnya, apabila konsentrasi salah satu ion bertambah, maka konsentrasi ion lainnya akan menurun.

CONTOH Hitung jumlah maksimum Ag. Cl yang dapat larut dalam larutan yang mengandung 1 10 -5 molal Na. Cl PENYELESAIAN Konsentrasi ion Cl- in dalam larutan mula-mula: 1 10 -5 molal Na. Cl Misal jumlah Ag. Cl yang terlarut adalah x molal, maka hasil kali kelarutan Ag. Cl adalah:

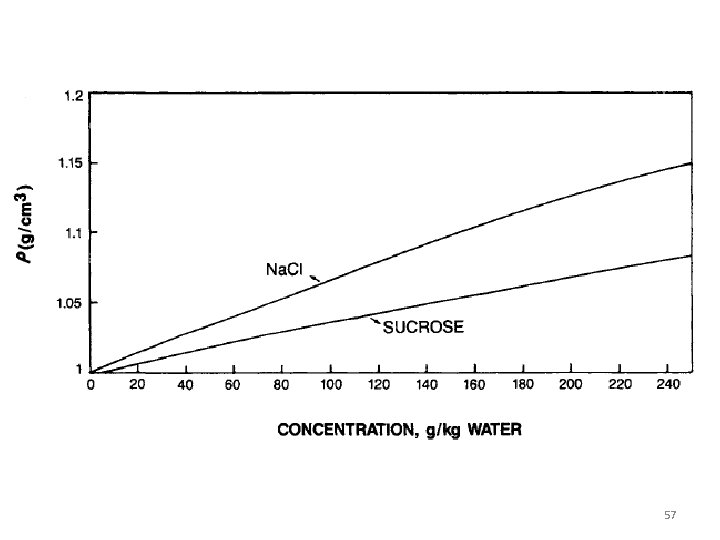
SIFAT-SIFAT LARUTAN DENSITY VISKOSITAS DIFUSIFITAS 56

57

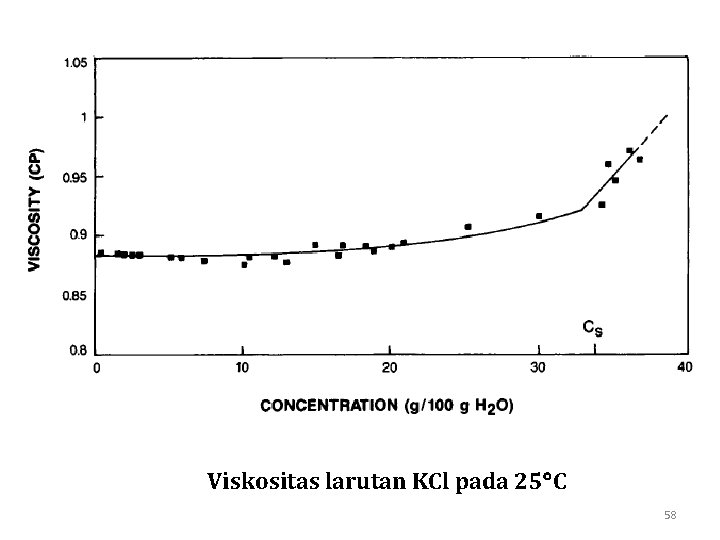
Viskositas larutan KCl pada 25 C 58

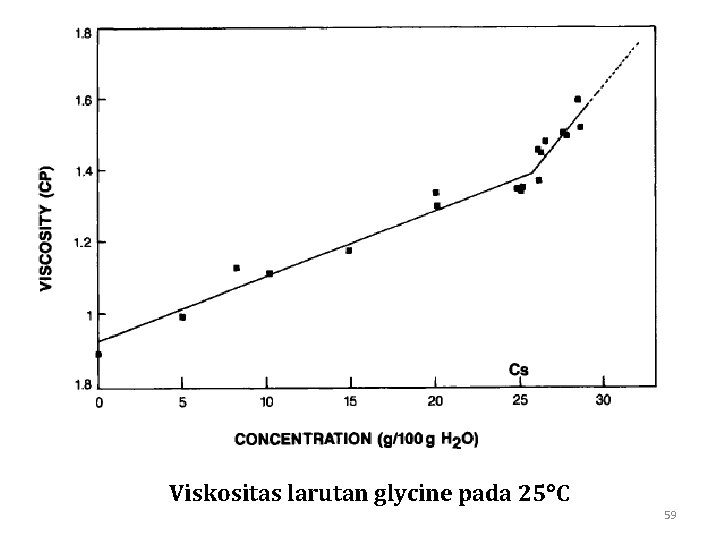
Viskositas larutan glycine pada 25 C 59

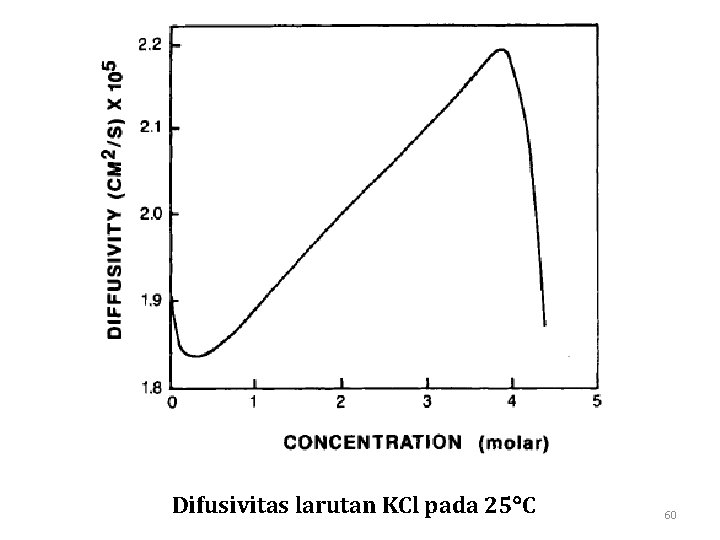
Difusivitas larutan KCl pada 25 C 60

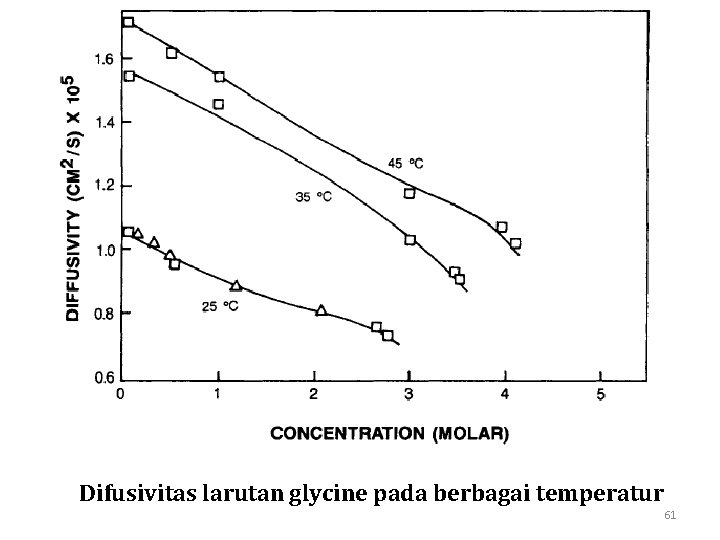
Difusivitas larutan glycine pada berbagai temperatur 61

SIFAT TERMAL LARUTAN Beberapa sifat termal yang diperlukan: • Kapasitas panas • Panas laten • Panas pencampuran, pelarutan, dan kristalisasi 62
 Kinetika kimia
Kinetika kimia Kedalam larutan basa lemah loh
Kedalam larutan basa lemah loh Pengertian larutan buffer
Pengertian larutan buffer Rumus oh-
Rumus oh- Ideal gas vs perfect gas
Ideal gas vs perfect gas Imaginary gas
Imaginary gas Gas law
Gas law Computational fluid dynamics
Computational fluid dynamics Bhopal gas tragedy causes
Bhopal gas tragedy causes Gas leaked in bhopal gas tragedy
Gas leaked in bhopal gas tragedy Volume molare
Volume molare Flue gas desulfurisation gas filter
Flue gas desulfurisation gas filter Poisonous gas leaked in bhopal gas tragedy
Poisonous gas leaked in bhopal gas tragedy Difference between ideal gas and real gas
Difference between ideal gas and real gas Gas exchange key events in gas exchange
Gas exchange key events in gas exchange Sifat larutan dan pemisahan
Sifat larutan dan pemisahan Jenis jenis emulsi
Jenis jenis emulsi Ukuran partikel suspensi
Ukuran partikel suspensi Elektolit adalah
Elektolit adalah Campuran garam terhidrolisis
Campuran garam terhidrolisis Tekanan zat padat dan cair
Tekanan zat padat dan cair Sifat fisika dan kimia gas mulia
Sifat fisika dan kimia gas mulia Latihan soal teori kinetik gas
Latihan soal teori kinetik gas Campuran homogen adalah
Campuran homogen adalah Soal dan pembahasan teori kinetik gas
Soal dan pembahasan teori kinetik gas Dalam ruangan yang bervolume 1 5 liter terdapat
Dalam ruangan yang bervolume 1 5 liter terdapat Awan antarbintang yang terdiri dari debu gas dan plasma
Awan antarbintang yang terdiri dari debu gas dan plasma Alkohol sekunder
Alkohol sekunder Ppt kimia erlangga
Ppt kimia erlangga Amfotir
Amfotir Macam macam larutan penyangga
Macam macam larutan penyangga Contoh larutan penyangga basa
Contoh larutan penyangga basa Campuran homogen tersusun dari
Campuran homogen tersusun dari Larutan adalah
Larutan adalah Tentukan massa zn dalam larutan na2zn(oh)
Tentukan massa zn dalam larutan na2zn(oh) Ridla bakri
Ridla bakri Satuan konsentrasi molaritas
Satuan konsentrasi molaritas Reaksi kimia dalam larutan air
Reaksi kimia dalam larutan air Faktor van't hoff
Faktor van't hoff Rumus tekanan uap
Rumus tekanan uap Pengertian konsentrasi larutan
Pengertian konsentrasi larutan Tekanan uap larutan
Tekanan uap larutan Cuka berasid atau beralkali
Cuka berasid atau beralkali Sifat larutan basa
Sifat larutan basa Rumus keformalan
Rumus keformalan Materi kimia kelas 12 semester 1 sifat koligatif larutan
Materi kimia kelas 12 semester 1 sifat koligatif larutan Hitung osmolaritas
Hitung osmolaritas Pipet tetes
Pipet tetes Campuran biner
Campuran biner Larutan hcl yang dijual di pasaran memiliki konsentrasi 45
Larutan hcl yang dijual di pasaran memiliki konsentrasi 45 Asas kekekalan energi
Asas kekekalan energi Rumus normalitas
Rumus normalitas Metode krioskopik adalah
Metode krioskopik adalah Contoh tindak balas termokimia
Contoh tindak balas termokimia Potiones adalah
Potiones adalah Larutan
Larutan Molaritas adalah
Molaritas adalah Solubility adalah
Solubility adalah Larutan burowi adalah
Larutan burowi adalah Larutan adalah campuran yang
Larutan adalah campuran yang Campuran yang menghasilkan garam
Campuran yang menghasilkan garam Sifat koligatif larutan adalah sifat yang bergantung pada
Sifat koligatif larutan adalah sifat yang bergantung pada Pengertian elektrolit dan non elektrolit
Pengertian elektrolit dan non elektrolit