HASIL KALI KELARUTAN Larutan adalah Campuran zat yang









![Karena Ag. Cl dalam fase padat dan tidak berubah, maka : K. [Ag. Cl] Karena Ag. Cl dalam fase padat dan tidak berubah, maka : K. [Ag. Cl]](https://slidetodoc.com/presentation_image_h/dde9148758a6e002f76ee139a4f9fa84/image-10.jpg)




![Ksp = = = [Ag+][Cl–] [2 x 1, 08. 10– 4][1, 08. 10– 4] Ksp = = = [Ag+][Cl–] [2 x 1, 08. 10– 4][1, 08. 10– 4]](https://slidetodoc.com/presentation_image_h/dde9148758a6e002f76ee139a4f9fa84/image-15.jpg)



![Ag+ yang digunakan untuk mengendapkan ion Cr. O 4= : Ksp = [Ag+]2[Cr. O Ag+ yang digunakan untuk mengendapkan ion Cr. O 4= : Ksp = [Ag+]2[Cr. O](https://slidetodoc.com/presentation_image_h/dde9148758a6e002f76ee139a4f9fa84/image-20.jpg)

![Ag. Cl x Ag+ x + Cl– x + 0, 01 Ksp = [Ag+][Cl–] Ag. Cl x Ag+ x + Cl– x + 0, 01 Ksp = [Ag+][Cl–]](https://slidetodoc.com/presentation_image_h/dde9148758a6e002f76ee139a4f9fa84/image-22.jpg)





- Slides: 28

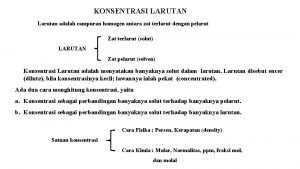
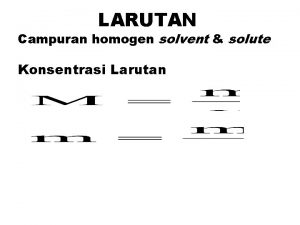
HASIL KALI KELARUTAN

Larutan adalah : Campuran zat yang homogen, memiliki komposisi merata atau serba sama diseluruh bagian volumenya.

Larutan mengandung : § § Zat terlarut : satu atau lebih (jumlahnya sedikit). Pelarut : komponen yang melarutkan zat terlarut dan terdapat dalam jumlah banyak.

Banyaknya zat terlarut yang dapat menghasilkan larutan jenuh dalam jumlah tertentu pelarut pada suhu tertentu disebut kelarutan. Jika larutan mengandung dengan jumlah maksimum zat terlarut pada suhu tertentu larutan jenuh. Sebelum mencapai titik jenuh disebut larutan tidak jenuh.

Kadang kadang dijumpai dengan zat terlarut dalam larutan lebih banyak daripada zat terlarut yang seharusnya dapat melarut pada suhu tertentu. Larutan ini disebut larutan lewat jenuh.

Kelarutan suatu zat bergantung pada : § Sifat zat yang terlarut, § Molekul pelarut, § Suhu, dan § Tekanan.

Kelarutan suatu zat (menurut Farmakope) : § Sangat mdh larut : kelarutannya dari 1 § Mudah larut : kelrtannya ant. 1 – 10 § Larut : kelrtannya 10 – 100 § Sukar larut : kelrtan. 100 – 1000 § Sangat sukar larut : kelrtan 1000 – 10. 000 § Praktis tidak larut : kelrtannya dari 10. 000

Zat X mempunyai kelarutan dlm 2, 8 Artinya : 1 bagian zat X terlarut dlm 2, 8 bagian air ( larutan jenuh ). Larutan yg mengandung 2 komponen disebut larutan biner, dan komposisinya adalah 1 zat terlarut & 1 pelarut.

Jika Ag. Cl dilarutkan dalam air, maka di dalam larutan tersebut ada kesetimbangan antara zat yang terlarut dan zat yang tidak larut. Ag. Cl Ag+ + Cl– tak larut [Ag+][Cl– K = ------[Ag. Cl]
![Karena Ag Cl dalam fase padat dan tidak berubah maka K Ag Cl Karena Ag. Cl dalam fase padat dan tidak berubah, maka : K. [Ag. Cl]](https://slidetodoc.com/presentation_image_h/dde9148758a6e002f76ee139a4f9fa84/image-10.jpg)
Karena Ag. Cl dalam fase padat dan tidak berubah, maka : K. [Ag. Cl] = [Ag+][Cl–] Ksp adalah suatu tetapan yang dinamakan Tetapan Hasil Kali Kelarutan hasil kali konsentrasi (dlm molar) semua ion dalam larutan jenuh pada suhu dan tekanan tertentu dan masing 2 ion dipangkatkan dgn koefisiennya.

Jadi larutan jenuh Ag. Cl pada suhu dan tekanan tertentu, maka hasil kali konsentrasi ion perak dan ion klorida adalah konstan. A 2 B 3 2 A + 3 B Ksp = [A]2. [B]3. Bila : [A]2. [B]3 < Ksp belum mengendap [A]2. [B]3 = Ksp larutan jenuh [A]2. [B]3 > Ksp larutan mengendap

Contoh : Zat Ag. Cl Ag. Br Ag. I Cd. S Cu. S Sr. SO 4 Ba. SO 4 Mg(OH)2 Ksp 1, 1. 10– 10 1, 3. 10– 12 1, 3. 10– 16 1, 4. 10– 28 2, 0. 10– 47 2, 8. 10– 7 9, 2. 10– 11 3, 4. 10– 11

Ksp suatu garam ukuran kelarutan garam tersebut dalam air. Contoh : Hitung kelarutan Ag. Cl dalam air ! Misal : Ag. Cl yang larut = x Ag. Cl Ag+ + Cl– x x x Ksp = [Ag+][Cl–] 1, 1. 10– 10 = x 2 x = 1, 05. 10– 5 M

Kelarutan Ag. Cl = 1, 05. 10– 5 x 143, 3 g/L = 1, 5. 10– 3 g/L = 1, 5 mg/L Hitung Ksp Ag 2 Cr. O 4, jika diketahui 1 liter jenuh mengandung 3, 57. 10– 2 g ! Ag 2 Cr. O 4 1, 08. 10– 4 = 3, 57. 10– 2/331, 7 = 1, 08. 10– 4 molar 2 Ag+ + Cr. O 4= 2 x 1, 08. 10– 4
![Ksp AgCl 2 x 1 08 10 41 08 10 4 Ksp = = = [Ag+][Cl–] [2 x 1, 08. 10– 4][1, 08. 10– 4]](https://slidetodoc.com/presentation_image_h/dde9148758a6e002f76ee139a4f9fa84/image-15.jpg)
Ksp = = = [Ag+][Cl–] [2 x 1, 08. 10– 4][1, 08. 10– 4] 4, 99. 10– 12. Dalam membandingkan kelarutan suatu garam, maka perlu memperhatikan struktur stoikiometrinya. Ag. Cl 1. 10– 10 Ag. Br 1. 10– 12 Ag. I 1. 10– 16

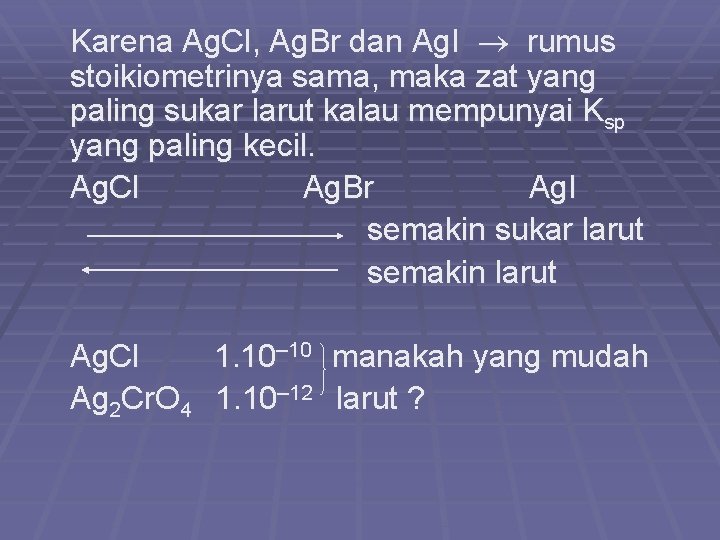
Karena Ag. Cl, Ag. Br dan Ag. I rumus stoikiometrinya sama, maka zat yang paling sukar larut kalau mempunyai Ksp yang paling kecil. Ag. Cl Ag. Br Ag. I semakin sukar larut semakin larut Ag. Cl 1. 10– 10 manakah yang mudah Ag 2 Cr. O 4 1. 10– 12 larut ?

Manakah yang mempunyai kelarutan : § Paling besar § Paling kecil Urutkan dari kelarutan kecil ke besar ! Cd. S 1, 4. 10– 28 Cu. S 1. 10– 14 Hg. S 4. 10– 54 Mn. S 1, 4. 10– 15 Ni. S 1, 4. 10– 24 Pb. S 5. 10– 29

Ksp Pb 3(PO 4)2 = 1, 5. 10– 32 Hitung kelarutan Pb 3(PO 4)2 (Mr. = 811, 5) jenuh dalam air ! Jawab : misal kelarutan Pb 3(PO 4)2 = x Pb 3(PO 4)2 3 Pb 2+ + 2 PO 43– x 3 x 2 x Ksp = [Pb 2+]3[PO 43–]2 1, 5. 10– 32 = [3 x]3 [2 x]2 X = 1, 69. 10– 7 molar Kelarutannya = 1, 69. 10– 7 x 811, 5 g/Liter

Kelarutan Pb 3(PO 4)2 = 1, 37. 10– 4 g/L = 0, 137 mg/L Campuran ion Cl– 0, 01 M & Cr. O 4= 0, 001 M ditambah Ag. NO 3 tetes demi tetes. Manakah yang mengendap lebih dahulu ? Jelaskan mengapa demikian ! Ag+ yang digunakan untuk mengendapkan Cl– : Ksp = [Ag+][Cl–] 1. 10– 10 = [Ag+][0, 01] [Ag+] = 1. 10– 8
![Ag yang digunakan untuk mengendapkan ion Cr O 4 Ksp Ag2Cr O Ag+ yang digunakan untuk mengendapkan ion Cr. O 4= : Ksp = [Ag+]2[Cr. O](https://slidetodoc.com/presentation_image_h/dde9148758a6e002f76ee139a4f9fa84/image-20.jpg)
Ag+ yang digunakan untuk mengendapkan ion Cr. O 4= : Ksp = [Ag+]2[Cr. O 4=] 1. 10– 12 = [Ag+]2[0, 001] [Ag+] = 3, 16. 10– 5 Ag+ yg dibutuhkan untuk mengendapkan : Ion Cl– : 1. 10– 8 Ion Cr. O 4= : 3, 16. 10– 5 Maka ion Cl– akan mengendap lebih dahulu, karena. .

Pengaruh Ion Senama Kelarutan garam yang sukar larut akan berkurang kalau larutan mengandung salah satu ion yang terdapat dalam garam tersebut. Misalnya melarutkan Ag. Cl dalam larutan yang mengandung Na. Cl. Contoh : Ag. Cl dilarutkan dalam larutan Na. Cl 0, 01 M Bagaimana kelarutannya ?
![Ag Cl x Ag x Cl x 0 01 Ksp AgCl Ag. Cl x Ag+ x + Cl– x + 0, 01 Ksp = [Ag+][Cl–]](https://slidetodoc.com/presentation_image_h/dde9148758a6e002f76ee139a4f9fa84/image-22.jpg)
Ag. Cl x Ag+ x + Cl– x + 0, 01 Ksp = [Ag+][Cl–] 1. 10– 10 = [x][0, 01] x =1. 10– 8 Maka adanya ion Cl–, kelarutan Ag. Cl semakin berkurang. Bila tidak ada ion klorida, maka : x = 1. 10– 5 Ksp = [Ag+][Cl–] 1. 10– 10 = [x][x] x =1. 10– 5

Pengendapan dengan H 2 S 2 H+ + S= K = 1. 10– 22 [H+]2[S=] K = ------[H 2 S] Karena gas H 2 S jenuh 0, 1 M, maka : K x [H 2 S] = [H+]2[S=] 1. 10– 22 x 0, 1 = [H+]2[S=] 1. 10– 23 = [H+]2[S=] p. S = 23 – 2 p. H

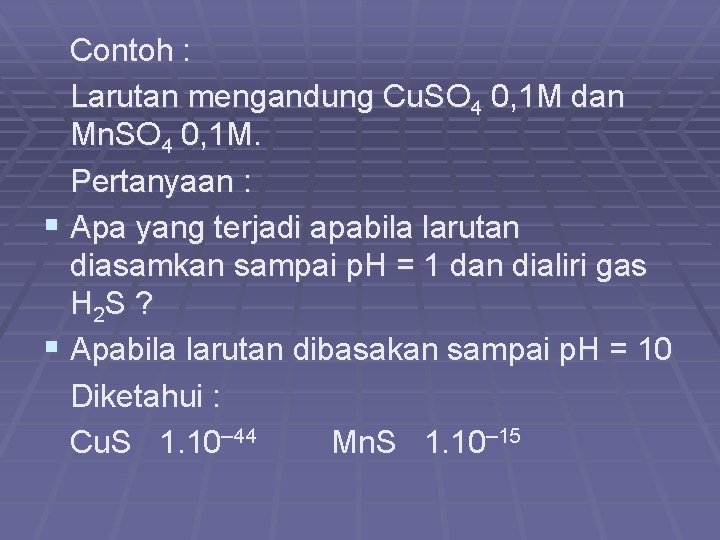
Contoh : Larutan mengandung Cu. SO 4 0, 1 M dan Mn. SO 4 0, 1 M. Pertanyaan : § Apa yang terjadi apabila larutan diasamkan sampai p. H = 1 dan dialiri gas H 2 S ? § Apabila larutan dibasakan sampai p. H = 10 Diketahui : Cu. S 1. 10– 44 Mn. S 1. 10– 15

Jawab : Bila p. H = 1, maka p. S = 23 – 2 x 1 = 21 S= = 1. 10– 21 Maka : [Cu 2+][S=] [Mn 2+][S=] [0, 1][1. 10– 21] 1. 10– 22 Ksp 1. 10– 44 1. 10– 15 mengendap tetap larut

Bila p. H = 10, maka p. S = 23 – 2 x 10 p. S = 3 S= = 1. 10– 3 Maka : [Cu 2+][S=] [Mn 2+][S=] [0, 1][1. 10– 3] 1. 10– 4 Ksp 1. 10– 44 1. 10– 15 mengendap karena harga Ksp hitung lebih besar dari Ksp teori dan keduanya tidak dapat dipisahkan.

Contoh : Larutan Ni. Cl 2 0, 001 M Pada p. H berapakan Ni. S mulai mengendap jika dialiri gas H 2 S ? Ksp = 1. 10– 24 Jawab : [Ni 2+][S=] = 1. 10– 24 [0, 001][S=] = 1. 10– 24 S= = 1. 10– 21 p. S = 23 – 2 p. H 21 = 23 – 2 p. H = 1 Pada p. H 1, Ni. S mulai mengendap.

Pada p. H berapakah Fe(OH)3 mulai mengendap dari larutan Fe. Cl 3 0, 01 M, jika Ksp 3, 8. 10– 38 ? Jawab : [Fe 3+][OH–]3 = 3, 8. 10– 38 [0, 01][OH–]3 = 3, 8. 10– 38 [OH–] = 1, 56. 10– 12 p. OH = 11, 81 p. H = 14 – 11, 81 = 2, 19 Fe(OH)3 mulai mengendap pada p. H 2, 19
 Ksp s
Ksp s Hasil kali titik (dot product)
Hasil kali titik (dot product) Ke dalam larutan basa lemah loh
Ke dalam larutan basa lemah loh Larutan penyangga pada obat tetes mata
Larutan penyangga pada obat tetes mata Rumus basa lemah
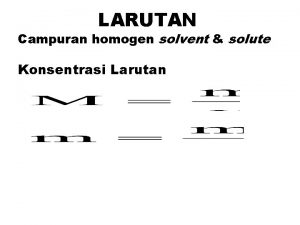
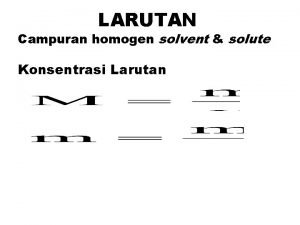
Rumus basa lemah Larutan adalah campuran yang
Larutan adalah campuran yang Larutan adalah campuran yang
Larutan adalah campuran yang Rumus normalitas
Rumus normalitas Larutan adalah campuran yang
Larutan adalah campuran yang Garam yang terhidrolisis sebagian dan bersifat basa adalah
Garam yang terhidrolisis sebagian dan bersifat basa adalah Campuran homogen adalah
Campuran homogen adalah Arti homogen
Arti homogen Peta konsep zat dan perubahannya
Peta konsep zat dan perubahannya Ekskresi mengeluarkan zat-zat berupa....
Ekskresi mengeluarkan zat-zat berupa.... Bagan zat campuran
Bagan zat campuran Menentukan hasil kali skalar dua vektor
Menentukan hasil kali skalar dua vektor Jarak 490 km ditempuh sebuah mobil dengan bensin 35 liter
Jarak 490 km ditempuh sebuah mobil dengan bensin 35 liter Jika harga 3 lusin pensil rp45.000
Jika harga 3 lusin pensil rp45.000 Himpunan ortogonal
Himpunan ortogonal Dasar hukum farmakope
Dasar hukum farmakope Rumus kelarutan
Rumus kelarutan Kelarutan gula
Kelarutan gula Pelarut anorganik contoh
Pelarut anorganik contoh Bentuk membran kenyal adalah
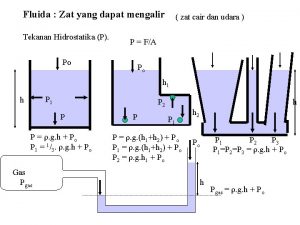
Bentuk membran kenyal adalah Zat yang dapat mengalir
Zat yang dapat mengalir Rumus gaya apung
Rumus gaya apung Zat adalah segala sesuatu yang memiliki
Zat adalah segala sesuatu yang memiliki Ciri phytoflagellata
Ciri phytoflagellata Sesuatu yang menempati ruang dan mempunyai masa disebut
Sesuatu yang menempati ruang dan mempunyai masa disebut