7 LARUTAN ELEKTROLIT ELEKTROKIMIA 1 LARUTAN ELEKTROLIT Larutan


























- Slides: 27

7 LARUTAN ELEKTROLIT & ELEKTROKIMIA

1. LARUTAN ELEKTROLIT Larutan adalah campuran 2 zat atau lebih yang dapat bercampur secara sempurna (homogen) Berdasarkan sifat daya hantar listrik, larutan dibagi ke dalam dua jenis : › Larutan elektrolit › Larutan non elektrolit

1. Larutan Elektrolit adalah larutan yang dapat menghantarkan arus listrik. Larutan ini dapat menghantarkan arus listrik dikarenakan zat yang terlarut dalam air berubah menjadi ion. Misal : Na. Cl → Na+ + Cl. Banyaknya ion dalam larutan berpengaruh terhadap daya hantar listrik. Semakin banyak ion yang terkandung dalam larutan maka semakin kuat daya hantar listriknya.

Banyaknya ion yang terkandung dalam larutan dinyatakan dengan derajat ionisasi (α), yaitu perbandingan mol zat terionisasi dengan mol zat mula-mula. Ba. Cl 2 → Ba 2+ + 2 Cl. Na 2 S → 2 Na+ + S 2 -

Larutan elektrolit dibagi jadi dua jenis : Ø Elektrolit Kuat : elektrolit yang dalam larutan banyak menghasilkan ion (α = 1) Contoh : Na. Cl, H 2 SO 4, K 2 SO 4, dan Na. OH Ø Elektrolit Lemah : elektrolit yang dalam larutan sedikit menghasilkan ion (0<α<1) Contoh : NH 4 OH, HCN, CH 3 COOH dan H 3 PO 4

2. Larutan Non Elektrolit Adalah larutan yang tidak dapat menghantarkan arus listrik. Contoh : C 2 H 5 OH (alkohol) CH 3 -O-CH 3 (eter) CO(NH 2)2 (urea) C 6 H 6 (benzena) C 6 H 12 O 6 (glukosa)

LATIHAN 1. Apakah yang dimaksud larutan 2. Bagaimanakah cara menentukan apakah suatu larutan tergolong elektrolit atau nonelektrolit? Jelaskan. 3. Sebutkan tanda – tanda larutan yang menghantarkan listrik. 4. Sebutkan tiga contoh larutan elektrolit dan tiga contoh larutan nonelektrolit

. 6. Lengkapi data hasil pengujian daya hantar listrik beberapa larutan berikut: PENGAMATAN LARUTAN SIFAT LARUTAN NYALA LAMPU GELEMBUNG GAS A Tidak menyala Ada . . . B Tidak menyala Tidak ada . . . C Menyala Ada . . . D Tidak menyala Ada . . . E Menyala Ada . . . F Tidak menyala Tidak ada . . . G Menyala Ada . . .

7. 2 Menerapkan Konsep Reaksi Redoks Dalam Elektrokimia

Aturan bilangan oksidasi Bil. Oksidasi atom H = +1 2. Bil. Oksidasi atom O = - 2 3. Bilangan oksidasi logam = + Golongan I A = +1 (Li, Na, K, Cs) Golongan IIA = +2 (Be, Mg, Ca, Sr, Ba, Ra) 4. Jumlah Bil. Oksidasi atom dalam senyawa = 0 5. Jumlah Bil. Oksidasi atom dalam ion = muatannya 1.

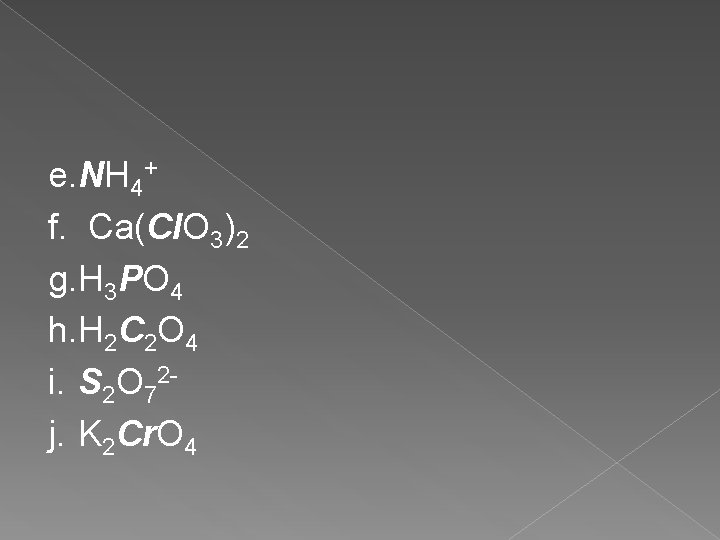
LATIHAN Tentukan B. O unsur yang dicetak miring dan tebal pada spesi berikut : a. CH 4 b. Fe 2 O 3 c. H 2 SO 4 d. Cr 2 O 72 -

e. NH 4+ f. Ca(Cl. O 3)2 g. H 3 PO 4 h. H 2 C 2 O 4 i. S 2 O 72 j. K 2 Cr. O 4

Salah Satu aplikasi dari prinsip reaksi redoks adalah sel-sel elektrokimia, yaitu reaksi yang mengubah energi kimia menjadi energi listrik atau sebaliknya. Sel elektrokimia dibagi menjadi dua : 1. Sel volta 2. Sel Elektrolisis

Sel volta Susunan sel volta Sel volta merupakan suatu perangkat yang mengubah energi dari suatu reaksi redoks spontan menjadi energi listrik. Sel volta dikembangkan oleh Alessandro Volta (1745 -1827) dan Luigi Galvani (1737 -1798) dari Italia.

Prinsip Kerja sel volta Reaksi : Zn + Cu 2+ → Zn 2+ + Cu Seng bertindak sebagai anoda (mengalami oksidasi)dan tembaga bertindak sebagai katoda (mengalami reduksi). Perpindahan elektron dari anoda ke katoda dapat dimanfaatkan sebagai sumber arus listrik.

Proses Logam zeng dalam larutan melepaskan ion Zn 2+ dan logam tembaga melepaskan ion Cu 2+. Logam zeng larut dengan melepas dua elektron Zn → Zn 2+ + 2 e Elektron mengalir ke logam Cu melalui kawat penghantar dan ion Cu 2+ mengambil elektron dari logam Cu dan mengendap Cu 2+ + 2 e → Cu


Hal-hal penting Sel Volta : a. Diantara dua elektroda pada sel volta, logam yang memiliki E 0 lebih kecil selalu sebagai anode. b. Karena elektron (muatan negatif) dipidah dari anoda ke katoda, maka pada sel volta anoda merupakan elektroda negatif dan katoda merupakan elektroda positif. c. Suatu sel volta digambarkan melalui notasi : Anode │ larutan (ion) ║ larutan (ion) │katoda Garis satu adalah pemisah antara logam dengan larutan, garis dua menyatakan jembatan garam

d. Potensial listrik yang dihasilkan sel volta disebut potensial sel (E 0) dan selalu berharga positif. E 0 sel = E 0 reduksi E 0 oksidasi = E 0 katoda - E 0 anoda = E 0 kanan E 0 kiri = E 0 besar E 0 kecil Nb. Potensial sel merupakan selisih potensial listrik antara elektroda yang mendorong elektron mengalir yang disebabkan perbedaan rapatan muatan antara elektroda-elektroda.

Sel Elektrolisis (Sir Humphry Davy & Michael Varaday) Adalah perubahan energi listrik menjadi energi kimia, dimana arus listrik digunakan untuk mendorong berlangsungnya reaksi redoks yang tidak spontan dengan penguraian elektrolit menjadi unsur-unsurnya. Kegunaan : Dapat memperoleh gas-gas halogen, hidrogen, oksigen Dapat menghitung konsentrasi ion logam dalam suatu larutan Proses penyepuhan (Elektroplating) Pemurnian logam

Hukum Faraday •


TUGAS 1. Diketahui potensial elektroda sbb : Co 2+ + 2 e → Co; E 0 = -0, 28 V K+ + e → K ; E 0 = -2, 92 V Tentukan : a. Anode dan katode c. Reaksi sel b. Notasi sel d. Potensial sel 2. Berapa detik arus listrik 3, 80 ampere harus dialirkan melalui larutan Ni. Cl 2 agar menghasilkan 1, 16 gram logam Ni pada Katode? (Ar. Ni = 58) reaksi : Ni 2+ + 2 e → Ni 3. Arus listrik yang sama dialirkan melalui larutan Cu. SO 4 dan larutan XCl 2 massa logam yang terbentuk pada kedua larutan 20 gram Cu dan 12, 5 gram logam X, jika Ar. Cu = 64, tentukan Ar. X (reaksi : Cu 2+ + 2 e → Cu)

4. Apakah yang anda ketahui tentang korosi ? 5. Tuliskan 5 cara mencegah terjadinya korosi pada besi ?


JAWABLAH DENGAN TEPAT 1. Diketahui potensial elektroda sbb : Pb 2+ + 2 e → Pb E 0 = - 0, 13 V Ni 2+ + 2 e → Ni E 0 = - 0, 25 V Tentukan : a. Anode dan katode c. Reaksi sel b. Notasi sel d. Potensial sel 2. Jika larutan Ni. Cl 2 dielektrolisis dengan kuat arus 2 A selama 1930 detik (Ar Ni = 58) Hitunglah endapan Ni yang terbentuk di katoda. Reaksi: Ni 2+ + 2 e → Ni

3. Berapa detik arus listrik 10 ampere harus dialirkan melalui larutan Cu. SO 4 agar menghasilkan 3, 175 gram logam Cu pada Katode? (Ar. Cu = 63, 5) reaksi : Cu 2+ + 2 e → Cu
 Larutan elektrolit
Larutan elektrolit Elektrolit
Elektrolit Caoh2 elektrolit atau non elektrolit
Caoh2 elektrolit atau non elektrolit Bab 2 reaksi redoks dan elektrokimia
Bab 2 reaksi redoks dan elektrokimia Energi bebas gibbs
Energi bebas gibbs Sel galvani
Sel galvani Rumus oh-
Rumus oh- Campuran berikut bersifat penyangga, kecuali...
Campuran berikut bersifat penyangga, kecuali... Larutan penyangga adalah larutan yang
Larutan penyangga adalah larutan yang Teori asam basa arrhenius
Teori asam basa arrhenius Kolika je koncentracija vodonikovih jona
Kolika je koncentracija vodonikovih jona Hipetonik
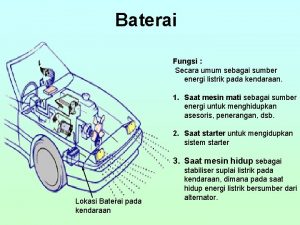
Hipetonik Fungsi elektrolit baterai
Fungsi elektrolit baterai Sıvı elektrolit dengesini düzenleyen hormonlar
Sıvı elektrolit dengesini düzenleyen hormonlar Termasuk elektrolit
Termasuk elektrolit Elektrolitlarda elektr toki
Elektrolitlarda elektr toki Elektrolit
Elektrolit Redoks tepkimeleri
Redoks tepkimeleri Sifat koligatif
Sifat koligatif Pengertian emulgator
Pengertian emulgator Collyria adalah
Collyria adalah Materi kimia kelas 12 semester 1 sifat koligatif larutan
Materi kimia kelas 12 semester 1 sifat koligatif larutan Rumus fraksi mol
Rumus fraksi mol Macam macam larutan penyangga
Macam macam larutan penyangga Granulasi mae
Granulasi mae Larutan hcl yang dijual di pasaran memiliki konsentrasi 45
Larutan hcl yang dijual di pasaran memiliki konsentrasi 45 Metode krioskopik adalah
Metode krioskopik adalah Contoh bahan berasid
Contoh bahan berasid