Larutan Elektrolit dan Reaksi Reduksi Oksidasi SMAK 1

















- Slides: 27

Larutan Elektrolit dan Reaksi Reduksi Oksidasi SMAK 1 PENABUR Jakata Kimia X © KS

Larutan Daya Hantar Listrik w Larutan Non Elektrolit w Larutan Elektrolit Lemah w Larutan Elektrolit Kuat

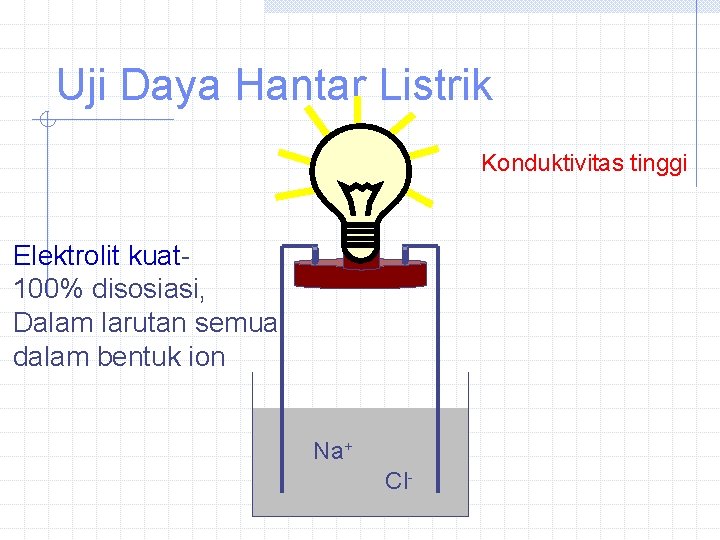
Uji Daya Hantar Listrik Konduktivitas tinggi Elektrolit kuat 100% disosiasi, Dalam larutan semua dalam bentuk ion Na+ Cl-

Uji Daya Hantar Listrik Konduktivitas lemah Elektrolit lemah. Disosiasi sebagian, Dalam larutan terdapat ion dan molekul CH 3 COOH H+ CH 3 COO-

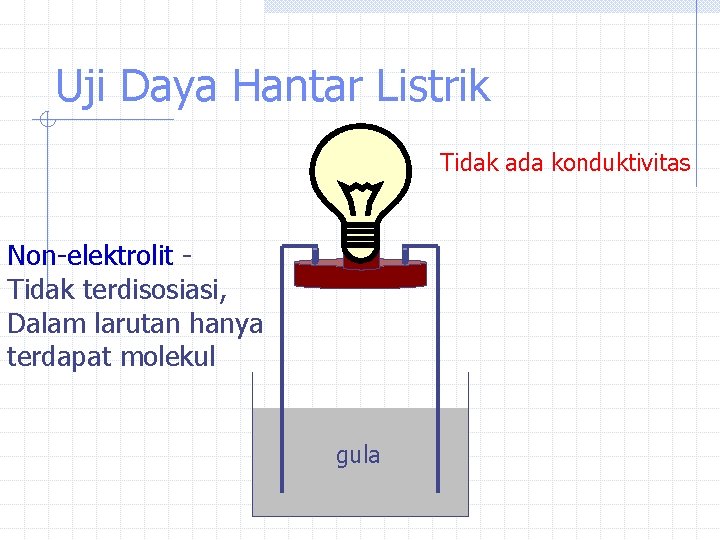
Uji Daya Hantar Listrik Tidak ada konduktivitas Non-elektrolit Tidak terdisosiasi, Dalam larutan hanya terdapat molekul gula

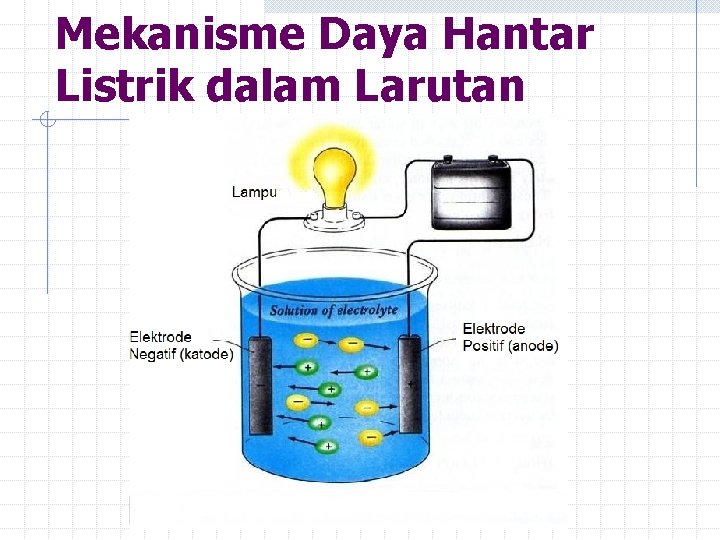
Mekanisme Daya Hantar Listrik dalam Larutan

Senyawa Elektrolit Senyawa Ion Contoh: Na. Cl, Mg. F 2, Ca. F 2, dan lain-lain Senyawa Kovalen Polar Contoh: HCl, CH 3 COOH, dan lain-lain

Senyawa Ion VS Senyawa Kovalen Polar Jenis Elektrolit Bentuk Elektrolit Padatan Lelehan Larutan Senyawa Ion Non Konduktor konduktor Senyawa Kovalen Non Konduktor konduktor Tidak semua senyawa kovalen polar tergolong elektrolit karena tidak dapat mengalami ionisasi dalam air

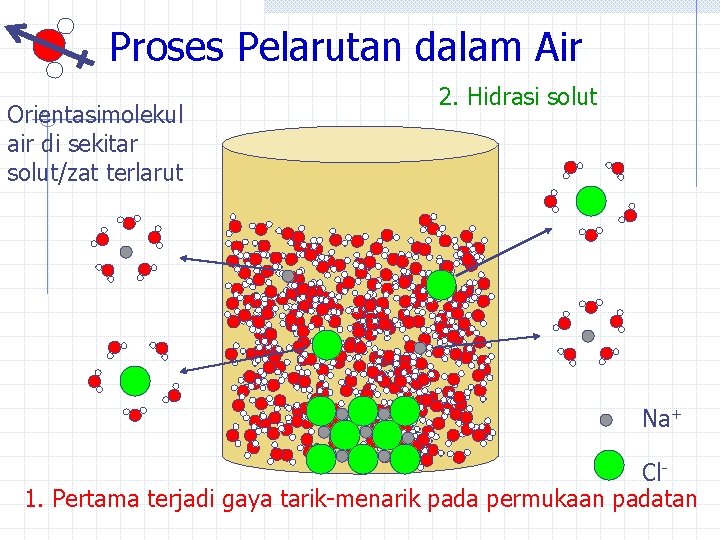
Proses Pelarutan dalam Air Orientasimolekul air di sekitar solut/zat terlarut 2. Hidrasi solut Na+ Cl 1. Pertama terjadi gaya tarik-menarik pada permukaan padatan

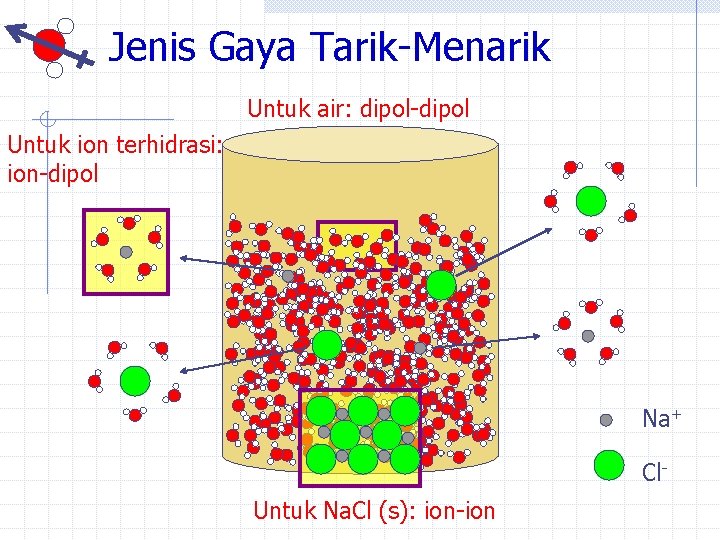
Jenis Gaya Tarik-Menarik Untuk air: dipol-dipol Untuk ion terhidrasi: ion-dipol Na+ Cl. Untuk Na. Cl (s): ion-ion

Derajat Ionisasi ( ) Perbedaan daya hantar larutan disebabkan perbedaan jumlah ion dalam larutan Perbedaan Jumlah zat yang mengion kemampuan = mengion Jumlah zat mula-mula Elektrolit kuat: Garam dapur (Na. Cl), larutan asam sulfat (H 2 SO 4), larutan asam klorida (HCl) dan larutan natrium hidroksida (Na. OH) Elektrolit lemah: Larutan asam cuka (CH 3 COOH) dan larutan amonia (NH 3)

Reaksi Reduksi Oksidasi Definisi Awal Ø Oksidasi : reaksi pengikatan oksigen Ø Reduksi : reaksi pelepasan oksigen Definisi Berikutnya Ø Oksidasi : reaksi pelepasan elektron Ø Reduksi : reaksi penerimaan elektron Definisi Terkini Ø Oksidasi : reaksi peningkatan bilangan oksidasi Ø Reduksi : reaksi penurunan bilangan oksidasi

Reaksi Reduksi Oksidasi Definisi Awal Ø Oksidasi : reaksi pengikatan oksigen Ex: reaksi perkaratan besi (Fe) oksidasi belerang oleh KCl. O 3 3 S(s) + 2 KCl. O 3(s) 2 KCl(s) + 3 SO 2(g) Sumber oksigen = oksidator

Reaksi Reduksi Oksidasi Ø Reduksi : reaksi pelepasan oksigen Ex: Fe 2 O 3 (s) + 3 CO(g) Cu. O(s) + H 2(g) 2 Fe(s) + 3 CO 2(g) Cu(s) + H 2 O(g) Zat yang menarik oksigen = reduktor

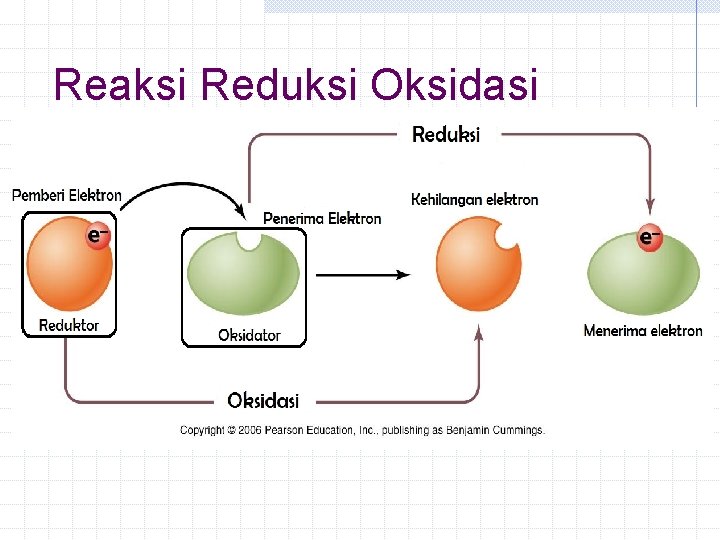
Reaksi Reduksi Oksidasi Definisi Berikutnya Ø Oksidasi : reaksi pelepasan elektron Ex: Ø Reduksi : reaksi penerimaan elektron Ex:

Reaksi Reduksi Oksidasi

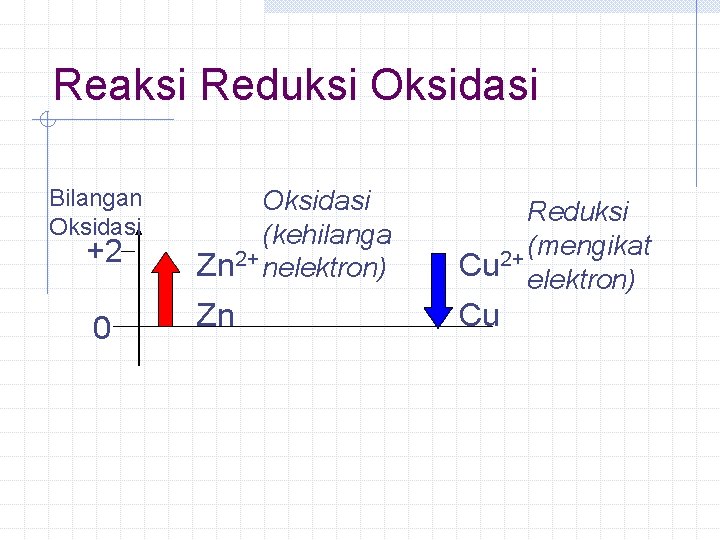
Reaksi Reduksi Oksidasi Definisi Terkini Ø Oksidasi Peningkatan bilangan oksidasi Ø Reduksi Penurunan bilangan oksidasi Contoh: Zn + Cu. SO 4 Zn. SO 4 + Cu

Reaksi Reduksi Oksidasi Bilangan Oksidasi +2 0 Oksidasi (kehilanga Zn 2+ nelektron) Reduksi (mengikat 2+ Cu elektron) Zn Cu

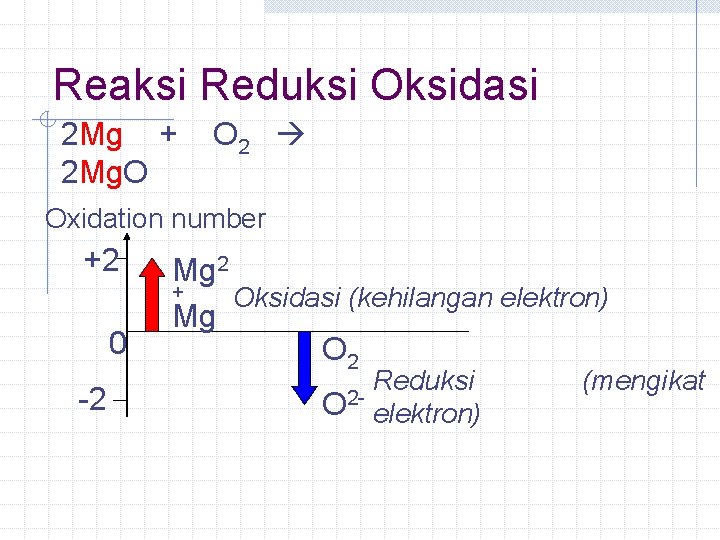
Reaksi Reduksi Oksidasi 2 Mg + 2 Mg. O O 2 Oxidation number +2 0 -2 Mg 2 + Oksidasi (kehilangan elektron) Mg O 2 Reduksi O 2 - elektron) (mengikat

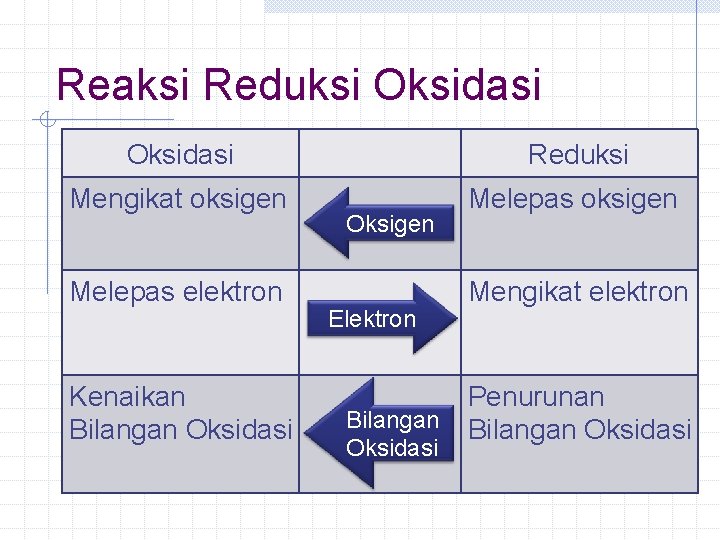
Reaksi Reduksi Oksidasi Reduksi Mengikat oksigen Melepas elektron Kenaikan Bilangan Oksidasi Oksigen Elektron Bilangan Oksidasi Mengikat elektron Penurunan Bilangan Oksidasi

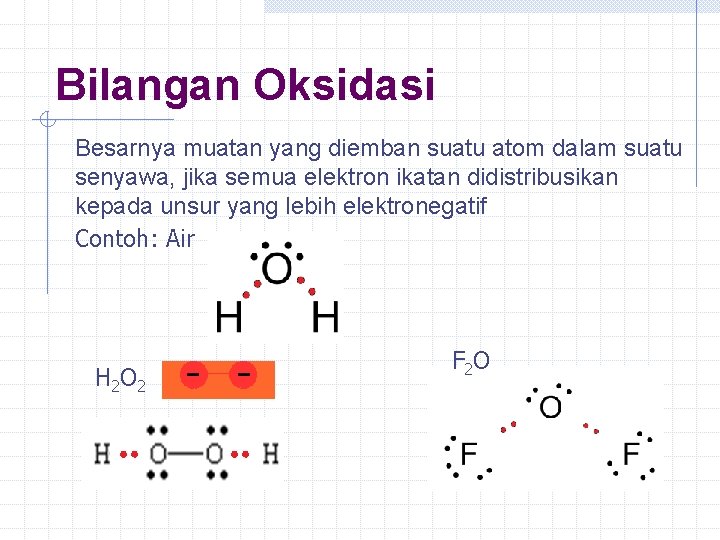
Bilangan Oksidasi Besarnya muatan yang diemban suatu atom dalam suatu senyawa, jika semua elektron ikatan didistribusikan kepada unsur yang lebih elektronegatif Contoh: Air H 2 O 2 F 2 O

Aturan Penentuan Bilangan Oksidasi 1. Bilangan oksidasi unsur bebas = 0 Ex: bilangan oksidasi atom pada unsur Fe, Na, Cu, H 2, Cl 2, Br 2, I 2, O 2 = 0 2. Bilangan oksidasi fluorin = -1 3. Bilangan oksidasi logam +

Aturan Penentuan Bilangan Oksidasi 4. Bilangan oksidasi unsur ion tunggal sama dengan muatannya 5. Bilangan oksidasi atom H umumnya = +1, kecuali dalam senyawanya dengan logam, dimana bilangan oksidasi atom H = -1 6. Bilangan oksidasi atom O umumnya = -2, kecuali § Dalam F 2 O, bilangan oksidasi atom O = +2 § Dalam peroksida, ex: H 2 O 2, bilangan oksidasi atom O = -1 § Dalam superoksida, ex: KO 2, bilangan oksidasi atom O = -½ § Dalam senyawa terner atau senyawa yang lebih

Aturan Penentuan Bilangan Oksidasi 7. Jumlah bilangan oksidasi atom unsur-unsur dalam suatu senyawa = 0 8. Jumlah bilangan oksidasi atom unsur-unsur dalam suatu ion poliatom = muatannya

Redoks or not? Reaksi kimia tergolong redoks jika terdapat perubahan bilangan oksidasi dari pereaksi menjadi produk

Disproporsionasi dan konproporsionasi Edisi khusus reaksi redoks: Disproporsionasi – satu senyawa terurai dengan dua tingkat oksidasi yang berbeda H 2 O 2 (aq) katalis 2(-1) H 2 O ( l ) + O 2 ( g ) -2 2(0) H 2 O 2 mengalami KEDUANYA oksidasi dan reduksi! Konproporsionasi – Dua jenis tingkat oksidasi menjadi satu. Cr 1+ (aq) + Cr 3+(aq) 2 Cr 2+ (aq)

Sekian dan terimakasih
 Larutan elektrolit
Larutan elektrolit Oksidasi adalah
Oksidasi adalah Pengertian larutan elektrolit
Pengertian larutan elektrolit Nyala api bunsen
Nyala api bunsen Caoh2 elektrolit atau non elektrolit
Caoh2 elektrolit atau non elektrolit Contoh soal perhitungan titrasi redoks
Contoh soal perhitungan titrasi redoks Reaksi oksidasi alkohol
Reaksi oksidasi alkohol Oksidasi
Oksidasi Reaksi kimia
Reaksi kimia Na2ci2
Na2ci2 Elektron valensi fluor
Elektron valensi fluor Ke dalam larutan basa lemah loh ditambahkan
Ke dalam larutan basa lemah loh ditambahkan Larutan penyangga dalam obat tetes mata
Larutan penyangga dalam obat tetes mata Rumus ph larutan
Rumus ph larutan Reaksi kimia dalam larutan air
Reaksi kimia dalam larutan air Anatomi dan fisiologi cairan tubuh
Anatomi dan fisiologi cairan tubuh Reaksi redoks adalah gabungan dari reaksi
Reaksi redoks adalah gabungan dari reaksi Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi
Reaksi ch3 ch2 ch2 ch2 + hcl disebut reaksi Gas mulia
Gas mulia 2 metil butanamina
2 metil butanamina Winiary dobre pomysły lepszy smak
Winiary dobre pomysły lepszy smak Jabłka grójeckie smak
Jabłka grójeckie smak Guld kemisk beteckning
Guld kemisk beteckning Reduksi dfa
Reduksi dfa Lambang determinan matriks
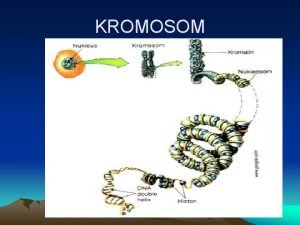
Lambang determinan matriks Kromosom
Kromosom Untuk pasangan state yang berarti tidak dapat dibedakan?
Untuk pasangan state yang berarti tidak dapat dibedakan? Sıvı elektrolit dengesini düzenleyen hormonlar
Sıvı elektrolit dengesini düzenleyen hormonlar