Reaksi Oksidasi Reduksi KELAS X SEMESTER GENAP YAYASAN




















- Slides: 22

Reaksi Oksidasi Reduksi KELAS X SEMESTER GENAP YAYASAN PENDIDIKAN ISLAM AL-BARKAH (YAPISA) CIKALONGKULON 2015/2016

Standar Kompetensi Memahami sifat-sifat larutan nonelektrolit dan elektrolit, serta reaksi oksidasi-reduksi Kompetensi Dasar Menjelaskan perkembangan konsep reaksi oksidasi- reduksi dan hubungannya dengan tata nama senyawa serta penerapannya

Indikator • Membedakan konsep oksidasi reduksi ditinjau dari penggabungan dan pelepasan oksigen, pelepasan dan penerimaan elektron, serta peningkatan dan penurunan bilangan oksidasi. ● Menentukan bilangan oksidasi atom unsurdalam senyawa atau ion. • Menentukan oksidator dan reduktor dalam reaksi redoks

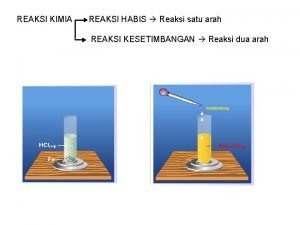
REAKSI REDOKS Ada tiga konsep yang digunakan dalam mengkaji pengertian reaksi redoks 1. 2. 3. Pengertian Redoks berdasarkan konsep pelepasan dan pengikatan oksigen Pengertian reaksi redoks berdasarkan konsep perpidahan elektron Pengertian reaksi redoks berdasarkan bilangan oksidasi

a. Pengertian redoks berdasarkan pengikatan dan pelepasan oksigen 1. Reaksi Oksidasi adalah Peristiwa bereaksinya suatu zat dengan oksigen 2. Reaksi Reduksi adalah proses pelepasan gas oksigen

Contoh reaksi redoks ▪ Oksidasi 4 Fe + 3 O 2 2 Mn + O 2 ▪ Reduksi 2 KCl. O 3 2 Fe 2 O 3 2 Mn. O 2 KCl + 3 O 2

b. Pengertian reaksi redoks bedasarkan konsep perpindahan elektron ■ Oksidasi adalah pelepasan elektron ■ Reduksi adalah penerimaan elektron

n Contoh Cu →Cu 2+ + 2 e − (oksidasi) 2 Cu → 2 Cu 2+ + 4 e − (oksidasi) O 2 + 4 e− → 2 O 2 − (reduksi) Cl 2 + 2 e− → 2 Cl − (reduksi)

c. Pengertian reaksi redoks berdasarkan bilangan oksidasi Bilangan oksidasi yaitu angka atau bilangan yang menyatakan banyaknya elektron yang telah dilepaskan atau diterima oleh suatu atom dalam suatu senyawa. Setiap atom mempunyai muatan yang disebut bilangan oksidasi (biloks) Biloks diberi tanda positif (+) jika atom melepaskan elektron dan biloks diberi tanda negatif jika atom menerima elektron.

Cara Menentukan Biloks Unsur a. b. c. Biloks unsur bebas adalah nol, contoh Ne, H 2, O 2, Cl 2, P 4, S 8, C, Cu, Fe dan Na Biloks ion monoatom sama dengan muatannya, contoh : Na+ = + 1, Mg+ = +2. Jumlah biloks untuk semua atom dalam senyawa adalah nol, Contoh : Cu dan O dalam Cu. O adalah nol

d. e. Jumlah biloks atom-atom pembentuk ion poliatom sama dengan muatan ion poliatom tersebut, contoh : atom O dan H dalam OH- =-1 Biloks ion monoatom sama dengan muatannya, contoh : Na+ = + 1, Mg+ = +2. Biloks unsur gol IA dalam senyawa adalah + 1, dan unsur pada gol IIA = +2, contoh : K dalam KCl, KNO 3 = +1, Mg dalam Mg. SO 4 = + 2

f. g. h. Biloks unsur pada gol VIIA adalah +1, contoh : Cl dalam Na. Cl, Mg. Cl 2, Fe. Cl 3 = -1 Biloks hidrogen dalam senyawa adalah +1, kecuali dalkam hidrida biloksnya + =-1, contoh H dalam H 2 O, NH 3 = +1, H dalam Na. H dan Ca. H 2 = -1 Biloks oksigen dalam senyawa adalah -2, kecua; I dalam peroksida (biloks oksigen =-1) dalam senyawa biner dengan flour = +2

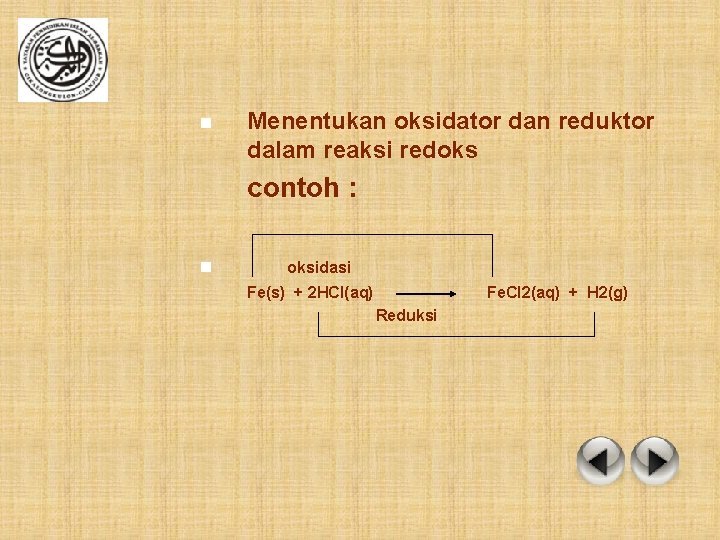
n Menentukan oksidator dan reduktor dalam reaksi redoks contoh : n oksidasi Fe(s) + 2 HCl(aq) Fe. Cl 2(aq) + H 2(g) Reduksi

Ø Pada reaksi diatas, Fe bertindak sebagai pereduksi dan HCl pengoksidasi, sedangkan Fe. Cl 2 merupakan hasil oksidasi dan gas H 2 hasil reduksi. Atom klorin dalam hal ini tidak mengalami oksidasi maupun reduksi

Contoh Soal 1. Bilangan oksidasi crom dan selenium dalam senyawa K 2 Cr 2 O 7 adalah …. Penyelesaian : K 2 Cr 2 O 7, 2. biloks K + 2 biloks Cr + 7 biloks O = 0 (2. +1) + (2. Ciloks Cr) + ( 7 biloks O ) = 0 (+2) + (2 Cr )+ (7. -2) = 0 2 Cr = (+12) Biloks Cr = +6

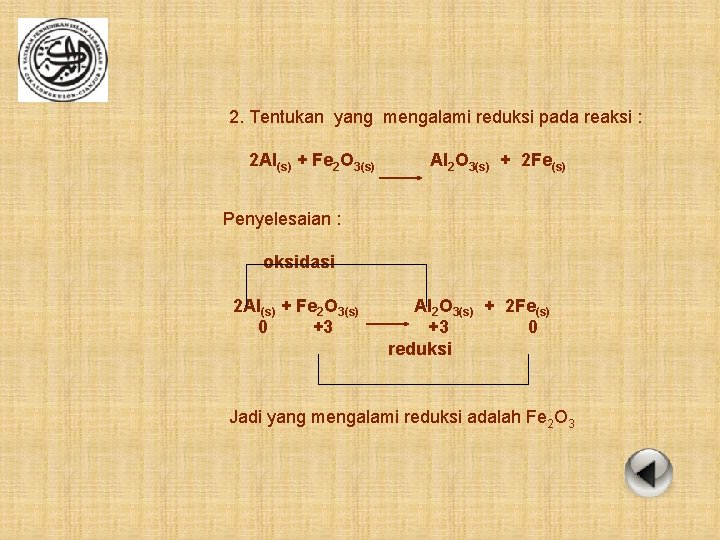
2. Tentukan yang mengalami reduksi pada reaksi : 2 Al(s) + Fe 2 O 3(s) Al 2 O 3(s) + 2 Fe(s) Penyelesaian : oksidasi 2 Al(s) + Fe 2 O 3(s) 0 +3 Al 2 O 3(s) + 2 Fe(s) +3 0 reduksi Jadi yang mengalami reduksi adalah Fe 2 O 3

LATIHAN 1. Pada reaksi Fe 2 O 3 + 3 CO 2 Fe + 3 CO 2, CO mengalami oksidasi karena …. a. jumlah elektronnya bertambah b. jumlah elektronnya berkurang c. jumlah oksigennya berkurang d. jumlah oksigennya bertambah e. jumlah hidrogennya berkurang

2. Contoh reaksi oksidasi adalah. . a. Cu 2+ + 2 e Cu b. Cl + 2 e 2 Clc. 2 KCl. O 3 + 2 KCl +3 O 2 d. Fe 2+ Fe 3+ +e e. Cu. O + H 2 Cu + H 2 O

3. Fosfor dalam senyawa Ca 2 P 2 O 7. 4 H 2 O memiliki tingkat oksidasi …. . a. +3 b. -3 c. +5 d. -5 e. +7

4. Pada reaksi 2 Na +2 H 2 O 2 Na. OH +H 2. Bilangan oksidasi Na akan berubah dari … a. 0 menjadi -1 b. 0 menjadi +1 c. -1 menjadi 0 d. +1 menjadi -1 e. +1 menjadi 0

5. Diketahui reaksi : 2 HI + 2 HNO 2 2 H 2 O + 2 NO + I 2 Pernyataan berikut yangtepat adalah. . a. HI adalah zat pengoksidasi b. HNO 2 adalah zat pengoksidasi c. H 2 O adalah zat pereduksi d. H 2 O adalah zat pengoksidasi e. NO adalah zat pengoksidasi

REFERENSI Purba, Michael, 2002, Kimia 1 B SMU , Jakarta , erlangga. Sutresna Nana, 1994, Kimia 1 untuk SMU kelas 1, cetakan I, Ganesa Exact. Sutresna Nana, 2004, Kimia untuk SMA kelas 1, cetakan II, grafindo. Sri Wahyuni, 2004, Master Kimia SMA, Erlangga. Semoga Bermanfa’at
 Oksidasi adalah
Oksidasi adalah Nyala api reduksi dan oksidasi
Nyala api reduksi dan oksidasi Soal titrasi redoks
Soal titrasi redoks Materi akidah akhlak kelas 7 semester genap
Materi akidah akhlak kelas 7 semester genap Reaksi oksidasi biologi
Reaksi oksidasi biologi Ciriciri reaksi oksidasi
Ciriciri reaksi oksidasi Reaksi oksidasi adalah
Reaksi oksidasi adalah Reaksi oksidasi alkohol
Reaksi oksidasi alkohol Hasil reaksi ch3-ch2-ch=ch2+hcl
Hasil reaksi ch3-ch2-ch=ch2+hcl Reaksi reaksi gas mulia
Reaksi reaksi gas mulia Contoh amina dalam kehidupan sehari-hari
Contoh amina dalam kehidupan sehari-hari Algoritma yang merupakan gabungan dari beberapa rbm
Algoritma yang merupakan gabungan dari beberapa rbm Kompetensi dasar fisika kelas 11 semester 1
Kompetensi dasar fisika kelas 11 semester 1 Materi atletik kelas 5 sd
Materi atletik kelas 5 sd Pitutur bener puniku sayektine apantes tiniru
Pitutur bener puniku sayektine apantes tiniru Materi sosiologi kelas 12
Materi sosiologi kelas 12 Materi tik kelas 8
Materi tik kelas 8 Kd tik kelas 9 semester 2
Kd tik kelas 9 semester 2 Contoh media pembelajaran seni budaya
Contoh media pembelajaran seni budaya Aktivitas 1 prakarya kelas 11
Aktivitas 1 prakarya kelas 11 Kedudukan garis terhadap garis lainnya
Kedudukan garis terhadap garis lainnya Materi agama katolik kelas 12 semester 1
Materi agama katolik kelas 12 semester 1 Rangkuman materi ips kelas 7 semester 1
Rangkuman materi ips kelas 7 semester 1