ELEKTROLIT DAN NON ELEKTROLIT A Pengertian Larutan Elektrolit














- Slides: 21

ELEKTROLIT DAN NON ELEKTROLIT

A. Pengertian Larutan Elektrolit dan Non elektrolit a. Larutan Elektrolit : larutan yang dapat menghantarkan arus listrik b. Larutan non elektrolit: larutan yang tidak dapat menghantarkan arus listrik

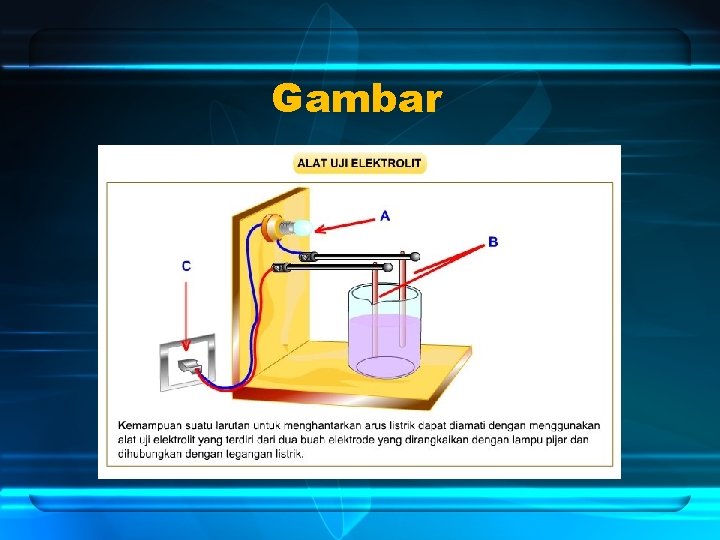
B. Teori Ion Svante Arrhenius Menurut Arrhenius, larutan elektrolit dapat menghantarkan arus listrik karena mengandung ion-ion yang dapat bergerak bebas

Gambar

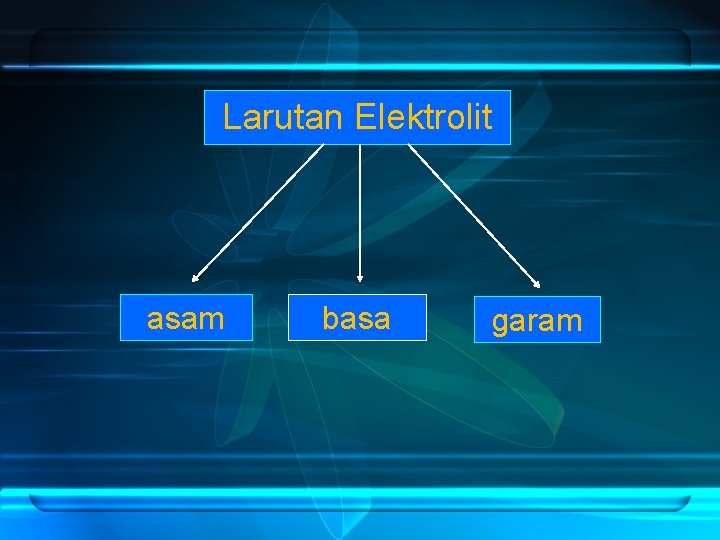
Larutan Elektrolit asam basa garam

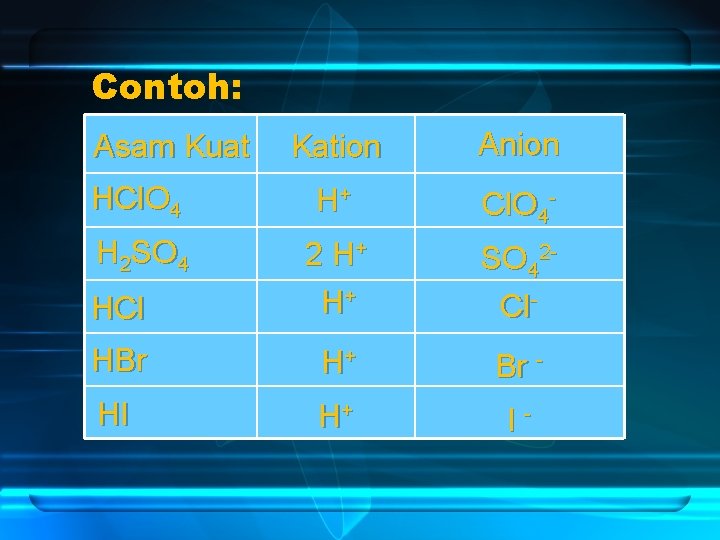
1. Larutan Asam ( H+) a. Asam Kuat Larutan asam kuat akan terionisasi Sempurna menjadi ion H+ dan sisa asam X-

Contoh: Kation Anion HCl. O 4 H+ Cl. O 4 - H 2 SO 4 HCl 2 H+ H+ SO 42 Cl- HBr H+ Br - HI H+ I- Asam Kuat

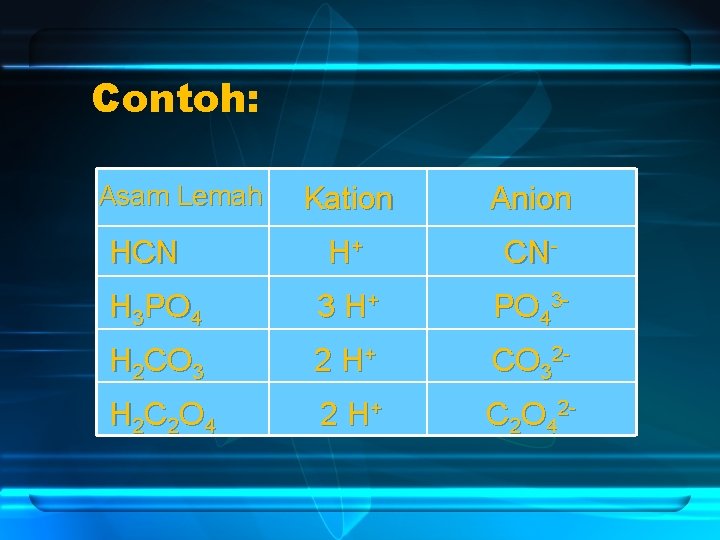
b. Asam lemah tidak terionisasi sempurna seperti asam kuat sehingga uji elektrolit hanya terlihat gelembung-gelembung gas pada elektroda.

Contoh: Asam Lemah Kation Anion H+ CN- H 3 PO 4 3 H+ PO 43 - H 2 CO 3 2 H+ CO 32 - H 2 C 2 O 4 2 H+ C 2 O 42 - HCN

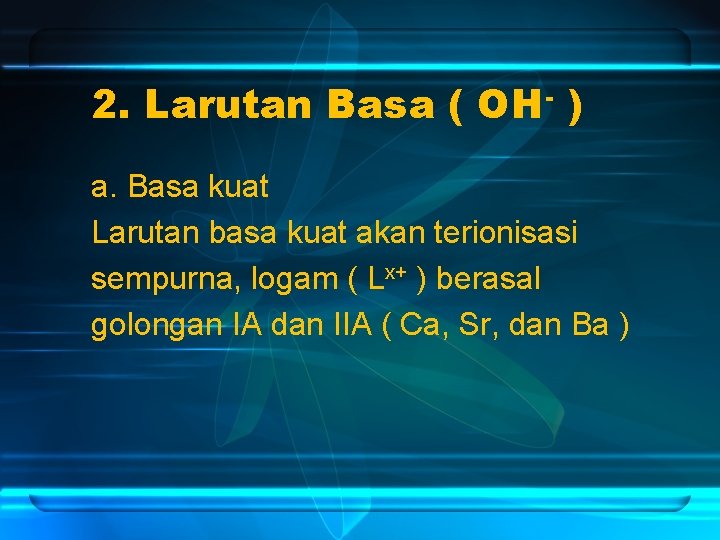
2. Larutan Basa ( OH- ) a. Basa kuat Larutan basa kuat akan terionisasi sempurna, logam ( Lx+ ) berasal golongan IA dan IIA ( Ca, Sr, dan Ba )

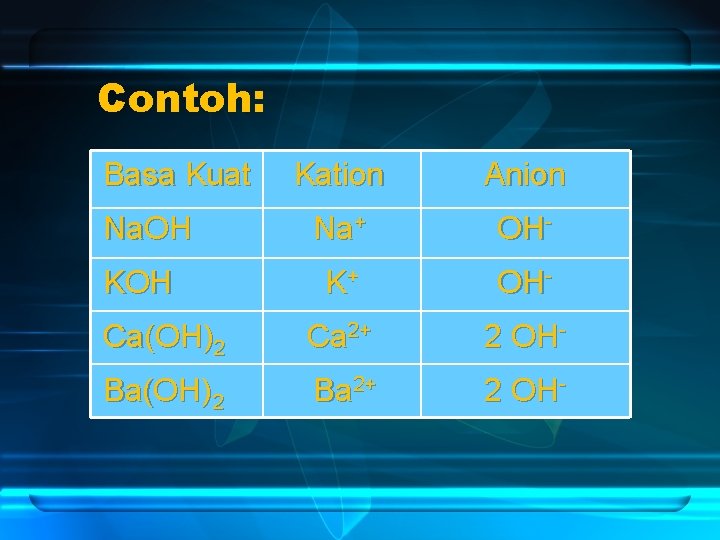
Contoh: Basa Kuat Kation Anion Na+ OH- K+ OH- Ca(OH)2 Ca 2+ 2 OH- Ba(OH)2 Ba 2+ 2 OH- Na. OH KOH

b. Basa lemah Larutan basa lemah tidak terionisasi sempurna sama dengan asam lemah Contoh: Kation Anion Fe(OH)3 Fe 3+ 3 OH- Al(OH)3 Al 3+ 3 OH- Zn(OH)2 Zn 2+ 2 OH- Basa Lemah

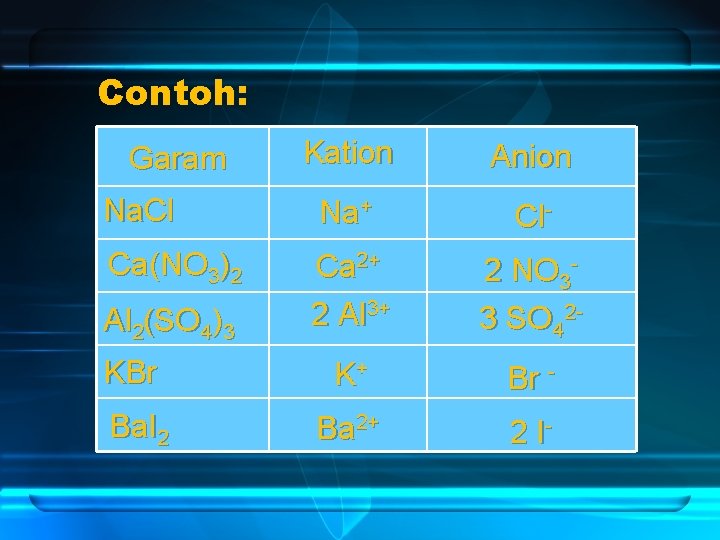
3. Larutan Garam Larutan garam umumnya larutan elektrolit kuat jadi akan terionisasi sempurna seperti asam kuat dan basa kuat. Contoh: Na. Cl, Ca(NO 3)2, Al 2(SO 4)3

Contoh: Kation Anion Na. Cl Na+ Cl- Ca(NO 3)2 Ca 2+ 2 Al 3+ 2 NO 33 SO 42 - KBr K+ Br - Ba. I 2 Ba 2+ 2 I- Garam Al 2(SO 4)3

Reaksi asam, basa, garam a. asam + basa b. Logam + asam c. Logam + garam d. Garam-1 + garam-2

Asam + Basa Garam + Air Contoh: HCl (aq) + Na. OH (aq) Na. Cl (aq) + H 2 O (l) Persamaan ion: H+(aq)+ Cl-(aq) + Na+(aq)+ OH-(aq) Na+ (aq) + Cl- (aq) + H 2 O (l) Persamaan ion Bersih: H+ (aq) + OH- (aq) H 2 O (l)

Logam + Asam Garam + H 2(g) 2 Al(s) + 3 H 2 SO 4(aq) Al 2(SO 4)3(aq) + 3 H 2(g) Persamaan ion 2 Al(s) + 6 H+(aq) + 3 SO 42 -(aq) 2 Al 3+(aq) + 3 SO 42 -(aq) + 3 H 2(g) Persamaan ion bersih 2 Al(s) + 6 H+(aq) 2 Al 3+(aq) +3 H 2(g)

Logam+Garam 3 Na(s) +Fe. Cl 3(aq) 3 Na. Cl(aq)+ Fe(s) Persamaan ion: 3 Na(s) +Fe 3+(aq) + 3 Cl- (aq) 3 Na+(aq) + 3 Cl-(aq) + Fe(s) Persamaan ion bersih: 3 Na(s) +Fe 3+ (aq) 3 Na+ (aq)+ Fe(s)

Garam 1+Garam 2 Garam 3+Garam 4 Pb(NO 3)2 (aq) + 2 KI (aq) Pb. I 2 (s) + 2 KNO 3(aq) Persamaan ion bersih: Pb (aq) + 2 I- (aq) Pb. I 2 (s)


 Non elektrolit
Non elektrolit Elektrolit
Elektrolit Asam sulfat dapat menghantarkan arus listrik karena
Asam sulfat dapat menghantarkan arus listrik karena Ke dalam larutan basa lemah loh
Ke dalam larutan basa lemah loh Larutan penyangga
Larutan penyangga Larutan penyangga adalah
Larutan penyangga adalah Elektrolit
Elektrolit Dieu cherche encore des hommes forts lyrics
Dieu cherche encore des hommes forts lyrics Pengertian konsentrasi larutan
Pengertian konsentrasi larutan Sıvı elektrolit dengesini düzenleyen hormonlar
Sıvı elektrolit dengesini düzenleyen hormonlar Elektrokimyo
Elektrokimyo Arrhenius 1884
Arrhenius 1884 Hipomagnesemi
Hipomagnesemi Termasuk elektrolit
Termasuk elektrolit Redoks tepkimeleri örnekleri
Redoks tepkimeleri örnekleri Disocija
Disocija Fungsi elektrolit baterai
Fungsi elektrolit baterai Barang eksklusif adalah
Barang eksklusif adalah Sublimisasi
Sublimisasi Alasan dibuat sediaan emulsi
Alasan dibuat sediaan emulsi Koloid adalah
Koloid adalah Campuran berikut yang menghasilkan
Campuran berikut yang menghasilkan