ELEKTROKIMIA Kelompok 1 Florensia Indan Stepani 0806321575 Nurhafizah





































- Slides: 43

ELEKTROKIMIA Kelompok 1 Florensia Indan Stepani (0806321575 ) Nurhafizah Putri (0806460540) Pauline Leon Artha (0806460553) Prima Anggreni (0806460566)

Pokok Pembahasan 1. Pengertian Elektrokimia 2. Jenis – jenis sel Elektrokimia 3. Elektroda 4. Potensial Elektroda 5. Reaksi Redoks 6. Termodinamika sel elektrokimia 7. Persamaan Nernst

1. Pengertian Elektokimia Elektrokimia merupakan ilmu yang mempelajari hubungan antara perubahan (reaksi) kimia dengan kerja listrik, biasanya melibatkan sel elektrokimia yang menerapkan prinsip reaksi redoks dalam aplikasinya.

2. Jenis Sel Elektrokimia SEL GALVANIK (sel volta) Sel galvani (sel volta) merupakan sel elektrokimia yang dapat menghasilkan energi listrik yang disebabkan oleh terjadinya reaksi redoks yang spontan

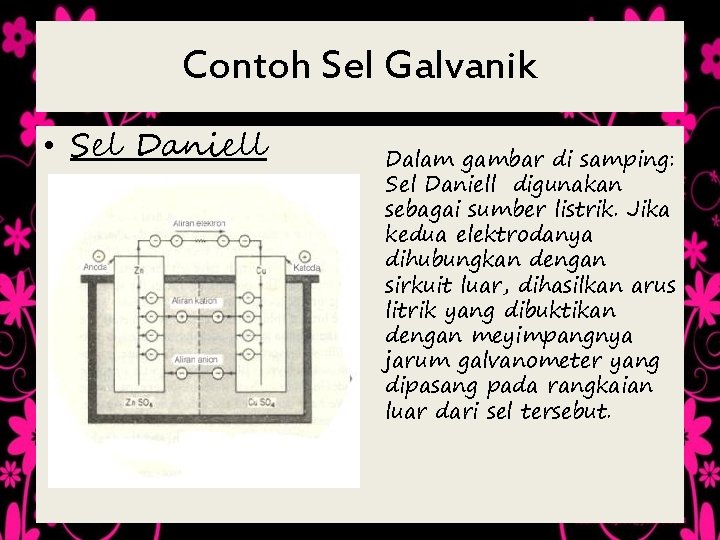
Contoh Sel Galvanik • Sel Daniell Dalam gambar di samping: Sel Daniell digunakan sebagai sumber listrik. Jika kedua elektrodanya dihubungkan dengan sirkuit luar, dihasilkan arus litrik yang dibuktikan dengan meyimpangnya jarum galvanometer yang dipasang pada rangkaian luar dari sel tersebut.

SEL DANIELL dan Jembatan Garam Ketika sel Daniell digunakan sebagai sumber listrik terjadi perubahan dari Zn menjadi Zn 2+ yang larut • Zn(s) ® Zn 2+(aq) + 2 e- (reaksi oksidasi) • Cu 2+(aq) + 2 e- ® Cu(s) (reaksi reduksi) Dalam hal ini, massa Zn mengalami pengurangan, sedangkan elektroda Cu bertambah massanya, karena terjadi pengendapan Cu dari Cu 2+ dalam larutan.

Penentuan Kutub Positif dan Negatif ( Sel Daniell ) • Ketika sel Daniell dihubungkan dengan golvanometer, terjadi arus elektron dari tembaga ke seng. Oleh karena itu logam seng bertindak sebagai kutub negatif dan logam tembaga sebagai kutub positif. Bersamaan dengan itu pada larutan dalam sel tersebut terjadi arus positif dari kiri ke kanan sebagai akibat dari mengalirnya sebagian ion Zn 2+ (karena dalam larutan sebelah kiri terjadi kelebihan ion Zn 2+ dibandingkan dengan ion SO 42 -yang ada). • Reaksi total yang terjadi pada sel Daniell adalah : Zn(s) + Cu 2+(aq) ® Zn 2+(aq) + Cu(s) • Reaksi tersebut merupakan reaksi redoks spontan

ATURAN SEL GALVANIK • Penulisan Notasi Zn l Zn 2+ ll Cu 2+ l Cu Zn l Zn 2+ Cu 2+ l Cu – Garis tunggal menyatakan perbedaan fasa – Garis ganda menyatakan perbedaan elektroda – Garis putus – putus menyatakan adanya jembatan garam pada sel elektrokimia. Jembatan garam diperlukan bila larutan pada anoda & katoda dapat saling bereaksi

Deret Volta Li K Ba Ca Na Mg Al Zn Cr Fe Ni Si Pb (H) Cu Hg Ag Pt Au • Makin ke kanan, mudah direduksi sukar dioksidasi • Makin ke kiri, mudah dioksidasi sukar direduksi

Macam-macam Sel Volta • Sel Kering atau Sel Leclance v katoda: karbon ; anoda: Zn v. Elektrolit : Campuran berupa pasta yaitu Mn. O 2 + NH 4 Cl + sedikit Air • Sel aki v. Katoda: Pb. O 2 ; anoda : Pb v. Elektrolit : Larutan H 2 SO 4

Macam-macam Sel Volta ( 2) • Sel bahan bakar v. Elektoda : Ni v. Elektrolit : Larutan KOH v. Bahan bakar : H 2 dan O 2 • Baterai Ni-Cd v. Katoda : Ni. O 2 dengan sedikit air v. Anoda : Cd

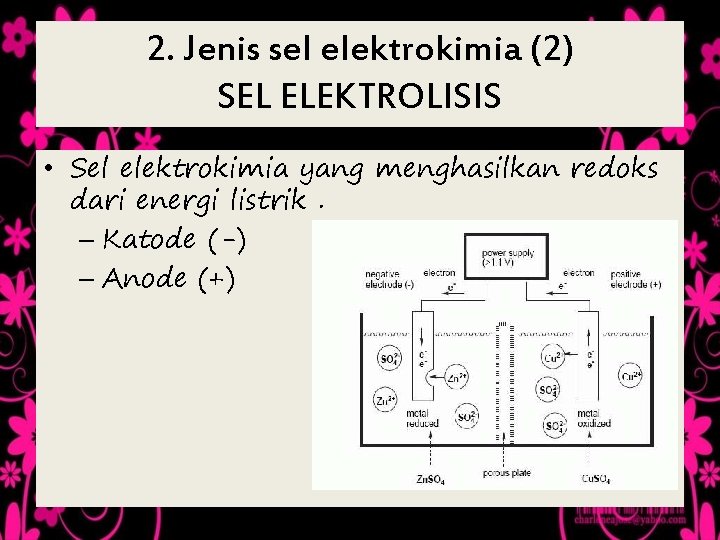
2. Jenis sel elektrokimia (2) SEL ELEKTROLISIS • Sel elektrokimia yang menghasilkan redoks dari energi listrik. – Katode (-) – Anode (+)

Reaksi - reaksi Sel Elektreolisis • • Reaksi Pada Katode Ø Ion positif akan mengalami reduksi, kecuali kation (+) yang berasal dari logam IA, IIA, dan Mn dalam larutan air tidak mengalami reduksi, yang mengalami reduksi adalah H 2 O, Reaksinya: Ø 2 H 20 + 2 e H 2 + 2 OHØ Ion logam IA, IIA. Al, dan Mn berbentuk lelehan (leburan) akan mengalami reduksi Reaksi Pada Anode Ø Ion negatif akan mengalami oksidasi jika elektrodanya nonaktif (Pt dan C). Ion negatif yang mengandung O (SO 42, Mn. O 4 -, NO 3 -, dll) tidak mengalami oksidasi, yang mengalami oksidasi adalah H 2 O Ø Reaksi : 2 H 2 O 4 H+ + O 2 + 4 e Ø Jika elektrode anode merupakan logam aktif (selain Pt dan C) yang mengalami Oksidasi adalah elektrode tersebut.

3. ELEKTRODA Elektroda dalam sel elektrokimia dapat disebut sebagai anoda atau katoda. • • Anoda merupakan elektroda di mana elektron datang dari sel elektrokimia sehingga oksidasi terjadi Katoda merupakan elektroda di mana elektron memasuki sel elektrokimia sehingga reduksi terjadi. Setiap elektroda dapat menjadi sebuah anoda atau katoda tergantung dari tegangan listrik yang diberikan ke sel elektrokimia tersebut. Elektroda bipolar adalah elektroda yang berfungsi sebagai anoda dari sebuah sel elektrokimia dan katoda bagi sel elektrokimia lainnya. ELEKTRODA INERT ELEKTRODA ACUAN LABORATORIUM

Jenis –jenis Elektroda A. Elektroda Inert elektroda yang tidak ikut bereaksi dalam reaksi kimia yang terjadi. Contoh elektroda inert: platina Sebuah sel dari sistem Fe 3+ + e Fe 2+ Pt I Fe 3+ (x M) + Fe 2+ (y M) II Ce 4+ (a M) + Ce 3+ (b M) I Pt

Jenis-jenis Elektroda (2) B. Elektroda-elektroda Acuan Laboratorium 1. Elektroda Kalomel raksa (Hg) ada dalam keadaan kontak dengan raksa (I) klorida, Hg 2 Cl 2 (kalomel), dicelupkan ke dalam larutan KCl 0, 1 m atau KCl jenuh. Jika diset dengan elektroda hidrogen standar. • Pt, H 2 (1 bar)| H+ || Cl‑ | Hg 2 Cl 2(s)|Hg • Reaksi elektroda : reaksi di katoda : ½ H 2 H + + ereaksi di anoda : ½ Hg 2 Cl 2 + e Hg + Cl. Reaksi keseluruhan : ½ H 2 + ½ Hg 2 Cl 2 (s) H+ + Cl- + Hg • Emf pada keadaan standar 0, 337 Volt (Eo = 0, 337 V) • Jika digunakan KCl jenuh pada 250 C memberikan E = 0, 2412 V.

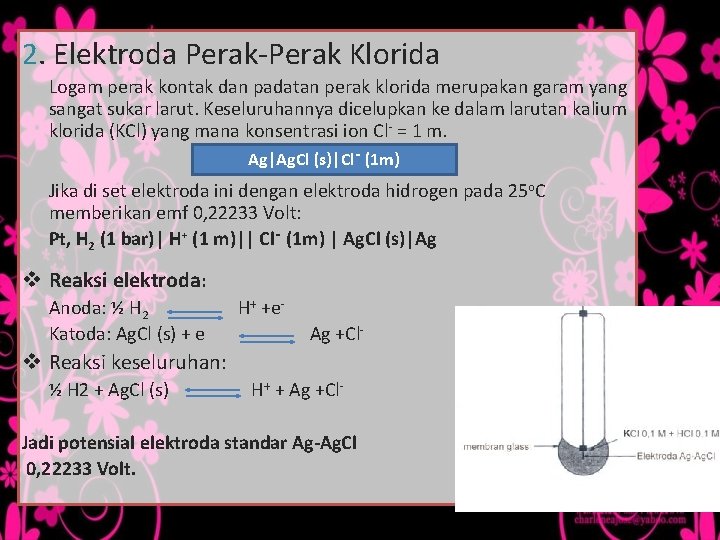
2. Elektroda Perak-Perak Klorida Logam perak kontak dan padatan perak klorida merupakan garam yang sangat sukar larut. Keseluruhannya dicelupkan ke dalam larutan kalium klorida (KCl) yang mana konsentrasi ion Cl- = 1 m. Ag|Ag. Cl (s)|Cl‑ (1 m) Jika di set elektroda ini dengan elektroda hidrogen pada 25 o. C memberikan emf 0, 22233 Volt: Pt, H 2 (1 bar)| H+ (1 m)|| Cl‑ (1 m) | Ag. Cl (s)|Ag v Reaksi elektroda: Anoda: ½ H 2 Katoda: Ag. Cl (s) + e H+ +e. Ag +Cl- v Reaksi keseluruhan: ½ H 2 + Ag. Cl (s) H+ + Ag +Cl- Jadi potensial elektroda standar Ag-Ag. Cl 0, 22233 Volt.

4. Potential Elektroda Potensial Elektroda merupakan ukuran terhadap besarnya kecenderungan suatu unsur untuk melepaskan atau mempertahankan elektron. • Potensial elektroda tergantung pada : - Jenis Elektroda - Suhu - Konsentrasi ionnya

Menghitung Potensial Elektroda Sel E° sel = E° red - E° oks E sel = E° sel - RT/n. F ln C E sel = E° sel - 0. 059/n log C Pada T = 25° C • Catatan : E° = potensial reduksi standar (volt) R = tetapan gas - [ volt. coulomb/mol. °K] = 8. 314 T = suhu mutlak (°K) n = jumlah elektron F = 96. 500 coulomb C = [bentuk oksidasi]/[bentuk reduksi]


Potensial Elektroda Standar • Potensial Elektroda Standar merupakan potensial yang terkait dengan setengah reaksi yang ada (wadah elektroda) dan biasanya ditulis dalam setengah reaksi reduksi. § Bentuk teroksidasi + ne bentuk tereduksi Eo 1/2 sel § Eosel = Eokatoda - Eoanoda

Elektroda Hidrogen Standar (Eo H 2) E° H 2 diukur pada 25° C, 1 atm dan {H+} = 1 molar yaitu sebagai berikut: q 2 H+(aq, 1 M) + 2 e H 2(g, 1 atm) Eorujukan = 0 volt q H 2(g, 1 atm) 2 H+(aq, 1 M) + 2 e –Eorujukan = 0 volt E° H 2 biasa digunakan untuk menentukan potensial elektroda standar zat lainnya. • Logam sebelah kiri H : E° elektroda < 0 • Logam sebelah kanan H : E° elektroda > 0

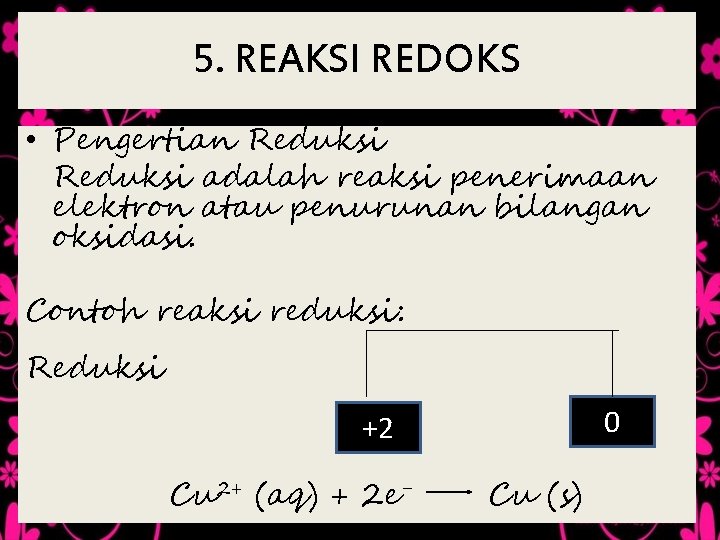
5. REAKSI REDOKS • Pengertian Reduksi adalah reaksi penerimaan elektron atau penurunan bilangan oksidasi. Contoh reaksi reduksi: Reduksi 0 +2 Cu 2+ (aq) + 2 e- Cu (s)

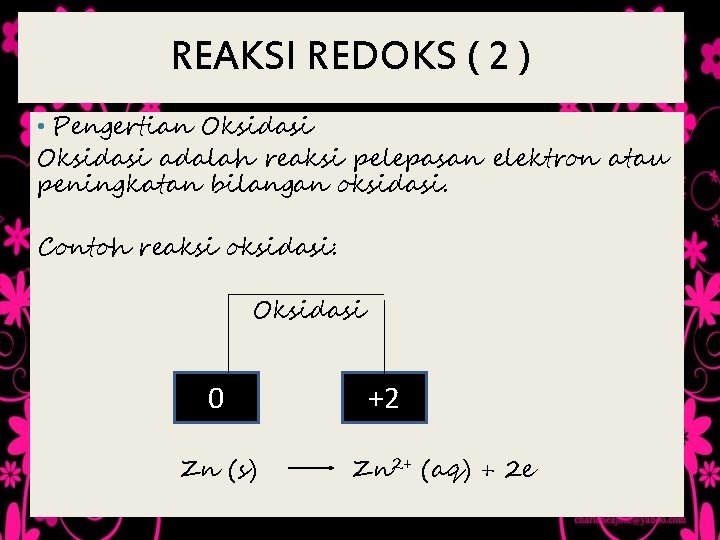
REAKSI REDOKS ( 2 ) • Pengertian Oksidasi adalah reaksi pelepasan elektron atau peningkatan bilangan oksidasi. Contoh reaksi oksidasi: Oksidasi 0 Zn (s) +2 Zn 2+ (aq) + 2 e

REAKSI REDOKS ( 3 ) Reaksi redoks adalah reaksi yang di dalamnya terjadi serah terima elektron antarzat. Contoh reaksi redoks: Cu 2+ (aq) + 2 e. Zn (s) Cu 2+ (aq) + Zn (s) Cu (s) Zn 2+ (aq) + 2 e. Cu (s) + Zn 2+ (aq)

Reaksi Autoredoks Reaksi autoredoks atau reaksi disproporsionasi adalah reaksi ketika suatu zat mengalami reaksi reduksi dan reaksi oksidasi secara serentak.

Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi Tahapan: a. Tulis secara terpisah persamaan setengah reaksi reduksi dan setengah reaksi oksidasi b. Setarakan unsur yang mengalami redoks c. Tambahkan molekul H 2 O pada Ø Ruas yang kekurangan O (jika reaksi berlangsung dalam suasana asam) Ø Ruas yang kelebihan O (jika reaksi berlangsung dalam suasana basa)

Penyetaraan Reaksi Redoks dengan Cara Setengah Reaksi ( 2) d. Setarakan atom hidrogen dengan ion H+ pada suasana asam atau dengan ion OH - pada suasana basa e. Setarakan muatan pada kedua ruas dengan menambahkan elektron f. Jumlahkan kedua persamaan setengah reksi tersebut dengan menyetarakan lebih dahulu jumlah elektronnya

Penyetaraan Reaksi Redoks dengan Cara Perubahan Bilangan Oksidasi a. Setarakan jumlah unsur-unsur yang mengalami perubahan bilangan oksidasi b. Tentukan bilangan oksidasi unsur-unsur tersebut dan perubahannya c. Setarakan jumlah kedua perubahan bilangan oksidasi tersebut d. Hitung jumlah muatan di ruas kiri dan ruas kanan e. Jika muatan di ruas kiri lebih negatif, tambahkan ion H+ (berarti, suasana asam). Jika muatan di sebelah kiri lebih positif, tambahkan ion OH(berarti, suasana basa). f. Tambahkan H 2 O di ruas kanan untuk menyetarakan jumlah atom hidrogen

Reduktor dan Oksidator • Zat pengoksidasi (oksidator) adalah spesies yang melakukan oksidasi, mengambil elektron dari zat yang teroksidasi. • Zat pereduksi (reduktor) adalah spesies yang melakukan reduksi memberikan elektron kepada zat yang tereduksi.

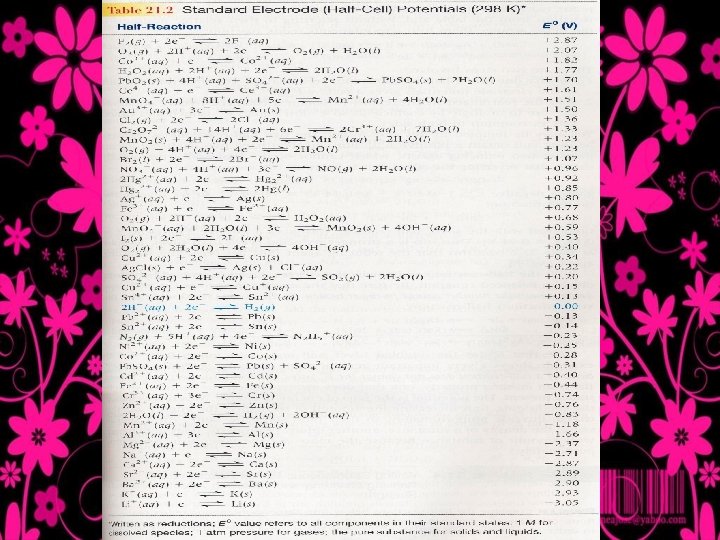
Kekuatan Relatif Oksidator dan Reduktor • Semua nilai adalah relatif terhadap elektroda hidrogen standar (referensi) 2 H+ (aq, 1 M) + 2 e H 2 (g, 1 atm) • Menurut konvensi semua setengah reaksi ditulis sebagai reaksi reduksi artinya semua reaktan pengoksidasi dan semua produk pereduksi • Nilai Eo yang diberikan adalah setengah reaksi tertulis, semakin positif nilainya semakin besar kecenderungan reaksi tersebut terjadi • Nilai Eo memiliki nilai yang sama tetapi berbeda tanda jika reaksinya kita balik • Berdasarkan tabel semakin keatas semakin oksidator dan semakin kebawah semakin reduktor

• Langkah-Langkah Penulisan Reaksi Elektrokimia: 1. Tulis setengah reaksi untuk sisi kanan elektroda dengan elektron pada sisi kiri. 2. Tulis setengah reaksi dan potensial standar untuk sisi kiri elektroda dengan cara yang sama. 3. Jika perlu, kalikan salah satu atau kedua persamaan dengan bilangan-bilangan yang sesuai sehingga jumlah dari elektron-elektron adalah sama dalam kedua persamaan. Di sini kita akan mengalikan setengah reaksi perak dengan 2 4. Kurangkan sisi kiri setengah-reaksi dari kanan. Juga kurangkan potensial-potensial standar 5. Tanda Eo. Sel adalah sama seperti polaritas dari sisi kanan elektroda. Disini kalium adalah negatif, dan perak positif 6. Tanda Eosel juga memberitahukan arah reaksi spontan. Jika positif, arah ke kanan. Jika negatif arah ke kiri.

6. Termodinamika Sel Elektrokimia • Energi bebas Gibbs hanya dapat diukur jika sel bersifat reversibel Kenyataannya sel yang biasa digunakan sehari-hari tidak bersifat reversibel karena adanya sejumlah besar arus listrik yang bergerak melalui sel • sehingga |∆ G | = W maksimal

Termodinamika Sel Elektrokimia (2) Dimana “W” energi listrik W listrik = - n FE sel Ket: n = jumlah ekuivalen reaktan yang di ubah menjadi produk F = muatan yang sebanding dengan jumlah mol elektron Esel = GGL sel Sehingga dapat disubstitusikan ∆ G = - n F Esel

Termodinamika Sel Elektrokimia (3) • Bila reaktan dan produk dalam keadaan standar, maka ∆ Gº = - n F Eºsel • Perubahan energi bebas / kerja yang dilakukan dengan memberikan bilangan elektron Avogadro melalui sebuah voltase E adalah (Ne)E, dimana N= bil. Avogadro dan e = muatan elektron. Produk Ne adalah 96. 500=1 Faraday F

Entropi dan Entalpi • Entalpi adalah kandungan kalor sistem dalam tekanan tetap, perubahan ∆H bernilai negatif untuk reaksi eksoterm, dan positif untuk reaksi endoterm. • Entropi adalah fungsi keadaan, dan merupakan kriteria yang menentukan apakah suatu keadaan dapat dicapai dengan spontan dari keadaan lain. • Entrpoi sangat berhubungan dengan hkm termodinamika ke– 2 ∆S > 0 (sistem terisolas)

Hubungan Antara Entropi dan Perubahan Energi GIBBS • Proses yang secara termodinamika ireversibel akan menghasilkan entropi. Entropi berkaitan dengan ketidakteraturan sistem dalam termodinamika statistik, menurut persamaan: S = k ln W Catatan : “k” adalah tetapan Boltzmann “W” adalah jumlah susunan atom

Hubungan Antara Entropi dan Perubahan Energi GIBBS (2) • Energi bebas Gibbs Kuantitas ini didefinisikan dengan: ∆G = ∆H – T∆S • Reaksi spontan terjadi bila energi Gibbs reaksi pada suhu dan tekanan tetap negatif. Perubahan energi bebas Gibbs standar berhubungan dengan tetapan kesetimbangan reaksi A = B melalui: ∆ G 0 = -RT ln K • K bernilai lebih besar dari 1 bila ∆G 0 negatif, dan reaksi berlangsung spontan ke kanan.

7. Persamaan Nernst • Persamaan nernst merupakan persamaan yang menyatakan hubungan antara potensial dari sebuah elektron ion-ion metal dan konsentrasi dari ion dalam sebuah larutan

7. Persamaan Nernst non standar


Pertanyaan 1 • Bahan yang digunakan untuk meyumbat ujung-ujung pipa pada jembatan garam Jawab Jembatan garam merupakan pipa berbentuk U yang di dalamnya diisi dengan larutan yang mengandung garam, dan pada ujung-ujung pipa U ( penyumbatnya berupa agar-agar ). Agar-agar digunakan agar larutan yang terdapat di dalam pipa U tidak bercampu dengan larutan di bagian anode dan katode.

Pertanyaan 2 • Mengapa pada gambar sel galvanik ( pada slide ke-4 ), Na+ tidak emgalir ke arah anode melainkan katode, begitu juga sebaliknya pada zat SO 4 ( 2 -) tidak mengalir ke arah anode melainkan ke katode Jawab: Elektron yang dihasilkan akan bermigrasi ke logam dengan kecenderungan ionisasi lebih rendah melalui kawat. Pada logam dengan kecenderungan ionisasi lebih rendah, kation akan direduksi dengan menerima elektron yang mengalir ke elektroda.