LARUTAN Campuran homogen solvent solute Konsentrasi Larutan Contoh















- Slides: 17

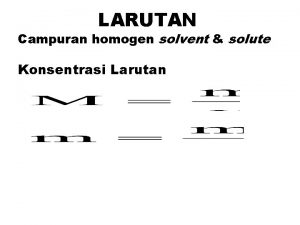
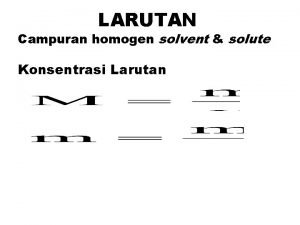
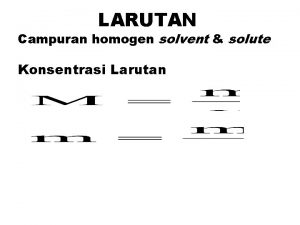
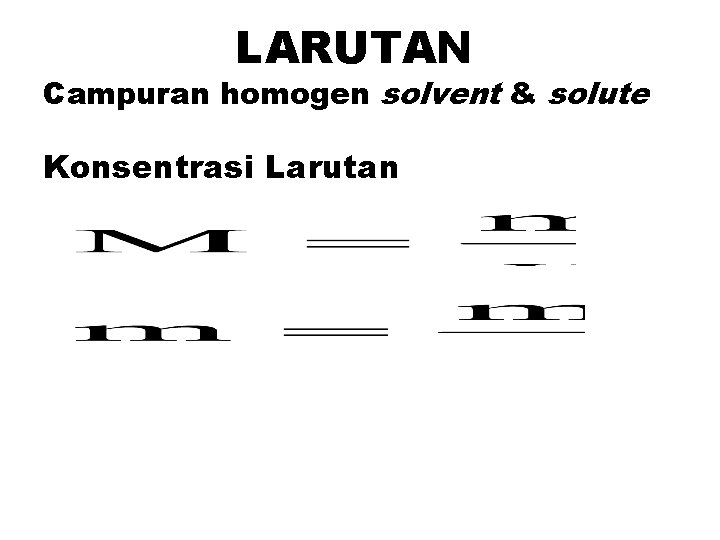
LARUTAN Campuran homogen solvent & solute Konsentrasi Larutan

Contoh soal 1: Terdapat tiga macam larutan, yaitu: a. 0, 36 g C 6 H 12 O 6 dalam 2 kg air b. 0, 32 g Cu. SO 4 dalam 2 kg air c. 0, 267 g Al. Cl 3 dalam 2 kg air Massa atom relatif (Ar) H = 1, C = 12, O = 16, Al = 27, S = 32, Cl = 35, 5, Cu = 64 Hitunglah berapa m konsentrasi tiap larutan ? Jawab:

a. Mr C 6 H 12 O 6 = (6 x 12)+(12 X 1)+(6 X 16) = 180 g/mol Mol C 6 H 12 O 6 = 0, 36 g : 180 g/mol = 0, 002 mol Molalitas C 6 H 12 O 6 = 0, 002 mol : 2 kg = 0, 001 m b. Mr Cu. SO 4 = (1 X 64)+(1 x 32)+(4 x 16) = 160 g/mol Mol Cu. SO 4 = 0, 32 g : 160 g/mol = 0, 002 mol Molalitas Cu. SO 4 = 0, 002 mol : 2 kg = 0, 001 m

c. Mr Al. Cl 3 = (1 x 27) + (3 x 35, 5) = 133, 5 g/mol Mol Al. Cl 3 = 0, 267 g : 133, 5 g/mol = 0, 002 mol Molalitas Al. Cl 3 = 0, 002 mol : 2 kg = 0, 001 m

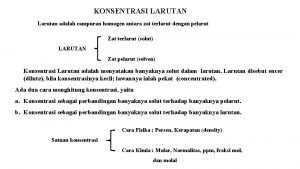
Kelarutan (solubility) = Kemampuan melarut (g solute / 100 g pelarut) Ø solute = kelarutan jenuh Ø solute < kelarutan tak jenuh (unsaturated) Ø solute > kelarutan lewat jenuh (supersaturated)

Faktor yang mempengaruhi kelarutan Ø Jenis zat terlarut & jenis pelarut: like dissolves like Ø Tekanan: Hukum Henry (William Henry: 1774 -1836) Kelarutan gas Tekanan Ø Temperatur : azas Le Chatelier (Henri Louis Le Chatelier: 18501936)

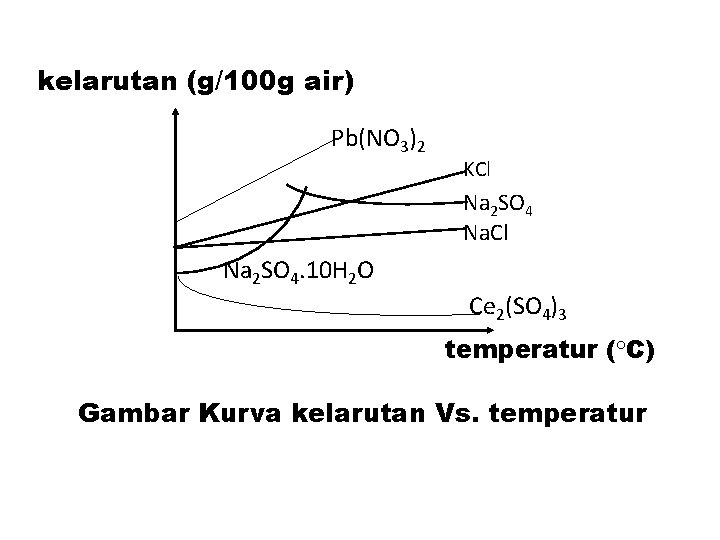
kelarutan (g/100 g air) Pb(NO 3)2 KCl Na 2 SO 4 Na. Cl Na 2 SO 4. 10 H 2 O Ce 2(SO 4)3 temperatur ( C) Gambar Kurva kelarutan Vs. temperatur

Daya Hantar Listrik Larutan a. Elektrolit = menghantarkan listrik Ø Elektrolit Kuat: → terion sempurna – Asam kuat (contoh: HCl, HBr, HI, H 2 SO 4, HNO 3, HCLO 4) – Basa kuat: IA & IIA (contoh: Na. OH, KOH, Mg(OH)2, Ba(OH)2, Sr(OH)2) – Garam (contoh: Na. Cl, KCl, Mg. Cl 2, KNO 3, Ag. NO 3, Cu. SO 4, Mg. SO 4) Ø Elektrolit Lemah: → terion sebagian – Asam lemah (contoh: HF, H 2 S, HCN, H 2 CO 3, HCOOH, CH 3 COOH) – Basa lemah (contoh: NH 3, N 2 H 4, CH 3 NH 2, (CH 3)2 NH)

b. Nonelektrolit: → tidak terion Contoh: C 6 H 12 O 6, CO(NH 2)2, CH 4, C 3 H 8, C 13 H 10 O, C 2 H 5 OH

Sifat Koligatif Larutan Menurut Van't Hoff : Larutan sangat encer i = jumlah ion Sifat Koligatif Non-elektrolit Elektrolit Penurunan P = P 0. XA P = i. P 0. XA Tekanan Uap Kenaikan Titik tb = kb. m tb = i. kb. m Didih Penurunan tf = kf. m tf = i. kf. m Titik Beku Tekanan Osmose

Contoh soal 2: Terdapat tiga macam larutan, yaitu: i. 0, 36 g C 6 H 12 O 6 dalam 2 kg air ii. 0, 32 g Cu. SO 4 dalam 2 kg air iii. 0, 267 g Al. Cl 3 dalam 2 kg air Volume larutan = 2 L kb air = 0, 512 C/m kf air = 1, 86 C/m Massa atom relatif (Ar) H = 1, C = 12, O = 16, Al = 27, S = 32, Cl = 35, 5, Cu = 64

Hitunglah: a. Titik didih tiap larutan. b. Titik beku tiap larutan. c. Tekanan uap tiap larutan, jika tekanan uap air murni 1 atm. d. Tekanan osmose tiap larutan pada 27 C. Jawab : Mol dan molalitas sudah dihitung pada soal 1 (lihat jawaban soal 1) Mol 2 kg air = 2000 g : 18 g/mol = 111, 111 mol

a. tb larutan = tb air + tb (i) tb C 6 H 12 O 6 = 100 + (0, 512 x 0, 001) = 100, 000512 C (ii) tb Cu. SO 4 = 100 + (2 x 0, 512 x 0, 001) = 100, 001024 C (iii)tb Al. Cl 3 = 100 + (4 x 0, 512 x 0, 001) = 100, 002048 C b. tf larutan = tf air – tf (i) tf C 6 H 12 O 6 = 0 – (1, 86 x 0, 001) = – 0, 00186 C (ii) tf Cu. SO 4 = 0 – (2 x 1, 86 x 0, 001) = – 0, 00372 C (iii) tf Al. Cl 3 = 0 – (4 x 1, 86 x 0, 001) = – 0, 00744 C

c. P larutan = P air – P (i) P C 6 H 12 O 6 = 1 – 1. {0, 002 : (0, 002+111, 111)} = 0, 999982 atm (ii) P Cu. SO 4 = 1– 2. 1. {0, 002 : (0, 002+111, 111)} = 0, 999964 atm (iii) P Al. Cl 3 = 1 – 4. 1. {0, 002 : (0, 002+111, 111)} = 0, 999928 atm d. larutan non-elektrolit = n. R. T : V larutan elektrolit = i. n. R. T : V (i) C 6 H 12 O 6 = (0, 002). (0, 08206). (27+273) : 2 = 0, 024618 atm (ii) Cu. SO 4 = 2. (0, 002). (0, 08206). (27+273) : 2 = 0, 049236 atm (iii) Al. Cl 3 = 4. (0, 002). (0, 08206). (27+273) : 2 = 0, 098472 atm

Soal latihan: 1. Terdapat 2 L larutan gula 0, 0005 m dan 2 L larutan Na. Cl 0, 0005 m (massa air = 2 kg). Jika kb air = 0, 512 C/m, kf air = 1, 86 C/m a. Berapa atm tekanan uap larutan jika tekanan uap air murni = 0, 3 atm? b. Berapa C titik didih larutan? c. Berapa C titik beku larutan? d. Berapa atm tekanan osmose larutan pada suhu 27 C ?

2. Titik didih larutan glukosa 100, 000512 C. Jika larutan dianggap ideal, Hitunglah: a. Berapa molalitas larutan? b. Berapa C titik beku larutan? c. Berapa atm tekanan uap larutan pada suhu 27 C ? (tekanan uap air murni = 26, 74 mm. Hg) d. Berapa atm tekanan osmose larutan pada suhu 27 C ?

3. Sama dengan nomor 2, untuk larutan Al. Cl 3 4. Untuk mencegah osmose, maka pada 100 m. L larutan Al. Cl 3 harus diberikan tekanan osmose sebesar 0, 1 atm pada suhu 27 C. Jika larutannya ideal, hitunglah: a. Berapa atm tekanan uap larutan pada suhu 27 C ? (tekanan uap air murni = 26, 74 mm. Hg) b. Berapa C titik beku larutan? c. Berapa C titik didih larutan?
 Contoh homogen
Contoh homogen Campuran larutan berikut bersifat buffer, kecuali . .
Campuran larutan berikut bersifat buffer, kecuali . . Homogen
Homogen Homogen
Homogen Rumus empiris adalah
Rumus empiris adalah Pengertian konsentrasi larutan
Pengertian konsentrasi larutan Campuran homogen
Campuran homogen Konsentrasi larutan dalam persen
Konsentrasi larutan dalam persen Konsentrasi larutan
Konsentrasi larutan Larutan adalah
Larutan adalah Define solute and solvent
Define solute and solvent Solute vs solvent
Solute vs solvent Solvent vs solute
Solvent vs solute Solute
Solute Hypotonic solution
Hypotonic solution Quizlet
Quizlet A homogeneous mixture of a solute and solvent
A homogeneous mixture of a solute and solvent Solute-solvent combinations
Solute-solvent combinations