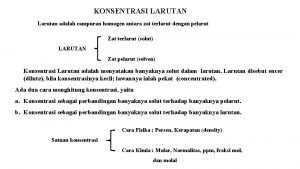
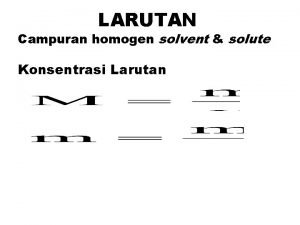
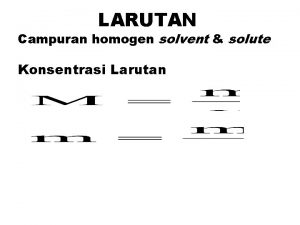
LARUTAN Larutan campuran yang homogen terdiri dari zat
















![Asam lemah : [H+] = √ Ka [asam] Bila derajad ionisasinya (α) diketahui, maka Asam lemah : [H+] = √ Ka [asam] Bila derajad ionisasinya (α) diketahui, maka](https://slidetodoc.com/presentation_image_h/083d4da9d1d6598cb7987cab30f449af/image-20.jpg)




![MENGHITUNG p. H * Bila basa kuat bersisa, gunakan rumus : [OH-] = Konsentrasi MENGHITUNG p. H * Bila basa kuat bersisa, gunakan rumus : [OH-] = Konsentrasi](https://slidetodoc.com/presentation_image_h/083d4da9d1d6598cb7987cab30f449af/image-27.jpg)








- Slides: 36

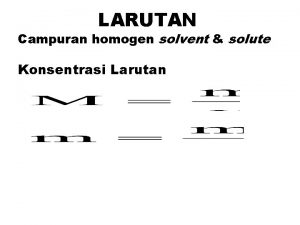
LARUTAN Larutan - campuran yang homogen - terdiri dari zat terlarut (solute) dan zat pelarut (solvent) Contoh: larutan gula berarti gula sebagai zat terlarut dan air sebagai pelarut Larutan jenuh - jumlah maksimum zat terlarut yang dapat melarut pada temperatur tertentu Larutan lewat jenuh - zat terlarut lebih banyak daripada zat terlarut yang seharusnya dapat melarut pada temperatur tertentu

u Kelarutan banyaknya zat terlarut yang dapat menghasilkan larutan jenuh dalam jumlah tertentu pelarut pada T konstan

Kelarutan zat tergantung pada : - sifat zat pelarut / zat terlarut - temperatur - tekanan Konsentrasi Larutan : Menyatakan jumlah zat terlarut dalam suatu larutan atau pelarut 1. Persen Berat (%w) = persen massa menyatakan jumlah gram zat terlarut dalam 100 gram larutan. WA = gram zat terlarut Wtotal = gram larutan

Contoh : 1. Hitung berapa % berat larutan infus yang dibuat dengan melarutkan 25 gram Na. Cl dalam 75 g air.

2. Persen Volume (%V) menyatakan jumlah volume (liter) zat terlarut dalam 100 liter larutan. VA = ml zat terlarut Vtotal = ml larutan Contoh: 50 m. L alkohol dicampur dengan air 50 m. L menghasilkan 96, 54 m. L larutan. Hitung % volume masing-masing komponen.

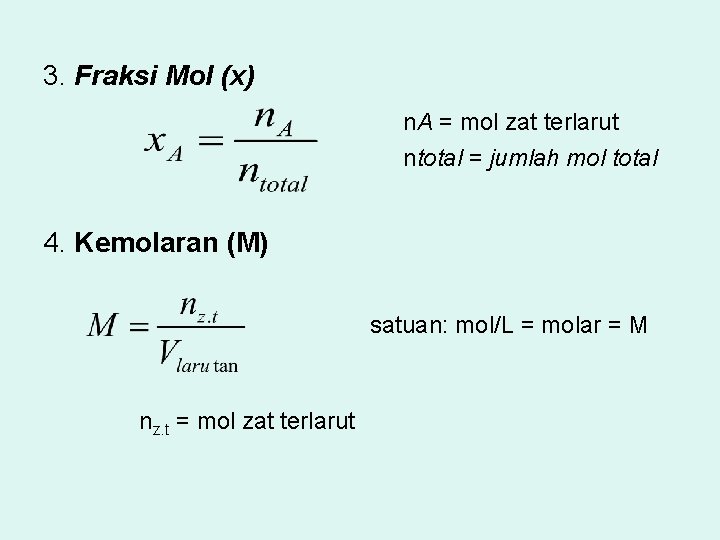
3. Fraksi Mol (x) n. A = mol zat terlarut ntotal = jumlah mol total 4. Kemolaran (M) satuan: mol/L = molar = M nz. t = mol zat terlarut

Contoh : 1. 117 g Na. Cl dilarutkan dalam 3 kg H 2 O Hitung fraksi mol Na. Cl dan H 2 O dalam larutan tersebut. (Mr Na. Cl = 58, 5, Mr H 2 O = 18) 2. 80 g Na. OH dilarutkan dalam air kemudian diencerkan menjadi 1 L larutan. Hitung kemolaran (Molaritas). Mr Na. OH = 40

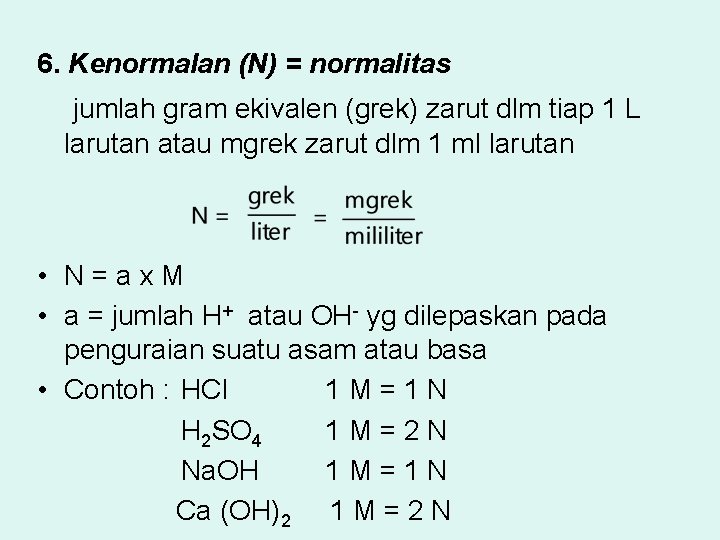
6. Kenormalan (N) = normalitas jumlah gram ekivalen (grek) zarut dlm tiap 1 L larutan atau mgrek zarut dlm 1 ml larutan • N=ax. M • a = jumlah H+ atau OH- yg dilepaskan pada penguraian suatu asam atau basa • Contoh : HCl 1 M=1 N H 2 SO 4 1 M=2 N Na. OH 1 M=1 N Ca (OH)2 1 M = 2 N

Contoh : 147, 0 g asam sulfat (Mr = 98) dilarutkan dengan air hingga volume larutan menjadi 2 liter. Tentukan normalitas larutan tersebut!

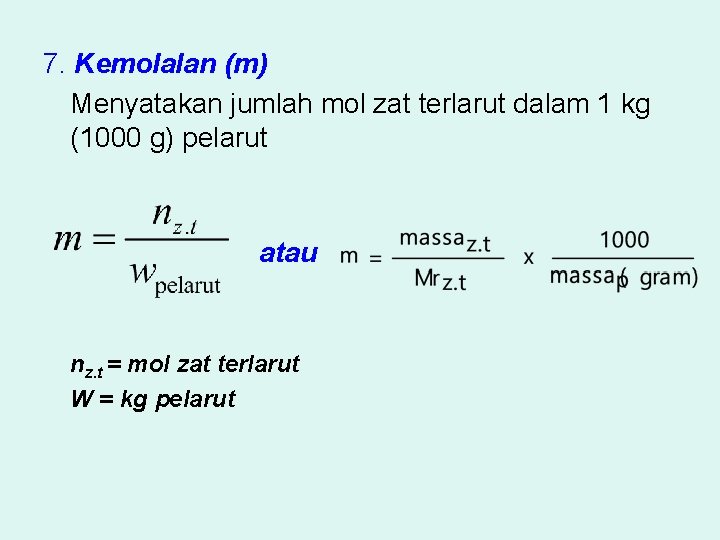
7. Kemolalan (m) Menyatakan jumlah mol zat terlarut dalam 1 kg (1000 g) pelarut atau nz. t = mol zat terlarut W = kg pelarut

1. Diketahui suatu larutan 0, 25 molal. Jika kita gunakan air 250 gram sebagai pelarut, maka tentukanlah massa zat terlarutnya! (Mr zat terlarut = 60)

Pada campuran zat yang sejenis berlaku rumus : Mc. Vc = M 1. V 1 + M 2. V 2 + …… + Mn. Vn Contoh : 1. Larutan asam klorida 0, 25 M sebanyak 200 m. L dicampur dengan asam klorida 0, 3 M sebanyak 250 m. L, kemudian ke dalam campuran tersebut ditambahkan lagi asam klorida 0, 2 M sampai volume campuran akhirnya menjadi 600 m. L. Tentukanlah konsentrasi campuran sekarang!

Pada pengenceran berlaku rumus: suatu zat M 1. V 1 = M 2. V 2 Contoh : 1. Ke dalam 275 m. L larutan H 2 SO 4 0, 75 M ditambahkan air sebanyak 525 m. L. Tentukanlah konsentrasi larutan setelah penambahan air!

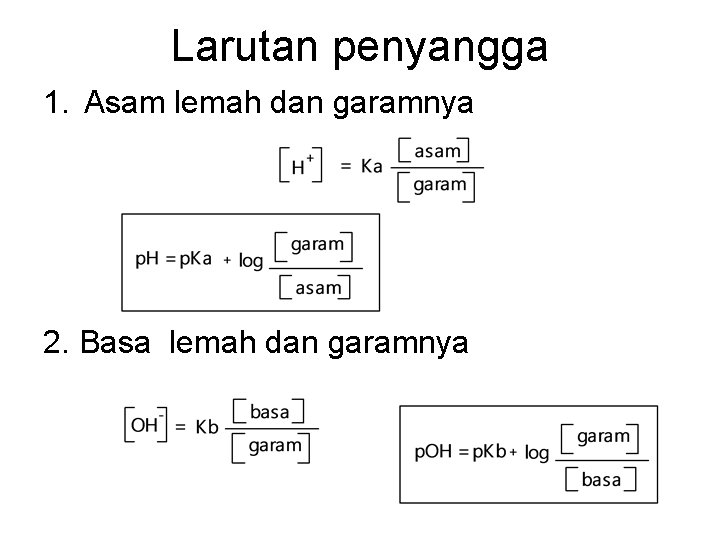
Macam-macam larutan Larutan non elektrolit : larutan yang tidak dapat menghantarkan arus listrik larutan gula Larutan elektrolit : larutan yang dapat menghantarkan arus listrik larutan garam Na. Cl, asam, basa Larutan bufer/penyangga mempertahankan p. H Terbentuk dari: - asam lemah dan garamnya (CH 3 COOH dan CH 3 COONa - basa lemah dan garamnya (NH 4 OH dan NH 4 Cl)

TEORI ASAM BASA 1. Arrhenius Asam adalah suatu senyawa yang apabila dilarutkan dalam air akan menghasilkan ion hidrogen (H+) atau ion hidronium (H 3 O+) contoh : HCl (aq)→ H+ + Cl. Basa adalah suatu senyawa yang apabila dilarutkan dalam air akan menghasilkan ion hidroksida (OH-) contoh : Na. OH (aq) → Na+ + OH-

TEORI ASAM BASA 2. Bronsted dan Lowry Asam adalah zat yg bertindak sebagai pendonor proton (memberikan proton) pada basa Basa adalah zat yang bertindak sebagai akseptor proton (menerima proton) dari asam contoh : HCl + H 2 O → H 3 O+ + Clasam 1 basa 2 asam 2 basa 1

TEORI ASAM BASA 3. Lewis Asam adalah suatu zat yang bertindak sebagai penerima (akseptor) pasangan elektron. Basa adalah suatu zat yang bertindak sebagai pemberi (donor) pasangan elektron.

MENGHITUNG p. H Untuk menghitung p. H larutan kita gunakan persamaan: p. H = -log [H+] p. OH = -log [OH-] p. H = 14 - p. OH Asam kuat : [H+] = n x [asam] Basa kuat : [OH-] = n x [basa]

Ø Contoh 1 (asam kuat dan basa kuat) Tentukan p. H larutan berikut: a. HCl 0, 01 M b. Na. OH 0, 01 M c. 4, 9 g H 2 SO 4 (Mr = 98) yang terlarut dalam 1000 m. L larutan d. 3, 44 g Ba(OH)2 (Mr = 172) yang terlarut dalam 1000 m. L larutan
![Asam lemah H Ka asam Bila derajad ionisasinya α diketahui maka Asam lemah : [H+] = √ Ka [asam] Bila derajad ionisasinya (α) diketahui, maka](https://slidetodoc.com/presentation_image_h/083d4da9d1d6598cb7987cab30f449af/image-20.jpg)
Asam lemah : [H+] = √ Ka [asam] Bila derajad ionisasinya (α) diketahui, maka : Konsentrasi asam yg terionisasi = α x [asam] Konsentrasi ion H+ yg terbentuk = α x [asam] [H+] = α x [asam] Basa lemah : [OH-] = √ Kb [basa] dan [OH-] = α x [basa]

Ø Contoh 2 (asam lemah dan basa lemah ) 1. Tentukan p. H larutan berikut: a. CH 3 COOH 0, 05 M (Ka = 1, 75 x 10 -5 ) b. NH 4 OH 0, 2 M (Kb = 1, 75 x 10 -5 ) c. 6, 0 g CH 3 COOH (Mr = 60) yang terlarut dalam 1000 m. L larutan d. 3, 5 g NH 4 OH (Mr = 35) yang terlarut dalam 1000 m. L larutan 2. Tentukanlah derajat ionisasi (dalam %) larutan HCN 1, 00 M (Ka = 4, 43 x 10 -10)

3. p. H larutan suatu asam HA yang konsentrasinya 0, 08 M adalah 3, 00. Tentukan harga Ka dan derajat ionisasi (dalam %) asam itu!

Larutan penyangga 1. Asam lemah dan garamnya 2. Basa lemah dan garamnya

MENGHITUNG p. H 1. Asam Kuat + Basa Kuat * Bila keduanya habis, gunakan rumus: p. H larutan = 7 (netral) * Bila asam kuat bersisa, gunakan rumus: [H+] = Konsentrasi asam kuat x Valensi asam kuat * Bila basa kuat bersisa, gunakan rumus : [OH-] = Konsentrasi basa kuat x Valensi basa kuat

MENGHITUNG p. H 2. Asam kuat + basa lemah * Bila keduanya habis, gunakan rumus hidrolisis * Bila asam kuat bersisa, gunakan rumus : [H+] = Konsentrasi asam kuat x Valensi asam kuat

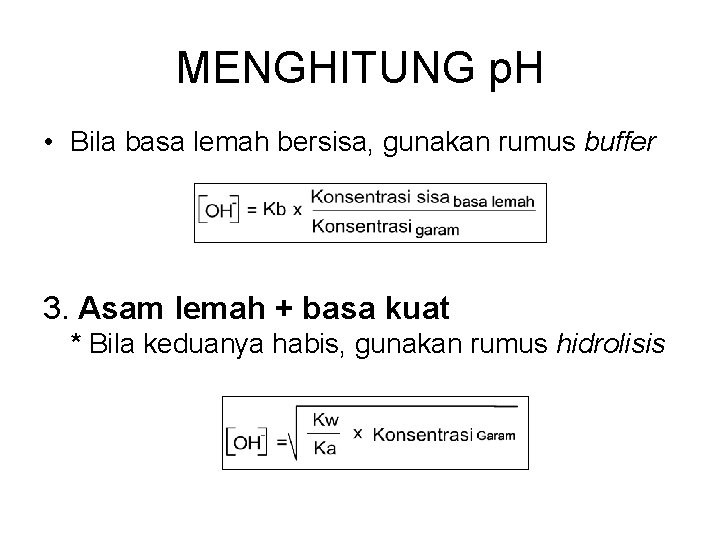
MENGHITUNG p. H • Bila basa lemah bersisa, gunakan rumus buffer 3. Asam lemah + basa kuat * Bila keduanya habis, gunakan rumus hidrolisis
![MENGHITUNG p H Bila basa kuat bersisa gunakan rumus OH Konsentrasi MENGHITUNG p. H * Bila basa kuat bersisa, gunakan rumus : [OH-] = Konsentrasi](https://slidetodoc.com/presentation_image_h/083d4da9d1d6598cb7987cab30f449af/image-27.jpg)
MENGHITUNG p. H * Bila basa kuat bersisa, gunakan rumus : [OH-] = Konsentrasi basa kuat x Valensi basa kuat * Bila asam lemah bersisa, gunakan rumus buffer:

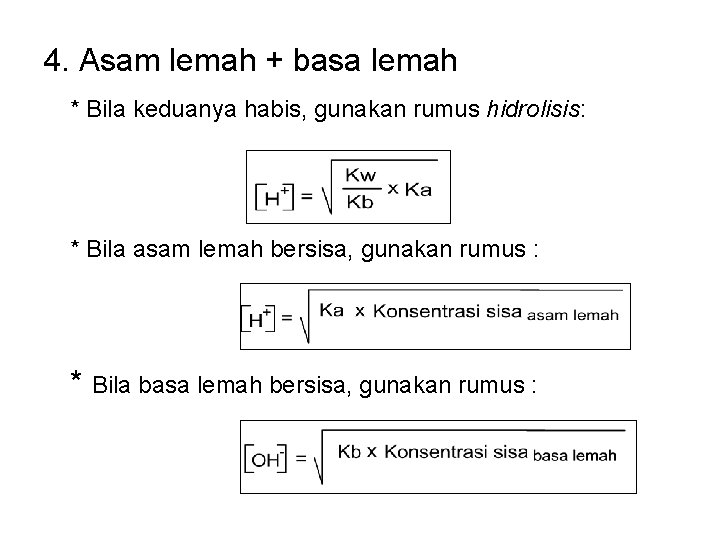
4. Asam lemah + basa lemah * Bila keduanya habis, gunakan rumus hidrolisis: * Bila asam lemah bersisa, gunakan rumus : * Bila basa lemah bersisa, gunakan rumus :

Sifat koligatif larutan Hukum Raoult 1. penurunan tekanan uap n. B = mol zat terlarut n. A = mol pelarut Po = tekanan uap jenuh pelarut murni ∆P = penurunan tekanan uap 2. kenaikan titik didih Kb = konstanta kenaikan titik didih m = molalitas

3. Penurunan titik beku Kf = konstanta penurunan titik beku m = molalitas 4. Tekanan osmosis p = tekanan osmosis (atm) C = konsentrasi (Molar) R = tetapan gas = 0, 082 ℓ atm. mol-1. K-1 T = temperatur dalam K = C + 273

Derajat ionisasi ( ) bagian dari 1 mol zat elektrolit yang terinonisasi menjadi ion-ionnya = mol zat yang terionisasi mol zat yang dilarutkan Elektrolit kuat = 1 Non elektrolit = 0 Elektrolit lemah 0 < < 1

Harga dipengaruhi oleh : - sifat solute - sifat solvent - temperatur - konsentrasi

Hukum Raoult tidak berlaku untuk larutan elektrolit yang berlaku hukum Van’t Hoff Tb = Kb. m. (1 + (n-1) ) Tf = Kf. m. (1+ (n-1) ) p = C. R. T. (1+ (n-1) ) P = Po. XB. (1+ (n-1) ) n = jumlah ion dr zat elektrolit = derajat ionisasi

KELARUTAN DAN HASIL KALIKELARUTAN Kelarutan (s) adalah banyaknya jumlah mol maksimum zat yang dapat larut dalam suatu larutan yang bervolume 1 liter Contoh : Tentukanlah kelarutan Mg(OH)2 dalam Molar, jika 5, 8 gram Mg(OH)2 larut dalam 500 m. L air! (Mr Mg(OH)2 = 58) Jawab:

Hasil kali kelarutan (Ksp) adalah hasil perkalian konsentrasi ion-ion dalam suatu larutan jenuh dipangkatkan masing-masing koefisiensinya. Contoh: Tentukan Ksp dari Na. Cl, Na 2 SO 4, H 3 PO 4 Jawab: - Na. Cl → Na+ + Cls s s Ksp = [Na+] [Cl-] = s x s = s 2 - Na 2 SO 4 → 2 Na+ + SO 4 s 2 s s Ksp = [Na+]2 [SO 4 -] = [2 s]2 x s = 4 s 3

Pengaruh Ion Sejenis Ion sejenis akan memperkecil kelarutan Contoh : Jika diketahui Ksp Ag. Cl = 10 -10. Maka tentukan kelarutan Ag. Cl dalam air dan dalam KCl 0, 15 M! Dalam air : Ksp Ag. Cl = s x s 10 -10 = s 2 → s = √ 10 -10 = 10 -5 Dalam KCl 0, 15 M : KCl → K+ + Cl 0, 15 Ksp Ag. Cl = [Ag+] [Cl] 10 -10 = [Ag+] 0, 15 [Ag+] = 6, 7. 10 -10 0, 15
 Campuran homogen adalah
Campuran homogen adalah Apa itu campuran homogen
Apa itu campuran homogen Campuran homogen tersusun dari titik-titik dan titik-titik
Campuran homogen tersusun dari titik-titik dan titik-titik Campuran berikut bersifat penyangga kecuali
Campuran berikut bersifat penyangga kecuali Dalam larutan mcl 0 1 m
Dalam larutan mcl 0 1 m Contoh sifat ekstensif
Contoh sifat ekstensif Zat non gizi
Zat non gizi Komponen non gizi jenis zat warna dan flavor terdiri dari
Komponen non gizi jenis zat warna dan flavor terdiri dari Larutan hcl yang dijual di pasaran memiliki konsentrasi 45
Larutan hcl yang dijual di pasaran memiliki konsentrasi 45 Larutan adalah campuran yang
Larutan adalah campuran yang Konsentrasi larutan
Konsentrasi larutan Larutan adalah campuran yang
Larutan adalah campuran yang Peta konsep zat cair
Peta konsep zat cair Ekskresi mengeluarkan zat-zat berupa....
Ekskresi mengeluarkan zat-zat berupa.... Pengertian larutan penyangga
Pengertian larutan penyangga Rumus asam lemah
Rumus asam lemah Contoh bagan zat tunggal dan campuran
Contoh bagan zat tunggal dan campuran Rumah gedung
Rumah gedung Wadah sebagai bagian terluar disebut
Wadah sebagai bagian terluar disebut Pengertian wilayah menurut fenneman
Pengertian wilayah menurut fenneman Dilatasi dan shear
Dilatasi dan shear Sebuah benda tegar berputar dengan kecepatan
Sebuah benda tegar berputar dengan kecepatan Tentukan nilai peluang seekor beruang akan mati
Tentukan nilai peluang seekor beruang akan mati Kriteria penjadualan yang optimal terdiri dari ?
Kriteria penjadualan yang optimal terdiri dari ? Kumpulan peraturan yang terdiri dari norma dan sanksi
Kumpulan peraturan yang terdiri dari norma dan sanksi Benang yang terdiri dari satu slide filamen adalah
Benang yang terdiri dari satu slide filamen adalah Komponen sistem firewall
Komponen sistem firewall Kumpulan peraturan yang terdiri dari norma dan sanksi
Kumpulan peraturan yang terdiri dari norma dan sanksi Suatu tim lomba pesona kimia
Suatu tim lomba pesona kimia Kalimat deduktif adalah
Kalimat deduktif adalah Diberikan sebuah rangkaian yang terdiri dari dua buah loop
Diberikan sebuah rangkaian yang terdiri dari dua buah loop Jelaskan struktur data array
Jelaskan struktur data array Berikut struktur batin puisi, kecuali…..
Berikut struktur batin puisi, kecuali….. Setiap kelompok
Setiap kelompok Asreoid
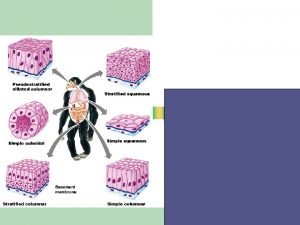
Asreoid Epitel
Epitel Flytande avgränsning
Flytande avgränsning