KONSENTRASI LARUTAN Larutan adalah campuran homogen antara zat














- Slides: 15

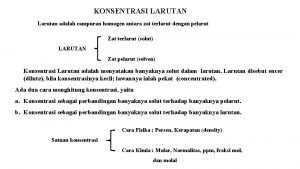
KONSENTRASI LARUTAN Larutan adalah campuran homogen antara zat terlarut dengan pelarut Zat terlarut (solut) LARUTAN Zat pelarut (solven) Konsentrasi Larutan adalah menyatakan banyaknya solut dalam larutan. Larutan disebut encer (dilute), bila konsentrasinya kecil; lawanya ialah pekat (concentrated). Ada dua cara menghitung konsentrasi, yaitu a. Konsentrasi sebagai perbandingan banyaknya solut terhadap banyaknya pelarut. b. Konsentrasi sebagai perbandingan banyaknya solut terhadap banyaknya larutan. Cara Fisika ; Persen, Kerapatan (density) Satuan konsentrasi Cara Kimia : Molar, Normalitas, ppm, fraksi mol,

Persen Berat (%-b), berapa persenkah berat zat terlarut dari berat larutan atau berapa gram zat terlarut terdapat dalam 100 gram larutan. Contoh Suatu logam campuran (alloy) tembaga dan aluminium mengandung 65, 6 g Cu dan 423, 1 g Al. Hitunglah persen berat komponen masing-masing. Jawab : 65, 6 g %-b Cu = x 100 % = 13, 4 % (65, 6 + 423, 1) g %-b Al = (100 – 13, 4) % = 86, 6 % Persen Volume (%-v), berapa persenkah volume zat terlarut dari volume larutan atau berapa ml zat terlarut terdapat dalam 100 ml larutan. Misalnya, Whisky, kandungan alkoholnya 40 %-v artinya 40 ml alkohol murni dalam 100 ml berapa persenkah berat zat terlarut dari berat larutan atau berapa gram zat terlarut terdapat dalam 100 gram larutan.

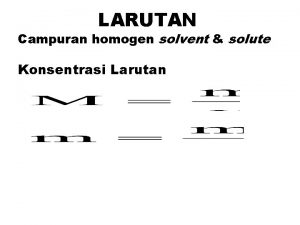
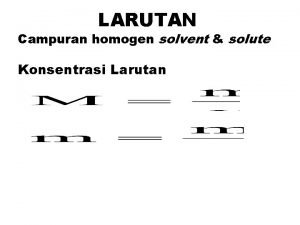
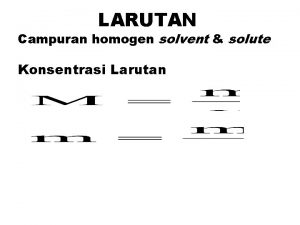
Density atau kerapatan ( g/cm 3 ) Menyatakan banyak zat dalam setiap 1 ml larutan. Misalnya, HCl memiliki density 0, 98 g/cm 3 Artinya dalam 1 ml larutan HCl terdapat 0, 98 g HCl atau di dalam 1 liter larutan HCl terdapat 980 g HCl. Molaritas (M) Menyatakan berapa mol zat terlarut terdapat dalam satu liter larutan. n M = ----v Dimana, M = molaritas; n = jumlah mol zat terlarut dan v = volume dalam liter. g n = g/Mr , maka M = ----------- atau mol = M x v Mr xv

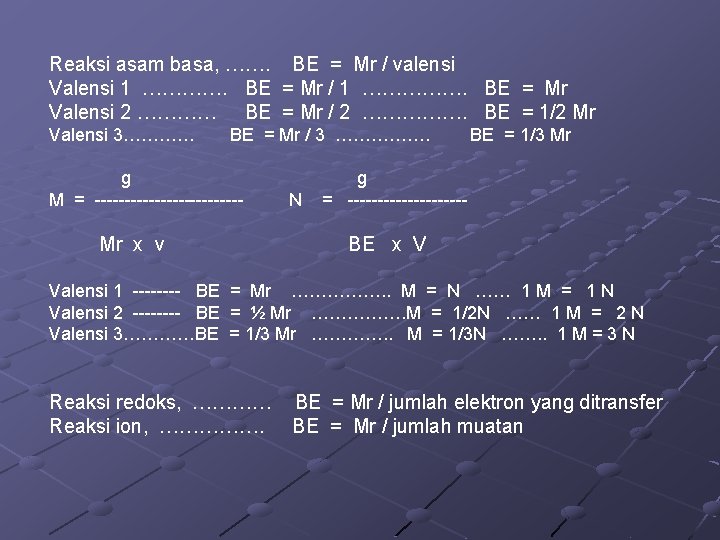
Normalitas Menyatakan berapa ekivalen zat terlarut dalam satu liter larutan. ekivalen (eq. ) N = --------------liter larutan Ekivalen adalah besaran yang nilainya dari reaksi yang dialami zat yang bersangkutan. Eq = g/BE , maka g N = ---------BE x v Reaksi asam basa, ……. BE = Mr / valensi Reaksi redoks, ………… BE = Mr / jumlah elektron yang ditransfer Reaksi ion, ……………. BE = Mr / jumlah muatan

Tugas 1. Hitunglah persen berat K 2 CO 3 dalam larutan yang dibuat dengan melarutkan 15 g K 2 CO 3 dalam 60 g air. 2. Suatu larutan dibuat dari 22, 2 g glukosa (C 6 H 12 O 6) dan air secukupnya sehingga terbentuk larutan 251 ml. Berapa konsentrasi molar larutan itu ? 3. Dalam 2, 0 liter larutan terdapat 49 g H 3 PO 4. Berapa konsentrasi molar larutan itu ? 4. Berapa g HNO 3 diperlukan untuk membuat 2, 85 liter larutan 0, 450 M ? 5. Hitunglah molaritas dan normalitas larutan Na. OH 10 %-b 6. Cuka pasar 4 %-b mempunyai density 1, 0058. Berapa molaritas dan normalitas cuka pasar itu ? CH 3 COOH (asam cuka).

1. 10 g Na. OH (Mr = 40) terlarut dalam 1 liter larutan. Tentukan konsentrasi Molaritas dan Normalitasnya. 2. 9, 8 g H 2 SO 4 (Mr = 98) terlarut dalam 500 ml larutan. Tentukan konsentrasi Normalitas dan Molaritasnya. 3. 4 g Ca. CO 3 (Mr = 100) terlarut dalam 2 liter larutan. Tentukan konsentrasi Normalitas dan Molaritasnya. Reaksi : Ca. CO 3 Ca 2+ + CO 32 - 4. 500 ml larutan HNO 3 0, 5 M kemasukan air 1500 ml. Tentukan faktor pengencerannya dan berapa konsentrasi HNO 3 sekarang ? 5. Bagaimana caranya membuat larutan a. 500 ml larutan 0, 1 M C 6 H 1206 (Mr = 180) b. 1. 000 ml larutan HCl 0, 2 M. Density HCl 1, 19 dam Mr = 36, 5


Reaksi asam basa, ……. BE = Mr / valensi Valensi 1 …………. BE = Mr / 1 ……………. BE = Mr Valensi 2 ………… BE = Mr / 2 ……………. BE = 1/2 Mr Valensi 3………… BE = Mr / 3 ……………. g M = ------------- Mr x v N BE = 1/3 Mr g = ---------- BE x V Valensi 1 ---- BE = Mr ……………. . M = N …… 1 M = 1 N Valensi 2 ---- BE = ½ Mr ……………. M = 1/2 N …… 1 M = 2 N Valensi 3…………BE = 1/3 Mr …………. . M = 1/3 N ……. . 1 M = 3 N Reaksi redoks, ………… BE = Mr / jumlah elektron yang ditransfer Reaksi ion, ……………. BE = Mr / jumlah muatan

ppm = part per million atau per sejuta 1 ppm = satu per sejuta 1 1 ppm = ---------------106 1 1 ppm = ---------------- x 104 1 ……………. . 102 1 1 ppm = ---------------- x 104 1% 1 ppm = 0, 0001 % 1 --------- = 0, 0001 10. 000

1 ppm = 1 mg / kg atau 1 ppm = 1 mg/ liter Soal 1. Dalam 1 ton batuan granit terkandung 2000 g logam Zn, tentukan berapa ppm dan persenkah Zn dalam batuan tersebut ? 2. Dalam lumpur sungai terdapat 10 ppm Hg. Berapa gram Hg dalam 10 ton lumpur sungai ? 3. Bagaimana caranya membuat larutan a. 500 ml larutan 0, 1 M C 6 H 1206 (Mr = 180) b. 100 ml larutan Na. OH 0, 5 M diencerkan sampai volume 1 liter Tentukan : - konsentrasi molar setelah diencerkan - besarnya faktor pengenceran b. 1. 000 ml larutan HCl 0, 2 M. Density HCl 1, 19 dan Mr = 36, 5

Apa makna berikut 1. 25 ppm Fe dalam air sungai 2. 25 ppm P 2 O 5 dalam tanah 3. Air limbah mengandung BOD 200 ppm

PENGENCERAN Penambahan zat pelarut kedalam sejumlah larutan yang konsentrasinya lebih tinggi. Penambahan pelarut ini tidak menambah ataupun mengurangi jumlah zat terlarut, baik dalam bentuk mol maupun berat Dalam persamaan matematika dapat ditulis Mol zat terlarut pada larutan pekat = mol zat terlarut pada larutan encer

n 1 = n 2 M 1 x v 1 = M 2 x v 2 Atau Berat zat terlarut [= berat zat pelarut V 1 x (%b/v)1 = v 2 x (%b/v)2 contoh Berapa volume H 2 SO 4 16 M yang diperlukan untuk membuat larutan H 2 SO 4 1 M sebanyak 100 ml v 1 = 6, 25 ml

2 gr Na. OH dilarutkan dalam air sehingga volume larutan 250 ml. Hitung kemolaran larutan tersebut 4, 9 gr H 2 SO 4 dilarutkan dalam air sehingga volume larutan 400 ml. Hitung Kenormalannya Hitung faksi mol HCl dalam larutan yang mengandung 0, 66 mol dalam 1, 5 kg H 2 O Bagaimana mendapatkan 150 ml larutan Na. OH 0, 5 M bila tersedia larutan Na. OH 4 M

Diket : 2 gr Na. OH (Mr= 40) vol = 250 ml 0, 25 L Ditya M = mol/liter M = 2/40/0. 25 = 1/8 /0. 25 = 0. 25 M N = 4. 9/ 49 x 0. 4 = 0. 25 N F. Mol = mol HCl/mol H 2 O = 0. 66/0. 66 +83. 33 = 0. 0078 18. 75
 Homogen
Homogen Gambar campuran homogen
Gambar campuran homogen Larutan adalah campuran yang
Larutan adalah campuran yang Materi adalah
Materi adalah Campuran larutan berikut bersifat buffer kecuali
Campuran larutan berikut bersifat buffer kecuali Satuan konsentrasi larutan
Satuan konsentrasi larutan Pengertian konsentrasi larutan
Pengertian konsentrasi larutan Campuran homogen
Campuran homogen Potiones adalah
Potiones adalah Larutan adalah campuran yang
Larutan adalah campuran yang Campuran homogen tersusun dari titik-titik dan titik-titik
Campuran homogen tersusun dari titik-titik dan titik-titik Peta konsep wujud benda
Peta konsep wujud benda Ekskresi mengeluarkan zat-zat berupa ...
Ekskresi mengeluarkan zat-zat berupa ... Larutan adalah campuran yang
Larutan adalah campuran yang Alternatif pola seleksi pasar sasaran
Alternatif pola seleksi pasar sasaran Pengertian larutan penyangga
Pengertian larutan penyangga