Materi Tiga LARUTAN KOMPETENSI Memiliki pemahanan sifatsifat larutan
















- Slides: 16

Materi Tiga : LARUTAN

KOMPETENSI : Memiliki pemahanan sifat-sifat larutan dan kesetimbangan ion dalam larutan Memiliki kemampuan untuk menginterpretasikan serta menerapkan dalam perhitungan kimia.

PENGANTAR : Larutan adalah campuran homogen atau serba sama antara dua zat atau lebih. Zat yang jumlahnya banyak disebut pelarut dan zat yang jumlahnya sedikit disebut zat terlarut. Larutan = pelarut + zat terlarut Pelarut : biasanya air, jumlahnya banyak Zat terlarut : jumlahnya lebih sedikit

MATERI POKOK BAHASAN : A. Satuan Konsentrasi B. Masalah Konsentrasi C. Elektrolit D. Sifat Koligatif Larutan E. p. H

A. SATUAN KONSENTRASI 1. Persentase (%) : jumlah gram zat terlarut dalam tiap 100 gram larutan. 2. Fraksi mol (X) : perbandingan jumlah mol suatu zat dalam larutan terhadap jumlah mol seluruh zat dalam larutan. 3. Kemolaran (M) : jumlah mol zat terlarut dalam tiap liter larutan. 4. Kemolalan (m) : jumlah mol zat terlarut dalam tiap 1000 gram pelarut. 5. Kenormalan (N) : jumlah grek zat terlarut dalam tiap liter larutan.

RUMUS –RUMUS : % = gram zat terlarut x 100 % gram larutan X = mol suatu zat : mol seluruh zat M = mol : liter = mmol : ml M = (1000 : p) X (gram : BM) N = grek : liter = mgrek : ml Grek = mol x jumlah H+ atau OH -

B. MASALAH KONSENTRASI Perhitungan jumlah zat terlarut: Mol zat terlarut = liter x M Pengenceran Larutan: V 1 M 1 = V 2 M 2 Pencampuran konsentrasi yang berbeda: M camp = V 1 M 1 + V 2 M 2 V 1 + V 2

C. ELEKTROLIT Definisi : zat yang jika dilarutkan ke dalam air akan terurai menjadi ion-ion (terionisasi), sehingga dapat menghantarkan listrik. Elektrolit kuat : zat yang dalam air akan terurai seluruhnya menjadi ionion (terionisasi sempurna) Elektrolit lemah : zat yang dalam air tidak seluruhnya terurai menjadi ionion (terionisasi sebagian)

ELEKTROLIT KUAT : ELEKTROLIT LEMAH : 1. Asam-asam kuat ( asam halogen, HNO 3, H 2 SO 4 ) 2. Basa-basa kuat ( Basa alkali, Sr(OH)2, Ba(OH)2 ) 3. Hampir semua garam adalah elektrolit kuat 4. Reaksinya berkesudahan (berlangsung sempurna ke arah kanan) 1. Asam –asam lainnya adalah asam-asam lemah. 2. Basa-basa lainnya adalah basa-basa lemah. 3. Garam yang tergolong elektrolit lemah adalah garam merkuri (II) 4. Reaksinya kesetimbangan (elektrolit hanya terionisasi sebagian). PERBANDINGAN :

LANJUTAN ELEKTROLIT : Besaran lain untuk menentukan kekuatan elektrolit adalah DERAJAD IONISASI (α ) α = mol zat yang terionisasi dibagi mol zat yang dilarutkan. Elektrolit kuat : α = 1 Elektrolit lemah : 0 < α < 1 Non Elektrolit : α = 0

D. SIFAT KOLIGATIF LARUTAN Definisi : sifat yang ditentukan oleh konsentrasi. Ada 4 hal yaitu : 1. 2. 3. 4. Kenaikan titik didih ( ΔTd) Penurunan titik beku ( ΔTb) Tekanan osmotik ( π ) Penurunan tekanan uap (Δp) Keempatnya ditentukan oleh konsentrasi atau banyaknya partikel zat terlarut. Makin besar konsentrasi makin besar pula sifat koligatifnya.

E. PH H 2 O memiliki sedikit sifat elektrolit, artinya air dapat terionisasi menghasilkan ion H+ dan ion OHJika air dilarutkan asam, maka asam akan melepaskan ion H+ Jika air dilarutkan basa, maka basa akan melepaskan ion OHJadi besarnya [H+] dalam larutan dapat digunakan untuk menyatakan larutan basa, asam atau netral.

Ingat : Larutan netral : p. H =7 Larutan asam : p. H < 7 Larutan basa : p. H > 7 Makin rendah harga p. H larutan makin bersifat asam dan sebaliknya makin tinggi bersifat basa.

SOAL-SOAL : Berapa gramkah Na. OH (BM=40) yang terlarut dalam 250 ml larutan Na. OH 0, 4 M. Berapa volume air yang harus ditambahkan pada 250 ml larutan HCl 0, 3 M untuk mendapatkan larutan HCL dengan konsentrasi 0, 1 M. 150 ml larutan H 2 SO 4 0, 2 M dicampurkan dengan 100 ml larutan H 2 SO 4 0, 3 M. Berapa konsentrasi larutan setelah dicampurkan?

SOAL – SOAL : 30 gram asetat (BM=60) dilarutkan dalam 45 gram air (BM=18). Hitunglah : Konsentrasi larutan dalam % dan fraksi mol masing-masing zat. 2 gram Na. OH (BM=40) dilarutkan dalam air sehingga volume larutan 250 ml. Hitung kemolaran larutan. 12 gram Urea (BM=60) dilarutkan dalam 500 gram air. Hitung kemolalan larutan. 4, 9 gram H 2 SO 4 (BM=98) dilarutkan dalam air sehingga volume larutan 400 ml. Hitunglah kenormalan larutan.

KESIMPULAN : Dalam suatu industri fungsi suatu larutan sangat penting, baik yang berfungsi sebagai pelarut maupun zat terlarut. Air merupakan pelarut yang paling murah, paling mudah dan paling banyak digunakan sebagai pelarut dalam banyak industri.
 Hubungan kompetensi inti kompetensi dasar dan indikator
Hubungan kompetensi inti kompetensi dasar dan indikator Kompetensi inti dan kompetensi dasar
Kompetensi inti dan kompetensi dasar Pertanyaan tentang kompetensi inti dan kompetensi dasar
Pertanyaan tentang kompetensi inti dan kompetensi dasar Kemampuan eksekutif untuk membangun hubungan baik dengan
Kemampuan eksekutif untuk membangun hubungan baik dengan Standar kompetensi dan kompetensi dasar mata pelajaran ips
Standar kompetensi dan kompetensi dasar mata pelajaran ips Kisi kisi uji kompetensi asesor 2020
Kisi kisi uji kompetensi asesor 2020 Larutan penyangga obat tetes mata
Larutan penyangga obat tetes mata Buffer adalah
Buffer adalah Campuran larutan larutan berikut bersifat buffer kecuali
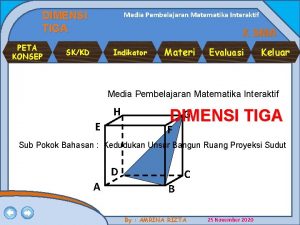
Campuran larutan larutan berikut bersifat buffer kecuali Peta konsep dimensi tiga kelas 12
Peta konsep dimensi tiga kelas 12 Larutan hcl yang dijual di pasaran memiliki konsentrasi 45
Larutan hcl yang dijual di pasaran memiliki konsentrasi 45 Materi kimia kelas 12 semester 1 sifat koligatif larutan
Materi kimia kelas 12 semester 1 sifat koligatif larutan Memiliki alas berbentuk lingkaran memiliki.
Memiliki alas berbentuk lingkaran memiliki. Sesuatu yang mempunyai massa dan menempati ruang disebut
Sesuatu yang mempunyai massa dan menempati ruang disebut Materi adalah segala sesuatu yang
Materi adalah segala sesuatu yang Menyusun peta kompetensi jabatan
Menyusun peta kompetensi jabatan Pengembangan indikator hots
Pengembangan indikator hots