Soal dan Pembahasan Teori Kinetik Gas XI IPA

Soal dan Pembahasan Teori Kinetik Gas XI IPA 5 2011/2012

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Endah Kusrini b. Mei Kurniawati

Sejumlah gas ideal bertekanan p dipanaskan dari 27 o. C menjadi 54 o. C. Jika volumenya naik menjadi dua kali, maka tekanannya menjadi…. Penyelesaian: Diket : p 1 = p ; T 1 = 27 o. C=300 K ; T 2 = 54 o. C=327 K ; V 1 = V ; V 2 = 2 V Ditanya: p 2 = …? Jawab: p 1 V 1 p 2 V 2 p V = p 2. 2 V T 2 300 327 300 p 2 = 327 p p 2 = 0, 55 p (endah & mei)

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Amalinda Via S b. Shofi Dhia A


TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Adityo Kumoro J. (01/XI IPA 5) b. Sholih Adam G. (27/XI IPA 5)

LKS HALAMAN 23 NO. 5
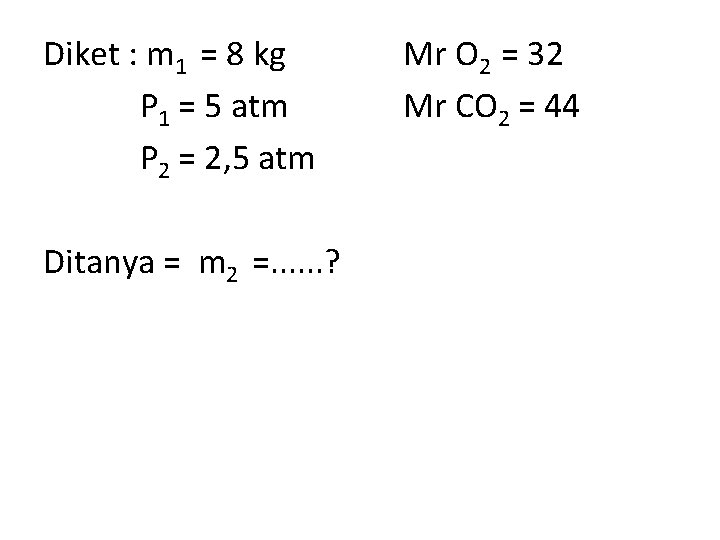
Diket : m 1 = 8 kg P 1 = 5 atm P 2 = 2, 5 atm Ditanya = m 2 =. . . ? Mr O 2 = 32 Mr CO 2 = 44
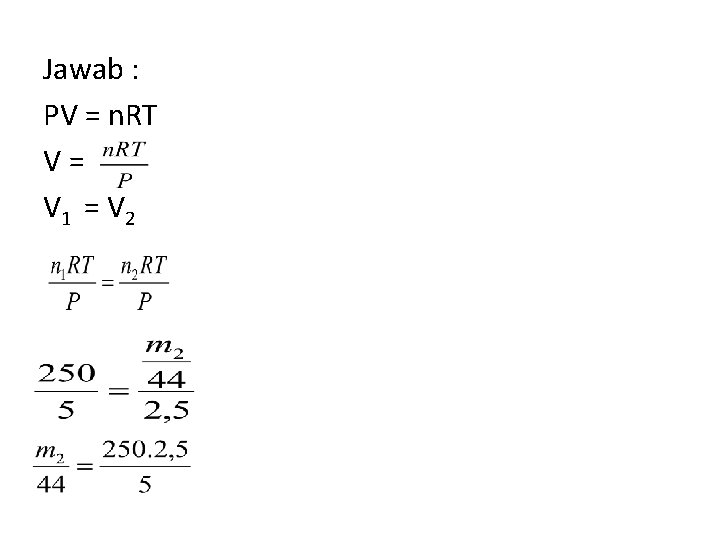
Jawab : PV = n. RT V = V 1 = V 2

m 2 = 50. 2, 5. 44 = 5500 gr = 5, 5 kg Jadi, nilai m 2 adalah 5, 5 kg

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Fakhriya Sakinatun b. Happy Nanda L

Soal ! Dalam ruang tertutup terdapat 2 mol gas monoatomik pada suhu 227 0 C. Jika tetapan Boltzman k = 1, 38. 10 -23 J/K dan bilangan Avogadro N 0 = 6, 0. 1023 partikel/mol energi kinetik rata-rata partikel gas tersebut adalah ? Jawab : Diket : n = 2 mol T = 227 0 C = 500 K k = 1, 38. 10 -23 J/K N 0 = 6, 0. 1023 partikel/mol Ditanya : Ek ? Solusi : Ek = Nk. T = x 6, 0. 1023 x 2 x 1, 38. 10 -23 x 500 = 12. 420 J

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Atha Hafizah D. P. b. Naumi Damayanti B.

• Di angkasa luar terdapat sekitar 1 atom H 2 per cmᵌ pada suhu sekitar 3, 5 K. Jika massa atom H 2 adalah 1 g/mol, tentukan a. Kelajuan efektif atom-atom H 2 itu b. Tekanan udara pada tempat itu

Jawab: • Diketahui: Kerapatan atom H 2 N/V = 1 atom/cmᵌ = 106 atom/mᵌ Suhu T = 3, 5 K M H 2 = 1 g/mol = 1 kg/kmol R = 8310 J/kmol

a. Kelajuan efektif VRMS = √ 3 RT/M = √ 3. (8310). (3, 5)/1 = 295, 4 m/s b. Tekanan udara p. V = N/NA. RT p = NRT/VNA N = 1 atom, V = 1 cmᵌ = 10 -6 mᵌ p = 1. (8310). (3, 5) / 10 -6. (6, 02. 10 -26 ) = 4, 83. 10 -17 Pa

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Alkindi Yahya b. Ikhwan Anshori

soal Energi kinetik rata-rata dari suatu molekul gas dalam sebuah bintang pada suhu 5000 K adalah ….

jawab k= 8, 314 x 103 JK-1 Ek = 3. 2 -1. k. T = 3. 2 -1. 1, 38 x 10 -23. 5000 K = 10350 x 10 -23 J = 1, 035 x 10 -19 J

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Muh Syaiful Jihad b. Syafik Bintang F.

16 gram gas Oksigen (M = 32 gr/mol) berada pada tekanan 1 atm dan suhu 27 o. C. Tentukan volume gas jika: a) diberikan nilai R = 8, 314 J/mol. K b) diberikan nilai R = 8314 J/kmol. K


TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Putri Intan P. b. Sugandhini Cakra M.

Hitunglah besarnya : a. Kecepatan rata-rata molekul gas? b. Kecepatan effektif molekul gas?



TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Fauzi Ristikasari b. Nena Tamara

Soal : • Gas dalam ruang tertutup memiliki suhu sebesar 2 T Kelvin energi kinetik rata-rata Ek = 1800 joule. Jika suhu gas dinaikkan hingga menjadi 3 T tentukan perbandingan energi kinetik rata-rata gas kondisi akhir terhadap kondisi awalnya dan besar Ek 2!

Jawab : • Diket : Ek 1 = 1800 J T 1 = 2 T T 2 = 3 T

• Ditanyakan : v. Ek 1 : Ek 2 v. Besar Ek 2
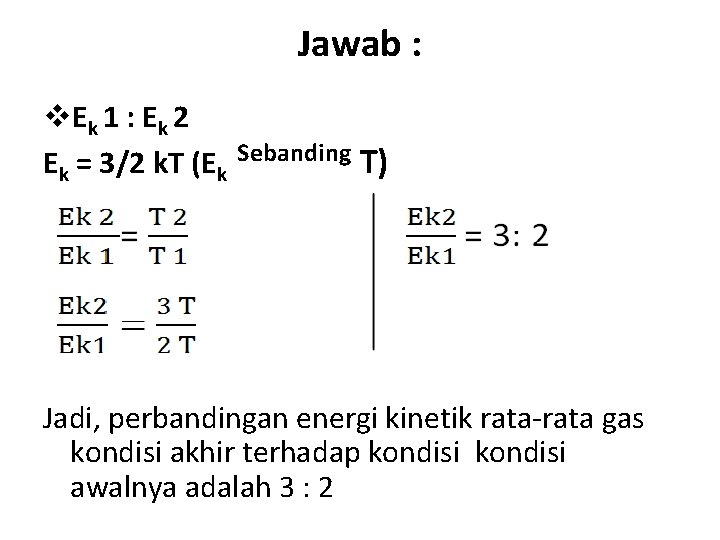
Jawab : v. E k 1 : E k 2 Ek = 3/2 k. T (Ek Sebanding T) Jadi, perbandingan energi kinetik rata-rata gas kondisi akhir terhadap kondisi awalnya adalah 3 : 2

v Besar Ek 2 = 3 x 1800 : 2 = 2700 J Jadi, besar Ek 2 adalah 2700 J

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Arsita Mien T. b. Nia Handayani

Soal teori kinetik gas • Sebuah tangki dengan volum 0, 5 m 3 mengandung 4 mol gas neon pada suhu 27 o C. Tentukan Energi kinetik total gas neon?

jawab • Besaran yg diketahui : • V = 0, 5 m 3 • n = 4 mol • T = 27 + 273 = 300 K

• • P = PV= n. RT Energi kinetik total:

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Ayu Ratna P. b. Tutu Wisti S.

soal • Suatu gas yang massanya 1. 95 kg pada suhu 27 o C memiliki volum 600 liter dan tekanan 5 atm. Tentukan massa molekul relative (Mr) gas tersebut?

Diketahui: • • • Besaran yang diketahui : m = 1, 95 kg = 1950 gram T = 27 + 273 = 300 K V = 600 liter P = 5 atm

jawaban • PV = n. RT • PV = • Mr =

TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Galih Arga N. b. Rizky Raka Z.

• pada gas bersuhu 200 K, tentukan suhu dari gas lain yang massa partikelnya 2 kali massa partikel pertama, agar kedua gas mempunyai kecepatan partikel yang sama!


TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Faisal Nurghani b. Miftah Nur Hidayat

• SOAL Massa atom relatif oksigen 16, massa sebuah atom hidrogen 1, 66 x 10 -27 kg dan k = 1, 38 x 1023 J/K. Jika suhu gas 770 C , dan berapa kecepatan rata-rata molekul gas oksigen?


TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Ardiyan Sena A. b. Ryan Damas W.

1. Apabila suhu gas dalam ruang tertutup dinaikkan menjadi empat kali suhu mula-mula, kecepatan molekul rata-rata menjadi…. . a) b) c) d) e) Setengahnya Seperempatnya Dua kalinya Empat kalinya Enam belas kalinya


TUGAS SOAL – SOAL FISIKA Nama Aggota: a. Alfabi Muhlisin S. b. Ekhandoko Aji W.

1. Gas Hidrogen (M=2, 0 kg/kmol ) pada suhu 4°C dan tekanan normal mengisi suatu wadah kosong yang memiliki volume 5, 0 x 10 -3 m 3. Sebuah lubang kecil seluas 2, 0 x 10 -14 m 2 dibuat pada dinding wadah. Hitung : a. Kelajuan rms dari molekul-molekul hidrogen b. Jumlah molekul hidrogen yang memasuki wadah setiap sekon c. Selang waktu untuk 1, 0 x 10 -14 mol hidrogen memasuki wadah, dan d. Tekanan dalam wadah setelah selang waktu ini (Tetapan gas R = 8, 31 x 103 kmol-1 K-1) (NA = 6, 02 x 1026 molekul/kmol)

• Ditanya : Vrms ? N per sekon ? T ? p ?

Diketahui: Suhu gas T = 4+273 = 277 K; tekanan normal p = 1 atm = 1, 0 x 105 Pa; volume wadah V = 5, 0 x 10 -3 m 3 gas R = 8, 31 x 103 kmol-1 K-1 NA = 6, 02 x 1026 molekul/kmol
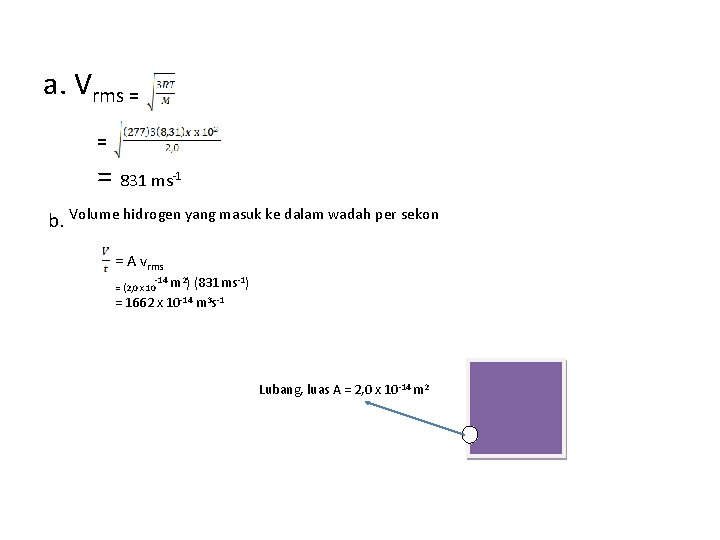
a. Vrms = = = 831 ms -1 b. Volume hidrogen yang masuk ke dalam wadah per sekon = A vrms -14 m 2) (831 ms-1) -14 3 -1 = 1662 x 10 m s = (2, 0 x 10 Lubang, luas A = 2, 0 x 10 -14 m 2

Jumlah molekul hidrogen per sekon, dihitung dari persamaan gas ideal p. V = n. RT p. V = N = = = 9, 7 x 1014 molekul s-1

c. Banyak mol n = 1, 0 x 10 -6 mol Jumlah molekul: N = (1, 0 x 10 -6 mol) x (6, 02 x 1026 molekul/kmol) N= 6, 02 x 1017 molekul Selang waktu t = d. Tekanan gas dalam wadah setelah t, dihitung dengan persamaan gas ideal p. V = n. RT = RT p = = = 0, 46 Pa
- Slides: 56