La liaison chimique I la liaison covalente La





























- Slides: 36

La liaison chimique I: la liaison covalente

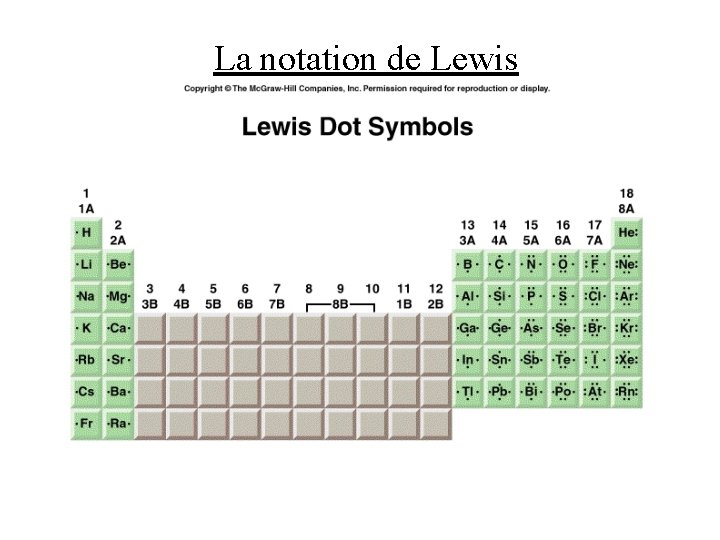
La notation de Lewis • les atomes réagissent ensemble pour former des molécules afin d’arriver à une configuration électronique plus stable • les électrons de valence nous intéressent le plus car ce sont les électrons de valence qui se font partagés entre deux atomes dans une liaison covalente • la notation de Lewis est la représentation d’un élément par son symbole entouré de points qui représentent les électrons de valence • parce que les membres d’un groupe ont le même nombre d’électrons de valence, ils partagent la même notation de Lewis (sauf pour He, qui est un des gaz rares) • la notation de Lewis fonctionne très mal pour les métaux de transition, les lanthanides, et les actinides

La notation de Lewis

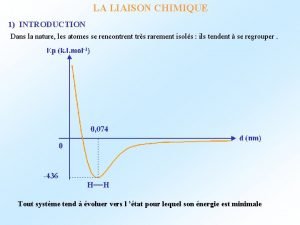
La liaison covalente • une liaison covalente est une liaison dans laquelle deux électrons sont partagés par deux atomes • dans une liaison covalente, chaque électron du doublet partagé est attiré par les noyaux des deux atomes • ces attractions aident à maintenir les deux atomes ensemble • seulement les électrons de valence participent aux liaisons covalentes

La structure de Lewis • les électrons qui ne participent pas à la formation d’une liaison covalente sont appellés des électrons nonliants ou des doublets libres • une structure de Lewis est une représentation des liaisons covalentes par la notation de Lewis où les doublets liants sont illustrés par de petits traits ou par des paires de points entre deux atomes et les doublets libres sont illustrés par des paires de points associées à chacun des atomes

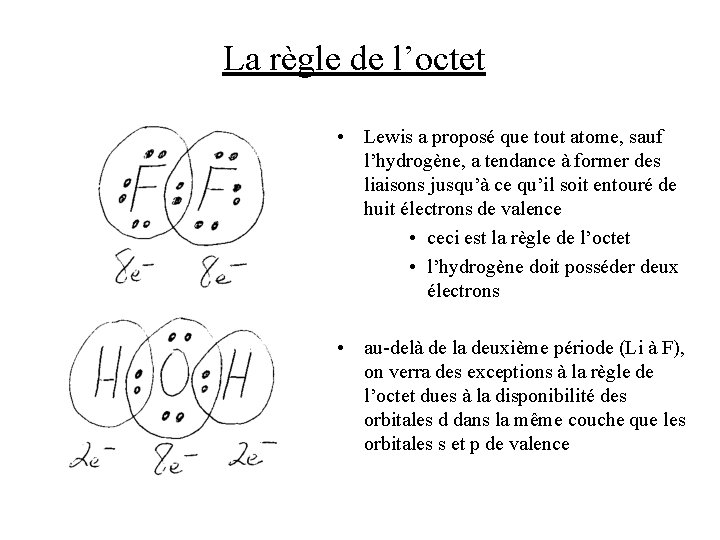
La règle de l’octet • Lewis a proposé que tout atome, sauf l’hydrogène, a tendance à former des liaisons jusqu’à ce qu’il soit entouré de huit électrons de valence • ceci est la règle de l’octet • l’hydrogène doit posséder deux électrons • au-delà de la deuxième période (Li à F), on verra des exceptions à la règle de l’octet dues à la disponibilité des orbitales d dans la même couche que les orbitales s et p de valence

Liaisons multiples • si deux atomes partagent un doublet d’électrons, ils forment une liaison simple • si deux atomes partagent deux doublets d’électrons, ils forment une liaison double • si deux atomes partagent trois doublets d’électrons, ils forment une liaison triple • pour une paire donnée d’atomes, les liaisons triples sont plus courtes et plus stables que les liaisons doubles, qui, elles, sont plus courtes et plus stables que les liaisons simples

La liaison covalente polaire • dans un diatomique homonucléaire (comme le H 2 ou le F 2), le partage des électrons est parfait • dans un diatomique hétéronucléaire (comme le HF), le partage n’est pas fait d’une manière égale, i. e. , l’électron passe plus de temps près d’un atome que l’autre • la liaison est dit covalente polaire (ou tout simplement polaire) • dans une liaison ionique, le transfert de l’électron est presque complet • dans une liaison polaire, il y a toujours un partage important

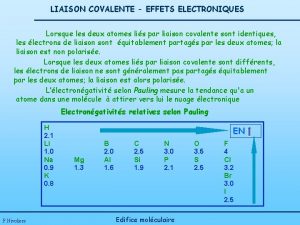
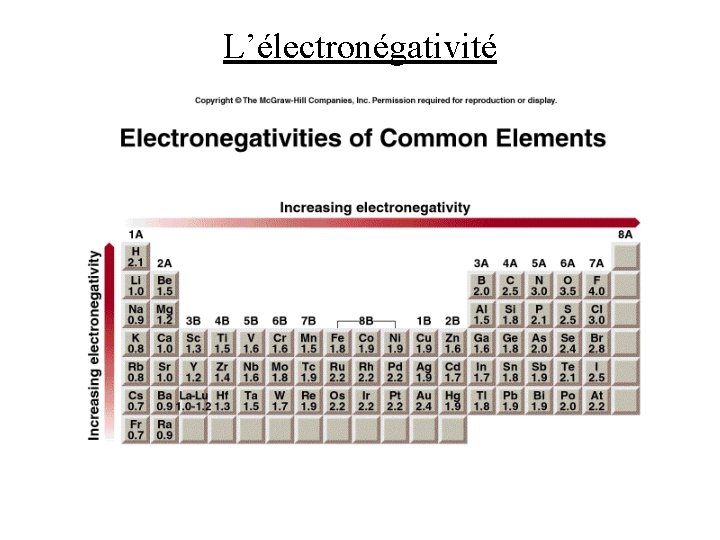
L’électronégativité • l’électronégativité est la tendance qu’a un atome à attirer vers lui les électrons dans une liaison chimique • l’électronégativité est une valeur relative, et donc sans unité • plus l’électronégativité d’un élément est élevée, plus cet élément a tendance à attirer des électrons • un élément qui a une affinité électronique forte et une énergie d’ionisation élevée tend à avoir une électronégativité forte • Pauling a établi une méthode pour calculer l’élecronégativité de la plupart des éléments

L’électronégativité

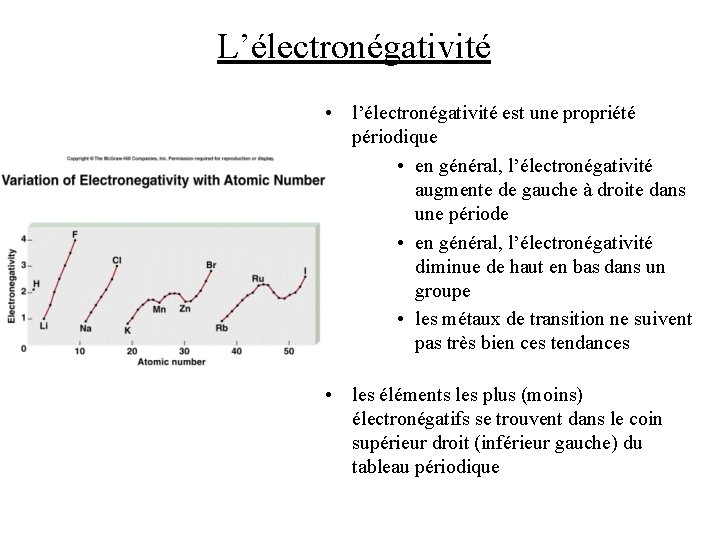
L’électronégativité • l’électronégativité est une propriété périodique • en général, l’électronégativité augmente de gauche à droite dans une période • en général, l’électronégativité diminue de haut en bas dans un groupe • les métaux de transition ne suivent pas très bien ces tendances • les éléments les plus (moins) électronégatifs se trouvent dans le coin supérieur droit (inférieur gauche) du tableau périodique

Liaisons covalentes polaires et liaisons ioniques • la liaison entre un métal et un non-métal tend à être ionique • la liaison entre deux éléments non-métalliques tend à être covalente polaire • règle générale: • si la différence d’électronégativité est égale ou supérieure à 2. 0, la liaison est essentiellement ionique • si la différence d’électronégativité est inférieure à 2. 0, la liaison est plutôt covalente polaire • si la liaison est entre deux atomes du même élément, la liaison est covalente pure

L’électronégativité et l’état d’oxydation • L’état d’oxydation indique le nombre de charges qu’aurait un atome dans une molécule si les électrons étaient transférés complètement au plus électronégatif des atomes participant à la liaison • eg. ; dans l’eau, l’O est plus électronégatif que l’H, donc l’O prend un électron de chaque H: l’O a une charge de -2 et chaque H a une charge de +1 • eg. ; dans le péroxyde d’hydrogène, chaque O a un nombre d’oxydation de seulement -1 car chaque O prend un électron d’un H mais ils partagent parfaitement les deux électrons entre les deux O`s • dans un composé qui contient le F, le F est toujours -1 car il est l’élément le plus électronégatif (et il ne se lie jamais à lui-même, sauf dans le F 2

Les règles d’écriture des structures de Lewis • étape 1: établir la structure squelettique du composé en utilisant les symboles chimiques et en plaçant côte à côte les atomes liés • en cas de doute, en général, l’atome le moins électronégatif occupe la position centrale • étape 2: compter le nombre total d’électrons de valence • dans le cas d’un anion, ajouter le nombre de charges négatives au total • dans le cas d’un cation, soustraire le nombre de charges positives du total

Les règles d’écriture des structures de Lewis • étape 3: tracer une liaison simple covalente entre l’atome central et chacun des atomes qui l’entourent • autant que possible, compléter les octets des atomes liés à l’atome central (sauf pour les hydrogènes, qui demandent seulement deux électrons) • le nombre d’électrons à la fin de cette étape doit être celui qu’on a déterminé dans l’étape 2 • étape 4: si la règle de l’octet n’est pas respectée par un atome, essayer de faire des liaisons doubles entre celui-ci et les atomes voisins, en utilisant les doublets libres de ces derniers

Les structures de Lewis • Exemple: Ecrivez la structure de Lewis de l’ion carbonate (CO 32 -). • Solution: • étape 1: le C est l’atome central car il est l’élément le moins électronégatif • étape 2: il y a (3)(6) + (1)(4) + 2 = 24 électrons • étape 3: • étape 4: le C n’a pas un octet donc on utilise un doublet libre d’un O (les 3 sont équivalents) pour former une liaison double entre le C et un O

Les structures de Lewis • Exemple: Ecrivez la structure de Lewis de l’ion nitrite (NO 2 -). • Solution: • étape 1: le N est l’atome central car il est l’élément le moins électronégatif • étape 2: il y a (2)(6) + (1)(5) + 1 = 18 • étape 3: • étape 4: le N n’a pas un octet donc on utilise un doublet libre d’un O (les 2 sont équivalents) pour former une liaison double entre le N et un O

La charge formelle et les structures de Lewis • pour un atome isolé, le nombre d’électrons qui lui sont associés correspond au nombre d’électrons de valence qu’il possède • dans une molécule, un atome possède les deux électrons dans chaque doublet libre qu’il possède, mais pour les doublets liants qui sont partagés entre deux atomes, un atome possède seulement la moitié du doublet liant • la charge formelle d’un atome dans une molécule est la différence entre le nombre d’électrons de valence contenu dans un atome isolé et le nombre d’électrons associés à ce même atome dans une structure de Lewis

La charge formelle et les structures de Lewis • charge formelle = nombre total d’électrons de valence dans l’atome isolé - nombre total d’électrons non-liants - 1/2 (nombre total d’électrons liants) • dans le cas d’une molécule neutre, la somme des charges formelles doit être zéro • dans le cas d’un ion, la somme des charges formelles doit être égale à la charge de l’ion • N. B. les charges formelles ne représentent pas la distribution réelle des charges dans une molécule • eg. ; pour le H 2 O, il n’y a pas de charges formelles mais on sait que l’électronégativité de l’O est plus haute que celle de H, donc l’O porte une petite charge négative et les H’s portent des petites charges positives

La charge formelle et les structures de Lewis • Exemple: Déterminez les charges formelles dans l’ion carbonate. • Solution: – pour l’atome C: – pour l’atome O dans C=O – pour l’atome O dans C-O – N. B. la somme des charges formelles (-2) est la charge de l’ion

La charge formelle et les structures de Lewis • si on a plusieurs structures de Lewis qui obéissent la règle de l’octet, on peut utiliser les charges formelles pour déterminer quelle structure est la meilleure • dans le cas d’une molécule neutre, une structure de Lewis qui ne comprend aucune charge formelle est préférable à une autre qui en comprend • une structure de Lewis qui comprend des charges formelles élevées ( 2, 3, etc. ) est moins plausible qu’une autre dans laquelle ces charges sont plus petites • si les structures de Lewis ont une distribution similaire de charges formelles, la plus plausible est celle dans laquelle les charges formelles négatives sont placées sur les atomes les plus électronégatifs

La charge formelle et les structures de Lewis • Exemple: Laquelle des structures de Lewis pour N 2 O est la meilleure? • Solution: La troisième structure est la pire structure car le N terminal possède une charge de -2. La première structure est meilleure que la deuxième car l’O est plus électronégatif que le N et la première place la charge formelle négative sur l’O tandis que la deuxième la place sur le N.

Le concept de résonance • si on regarde, par exemple, une molécule comme l’ozone, O 3, on a deux structures de Lewis différentes, mais équivalentes • chaque structure de Lewis prédit que l’ozone a une liaison double O=O et une liaison simple O-O • cependant, on constate expérimentalement que les deux liaisons O-O dans l’ozone sont équivalentes (même longueur, même force) • en réalité, l’ozone est une combinaison des deux structures de Lewis

Le concept de résonance • la résonance est l’utilisation de deux ou de plusieurs structures de Lewis pour représenter une molécule donnée • chacune des structures de Lewis est appelée une structure de résonance • le symbole indique les structures illustrées sont des structures de résonance • expérimentalement, on trouve que les liaisons dans l’ozone sont plus courtes et plus fortes que la liaison simple O-O dans le H 2 O 2 mais ils sont plus longues et plus faibles que la liaison double O=O dans le O 2

Le concept de résonance • il ne faut pas croire qu’une molécule comme l’ion carbonate passe successivement et rapidement de l’une à l’autre de ses structures de résonance • aucune des structures de résonance représente adéquatement la molécule réelle • on utilise le concept de la résonance pour expliquer pourquoi les trois liaisons C-O dans l’ion carbonate sont toutes identiques • N. B. si on change la position des atomes entre deux structures de Lewis, ceci n’est pas une résonance (plutôt, on a deux molécules distinctes)

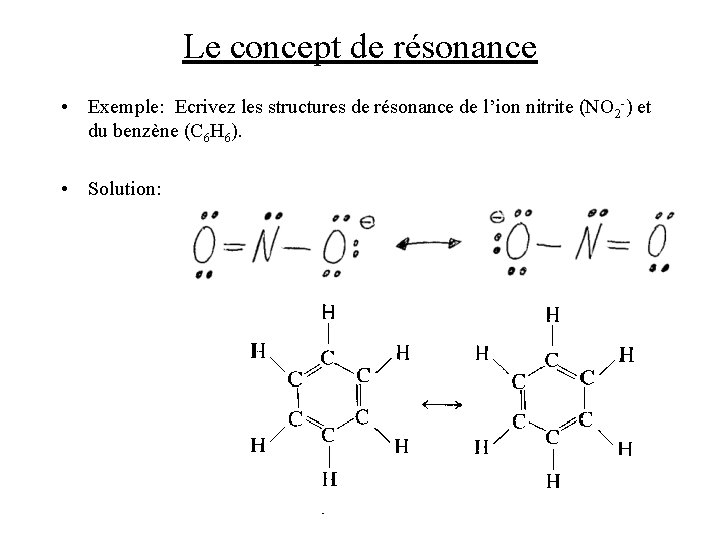
Le concept de résonance • Exemple: Ecrivez les structures de résonance de l’ion nitrite (NO 2 -) et du benzène (C 6 H 6). • Solution:

Les exceptions à la règle de l’octet: l’octet incomplet • dans certains composés, il est impossible de combler l’octet d’un atome • eg. ; à l’état gazeux, le Be. H 2 forme des molécules distinctes H-Be-H où seulement quatre électrons entrourent le Be et il est impossible de combler son octet • eg. ; le BF 3 est un molécule relativement stable • même si les trois dernières structures de résonance comblent l’octet du B, les expériences indiquent que la première structure de résonance domine

Les exceptions à la règle de l’octet: les molécules à nombre impair d’électrons • • certaines molécules contiennent un nombre impair d’électrons ces molécules sont des radicals libres et sont typiquement très réactives avec un nombre impair d’électrons, il est impossible d’obéir la règle de l’octet des exemples de telles molécules sont • l’oxyde d’azote: • le dioxyde d’azote: • l’anion superoxyde:

Les exceptions à la règle de l’octet: l’octet étendu • si l’atome central est de la troisième période (ou même plus bas dans le tableau périodique), les orbitales d de l’atome central peuvent participer aux liaisons covalentes • ces orbitales d permettent à l’atome central d’accomoder plus de huit électrons, soit un octet étendu • N. B. même si un atome peut avoir un octet étendu, il peut toujours choisir d’obéir la règle de l’octet • des exemples de telles molécules sont: l’hexafluorure du soufre le pentafluorure de phosphore

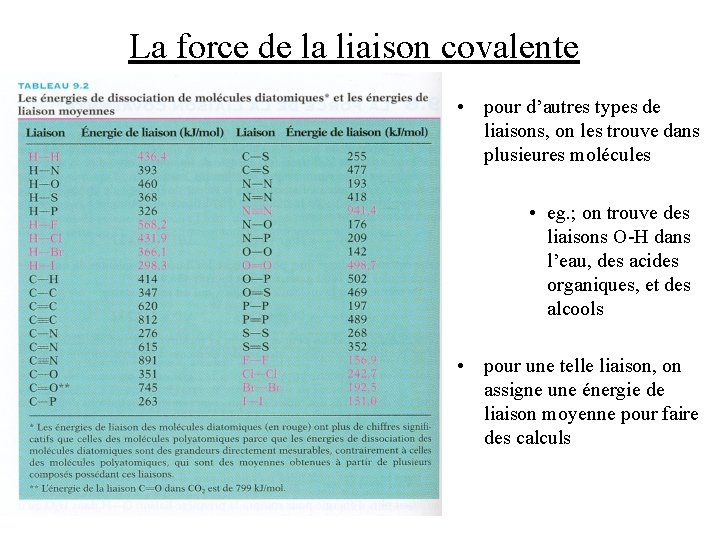
La force de la liaison covalente • l’énergie de liaison est la variation d’enthalpie requise pour rompre une liaison particulière dans une mole de molécules à l’état gazeux • eg. ; H 2(g) H(g) + H(g) Cl 2(g) Cl(g) + Cl(g) HCl(g) H(g) + Cl(g) Ho = +436. 4 k. J Ho = +242. 7 k. J Ho = +431. 9 k. J donc les énergies de liaison H-H, Cl-Cl, et H-Cl sont 436. 4 k. J, 242. 7 k. J, et 431. 9 k. J, respectivement • pour les liaisons qui existent seulement dans un diatomique unique, il est évident comment obtenir les énergies de liaison

La force de la liaison covalente • pour d’autres types de liaisons, on les trouve dans plusieures molécules • eg. ; on trouve des liaisons O-H dans l’eau, des acides organiques, et des alcools • pour une telle liaison, on assigne une énergie de liaison moyenne pour faire des calculs

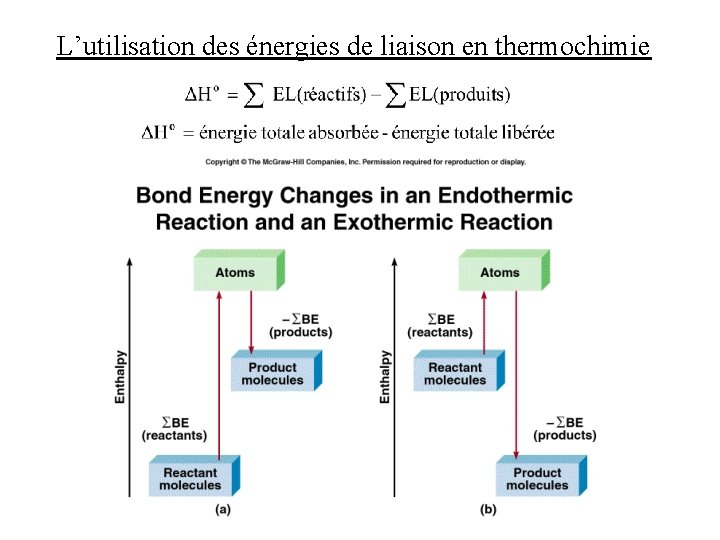
L’utilisation des énergies de liaison en thermochimie • la plupart des réactions chimiques impliquent la formation et la rupture de liaisons • on peut utiliser des énergies de liaison pour estimer les variations d’enthalpie des réactions qui se déroulent entièrement en phase gazeuse • parce qu’on néglige les forces intermoléculaires, les énergies de liaison ne sont pas suffisantes par elles-mêmes pour des réactions impliquant des solides et des liquides • pour estimer la variation d’enthalpie d’une réaction, on compare la somme des énergies de liaison des réactifs avec la somme des énergies de liaison dans les produits • si la première somme est plus grande que la deuxième, la réaction est endothermique • si la deuxième somme est plus grande que la première, la réaction est exothermique

L’utilisation des énergies de liaison en thermochimie

L’utilisation des énergies de liaison en thermochimie • Exemple: Soit la réaction H 2(g) + C 2 H 4(g) C 2 H 6(g) Estimez la variation d’enthalpie de cette réaction en utilisant les énergies de liaison données dans le tableau • Solution: • les réactifs contiennent une liaison H-H (436 k. J), une liaison C=C (620 k. J), et quatre liaisons C-H (414 k. J) • les produits contiennent une liaison C-C (347 k. J) et six liaisons C-H (414 k. J) • Ho = (1)(436 k. J) + (1)(620 k. J) + (4)(414 k. J) - (1)(347 k. J) - (6)(414 k. J) • Ho = -119 k. J (N. B. , la valeur exacte est -137 k. J)


 Traceur chimique
Traceur chimique Procédé chimique
Procédé chimique Espèce chimique naturelle exemple
Espèce chimique naturelle exemple L'affinité chimique
L'affinité chimique Famille chimique
Famille chimique Poisson composition
Poisson composition Déplacement chimique
Déplacement chimique Formule chimique basalte
Formule chimique basalte Potentiel chimique
Potentiel chimique Elmet berango
Elmet berango Absorption intestinale
Absorption intestinale équilibre chimique
équilibre chimique Digestion chimique
Digestion chimique Flu produit chimique
Flu produit chimique Risque chimique définition
Risque chimique définition Formule chimique c
Formule chimique c Procédé chimique
Procédé chimique Famille chimique
Famille chimique H y h tipo de enlace
H y h tipo de enlace Enlace covalente
Enlace covalente Ligação covalente so3
Ligação covalente so3 Enlace covalente polar
Enlace covalente polar Teoria vsepr
Teoria vsepr Ligação covalente
Ligação covalente Forças de ligação
Forças de ligação Ligação covalente
Ligação covalente Tetrahédrica
Tetrahédrica Enlace covalente polar ejemplos
Enlace covalente polar ejemplos Legame covalente dativo
Legame covalente dativo Cci estructura de lewis
Cci estructura de lewis Regla del octeto ejemplos
Regla del octeto ejemplos Ambroslena
Ambroslena Geometria molecular
Geometria molecular Legaturi covalente coordinative
Legaturi covalente coordinative Enlace covalente coordinado
Enlace covalente coordinado Tipos de redes cristalinas
Tipos de redes cristalinas Hio4 lewis
Hio4 lewis