UNIVERSIDADE Ligaes Qumicas FEDERAL DO ACREUFAC PETAGRONOMIA Tutor



















- Slides: 32

UNIVERSIDADE Ligações Químicas. FEDERAL DO ACRE-UFAC PET-AGRONOMIA Tutor: Dr. José Ribamar Silva. Bolsistas: Éllen, Sonaira, Ingrid. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

Ligações Químicas Maioria dos elementos químicos são instáveis no estado de átomo isolado. São estáveis gases nobres (He, Ne, Ar, Kr, Xe, Rn) n e- na C. V. 2 8 8 8 Átomos se ligam em busca da estabilidade química Teoria do Octeto Átomos ligam-se transferindo ou compartilhando elétrons da última camada em busca da estabilidade (configuração semelhante a de um gás nobre). ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

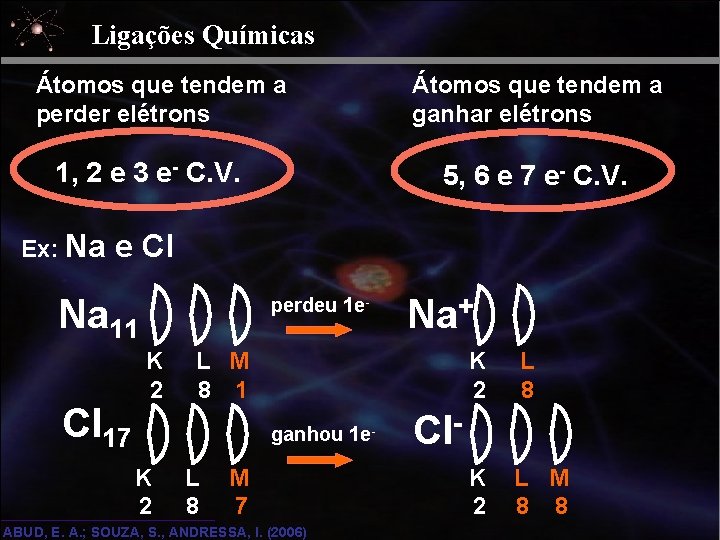
Ligações Químicas Átomos que tendem a perder elétrons 1, 2 e 3 e- C. V. Ex: Na Átomos que tendem a ganhar elétrons 5, 6 e 7 e- C. V. e Cl Na 11 Cl 17 perdeu 1 e- K 2 L M 8 1 ganhou 1 e- K 2 Na+ L 8 M 7 ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) K 2 L 8 K 2 L M 8 8 Cl-

Ligações Químicas COMO OS ÁTOMOS SE LIGAM? Transferindo ou compartilhando elétrons da última camada. TIPOS DE LIGAÇÕES: 1) Ligação Iônica 2) Ligação Covalente (Simples) 3) Ligação Covalente Coordenada ou Dativa 4) Ligação Metálica ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

Ligações Químicas CARACTERÍSTICAS: Transferência de elétrons de um átomo para outro. OCORRE ENTRE: - Metais e Não Metais - Hidrogênio e Metais Formam íons • Positivos cátions (perdem e-) • Negativos ânions (ganham e-) ÍONS Átomos ou grupo eletricamente. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) de átomos carregados

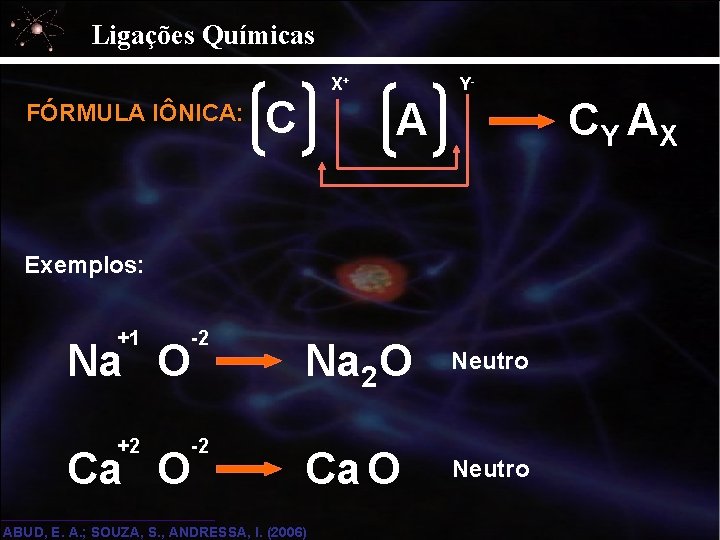
Ligações Químicas FÓRMULA IÔNICA: X+ C Y- A CY AX Exemplos: +1 -2 Na O Na 2 O Neutro +2 -2 Ca O Neutro Ca O ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

Ligações Químicas Exemplos de Ligações Iônicas: I) Na 11 e Cl 17 (Metal e Não Metal) Camada de Valência L C. V. Na 11 1 s 2 2 p 6 3 s 1 K 2 L 8 M 1 Família: 1 A (perde e-) ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) K Na M

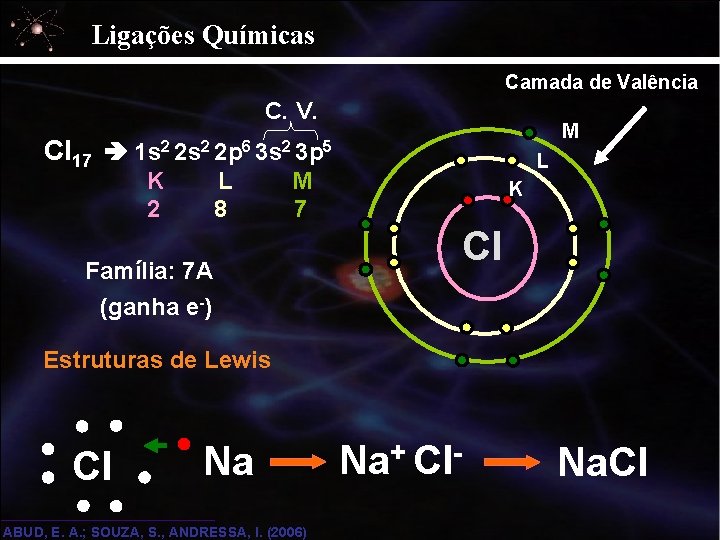
Ligações Químicas Camada de Valência C. V. M Cl 17 1 s 2 2 p 6 3 s 2 3 p 5 K 2 L 8 L M 7 K Cl Família: 7 A (ganha e-) Estruturas de Lewis Cl Na ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) Na+ Cl- Na. Cl

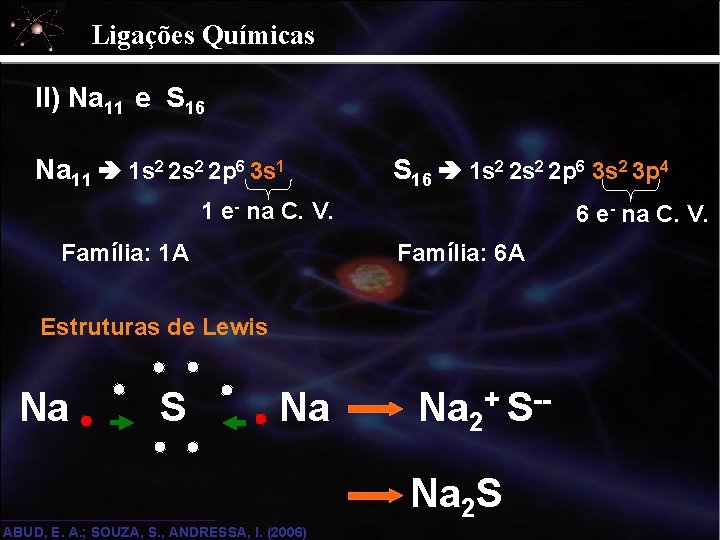
Ligações Químicas II) Na 11 e S 16 Na 11 1 s 2 2 p 6 3 s 1 S 16 1 s 2 2 p 6 3 s 2 3 p 4 1 e- na C. V. Família: 1 A 6 e- na C. V. Família: 6 A Estruturas de Lewis Na S Na Na 2+ S-Na 2 S ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

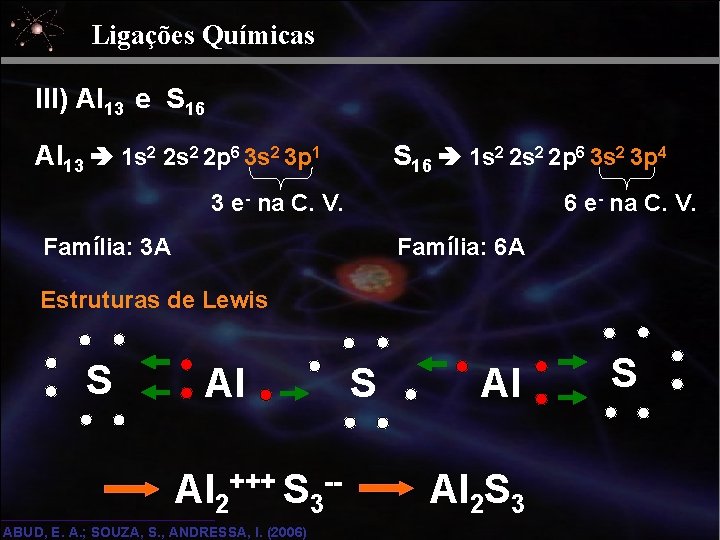
Ligações Químicas III) Al 13 e S 16 Al 13 1 s 2 2 p 6 3 s 2 3 p 1 S 16 1 s 2 2 p 6 3 s 2 3 p 4 3 e- na C. V. 6 e- na C. V. Família: 3 A Família: 6 A Estruturas de Lewis S Al Al 2+++ S 3 -- ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) S Al Al 2 S 3 S

Ligações Químicas PROPRIEDADES DOS COMPOSTOS IÔNICOS: Sólidos à temperatura ambiente; Elevados pontos de fusão e de ebulição; Conduzem a corrente elétrica no estado fundido ou em solução; Têm como melhor solvente a água. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) Cloreto de sódio e Sulfato de cobre. Cloreto de níquel, Dicromato de potássio e Cloreto de cobalto.

Ligações Químicas CARACTERÍSTICA: Compartilhamento de e- entre os átomos participantes da ligação química. OCORRE ENTRE: - Não Metal e Não Metal - Hidrogênio e Não Metais Moléculas MOLÉCULA Conjunto de átomos unidos por ligações covalentes. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

Ligações Químicas DIVIDIDA EM: LIGAÇÃO COVALENTE SIMPLES LIGAÇÃO COVALENTE COORDENADA (DATIVA) Características: - Compartilhamento de elétrons; - O par eletrônico é formado por 1 elétron de cada átomo participante da ligação. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

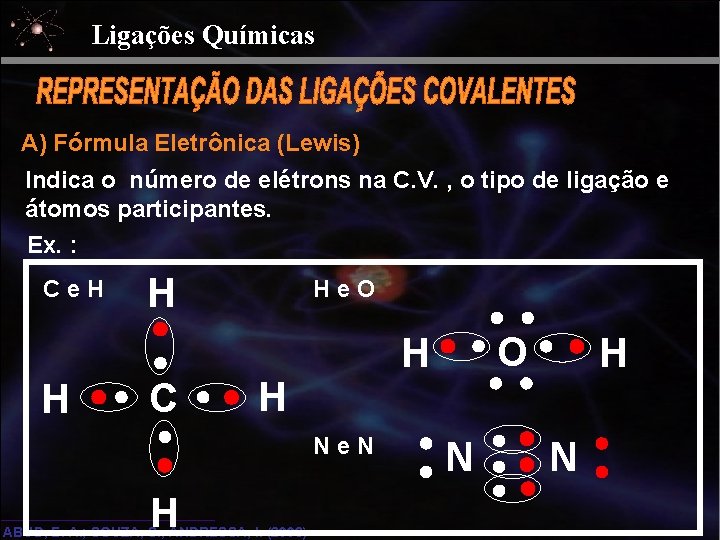
Ligações Químicas A) Fórmula Eletrônica (Lewis) Indica o número de elétrons na C. V. , o tipo de ligação e átomos participantes. Ex. : Ce. H H H C He. O H Ne. N H ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) O H N

Ligações Químicas B) Fórmula Estrutural Ex. : H H C O H H N N Indica o número de átomos e os pares de elétrons compartilhados (tipo de ligação). ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

Ligações Químicas Tipos de ligações Simples A B Dupla A B Tripla A B N˚ de pares eletrônicos Orbitais moleculares Exemplos 1 sigma (σ) H H H Cl 2 sigma (σ) pi (π) 3 sigma (σ) 2 pi (π) ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) O C N O N

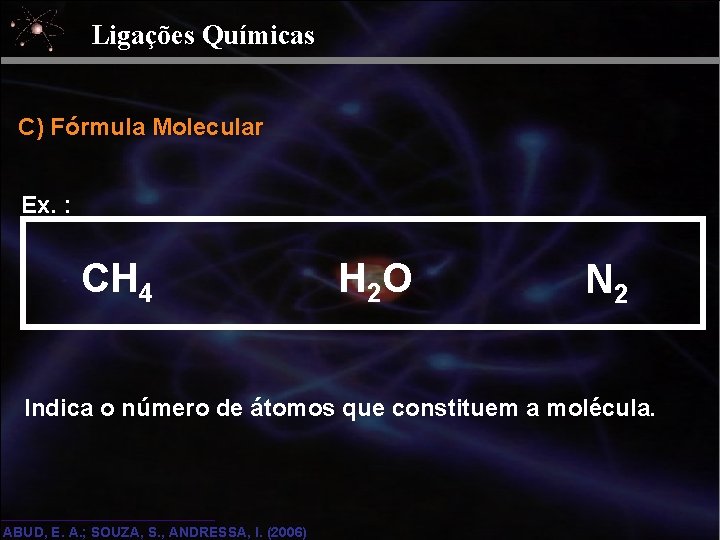
Ligações Químicas C) Fórmula Molecular Ex. : CH 4 H 2 O N 2 Indica o número de átomos que constituem a molécula. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

Ligações Químicas Ocorre entre: Não metal e não metal; Hidrogênio e não metais; - Átomos que precisam receber elétrons; CARACTERÍSTICA DA LIGAÇÃO DATIVA: Compartilhamento de elétrons em que o par eletrônico pertence a um só dos átomos. O átomo ao realizar ligação covalente dativa encontrase estabilizado e contém pares de elétrons livres; A ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

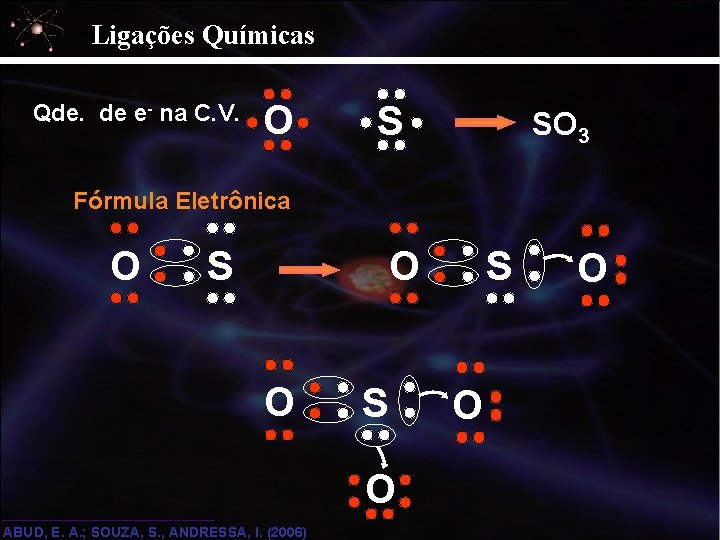
Ligações Químicas Covalente Simples x Dativa A B C Ligação covalente simples D Ligação covalente dativa Exemplos de Ligações Covalentes Coordenadas: M L 1) SO 3 K S 16 1 s 2, 2 p 6, 3 s 2, 3 p 4 6 e- na C. V. L K O 8 1 s 2, 2 p 4 6 e- na C. V. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) O S

Ligações Químicas Qde. de e- na C. V. O S SO 3 Fórmula Eletrônica O O S O ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) S O O

Ligações Químicas Fórmula Estrutural O S Fórmula Molecular O SO 3 O ð Na fórmula estrutural: - Ligação covalente simples Traço ( - Ligação covalente dativa uma seta ( ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) ) ).

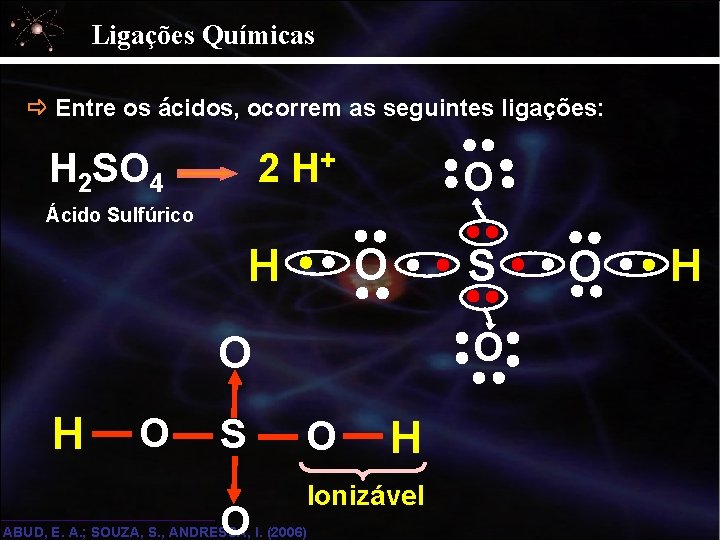
Ligações Químicas Entre os ácidos, ocorrem as seguintes ligações: 2 H+ O H 2 SO 4 Ácido Sulfúrico O H S O O H O S O O H Ionizável ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) O H

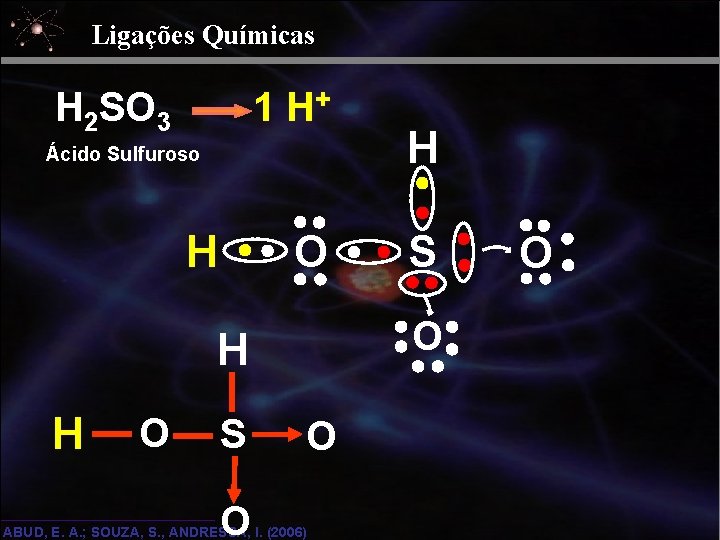
Ligações Químicas 1 H+ H 2 SO 3 Ácido Sulfuroso O H O S O H H H O ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) O

Ligações Químicas 1) Identifique em qual dos compostos abaixo ocorrem ligações dativas e quantas são: a) CO 2 b) SO 2 Estrutura Eletrônica O C O O S O Fórmula Estrutural O C O 4 ligações cov. simples ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) O S O 2 ligações cov. Simples 1 ligação dativa

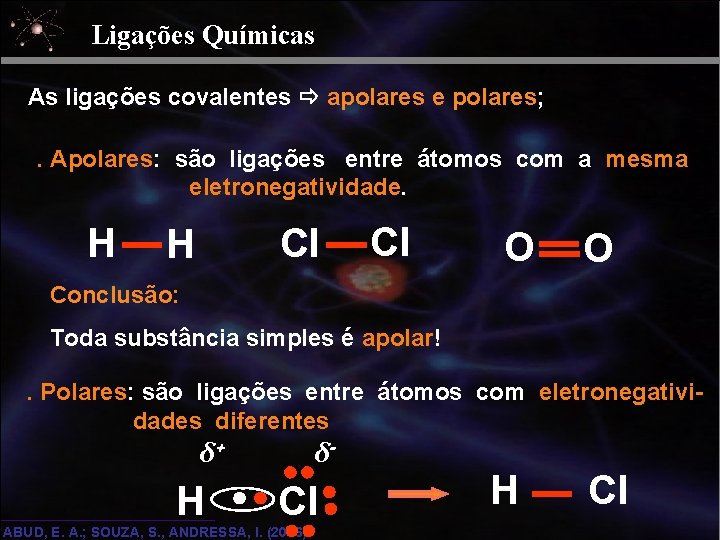
Ligações Químicas As ligações covalentes apolares e polares; . Apolares: são ligações entre átomos com a mesma eletronegatividade. H Cl O O Conclusão: Toda substância simples é apolar!. Polares: são ligações entre átomos com eletronegatividades diferentes δ+ H δ- Cl ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) H Cl

Ligações Químicas Polaridade x Nº de nuvens eletrônicas Se o número de nuvens for igual ao número de átomos ligados ao átomo central: molécula apolar; CO 2 O C O Se o número de nuvens for diferente do número de átomos ligados ao átomo central : molécula polar; SO 2 O S O Conclusão: Substância composta pode ser polar ou apolar. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

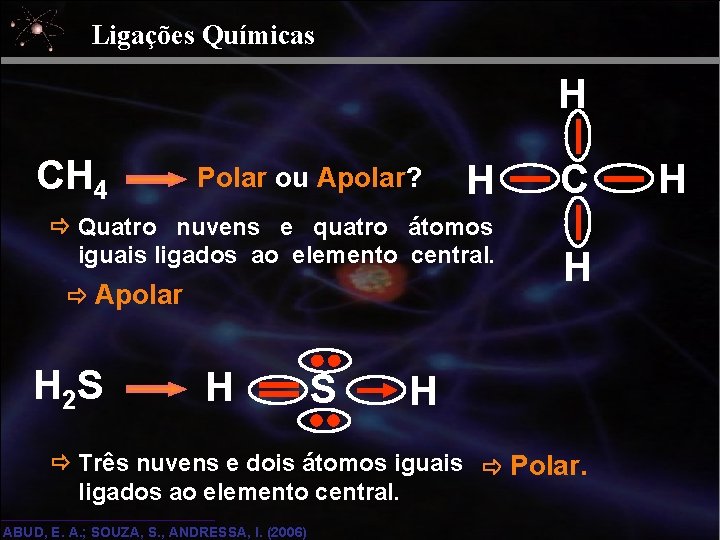
Ligações Químicas H CH 4 Polar ou Apolar? H Quatro nuvens e quatro átomos iguais ligados ao elemento central. Apolar H 2 S H S C H H Três nuvens e dois átomos iguais Polar. ligados ao elemento central. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) H

Ligações Químicas Ocorre entre: Metais e Metais; Metais e Semi-metais; CARACTERÍSTICAS: Os materiais resultante da ligação caracterizam-se por: metálica Serem bons condutores de eletricidade. Na ligação de metais com metais ou semi-metais formam-se as ligas metálicas; ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

Ligações Químicas Exemplos de ligas metálicas: Bronze: Cu + Sn Latão: Cu + Zn Solda: Pb + Sn Aço inoxidável: Fe + Cr + Ni ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

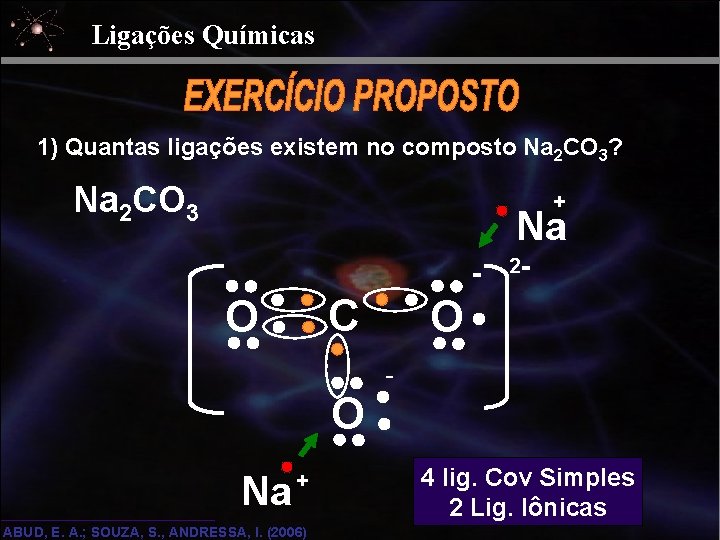
Ligações Químicas 1) Quantas ligações existem no composto Na 2 CO 3? Na 2 CO 3 + Na - C O O Na + ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006) 2 - O - 4 lig. Cov Simples 2 Lig. Iônicas

Ligações Químicas - Ligações químicas Estabilidade química dos átomos. - Ligações químicas Formação de utilizados na vida cotidiana; compostos muito . Ligação iônica: Todos os sais. Ex. : Na. Cl, Adubos. . Ligação covalente simples: H 2 O. Ligação covalente dativa: SO 3. Ligação metálica: aço inoxidável: Fe + C+ Cr + Ni ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)

Ligações Químicas Obrigada pela Atenção ! Éllen, Sonaira, Ingrid. ABUD, E. A. ; SOUZA, S. , ANDRESSA, I. (2006)