Liaison chimique Xavier Assfeld Laboratoire de Chimie thorique

Liaison chimique Xavier Assfeld Laboratoire de Chimie théorique Entrée 2 A, 7ème niveau

Ouvrages de références - 1 • Les incontournables: – « Les orbitales moléculaires en chimie » , Y. Jean et F. Volatron. Mc. GRAW-HILL – « Structure électronique des molécules » , Y. Jean et F. Volatron. EDISCIENCE – « Atomistique et liaison chimique » , Y. Jean et F. Volatron. EDISCIENCE – « Chimie 1. BIO-VETO » , P. Grécias et J. -P. Migeon. LAVOISIER

Des atomes aux molécules (2) • Séparation cœur/valence • nombre d’électrons de valence = numéro de la colonne • nom de famille : alcalins, alcalinoterreux, . . pnictogènes, chalcogènes, halogènes, gaz rares. • Les gaz rares sont chimiquement inertes : saturation de la couche de valence (Cl + e Cl ) • Notion d’électronégativité (c)

Des atomes aux molécules (3) • « plus un atome a tendance à attirer les électrons, plus il est électronégatif. » (il cherche à posséder la structure électronique du gaz rare le plus proche) G. R. c

Des atomes aux molécules (4) • Modèle de Lewis (1915) : « La liaison entre deux atomes provient de la mise en commun de deux électrons de valence. » – paire de liaison : H • + • H H—H H H • • H • • C • • H H—C—H • • H H

Des atomes aux molécules (5) –paire libre : H H • • H—N| H • • N • • H H La structure de Lewis d’une molécule ne donne aucune indication sur sa géométrie spatiale.
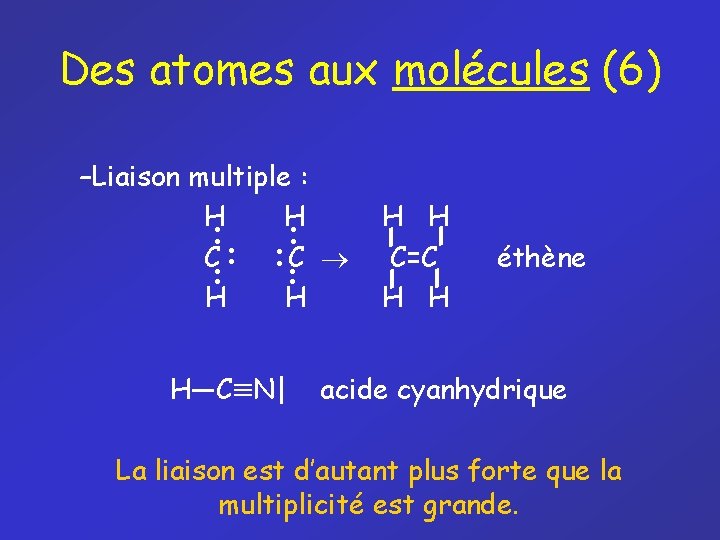
Des atomes aux molécules (6) –Liaison multiple : H • • • C • • H H H—C N| H H C=C H H éthène acide cyanhydrique La liaison est d’autant plus forte que la multiplicité est grande.

Des atomes aux molécules (7)

Des atomes aux molécules (8) — — |N—N| ou |N — N| ou N N? — — — • Règle de l’octet : « la stabilité maximale d’une molécule est obtenue lorsque chaque atome (sauf H ou He) est entouré de quatre paires d’électrons. »

Des atomes aux molécules (9) • Exceptions à la règle de l’octet. – Molécules hypovalentes : BH 3, Be. H 2, . . . – Molécules hypervalentes : Br. F 5, PCl 5, CLi 6, . . . – Règle de l’octet étendu pour les métaux de transition (18 électrons) : Zn. Cl 42 , . . .

Des atomes aux molécules (10) • Charges formelles : – liaisons datives : H 3 N + BH 3 ? – Compter les électrons « entourant » un atome et comparer avec le nombre d’électrons de valence. Ne pas confondre avec le décompte pour l’octet

Des atomes aux molécules (11) • Radicaux, Acides et Bases de Lewis – radicaux : électron non apparié (NH 2, OH, …) – acides : défaut d’au moins une paire libre par rapport à l ’octet – bases : possède au moins une paire libre

Des atomes aux molécules (12) • Limites diagrammes de Lewis – liaisons délocalisées, résonance, mésomèrie Exercice : Donner un diagramme de Lewis de l’acide nitreux (HNO 2) en accord avec la réalité expérimentale (2 liaisons N—O équivalentes)

Des atomes aux molécules (13) Deux formes mésomères limites qui résonnent Liaisons délocalisées

Des atomes aux molécules (14) Le benzène C 6 H 6. Formes de Kékulé

Des atomes aux molécules (14) Le benzène C 6 H 6. Formes de Kékulé • d(C–C) = 140 pm • d(C 2 H 6) = 154 pm • d(C 2 H 4) = 134 pm • d(C 2 H 2) = 120 pm Trois doubles liaisons délocalisées.

Des atomes aux molécules (15) Règles de sélection des formes mésomères. • Essayer de respecter la règle de l’octet • Faire apparaître un maximum de liaisons • Eviter les charges formelles trop nombreuses

Des atomes aux molécules (19) Le passage à la troisième dimension : l’arrangement spatial des atomes ! Modèle VSEPR (Gillespie 1992) « Autour de chaque atome, les paires d’électrons de valence (libres ou de liaison) s’éloignent le plus possible les unes des autres afin de minimiser leur répulsion électrostatique. »

Des atomes aux molécules (20) • Nomenclature : molécule AXn. Em A : atome central ; X : atome lié à A ; E : paire libre sur A • AXo. Yp. Em AXn. Em n = o + p • Les liaisons multiples ne forment qu’un seul domaine de répulsion.

Des atomes aux molécules (21) AXn. Em

Des atomes aux molécules (22) n+m=2 AX 2 : Be. H 2, Mg. Cl 2, CO 2, … linéaire n+m=3 triangulaire AX 3 : BH 3, Al. Cl 3, CO 32 , … AX 2 E : O 3, SO 2, … coudée
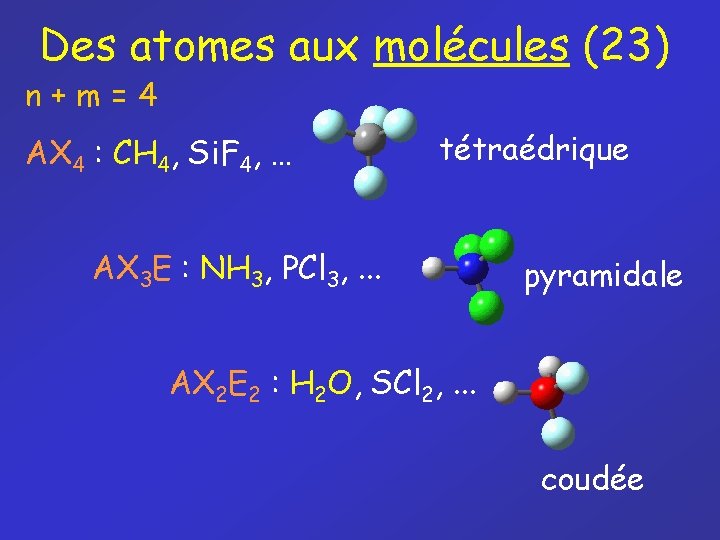
Des atomes aux molécules (23) n+m=4 AX 4 : CH 4, Si. F 4, … tétraédrique AX 3 E : NH 3, PCl 3, . . . pyramidale AX 2 E 2 : H 2 O, SCl 2, . . . coudée
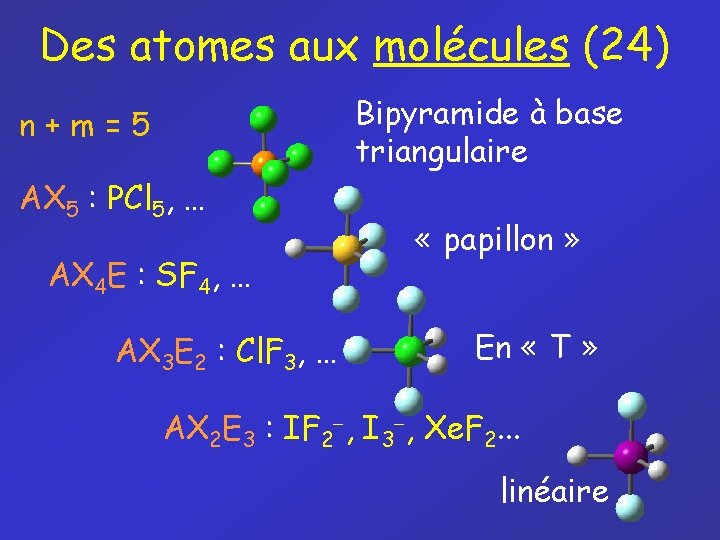
Des atomes aux molécules (24) Bipyramide à base triangulaire n+m=5 AX 5 : PCl 5, … AX 4 E : SF 4, … AX 3 E 2 : Cl. F 3, … « papillon » En « T » AX 2 E 3 : IF 2 , I 3 , Xe. F 2. . . linéaire
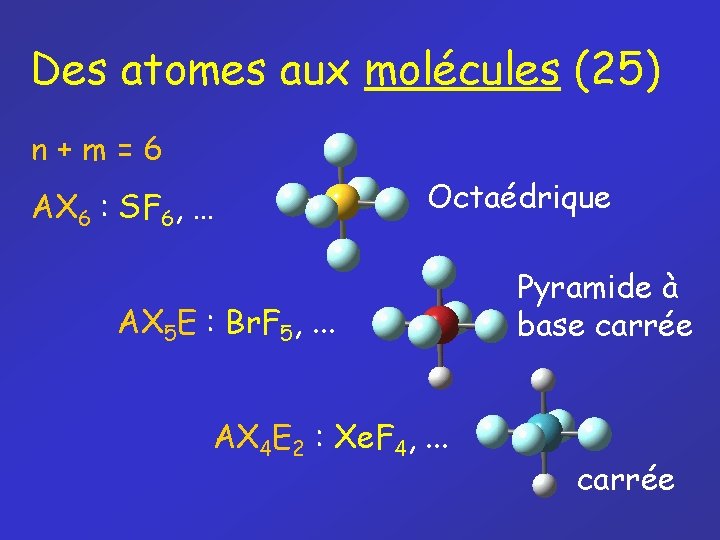
Des atomes aux molécules (25) n+m=6 AX 6 : SF 6, … Octaédrique AX 5 E : Br. F 5, . . . AX 4 E 2 : Xe. F 4, . . . Pyramide à base carrée

Des atomes aux molécules (26) n+m=7 AX 7 : IF 7, … Bipyramide à base pentagonale

Des atomes aux molécules (27) Subtilités : • répulsion n-n > n-l > l-l (n : paire libre ; l : paire liée)

Des atomes aux molécules (28) Influence de la mésomérie. Aniline Exercice : à l’aide des modèles de Lewis et VSEPR, expliquer pourquoi l’angle H-N-H vaut 113, 2° dans l’aniline, alors qu ’il vaut 107, 3° dans NH 3 et 120° dans l’ion iminium (H 2 CNH 2+).

Des atomes aux molécules (29) Limites du modèle VSEPR. • Pourquoi Si. H 3 est pyramidal et CH 3 plan ? • Pourquoi Ca. F 2 est coudé ? • Pourquoi C 2 H 4 est plan ? • Pourquoi BH 2 est linéaire ou coudé suivant qu’il est irradié par la lumière ? • . . .

Liens Web VSEPR : http: //neon. chem. ox. ac. uk/vrchemistry/ vsepr/intro/vsepr_splash. html

Des atomes aux molécules (30) • Moments dipolaires électriques. Grandeur vectorielle qui n’a de sens que pour les systèmes électriquement neutres. Si le barycentre des charges positives, chargé +q, ne correspond pas au barycentre des charges négatives, chargé q, la norme du moment dipolaire est égale au produit de la charge q par la distance d entre les barycentres.

Des atomes aux molécules (31) q en coulomb (C) d en mètre (m) m en C. m ou en Debye (D) 1 D = 3, 3. 10 30 C. m Les atomes isolés n’ont pas de moment dipolaire. Les molécules diatomiques homonucléaires non plus. Les molécules diatomiques hétéronucléaires ont un moment dipolaire non nul.

Des atomes aux molécules (32) L’atome le plus électronégatif a un excès d’électrons (charge électrique q) • q = 0 liaison purement covalente • q 0 liaison polaire • q = n. e liaison purement ionique
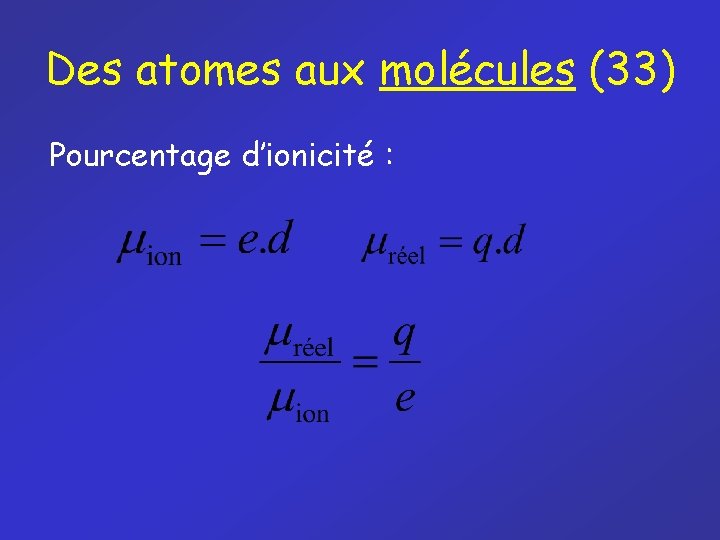
Des atomes aux molécules (33) Pourcentage d’ionicité :

Des atomes aux molécules (34) Molécules polyatomiques : ou en simplifiant : « le moment dipolaire moléculaire est égal à la somme vectorielle des moments dipolaires de liaison. » attention à la symétrie !

Des atomes aux molécules (35) Influence de la mésomérie. mexp : très faible et orienté de C vers O Règle : en général mésomérie > induction
- Slides: 35