Chimie 2 Equilibre chimique et p H du

Chimie 2 : Equilibre chimique et p. H du vivant Matériel : sol de soude et d’acide chlorhydrique c =0, 1 mol/L ; BBT , hélianthine et 4 béchers. Solution tampon à 4, 8 et eau distillée.

1. Equilibre chimique • Dans le cas d’une réaction limitée, l’état d’équilibre est atteint lorsque les concentrations finales des espèces n’évoluent plus. • Deux réactions inverses s’y produisent simultanément. Cet état final est un état 1 d'équilibre dynamique. 2
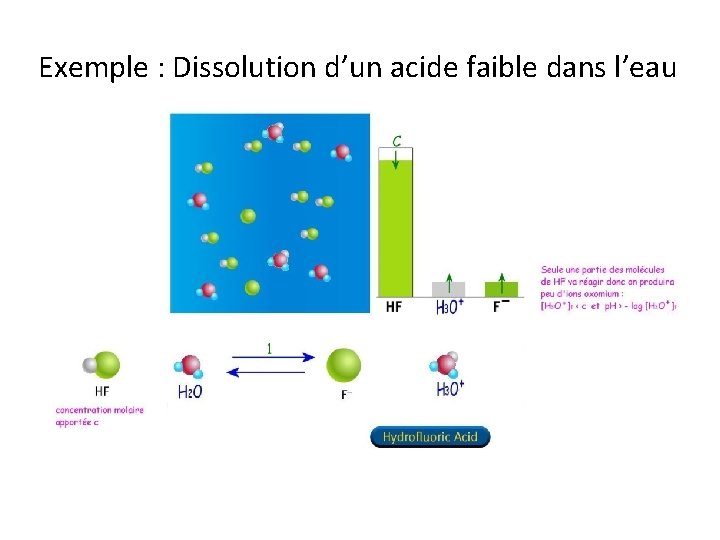
Exemple : Dissolution d’un acide faible dans l’eau

Equilibre final

2. Constante d'acidité • Tout couple Acide/Base, noté AH/A- est caractérisé par sa constante d’acidité Ka qui n’a pas d’unité, associée à la réaction acido-basique : AH(aq) + H 2 O(l) A-(aq) + H 3 O+(aq) • Le p. Ka est donné par la relation : p. Ka = - log Ka

Ka et p. Ka Une autre expression de la relation Ka = [H 3 O+]f. [A-]f / [AH]f On prend le log de cette relation : Log Ka = - p. H + log ([A-]f / [AH]f) Sachant que p. Ka = - log Ka -p. Ka = - p. H + log ([A-]f / [AH]f) Ce qui donne p. H = p. Ka + log ([A-]f / [AH]f)

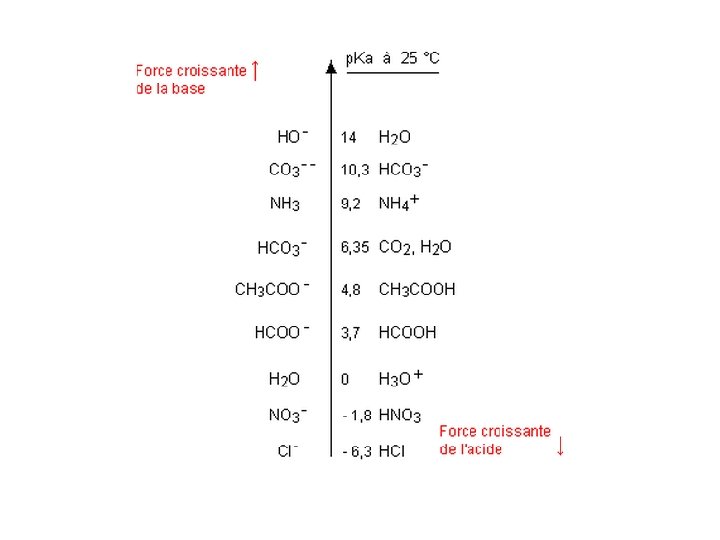
• Un acide est d’autant plus fort qu’il est plus dissocié dans l’eau (il produira plus de H 3 O+). • Plus la valeur du Ka d’un couple acide/base est petite, (plus celle du p. Ka est grande) plus l’acide est faible et inversement. • Une base est d’autant plus forte qu’elle est plus dissociée dans l’eau. • Plus la valeur du Ka d’un couple acide/base est petite, (plus celle du p. Ka est grande) plus la base est forte et inversement. • Le p. Ka d’un couple auquel appartient un acide fort est 0, celui d’un couple auquel appartient une base forte 14 à 25°C.

3. Domaines de prédominance • Une espèce X prédomine sur une espèce Y si [X] > [Y] • Le diagramme de prédominance se déduit de la relation :

• Pour p. H = p. Ka : AH et A- sont présents en concentrations égales, [AH] = [A-] • Pour p. H < p. Ka : A prédomine, [AH] > [A-] • Pour p. H > p. Ka : B prédomine, [AH] < [A-]
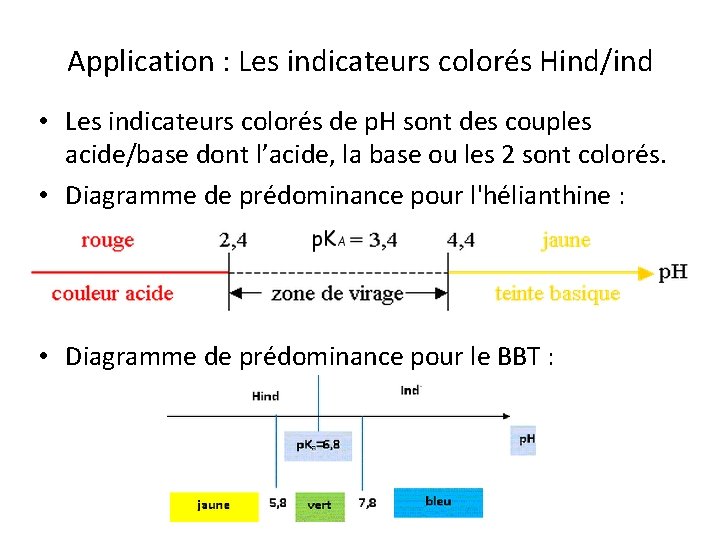
Application : Les indicateurs colorés Hind/ind • Les indicateurs colorés de p. H sont des couples acide/base dont l’acide, la base ou les 2 sont colorés. • Diagramme de prédominance pour l'hélianthine : • Diagramme de prédominance pour le BBT :

4. Familles chimiques • Un acide carboxylique de formule générale R -COOH est une molécule comportant un groupe carboxyle –COOH, c’est un acide faible dans l’eau. Sa base conjugué est un ions carboxylate R-COO-. • Une amine R-NH 2 comporte un groupe amine –NH 2, c’est une base faible dans l’eau. • Un acide -aminé comporte un groupe carboxyle et un groupe amine sur le même carbone. Il existe sous trois formes qui constituent 2 couples acide/base.
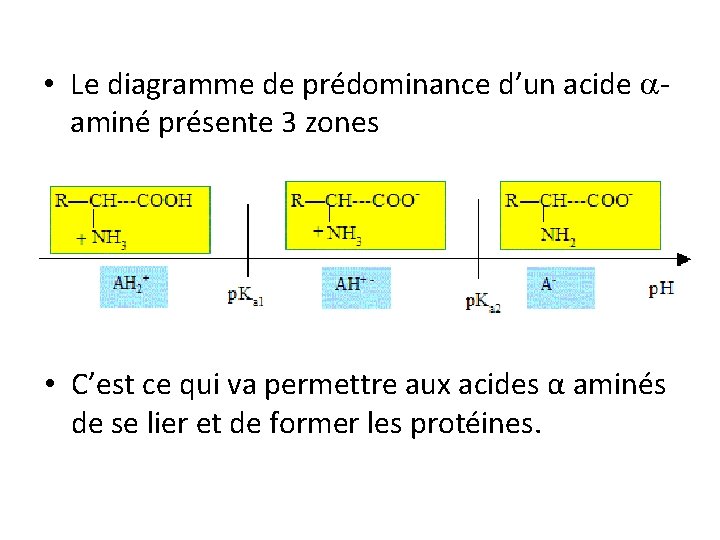
• Le diagramme de prédominance d’un acide aminé présente 3 zones • C’est ce qui va permettre aux acides α aminés de se lier et de former les protéines.

5. Solution tampon • Le p. H d’une solution tampon varie peu par addition d’une petite quantité d’acide ou de base, et par dilution modérée. • Une solution tampon est constituée d’un mélange en proportions voisines d’un acide faible et de sa base conjuguée. Le p. H contrôlé est alors proche du p. Ka du couple. (voir TP 2) • Le contrôle du p. H est fondamental pour de nombreux milieux biologiques.

Exemple : Le p. H du sang Le sang est un milieu tamponné, entre autre, par le couple acide carbonique H 2 CO 3 (ou CO 2, H 2 O) / ion bicarbonate HCO 3 - p. Ka = 6, 4
- Slides: 15