Molcules et Liaison chimique La liaison dans H



![La liaison ionique Na Na+ + ecoût: EI Résultat: [Ne] (+) Cl + e- La liaison ionique Na Na+ + ecoût: EI Résultat: [Ne] (+) Cl + e-](https://slidetodoc.com/presentation_image_h2/56f36ec49b39c5879278dc72d1008c4a/image-16.jpg)











- Slides: 50

Molécules et Liaison chimique

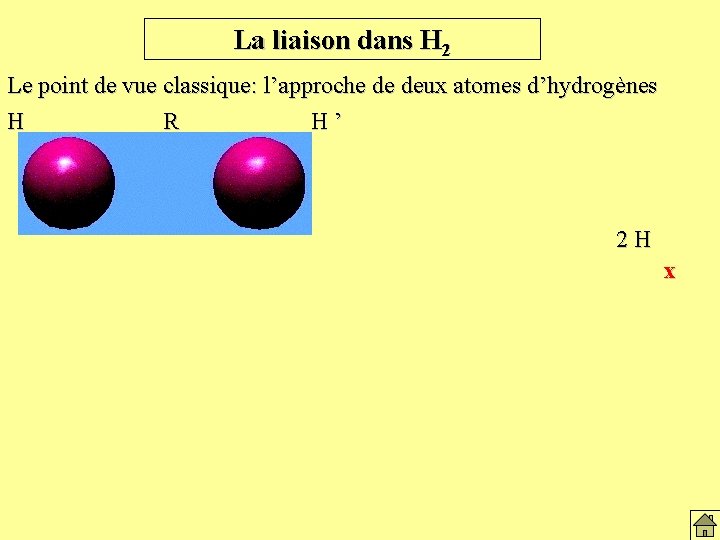
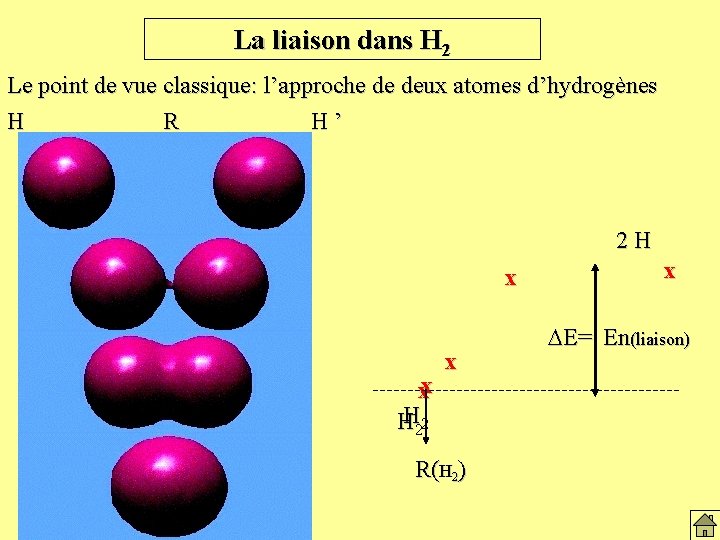
La liaison dans H 2 Le point de vue classique: l’approche de deux atomes d’hydrogènes H R H’ 2 H x

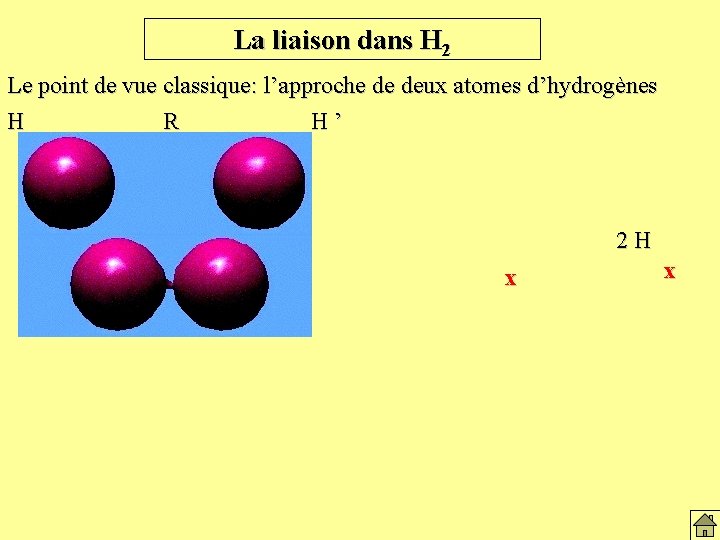
La liaison dans H 2 Le point de vue classique: l’approche de deux atomes d’hydrogènes H R H’ 2 H x x

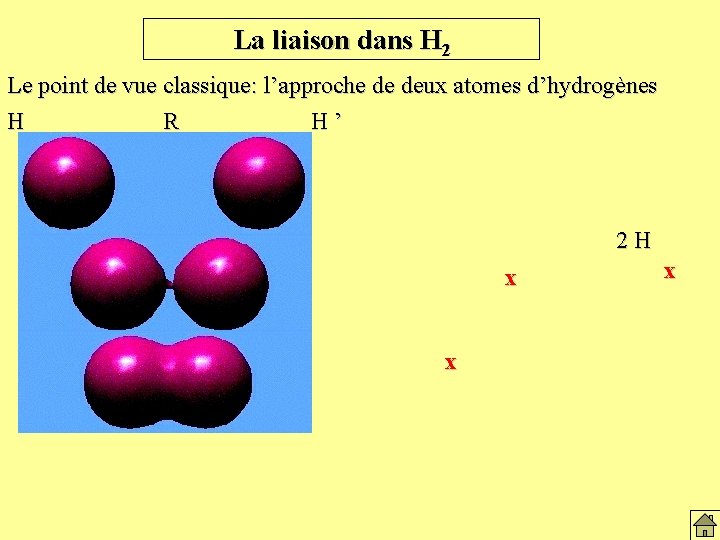
La liaison dans H 2 Le point de vue classique: l’approche de deux atomes d’hydrogènes H R H’ 2 H x x x

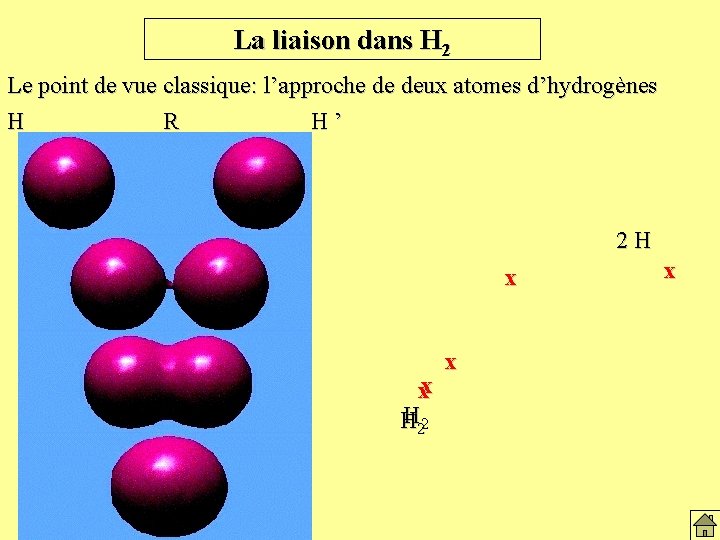
La liaison dans H 2 Le point de vue classique: l’approche de deux atomes d’hydrogènes H R H’ 2 H x xx H 22 H x x

La liaison dans H 2 Le point de vue classique: l’approche de deux atomes d’hydrogènes H R H’ 2 H x xx HH 22 x R(H 2) x DE= En(liaison)


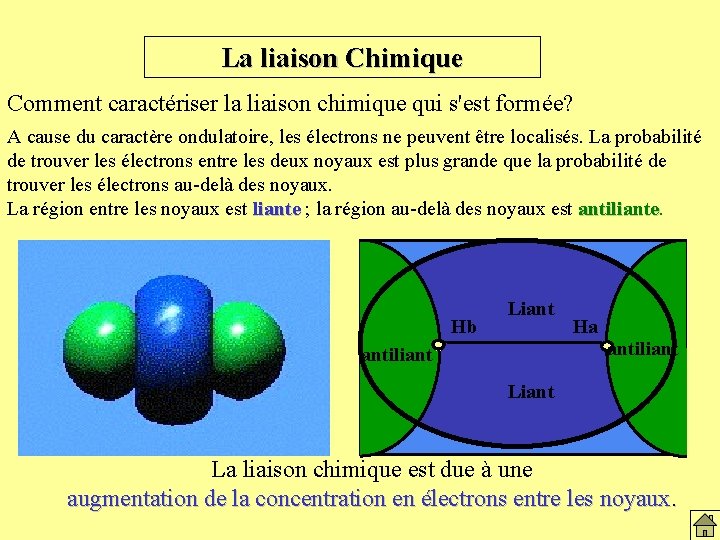
La liaison Chimique Comment caractériser la liaison chimique qui s'est formée? A cause du caractère ondulatoire, les électrons ne peuvent être localisés. La probabilité de trouver les électrons entre les deux noyaux est plus grande que la probabilité de trouver les électrons au-delà des noyaux. La région entre les noyaux est liante ; la région au-delà des noyaux est antiliante Hb Liant Ha antiliant Liant La liaison chimique est due à une augmentation de la concentration en électrons entre les noyaux.

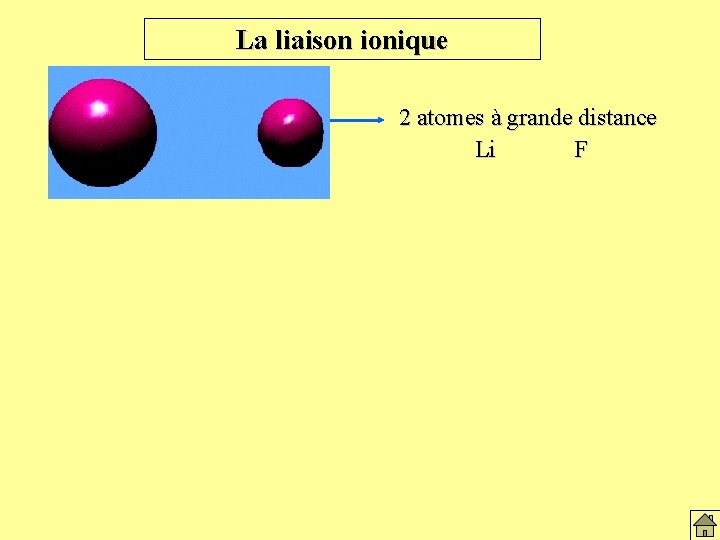
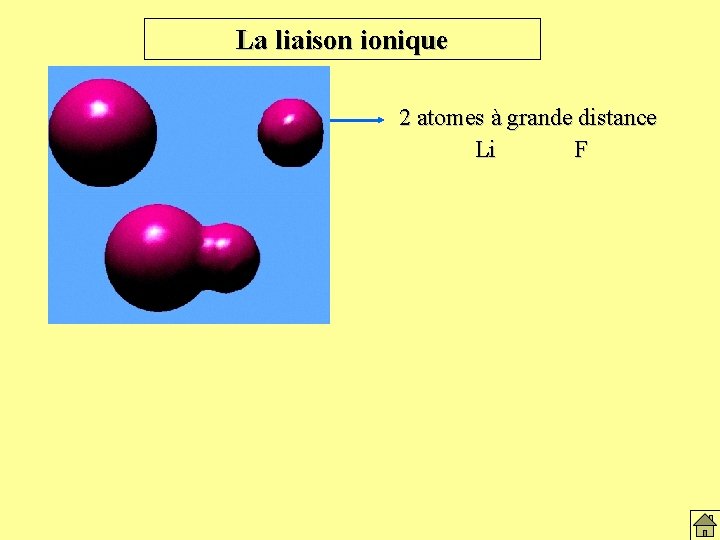
La liaison ionique 2 atomes à grande distance Li F

La liaison ionique 2 atomes à grande distance Li F

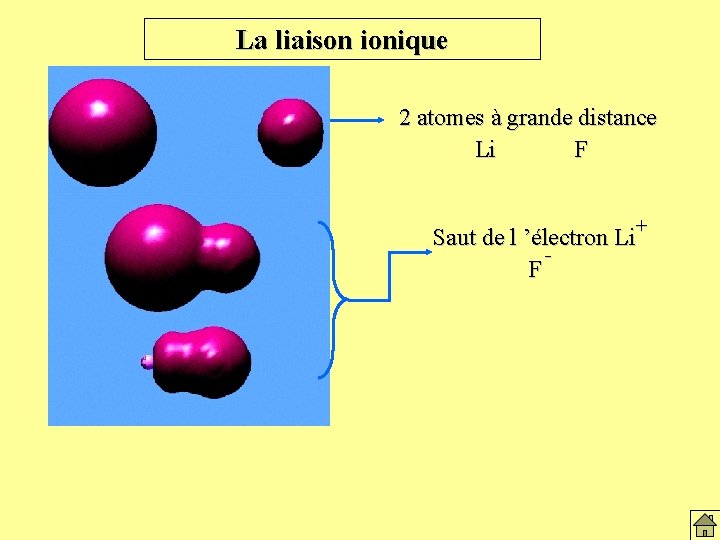
La liaison ionique 2 atomes à grande distance Li F + Saut de l ’électron Li F

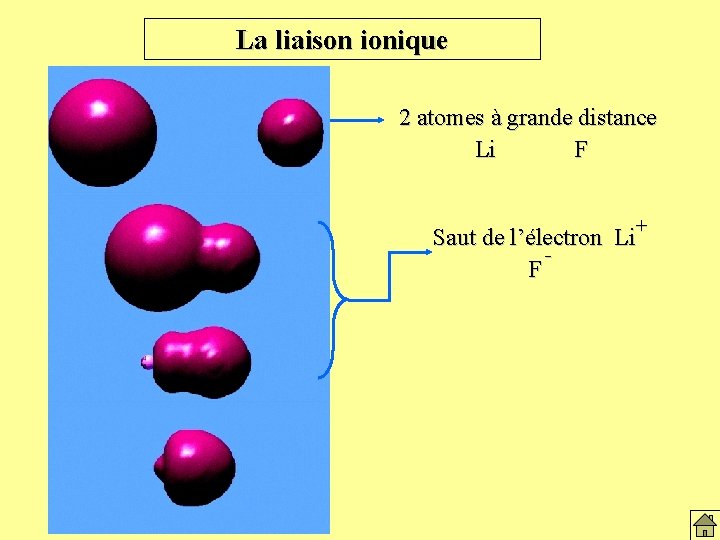
La liaison ionique 2 atomes à grande distance Li F + Saut de l’électron Li F

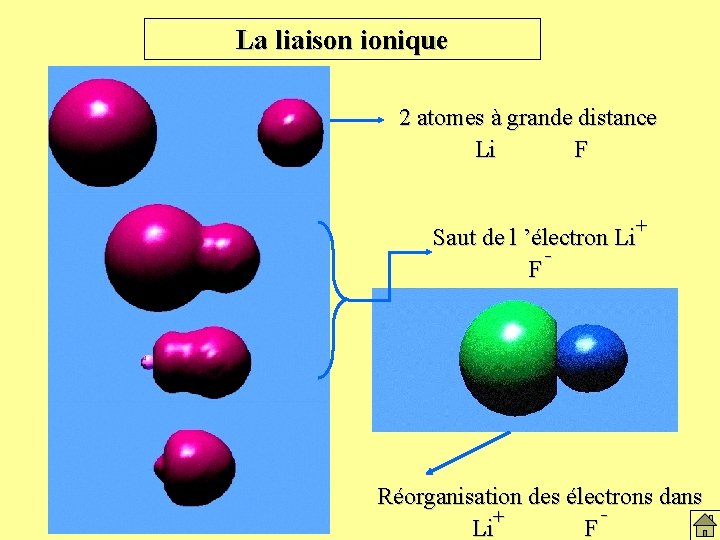
La liaison ionique 2 atomes à grande distance Li F + Saut de l ’électron Li F Réorganisation des électrons dans + Li F

L’octet de Lewis H 2 O, NH 3, CH 4, N 2, HNO 3, H 2 SO 4, … LEWIS observa que: • La plupart des molécules stables ont un nombre pair d ’électrons D ’où l’importance capitale du doublet électronique de liaison. • La plupart des molécules stables font apparaître un atome de la seconde (troisième) période entouré de 4 doublets électroniques D ’où l’importance capitale de l’octet • L’octet est aussi lié à la structure électronique des GAZ RARES, corps très peu réactionnels. En conséquence, la règle de l’octet de Lewis dit que: Une configuration électronique dont la couche externe renferme un octet d'électrons est particulièrement stable.

La liaison chimique La liaison s’établit entre atomes pour leur permettre d’adopter la configuration électronique du gaz rare Et respecter ainsi la règle de l ’octet. Les liaisons se classent en différents types; • La liaison covalente üpure üpolarisée üdative ou semi polaire • La liaison ionique. • La liaison métallique.
![La liaison ionique Na Na ecoût EI Résultat Ne Cl e La liaison ionique Na Na+ + ecoût: EI Résultat: [Ne] (+) Cl + e-](https://slidetodoc.com/presentation_image_h2/56f36ec49b39c5879278dc72d1008c4a/image-16.jpg)
La liaison ionique Na Na+ + ecoût: EI Résultat: [Ne] (+) Cl + e- Clcoût: Ae Résultat: [Ar] (-) Na + Cl Na+ + Cl- Na+Cl- Bilan? [Ne]+ [Ar]Le Bilan sera favorable à la liaison si EI est petit et Ae grand. c. à. d pour des éléments d ’électronégativité très différente. Ces composés sont généralement des solides ioniques. On y reviendra plus loin.

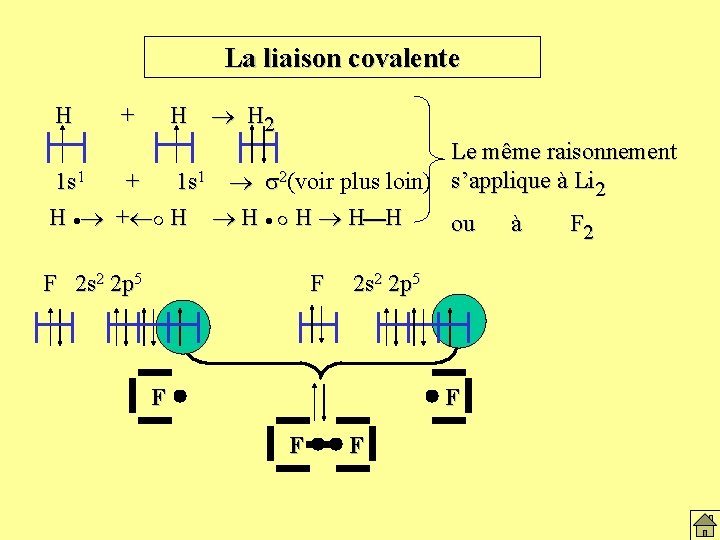
La liaison covalente H H H 2 + Le même raisonnement 1 s 1 + 1 s 1 s 2(voir plus loin) s’applique à Li 2 H + H H H ou à F 2 s 2 2 p 5 F F

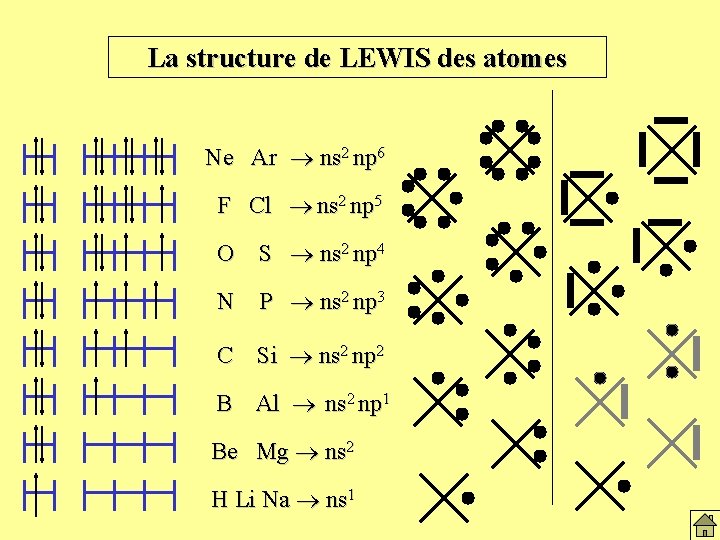
La structure de LEWIS des atomes Ne Ar ns 2 np 6 F Cl ns 2 np 5 O S ns 2 np 4 N P ns 2 np 3 C Si ns 2 np 2 B Al ns 2 np 1 Be Mg ns 2 H Li Na ns 1

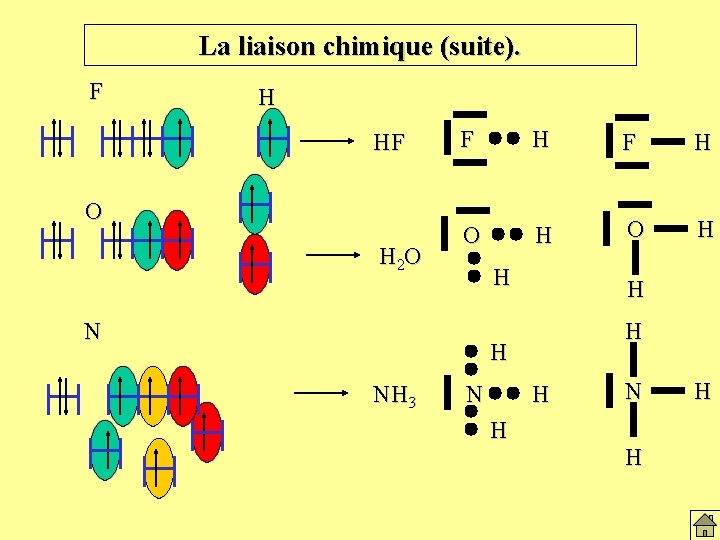
La liaison chimique (suite). F H HF O H 2 O F H O H H N H H H NH 3 N H H

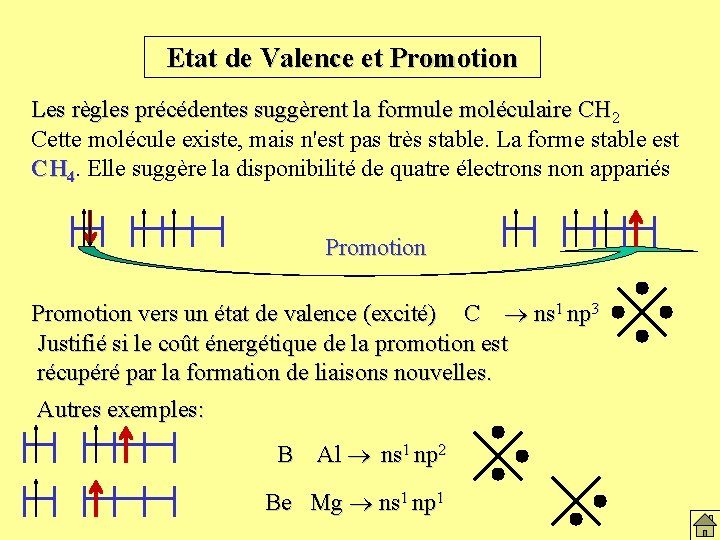
Etat de Valence et Promotion Les règles précédentes suggèrent la formule moléculaire CH 2 Cette molécule existe, mais n'est pas très stable. La forme stable est CH 4. Elle suggère la disponibilité de quatre électrons non appariés Promotion vers un état de valence (excité) C ns 1 np 3 Justifié si le coût énergétique de la promotion est récupéré par la formation de liaisons nouvelles. Autres exemples: B Al ns 1 np 2 Be Mg ns 1 np 1

La liaison covalente polarisée La liaison est covalente pure dans H 2, Cl 2, F 2, … Deux atomes de nature identique partagent « équitablement » les électrons. La liaison entre deux atomes de nature différente est covalente polarisée. La polarisation provient de la tendance d’un des deux atomes à attirer « préférentiellement » les électrons. L’électronégativité selon Pauling mesure la tendance qu'a un atome dans une molécule à attirer vers lui le nuage électronique.

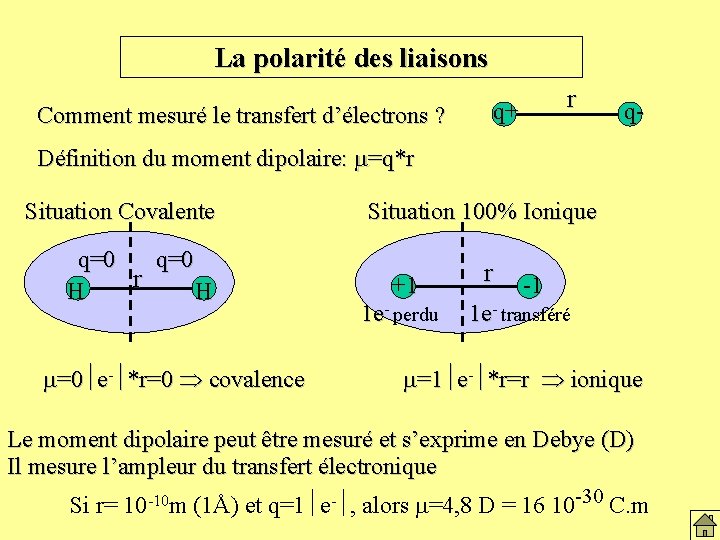
La polarité des liaisons Comment mesuré le transfert d’électrons ? r q+ q- Définition du moment dipolaire: m=q*r Situation Covalente q=0 r H H m=0 e- *r=0 covalence Situation 100% Ionique +1 1 e- perdu r -1 1 e- transféré m=1 e- *r=r ionique Le moment dipolaire peut être mesuré et s’exprime en Debye (D) Il mesure l’ampleur du transfert électronique Si r= 10 -10 m (1Å) et q=1 e- , alors m=4, 8 D = 16 10 -30 C. m

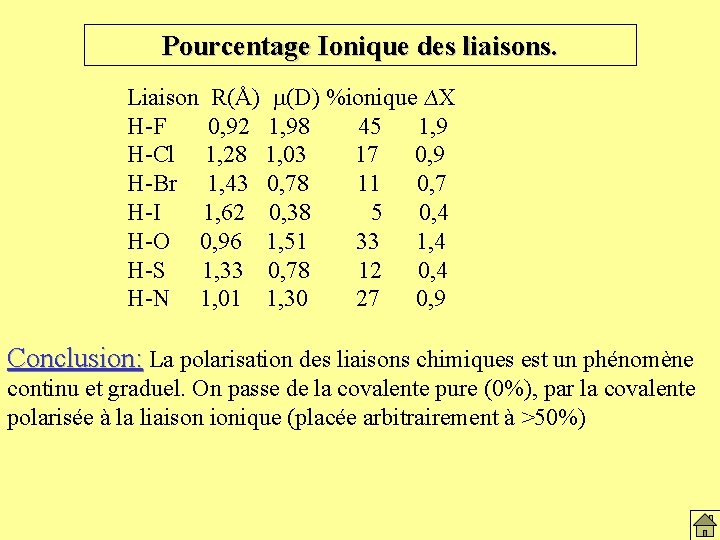
Pourcentage Ionique des liaisons. Liaison R(Å) m(D) %ionique ∆X H-F 0, 92 1, 98 45 1, 9 H-Cl 1, 28 1, 03 17 0, 9 H-Br 1, 43 0, 78 11 0, 7 H-I 1, 62 0, 38 5 0, 4 H-O 0, 96 1, 51 33 1, 4 H-S 1, 33 0, 78 12 0, 4 H-N 1, 01 1, 30 27 0, 9 Conclusion: La polarisation des liaisons chimiques est un phénomène continu et graduel. On passe de la covalente pure (0%), par la covalente polarisée à la liaison ionique (placée arbitrairement à >50%)

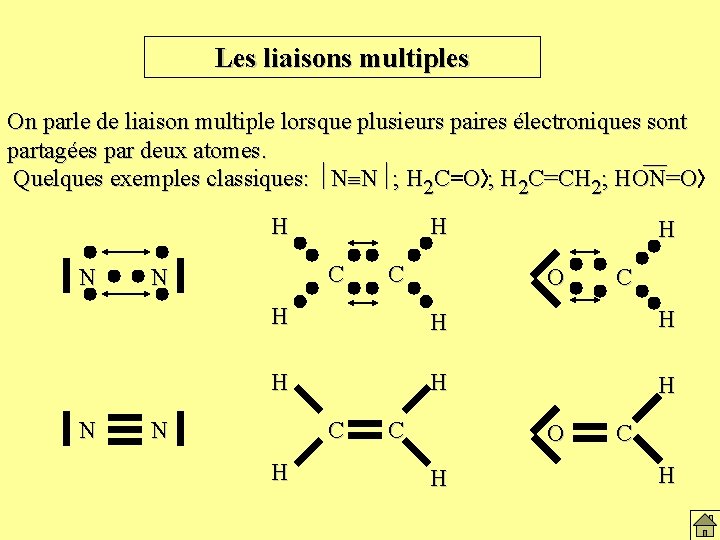
Les liaisons multiples On parle de liaison multiple lorsque plusieurs paires électroniques sont partagées par deux atomes. — Quelques exemples classiques: N N ; H 2 C=O ; H 2 C=CH 2; HON=O H N N H C N C H O C H H H N C H C O H C H

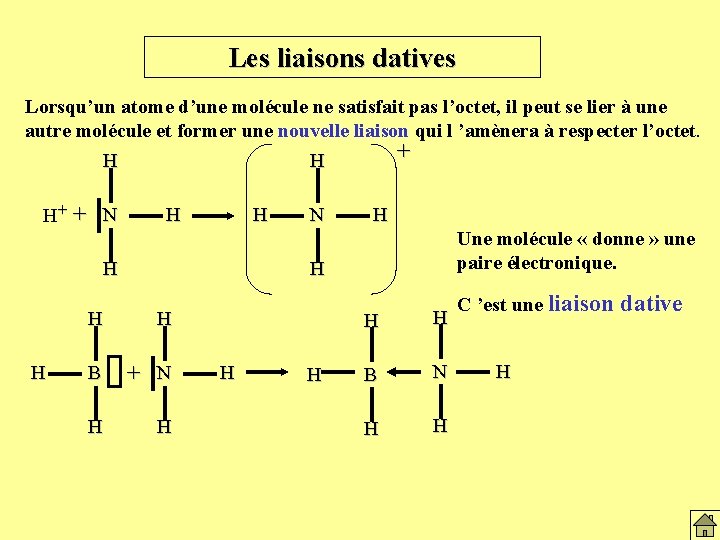
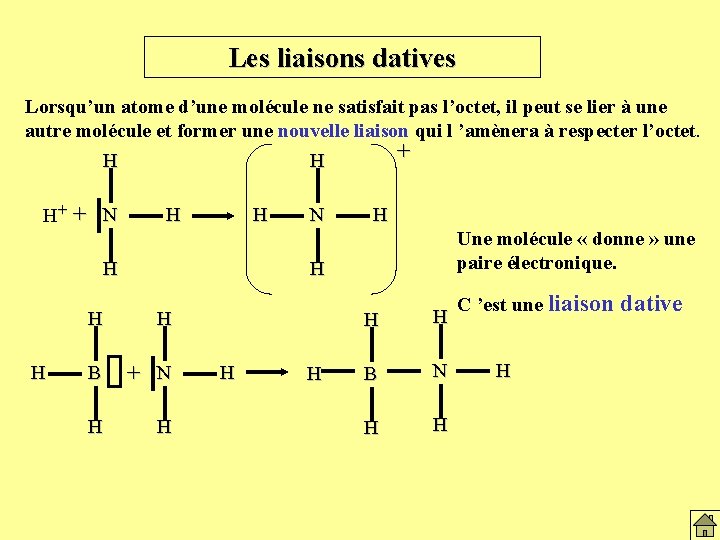
Les liaisons datives Lorsqu’un atome d’une molécule ne satisfait pas l’octet, il peut se lier à une autre molécule et former une nouvelle liaison qui l ’amènera à respecter l’octet. H H+ + N H H + H N H Une molécule « donne » une paire électronique. H H H B + N H H H B N H H C ’est une liaison dative H

Les liaisons datives Lorsqu’un atome d’une molécule ne satisfait pas l’octet, il peut se lier à une autre molécule et former une nouvelle liaison qui l ’amènera à respecter l’octet. H H+ + N H H + H N H Une molécule « donne » une paire électronique. H H H B + N H H H B N H H C ’est une liaison dative H

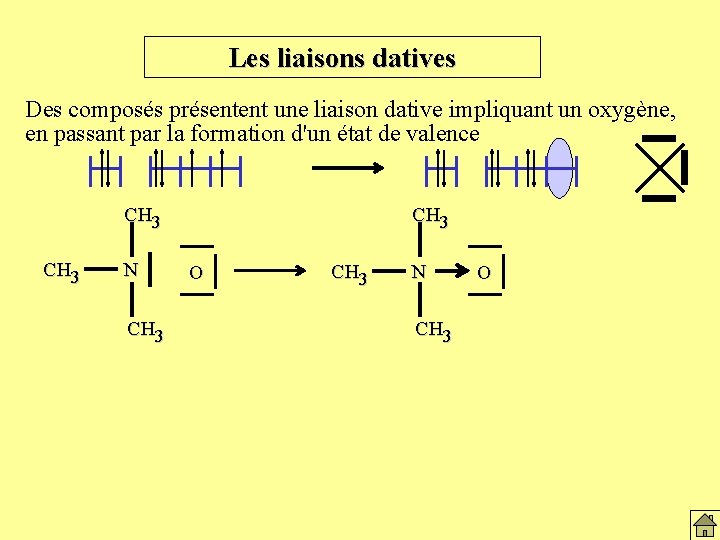
Les liaisons datives Des composés présentent une liaison dative impliquant un oxygène, en passant par la formation d'un état de valence CH 3 N CH 3 O

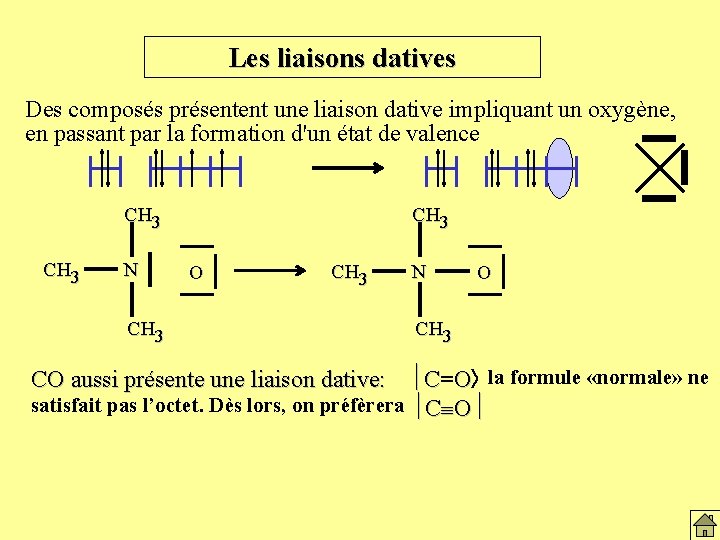
Les liaisons datives Des composés présentent une liaison dative impliquant un oxygène, en passant par la formation d'un état de valence CH 3 N CH 3 O CH 3 N O CH 3 CO aussi présente une liaison dative: C=O la formule «normale» ne satisfait pas l’octet. Dès lors, on préfèrera C O

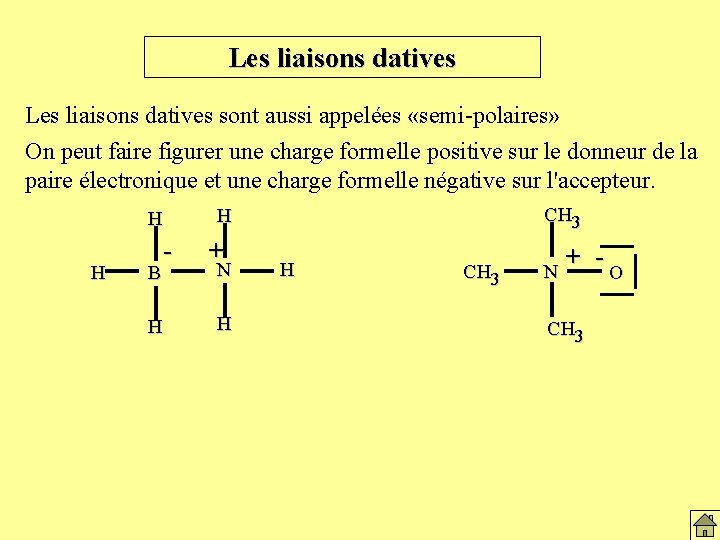
Les liaisons datives sont aussi appelées «semi-polaires» On peut faire figurer une charge formelle positive sur le donneur de la paire électronique et une charge formelle négative sur l'accepteur. H H B - H CH 3 H + N H H CH 3 N + -O CH 3

Le nombre d’oxydation Le nombre d'oxydation (N. O. ) permet "d'attribuer" aux atomes d'une molécule les électrons de liaison. Il indique l'importance de la perte ou du gain d'électrons de l'atome dans la molécule par rapport à l'atome libre a) Lorsque la liaison est une liaison covalente pure, on attribue "totalement" un électron de liaison à chaque atome. Son nombre d'oxydation est nul. « Le nombre d'oxydation des éléments est nul » . b) Lorsque le composé est ionique, le transfert d'électrons est total. Le nombre d'oxydation est égal à la charge de l'ion, signe compris. c) Dans toutes les autres liaisons, la paire d'électrons est complètement attribuée à l'atome le plus électronégatif.

Le nombre d’oxydation Les règles de calcul du nombre d'oxydation (N. O. ). 1) Dans une molécule neutre, la somme des nombres d'oxydation des éléments est nul. Dans les ions, cette somme est égale à la charge. 2) Le fluor, corps le plus électronégatif, a toujours un nombre d'oxydation égal à -1 [mais 0 dans F 2]. 3) L'oxygène se trouve en général à l'étage -2 [sauf 0 dans O 2; -1 dans les peroxydes (R-O-O-R') et lié au fluor] 4) L'hydrogène a en général un N. O. de +1 [sauf dans les hydrures où il vaut -1 et dans la molécule H 2 où il est nul] 5) Les nombres d'oxydation des éléments seront toujours compris entre N et N-8 où N est le numéro du groupe auquel il appartient.

Le nombre d’oxydation Quelques exemples: HCl N. O. (H) = +1 N. O. (Cl) =-1 H 2 CO N. O. (H) = +1 N. O. (O)=-2 N. O. (C)+[2*(+1) + (-2)] = 0 0 H 2 SO 4 N. O. (H) =+1 N. O. (O)=-2 N. O. (S)+[2*(+1) + 4*(-2)] = 0 6 Cl. O 4 - N. O. (O)=-2 N. O. (Cl)+[4*(-2)]= -1 7 Na. NO 3 N. O. (Na) =+1 N. O. (O)=-2 N. O. (N)+[(+1) + 3*(-2)] = 0 5

Les limites du modèle de LEWIS 1) Comment expliquer l’existence de PCl 5, composé « hypervalent » au sens de l ’octet qui ne peut justifier que l’existence de PCl 3 2)Dans certains cas, il ne permet pas de trouver une formule unique. Pour SO 2 faut il écrire: O S=O ou O=S O 3) Le caractère paramagnétique de molécules telles que O 2 ne s’explique pas par le modèle de Lewis. Solutions proposées: 1) La promotion vers un état de valence du P (S, …) 2) Introduction du concept de résonance 3) Seule une description quantique permet d'introduire ces particularités.

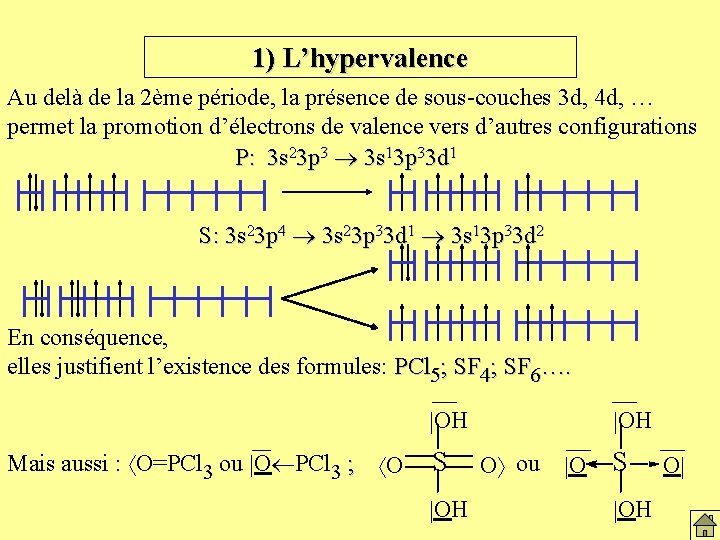
1) L’hypervalence Au delà de la 2ème période, la présence de sous-couches 3 d, 4 d, … permet la promotion d’électrons de valence vers d’autres configurations P: 3 s 23 p 3 3 s 13 p 33 d 1 S: 3 s 23 p 4 3 s 23 p 33 d 1 3 s 13 p 33 d 2 En conséquence, elles justifient l’existence des formules: PCl 5; SF 4; SF 6…. OH Mais aussi : O=PCl 3 ou O PCl 3 ; O S OH O ou O S OH O

2) La notion de résonance Lorsqu’une molécule est décrite par plusieurs formules de Lewis, aucune n’est adéquate. La structure réelle est intermédiaire entre celles-ci. On dit que ce sont des formules limites et que la structure réelle est une superposition pondérée de toutes ces formules, que la molécule résonne résonance entre toutes structures. On définit ainsi le concept de résonance. On relie les structures limites, ou formules de résonance, par la double flèche , indiquant par là qu’il faut tenir compte de leur ensemble Pour SO 2 il faut écrire: O S=O O=S O

2) La notion de résonance Quelques exemples: Pour SO 2 il faut écrire: O S=O O=S O ou

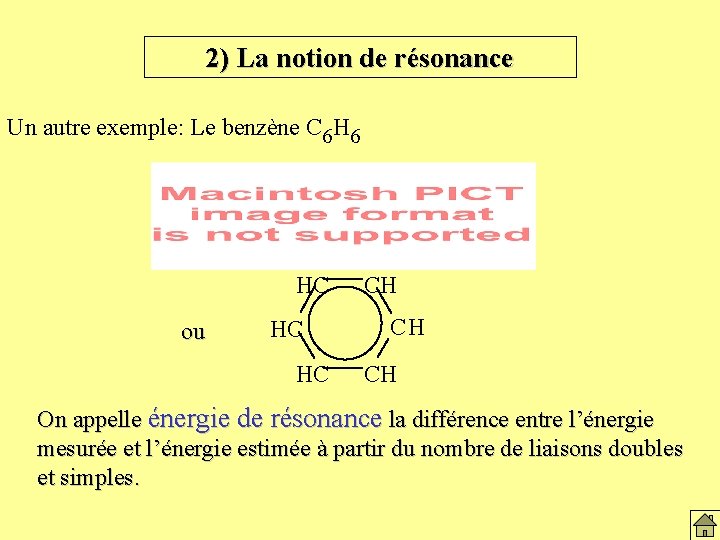
2) La notion de résonance Un autre exemple: Le benzène C 6 H 6 HC ou HC HC CH CH CH On appelle énergie de résonance la différence entre l’énergie mesurée et l’énergie estimée à partir du nombre de liaisons doubles et simples.

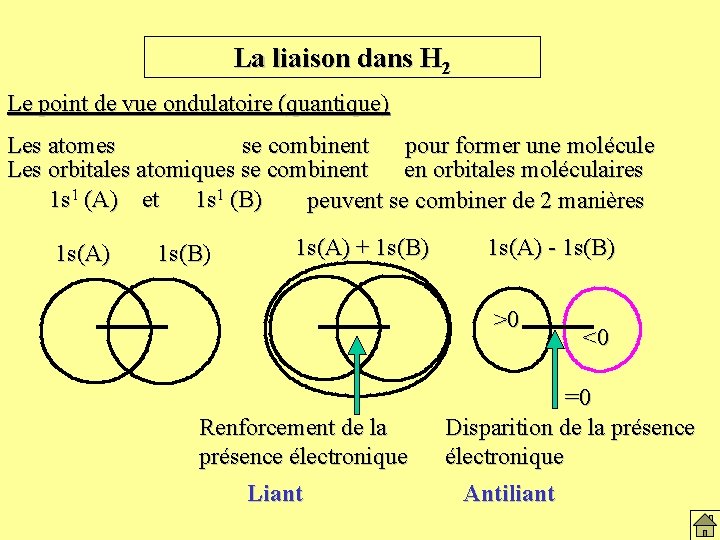
La liaison dans H 2 Le point de vue ondulatoire (quantique) Les atomes se combinent pour former une molécule Les orbitales atomiques se combinent en orbitales moléculaires 1 s 1 (A) et 1 s 1 (B) peuvent se combiner de 2 manières 1 s(A) 1 s(B) 1 s(A) + 1 s(B) 1 s(A) - 1 s(B) >0 Renforcement de la présence électronique Liant <0 =0 Disparition de la présence électronique Antiliant

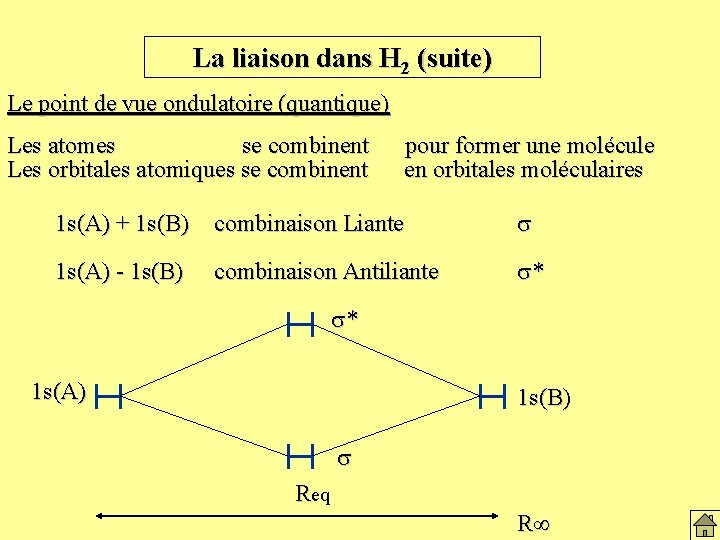
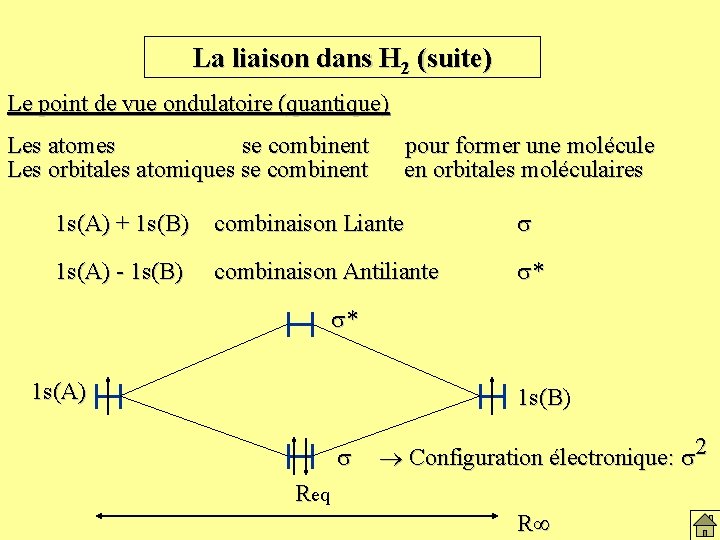
La liaison dans H 2 (suite) Le point de vue ondulatoire (quantique) Les atomes se combinent Les orbitales atomiques se combinent pour former une molécule en orbitales moléculaires 1 s(A) + 1 s(B) combinaison Liante s 1 s(A) - 1 s(B) combinaison Antiliante s* s* 1 s(A) 1 s(B) s Req R

La liaison dans H 2 (suite) Le point de vue ondulatoire (quantique) Les atomes se combinent Les orbitales atomiques se combinent pour former une molécule en orbitales moléculaires 1 s(A) + 1 s(B) combinaison Liante s 1 s(A) - 1 s(B) combinaison Antiliante s* s* 1 s(A) 1 s(B) s Req Configuration électronique: s 2 R

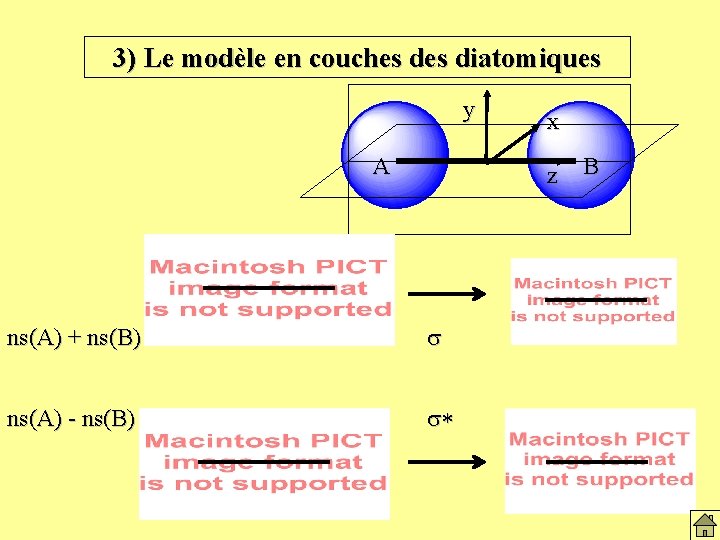
3) Le modèle en couches diatomiques - L'approche par la mécanique ondulatoire généralise la description de la liaison covalente de H 2 à l'étude de l'ensemble des molécules. - La distribution électronique d'une molécule est décrite à partir d'orbitales moléculaires construites par combinaisons d'orbitales atomiques

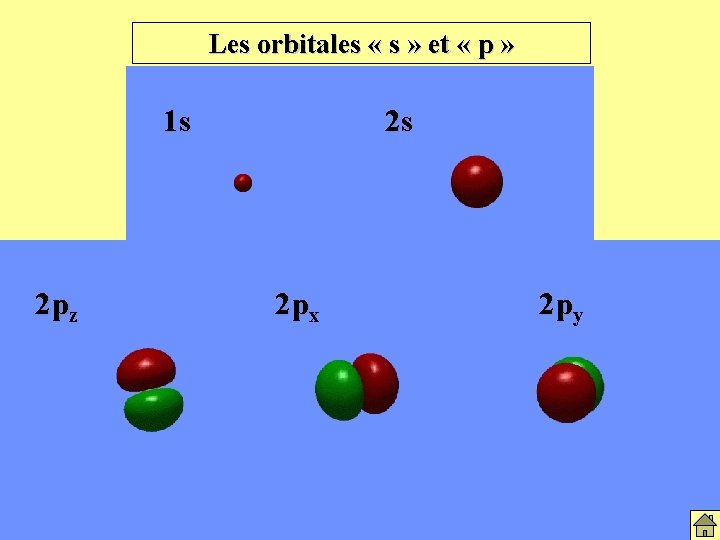
Les orbitales « s » et « p » 1 s 2 pz 2 s 2 px 2 py

3) Le modèle en couches diatomiques - L'approche par la mécanique ondulatoire généralise la description de la liaison covalente de H 2 à l'étude de l'ensemble des molécules. - La distribution électronique d'une molécule est décrite à partir d'orbitales moléculaires construites par combinaisons d'orbitales atomiques Principe de construction: 1) Choisir les orbitales atomiques associées aux diverses couches. Par exemple 1 s, 2 px, 2 py, et 2 pz. 2) Combiner deux à deux les orbitales atomiques possédant les mêmes nombres quantiques: c. A du premier atome avec c. B du second atome, 1 s avec 1 s, 2 s avec 2 s, 2 px avec 2 px, et ainsi de suite. Il existe deux combinaisons possibles: par addition N[ c. A + c. B ] ou par soustraction N[ c. A - c. B ]

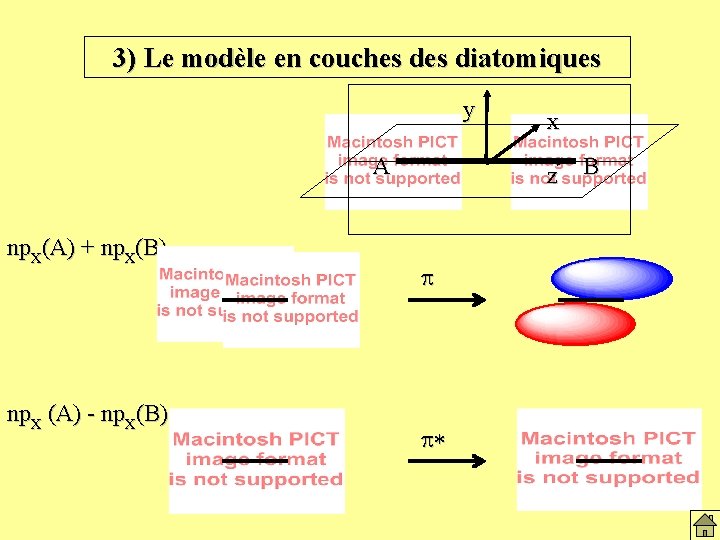
3) Le modèle en couches diatomiques y A x z ns(A) + ns(B) s ns(A) - ns(B) s* B

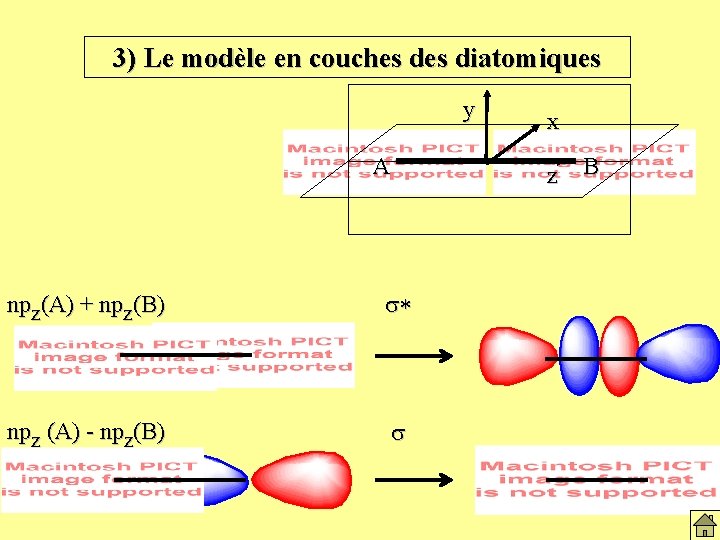
3) Le modèle en couches diatomiques y A npz(A) + npz(B) s* npz (A) - npz(B) s x z B

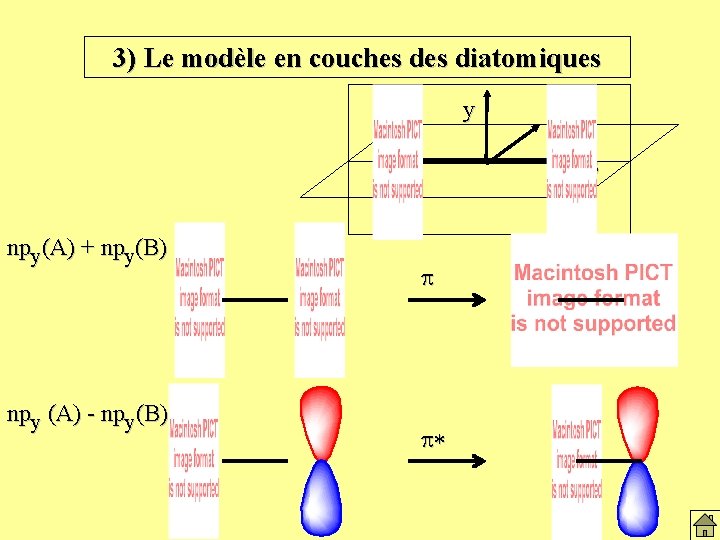
3) Le modèle en couches diatomiques y A npy(A) + npy(B) npy (A) - npy(B) x z p p* B

3) Le modèle en couches diatomiques y A npx(A) + npx(B) npx (A) - npx(B) x z p p* B

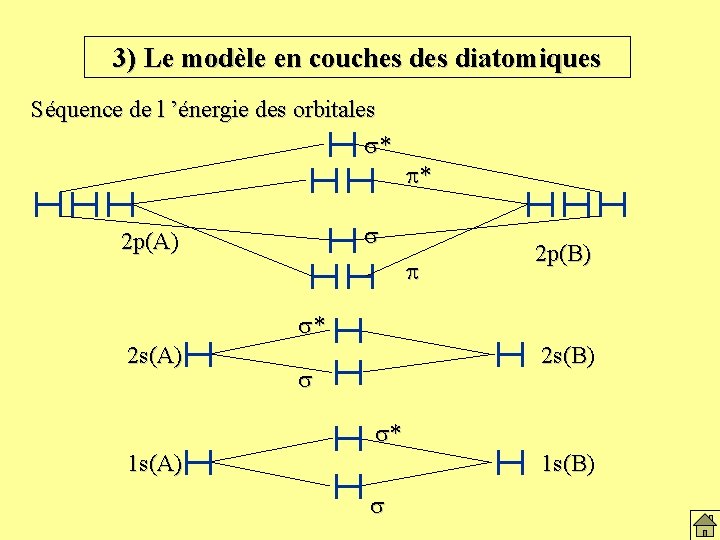
3) Le modèle en couches diatomiques Séquence de l ’énergie des orbitales s* p* s 2 p(A) p 2 p(B) s* 2 s(A) 2 s(B) s s* 1 s(A) 1 s(B) s

3) Le modèle en couches diatomiques Construction des configurations électroniques: Principe d’édification Nombre d’e- de liaison s 2 p* p 2 p* s 2 p p 2 p s 2 s* s 2 s s 1 s* s 1 s N 2 14 e- . . . s 2 s 2 s 2 s*2 p 2 px 2 p 2 py 2 s 2 pz 2 6 C 2 12 e- . . . s 2 s 2 s 2 s*2 p 2 px 2 p 2 py 2 4 B 2 10 e- . . . s 2 s 2 s 2 s*2 p 2 px 1 p 2 py 1 2 Be 2 8 e- . . . s 2 s 2 s 2 s*2 Li 2 6 e- . . . s 2 s 2 0 2 He 2 4 e- s 1 s 2 s 1 s*2 0 2 e- s 1 s 2 2 H 2

3) Le modèle en couches diatomiques Construction des configurations électroniques: Principe d’édification Nombre d’e- de liaison Ne 2 20 e- …. s 2 pz 2 p 2 px 2 p 2 py 2 p 2 px*2 p 2 py*2 s 2 pz*2 0 s 2 p* F 2 18 e- …. s 2 pz 2 p 2 px 2 p 2 py 2 p 2 px*2 p 2 py*2 2 p 2 p* p 2 p s 2 s* s 2 s s 1 s* s 1 s O 2 16 e- …. s 2 pz 2 p 2 px 2 p 2 py 2 p 2 px*1 p 2 py*1 N 2 14 e- . . . s 2 s 2 s 2 s*2 p 2 px 2 p 2 py 2 s 2 pz 2 4 6 C 2 12 e- . . . s 2 s 2 s 2 s*2 p 2 px 2 p 2 py 2 4 B 2 10 e- . . . s 2 s 2 s 2 s*2 p 2 px 1 p 2 py 1 2 Be 2 8 e- . . . s 2 s 2 s 2 s*2 Li 2 6 e- . . . s 2 s 2 0 2 He 2 4 e- s 1 s 2 s 1 s*2 0 2 e- s 1 s 2 2 H 2