Prrentre en Chimie Sance n 3 Fiche 4










- Slides: 17

Prérentrée en Chimie Séance n 3 Fiche 4. Tableau périodique Septembre 2020 Carole Marbeuf-Gueye CONSEIL: Regarder ce document sous powerpoint en format diaporama grand écran pour profiter des animations…et réfléchir aux questions avant les réponses

Programme Mise à niveau chimie 2020: *ATOME (fiches n 1 à 5) 1. 1 Description atome 1. 2 Quantité de matière et NAvogadro 1. 3 intro nombres quantiques , orbitales atomiques et Configurations électroniques 1. 4 Tableau périodique 1. 5 intro sur rayon atomique, énergie d’ionisation , affinité électronique *MOLECULE (fiches n 6 à 8) 2. 1 Initiation aux Formules de Lewis 2. 2 Dessins d’une tétraèdre 2. 3 Dessin dans l’espace de molécules: erreurs à éviter *REACTIONS (fiches n 9 à 10) 3. 1 Équilibrer une équation chimique, stoechiométrie 3. 2. échanges d’énergie 3. 3 vitesses de réaction *Pour les TP (fiche n 11) * Notations/Calculs en chimie (fiche n 12) légendes • « Oui Si » : partie non prioritaire sera vu en L 1 et L 2 * étudiants de médecine LAS et PAS: fiches conseillées avant cours chimie orga du Socle

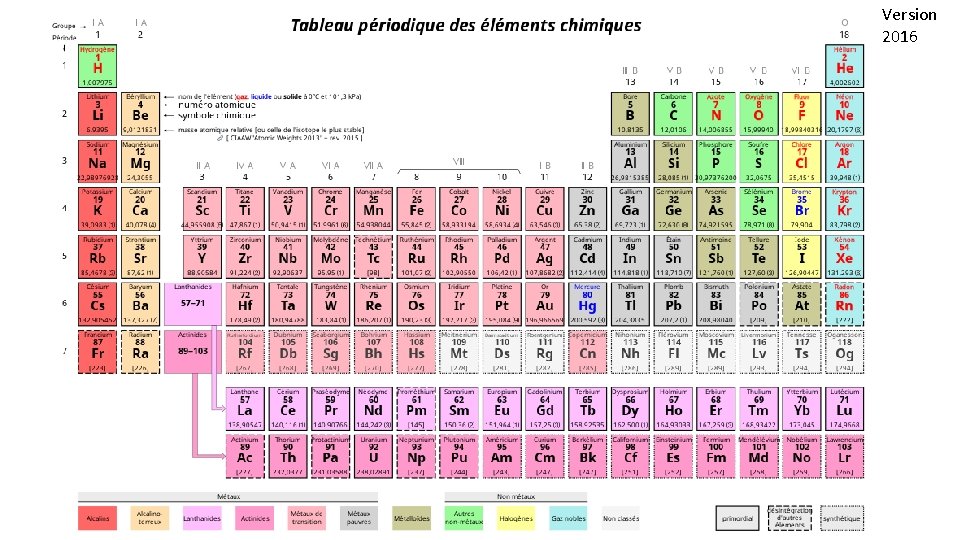
1. 4 Tableau périodique Mendeleiev (1869. . ) Classement par masse atomique croissant et propriétés chimiques , physiques Nombreux ajustements, connaissance de la structure électronique des atomes Mise en place de la classification tableau périodique actuelle 118 éléments par Z croissant De l'hydrogène 1 H à l'oganesson 118 Og. 18 colonnes 7 lignes Version 2016

1. 4 Tableau périodique 1. 4. 1. Astuce pour retrouver le début du tableau périodique Partie du tableau à connaître par coeur H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti Va Cr Mn Fe Co Ni Cu Zn Après H et He, afin de retrouver la position de chaque atome vous pouvez utiliser les phrases suivantes (ou d’autres à votre convenance) comme moyen mnémotechnique : Lili Bu bien Chez Notre Oncle Francois Nestor Napoléon Mangea Allègrement Six Poulets Sans Claquer Après Kaptain Cavern ! Scande Titi voyant Cro-Magnon Faire Comme Nikita Cui Zozotte

Version 2016

Nombreuses Informations dans les Version les plus complètes du tableau: Info pas toutes nécessaires pour nous en 1 ere année

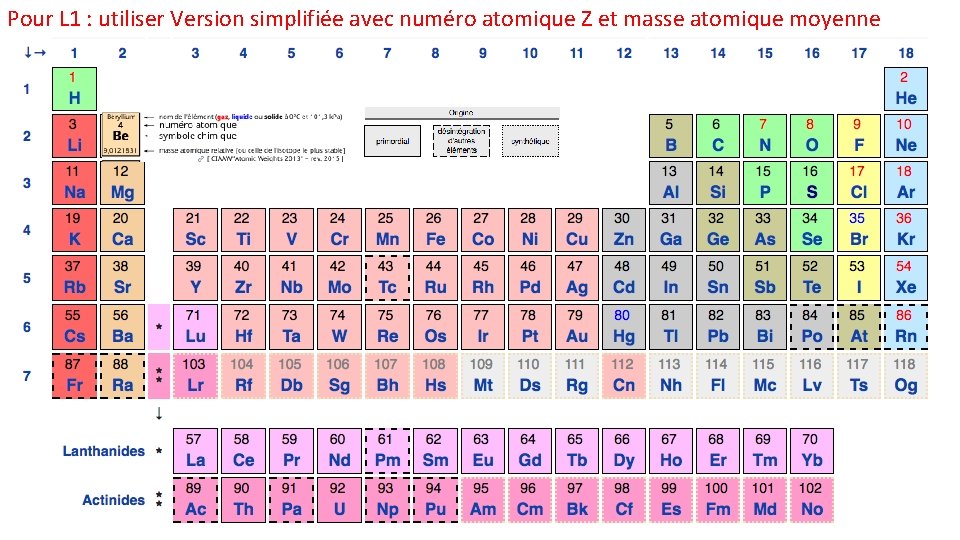
Pour L 1 : utiliser Version simplifiée avec numéro atomique Z et masse atomique moyenne

Q 1. Quels sont les éléments à l’état gazeux ou liquide(*)? Réponse Q 1. État gazeux? 11 éléments * 1ère ligne H et He • 2 ème ligne N et O F et Ne • des halogènes ( colonne 17) : F et Cl • Tous les gaz rares ( colonne 18) À l’état liquide? 2 éléments: un halogène Br et Hg (*)état standard d’un élément à 0°C et P=1 atm

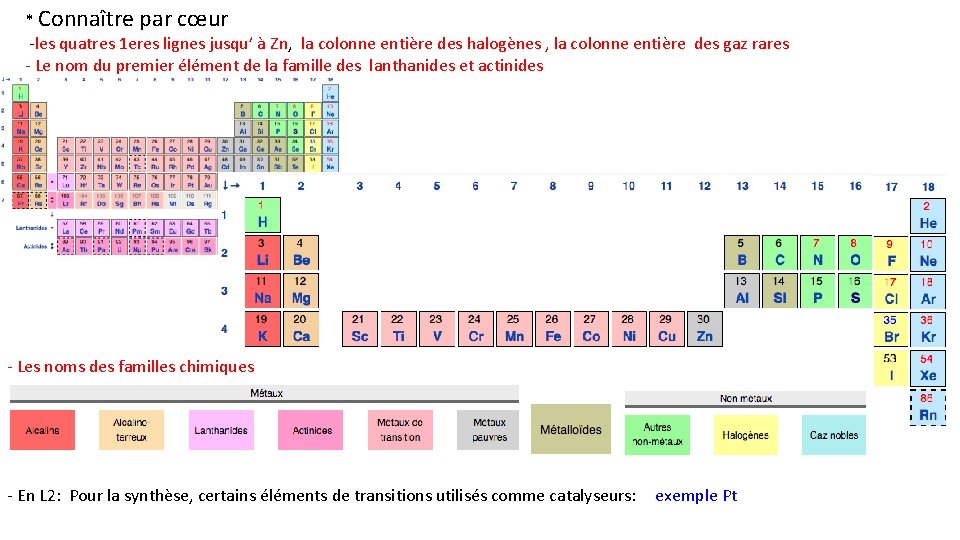
* Connaître par cœur -les quatres 1 eres lignes jusqu’ à Zn, la colonne entière des halogènes , la colonne entière des gaz rares - Le nom du premier élément de la famille des lanthanides et actinides - Les noms des familles chimiques - En L 2: Pour la synthèse, certains éléments de transitions utilisés comme catalyseurs: exemple Pt

*familles chimiques retrouvées de manière périodique dans le tableau Une Colonne = une famille chimique avec propriétés chimiques assez similaires. (H à part, métaux de transition, Lanthanides et Actinides également à part) - Noter que Les métalloïdes ont des caractéristiques intermédiaires entre métaux et non métaux

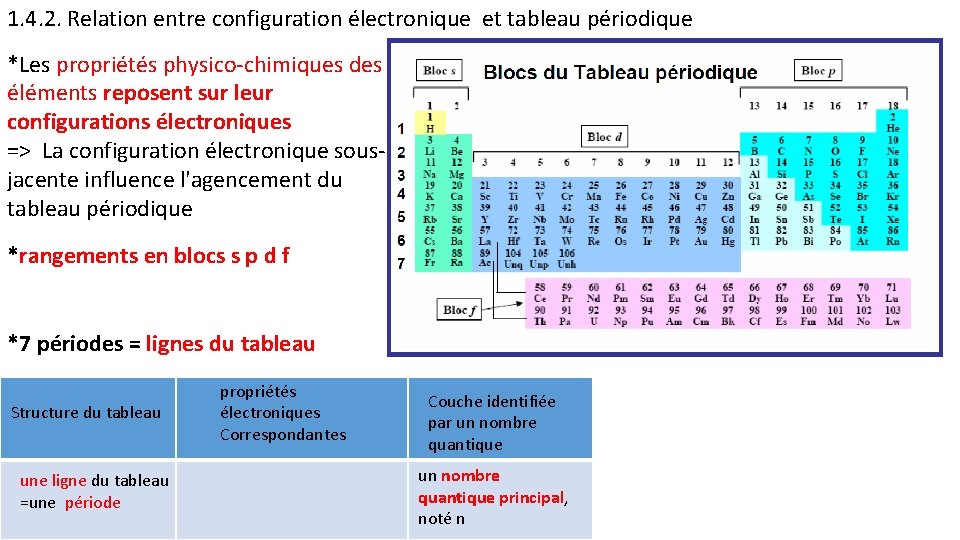
1. 4. 2. Relation entre configuration électronique et tableau périodique *Les propriétés physico-chimiques des éléments reposent sur leur configurations électroniques => La configuration électronique sousjacente influence l'agencement du tableau périodique *rangements en blocs s p d f *7 périodes = lignes du tableau Structure du tableau une ligne du tableau =une période propriétés électroniques Correspondantes Couche identifiée par un nombre quantique principal, noté n

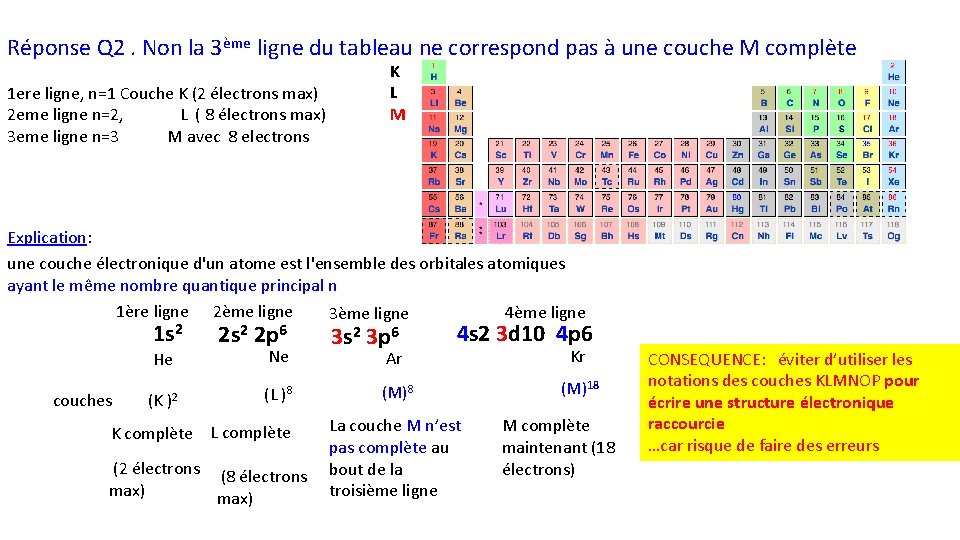
Q 2. : Est ce que la 3ème ligne du tableau correspond à une couche M complète? (Sachant qu’une couche électronique d'un atome est l'ensemble des orbitales atomiques partageant un même nombre quantique principal n) K L M …

Réponse Q 2. Non la 3ème ligne du tableau ne correspond pas à une couche M complète 1 ere ligne, n=1 Couche K (2 électrons max) 2 eme ligne n=2, L ( 8 électrons max) 3 eme ligne n=3 M avec 8 electrons K L M Explication: une couche électronique d'un atome est l'ensemble des orbitales atomiques ayant le même nombre quantique principal n 1ère ligne 2ème ligne 4ème ligne 3ème ligne 1 s 2 He couches (K )2 2 s 2 2 p 6 Ne (L )8 K complète L complète (2 électrons (8 électrons max) 3 s 2 3 p 6 Ar 4 s 2 3 d 10 4 p 6 (M)8 La couche M n’est pas complète au bout de la troisième ligne Kr (M)18 M complète maintenant (18 électrons) CONSEQUENCE: éviter d’utiliser les notations des couches KLMNOP pour écrire une structure électronique raccourcie …car risque de faire des erreurs

*Électrons de valence et électrons célibataires Q 3. En dehors du bloc d, Pour chaque colonne, Combien d’e- de valence et d’e- célibataires? Auront il la même formule de Lewis? Réponse Q 3. Les Éléments d’une même colonne ont: -Même nombre d’e- de valence et Même nombre d’e- célibataires => Donc même formule de Lewis 1 e 1 e= 2 e 0 e- 3 e 1 e- = e- de valence 4 e- 5 e- 6 e- 7 e- 8 e- s ou p 0 e- = e - 2 e- 3 e- 2 e- 1 e- célibataire

* ions monoatomiques (rappels de seconde: pour les trois 1ères lignes Et Colonnes 1, 2 , 16, 17, 18) ions monoatomiques typiques obtenus en recherchant la même structure électronique du gaz noble le plus proche. Nombre Colonne 1 électron(s) Des sous 1 ecouches externes Ions monoato miques Ion X+ Colonne 2 2 e- Ion X 2+ Isoélectronique du gaz rare précédant Colonne 16 Colonne 17 Colonne 18 De Oxygène 7 8 6 eélectrons Ion X 2 - Ion X- Isoélectronique du gaz rare suivant Pas d’ion, Très stables

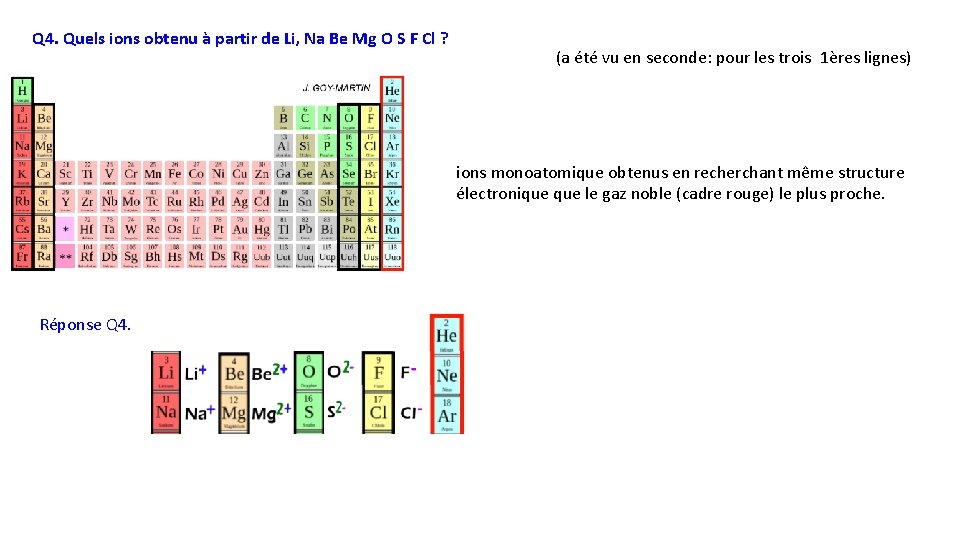
Q 4. Quels ions obtenu à partir de Li, Na Be Mg O S F Cl ? (a été vu en seconde: pour les trois 1ères lignes) ions monoatomique obtenus en recherchant même structure électronique le gaz noble (cadre rouge) le plus proche. Réponse Q 4.

1. 4. 3. rayon atomique, Energie de 1 ere ionisation , affinité électronique (Les justifications seront données en cours et ED de SV 1) Rayon atomique et L'énergie d'ionisation varient en sens contraires a) Rayon atomique c) Affinité électronique 1ère Ae = énergie dégagée à la suite de la capture d'un 1 er e- par un atome isolé. b) Energie d’ionisation Ei *Ei 1 de première ionisation = énergie nécessaire pour arracher un e- de la couche externe d’un atome : ATTENTION A et A + X+eet A- à l’état gazeux X- *dans le tableau périodique : Dans une colonne r augmente de haut en bas Dans une colonne: EI 1 diminue de haut en bas Dans une ligne: r diminue de gauche à droite Dans une ligne: Ei 1 augmente de gauche à droite r *r le plus grand EI r *Ei le plus grand (Plus Ei grand, plus e- difficile à arracher ) EI *Plus l'affinité électronique est grande, • plus la capture d'un e- par l'atome dégage de l'énergie • plus l’anion résultant est stable.